Гниет ли металл в воде
Обновлено: 19.05.2024
Морская вода является хорошо аэрированным (4-10 мг/л О2) нейтральным (рН = 7,3-8,6) электролитом с высокой электропроводностью (γ=0,5-6,7 См/м), обусловленной наличием солей от 2 (воды заливов, моря в местах впадения рек) до 40%. Средняя соленость открытых морей и океанов составляет 35%.
Солевой состав морской воды включает в себя в основном хлориды и сульфаты натрия, магния, кальция и калия. Благодаря большому содержанию хлоридов морская вода характеризуется высокой способностью к депассивации металлов. Морская коррозия металлов протекает по электрохимическому механизму преимущественно с кислородной деполяризацией и смешанным диффузионно-кинетическим катодным контролем.
Для разрушения металлов в морской воде характерно наряду с общей равномерной коррозией наличие разрушений в виде язв и питтинга. Средняя скорость коррозии стали в морской воде, рассчитанная по потере массы, составляет от 0,05 до 0,20 мм/год, а язвенной коррозии — до 1 мм/год. Холодное цинкование в среднем имеет скорость коррозии около 0,02 мм/год
На скорость коррозии металлов в морской воде оказывает влияние ряд факторов. Общая соленость морской воды не сильно влияет на интенсивность коррозионного процесса, в то время как некоторые отклонения от обычного состава, например, наличие сероводорода или различных загрязнений могут в несколько раз увеличить скорость коррозии.

Движение морской воды увеличивает скорость доставки кислорода к катодным участкам поверхности металла, а отсюда и скорость коррозии большинства металлов. В то же время для коррозионностойких сталей увеличение диффузии кислорода приводит к усилению пассивации поверхности и защите от питтинга.
При еще более значительных скоростях движения как морской, так и пресной воды могут появиться коррозионно-эрозионные разрушения, когда электрохимическая коррозия сильно ускоряется вследствие разрушения потоком воды защитной пленки на металле (пленки пассивности или продуктов коррозии). К таким разрушениям особенно склонны цинк, алюминий, медь и медные сплавы.
При очень быстром движении воды наблюдается коррозионная кавитация, когда наряду с коррозионным процессом происходит механическое разрушение металла ударным воздействием воды при смыкании вакуумно-паровых пузырьков. Скорости коррозионной кавитации могут достигать десятков миллиметров в год.
Температура воды двояко влияет на скорость коррозии: с одной стороны, повышение температуры ускоряет диффузию кислорода и реакции на анодных и катодных участках, а, с другой стороны, уменьшает растворимость кислорода, а отсюда и скорость коррозии.
Поэтому зависимость скорости коррозии от температуры воды имеет вид кривой с максимумом, соответствующим различным температурам при различных условиях (тип сплава, состав воды, возможности сохранения кислорода в закрытых системах и т.п.).
Металлический контакт разнородных металлов в морской воде приводит к усилению коррозии более электроотрицательного металла и снижению (или подавлению) коррозии более положительного металла. Заключение о коррозионном поведении контакта различных металлов можно сделать на основании сопоставления их стационарных потенциалов в данной среде. При неправильном выборе контактирующих металлов и отсутствии средств защиты возникает опасность весьма значительных коррозионных повреждений.
На интенсивность коррозии металлов в морской воде может оказать влияние обрастание поверхности морскими организмами (биокоррозия). На коррозию углеродистых и низколегированных сталей обрастание не оказывает особо заметного влияния, причем коррозия может при этом как усиливаться (при наличии сульфатредуцирующих бактерий, возникновении пар дифференциальной аэрации), так и уменьшаться (вследствие снижения содержания кислорода и кроющего действия обрастателей).
Влияние обрастания на коррозию нержавеющих сталей, алюминиевых и медных сплавов также неоднозначно, но в целом преобладает отрицательное влияние. Объясняется это тем, что эти материалы склонны к щелевой коррозии в зазорах, образуемых обрастателями, и к усилению коррозии при нарушениях сплошности пассивной пленки в связи с уменьшением содержания кислорода.
Резкое усиление коррозии металлоконструкций в морской воде, иногда в десятки раз, может иметь место в зоне действия блуждающих токов или токов утечки, когда поверхность металла подвергается сильной анодной поляризации под действием стекающего тока.
Процесс гниения металла,вопрос.
Кто нибудь может мне на обычном языке обьяснить процесс гниения металлов?Пример:гниёт когда металл скородировал и остаётся влажным.Перестаёт корродировать если уже есть ржавчина,но она высушена например феном или на солнце.Вощем хочется узнать как остановить процесс гниения.
Коррозию металла не остановишь это как рак даст метастазы,что конкретно гниет?
Всё просто. Окисление металла (ржавление) происходит ТОЛЬКО при взаимодействии с кислородом (из воздуха или воды). Исключив этот фактор коррозия прекратится.
То есть, например, погрузив ржавую деталь в масло, будет исключен процесс взаимодействия с кислородом.
Наверное никак если дело касается жестянки авто.Пишут что это начинается на молекулярном уровне.Приостановить можно.Была у меня Волга 10-ка,загнили задние крылья,так что я с ними ток не делал и чем только не мазал всё бесполезно.Год хватало а потом опять лезли жучки и причём как раковая опухоль увеличивалась.Дошло до сквозных дыр которые латал шпаклёвкой с наполнителем.Всё равно закончилось бы заменой крыльев но не успел,разбил в смятку.
Реакция взаимодействия железа с хлором — не в счет
процесс гниения есть процесс окисления металла, а окисление металла это потеря металлом электронов.
т.е. для того чтобы окислиться железо должно вступить в реакцию с каким либо веществом которому электронов не хватает (а у железа избыток имеется)
самый простой окислитель это кислород, так что на земле будет гнить все и всегда другое дело что кислород окисляет очень медленно сам по себе и на это можно забить.
другое дело окисление солями и прочими кошерными веществами (серной кислотой например), тут все проходит быстрее и последствия более страшные. плюс ко всему в случае с солями и кислотами процесс идет намного быстрее в присутствии воды, так как вода растворяя соли распределяет их по поверхности и при этом держит максимально близко, что как нельзя лучше благоприятствует реакции
есть еще окисление в присутствии гальванической пары, это когда 2 металла прикасаются и у одного явная нехватка электронов а у другого их избыток, так происходит например при контакте алюминия и железа железо восстанавливает алюминий и соотв теряет электроны (окисляется).
как общие советы, держать все в чистоте и в проветриваемом помещении ну и обработка всякими нейтральными веществами хорошо помогает например почему цинком покрывают у цинка электронов свободных еще больше чем у железа и соотв если что-то пытается восстановиться при помощи оцинкованной рамы, цинк в первую очередь жертвует электронами и рама остается нетронутой.
за неакадемичность изложения просьба тапками не кидать
Считается, что алюминий не ржавеет. Но это неправда. Рассказываем, почему.
Есть мнение, что алюминий не ржавеет и не портится на воздухе. Это близко к правде, но не совсем. К атмосферным воздействиям алюминий действительно устойчивее, чем железо. Но и он может корродировать, теряя твердость и внешний вид.
В этой статье расскажем, почему ржавеет алюминий и какие меры принимаются на производстве, чтобы этого избежать.
Почему (не) ржавеет алюминий
Микроструктура алюминия устроена так, что он защищает от коррозии сам себя. Под воздействием контакта с воздухом свободные атомы алюминия на поверхности «цепляют» кислород и образуют пленку из оксида алюминия. Она и препятствует запуску коррозионных процессов.
Но оксидная пленка − это не танковая броня. Скорее это кожица, как у яблока. Пока плод спрятан внутри, ему ничего не грозит. Если надкусить яблоко и оставить на тарелке, повреждение быстро начнет темнеть − пойдут те самые окислительные процессы.
Примерно то же самое происходит с алюминием. Пока пленка сохраняет целостность, все в порядке. Но, если ее нарушить, алюминий тоже будет корродировать. Сильнее всего оксидной пленке вредят механические воздействия, кислотные и щелочные соединения в атмосфере.
Самые серьезные разрушители алюминия − фтор, калий и натрий. Они вступают в реакцию с кислородом, как бы вытягивая его из оксидной пленки. Устойчивость материала к коррозии падает. Также для алюминия вредны соединения брома и хлора, растворы извести, цемент. Активно разрушается оксидный слой под воздействием соленого морского воздуха в прибрежных регионах.
Так выглядит ржавчина на старых автомобильных дискахТем более, «идеальная» оксидная пленка образуется только в лабораторных условиях с чистым алюминием и беспримесным воздухом. В реальной промышленности обычно используются сплавы на основе алюминия. Да и воздух чаще всего содержит целый букет разнообразных соединений.
Те же автомобильные диски, как правило, делают из сплавов с участием кремния. Кремний делает материал более текучим − это важно при выплавке дисков. Плюс повышает износостойкость изделия.
Антикоррозионные свойства зависят от состава алюминиевого сплава.
Повышение антикоррозионных свойств алюминия
В промышленности для повышения антикоррозионных свойств алюминия применяют анодирование.
Этот метод решает сразу две проблемы:
- Во-первых, дополнительно защищает алюминий от коррозии.
- Во-вторых, надежно окрашивает материал в один из многочисленных вариантов расцветки.
При анодировании с поверхности удаляется естественная оксидная пленка и создается новая − значительно толще и прочнее. Естественный оксидный слой обычно не превышает 0,01 мкм. Анодирование позволяет создать защитное покрытие толщиной до 25 мкм. Это уже не яблочная кожура, а настоящая скорлупа ореха. Повредить ее значительно сложнее. Поэтому анодированный алюминий значительно долговечнее обычного.
Процесс анодирования алюминия
Есть несколько технологий анодирования. В цехах «Новаметалтрейд» используется следующий подход:
Обезжиривание. Прокат погружается в ванну с поверхностно-активным веществом, которое удаляет грязь и пятна масел. Этот этап нужен, чтобы качественно подготовить поверхность к следующему.
Травление. Подготовленный прокат погружается в ванну с щелочным раствором, который разрушает естественную оксидную пленку и верхний слой чистого металла.
Осветление. В результате травления на поверхности металла остается тонкий слой из окислов элементов, которые входят в состав щелочного раствора. На этой стадии поверхность проката очищается от тяжелых металлов и готовится непосредственно к анодированию.
Анодирование. Прокат помещается в проводящую среду, и производится анодная поляризация. В результате на поверхности вырастает прочная пористая пленка, которая обеспечивает материалу высокую коррозионную стойкость.
Абсорбционное окрашивание. Прокат помещается в среду, содержащую красящий пигмент. Пигмент проникает в образовавшиеся поры, придавая поверхности ровный однородный цвет.
Уплотнение. Это финальный технологический этап. Прокат погружается в кипящую воду и выдерживается там. Под таким воздействием поры надежно закупориваются. Теперь пигмент не вымывается с поверхности под воздействием внешних факторов, а материал надолго сохраняет свой внешний вид.
Коррозия дачного стального водопровода — способы уберечь металл от разрушения
Водопровод — это огромное достижение человечества. «Без воды и не туды не не сюды», как пел один известный персонаж из знаменитого советского фильма сталинской эпохи. И на своем участке всегда хочется сделать его хорошо — чтобы было и красиво, и ремонтировать было не нужно, причем желательно никогда. Какие же проблемы могут подстерегать обычную стальную трубу?
Конечно, основной риск заключается в коррозии. А вот какая эта самая коррозия бывает и как с ней бороться, давайте обсудим в этой заметке.
Главная проблема любого металлического сооружения в нашем мире — это коррозия. Она уничтожает тысячи тонн металла ежегодно, разрушает металлоконструкции, в том числе такие важные, как мосты и трубопроводы. Нужно понимать, что коррозии подвержен почти любой металл и вопрос в допустимой степени разрушения конструкции, а не в полном исключении коррозии. Полностью ее исключить практически невозможно, да часто и не нужно.
Итак, первое, что сразу нужно иметь ввиду касательно нашего обсуждаемого частного водопровода, это то, как мы его будем размещать. Если над поверхностью земли, например, надземно на опорах, то у нас наружная поверхность трубопровода будет подвергаться атмосферной коррозии, а если закопаем под землю, то подземной или, правильнее сказать, почвенной. Второй вид существенно опаснее. От атмосферной коррозии есть простой и эффективный метод защиты — лакокрасочное покрытие. А если еще наш трубопровод иногда и подкрашивать в процессе эксплуатации, то никакой коррозии можно не опасаться.
Если же труба подземная, то ситуация становится немного сложнее — почвенная коррозия развивается с большей скоростью, по электрохимическому механизму. Тут сразу можем дать совет — никакой нержавейки или оцинковки под землю. Они ржавеют. Условия их применения не подразумевают подземное использование. У нержавейки другой механизм предотвращения коррозии (очень подробно об этом написано здесь ), который не предусматривает подземное размещение. А оцинковка — это вообще очень ограниченный метод защиты, который не применим чаще, чем применим.
Таким образом, если у нас есть проблемы с наружной почвенной коррозией — есть два способа их снять. Первый и самый простой — покрасить специальной стойкой краской. Несколько лет пролежит. Хотя на магистральных трубопроводах не зря используют не краску, а полиэтиленовые покрытия. Второй способ — этоэлектрохимическая защита: с интервалом 20-50 метров рядом с трубой в землю закапываются болванки другого металла, обладающего протекторными свойствами по отношению к стали, например магний, цинк или алюминий. С защищаемой трубой обеспечивается прямое электрическое соединение, используя обычный кабель. Такие болванки будут разрушаться, защищая собой сталь. Но это есть смысл делать, если вы уже знаете, что у вас подземные трубы корродируют быстро. В многих грунтах средней полосы они и так будут разрушаться по 30-40 лет, а на Севере и того дольше. При температурах ниже ноля скорость коррозии резко уменьшается. И спрашивается, зачем копья ломать?
Теперь про внутреннюю коррозию. Подземные воды, в особенности из артезианских скважин, в целом содержат немного кислорода, поэтому особой опасности для металлических труб не представляют. Если вода хлорируется, то металл это переносит хуже, но тоже живет. А вот если эту воду предварительно греть, а уже потом направлять в металлическую трубу, тогда могут быть проблемы. Нагретая вода начинает выделять кислород, а дальше сами понимаете. Коррозия водопроводов горячей воды вообще является глобальной и сложной задачей, выходящей за рамки данной заметки. Обзор проблемы и методы ее решения можно прочитать здесь . А в рамках нашего небольшого обзора стоит только сказать, что для частных домов проще следовать простому правилу — никаких металлических труб для нагретой горячей воды. И точка.
Что еще делать категорически нельзя? Ну, например, подключать водопровод в качестве заземления. Блуждающие токи очень быстро разрушают любой металл, поэтому крайне нежелательно делать заземлением любую полезную конструкцию в доме. Но это уже тема отдельной большой заметки.
Коррозия металла: почему ржавеет кузов и как с этим бороться

Думаете, что ржавчина — это проблема владельцев 15-летних "Жигулей"? Увы, рыжими пятнами покрываются и гарантийные авто, даже если кузов оцинкован. Разбираемся, как правильно ухаживать за металлом и можно ли защитить его от коррозии раз и навсегда.
Что такое кузов? Конструкция из тонкого листового металла, причем разных сплавов и со множеством сварных соединений. И еще не нужно забывать о том, что кузов используется как "минус" для бортовой сети, то есть постоянно проводит ток. Да он просто обязан ржаветь! Попробуем разобраться, что же происходит с кузовом машины и как с этим бороться.
Что такое ржавчина?
Коррозия железа или стали — процесс окисления металла кислородом в присутствии воды. На выходе получается гидратированный оксид железа — рыхлый порошок, который мы все называем ржавчиной.
Разрушения автомобильного кузова относят к классическим примерам электрохимической коррозии. Но вода и воздух — это лишь часть проблемы. Помимо обычных химических процессов важную роль в нем играют гальванические пары, возникающие между электрохимически неоднородными парами поверхностей.
Уже вижу, как на лицах читателей-гуманитариев возникает скучающее выражение. Не пугайтесь термина "гальваническая пара" — мы не на лекции по химии и сложных формул приводить не будем. Эта самая пара в частном случае — всего лишь соединение двух металлов.
Металлы, они почти как люди. Не любят, когда к ним прижимается кто-то чужой. Представьте себя в автобусе. К вам прижался помятый мужчина, вчера отмечавший с друзьями какой-нибудь День монтажника-высотника. Вот это в химии называется недопустимой гальванической парой. Алюминий и медь, никель и серебро, магний и сталь… Это "заклятые враги", которые в тесном электрическом соединении очень быстро "сожрут" друг друга.

Вообще-то, ни один металл долго не выдерживает близкого контакта с чужаком. Сами подумайте: даже если к вам прижалась фигуристая блондинка (или стройная шатенка, по вкусу), то первое время будет приятно… Но не будешь же так стоять всю жизнь. Особенно под дождем. Причем тут дождь? Сейчас все станет понятно.
В автомобиле очень много мест, где образуются гальванические пары. Не недопустимые, а "обычные". Точки сварки, кузовные панели из разного металла, различные крепежные элементы и агрегаты, даже разные точки одной пластины с разной механической обработкой поверхности. Между ними всеми постоянно есть разность потенциалов, а значит, в присутствии электролита будет и коррозия.
Стоп, а что такое электролит? Пытливый автомобилист вспомнит, что это некая едкая жидкость, которую заливают в аккумуляторы. И будет прав лишь отчасти. Электролит — это вообще любая субстанция, проводящая ток. В аккумулятор заливают слабый раствор кислоты, но не обязательно поливать машину кислотой, чтобы ускорить коррозию. С функциями электролита прекрасно справляется обычная вода. В чистом (дистиллированном) виде она электролитом не является, но в природе чистой воды не встречается…
Таким образом, в каждой образовавшейся гальванической паре под воздействием воды начинается разрушение металла на стороне анода — положительно заряженной стороны. Как победить этот процесс? Запретить металлам корродировать друг от друга мы не можем, но зато можем исключить из этой системы электролит. Без него "допустимые" гальванические пары могут существовать долго. Дольше, чем служит автомобиль.

Как с ржавчиной борются производители?
Самый простой способ защиты — покрыть поверхность металла пленкой, через которую электролит не проникнет. А если еще и металл будет хорошим, с низким содержанием примесей, способствующим коррозии (например серы), то результат получится вполне достойным.
Прикрыв фосфатную пленку слоями грунта и краски можно защитить кузов машины на долгие годы, именно по такому "рецепту" готовили кузова на протяжении десятков лет, и, как видите, довольно успешно — многие машины производства пятидесятых-шестидесятых годов смогли сохраниться до наших времен.
Но далеко не все, ведь со временем краска склонна к растрескиванию. Сначала не выдерживают внешние слои, потом трещины добираются до металла и фосфатной пленки. А при авариях и последующем ремонте покрытия часто наносят, не соблюдая абсолютной чистоты поверхности, оставляя на ней маленькие точки коррозии, которые всегда содержат в себе немного влаги. И под пленкой краски начинает появляться новый очаг разрушения.

Можно улучшать качество покрытия, применять все более эластичные краски, слой которых может быть чуть надежнее. Можно покрыть пластиковой пленкой. Но есть лучшая технология. Покрытие стали тонким слоем металла, имеющего более стойкую оксидную пленку, использовалось давно. Так называемая белая жесть — листовая сталь, покрытая тонким слоем олова, знакома всем, кто хоть раз в жизни видел консервную банку.
Олово для покрытия кузовов машин уже давно не применяют, хотя байки про луженые кузова ходят. Это отголосок технологии выправления брака при штамповке горячими припоями, когда часть поверхности вручную покрывали толстым слоем олова, и иногда самые сложные и важные части кузова машины и правда оказывались неплохо защищены.
Современные покрытия для предотвращения коррозии наносятся в заводских условиях до штамповки кузовных панелей, и в качестве "спасателей" используется цинк или алюминий. Оба этих металла, помимо наличия прочной оксидной пленки, обладают еще одним ценным качеством — меньшей электроотрицательностью. В уже упомянутой гальванической паре, которая образуется после разрушения внешней пленки краски, они, а не сталь будут играть роль анода, и, пока на панели остается немного алюминия или цинка, разрушаться будут именно они. Этим их свойством можно воспользоваться иначе, просто добавив немного порошка таких металлов в грунт, которым покрывают металл, что даст кузовной панели дополнительный шанс на долгую жизнь.

В некоторых отраслях промышленности, когда стоит задача защитить металл, применяют и другие технологии. Серьезные металлоконструкции могут быть оборудованы и специальными пластинами-протекторами из алюминия и цинка, которые можно менять со временем, и даже системами электрохимической защиты. С помощью источника напряжения такая система переносит анод на какие-то части конструкции, не являющиеся несущими. На автомобилях подобные вещи не встречаются.
Многослойный бутерброд, состоящий из слоя фосфатов на поверхности стали или цинка, слоя цинка или алюминия, антикоррозийного грунта с цинком и нескольких слоев краски и лака, даже в очень агрессивной внешней среде вроде обычного городского воздуха с влагой, грязью и солью позволяет сохранить кузовные панели на десяток-другой лет.
В местах, где слой краски легко повреждается (например на днище) используют толстые слои герметиков и мастики, которые дополнительно защищают поверхность краски. Мы привыкли называть это "антикором". Дополнительно во внутренние полости закачивают составы на основе парафина и масел, их задача вытеснять влагу с поверхностей, тем самым еще улучшая защиту.
Ни один из способов по одиночке не дает стопроцентной защиты, но все вместе они позволяют производителям давать восьми-десятилетнюю гарантию на отсутствие сквозной коррозии кузова. Однако нужно помнить, что коррозия подобна смерти. Ее приход можно замедлить или отложить, но нельзя исключить совсем. В общем, что мы говорим ржавчине? Правильно: "Не сегодня". Или, перефразируя современного классика, "не в этом году".

Как продлить жизнь кузову?
Итак, как бы вы ни любили свой автомобиль, рано или поздно он превратится в кучку гидратированного оксида железа. Но это не повод расстраиваться — жизнь кузовному металлу можно и нужно продлить.
Гарантия на отсутствие сквозной коррозии действует только при правильном восстановительном ремонте у дилера, не забывайте об этом. На ТО необходимо восстанавливать лакокрасочное покрытие (ЛКП) по правильной технологии.
Не пренебрегайте дополнительной антикоррозийной защитой — масляные и парафиновые пленки высыхают и испаряются, их нужно обновлять.
Держите кузов машины чистым. Грязь вбирает влагу, которая таким образом сохраняется на поверхности и долго выполняет свою разрушительную функцию, потихоньку проникая через микротрещины к железу.
Своевременно восстанавливайте повреждения ЛКП, даже если кузов оцинкованный. Ведь то, что "голый" металл не ржавеет, является следствием постоянного "расхода" металлов-защитников, а их на поверхности отнюдь не килограммы.
Пользуйтесь услугами квалифицированных кузовных сервисов, ведь правильное восстановление поверхности требует очень аккуратной и чистой работы, с полным пониманием происходящих процессов. А предложения просто закрасить всё слоем краски потолще обязательно приведут вас в кузовной цех еще раз, причем с куда более серьезными повреждениями металла.
«Рыжая чума», или что мы знаем о ржавчине и коррозии

Пожалуй, каждый автомобилист согласится с тем, что именно ржавчина – одна из самых неприятных проблем, способных омрачить настроение любого автовладельца. Казалось бы, ещё вчера машина радовала взгляд безупречным глянцем лакокрасочного покрытия и вдруг – по кузову полезли «жуки», появились рыжие пятна. На первых порах ничего, кроме эстетического неудовольствия автовладельца, ржавчина под собой не подразумевает. Да и сквозные дыры в крыльях или дверях автомобиля, возникающие в запущенных случаях, неприятны, но, практически неопасны. А вот когда процесс глубоко поразил детали силового каркаса кузова или подвеску машины, последствия могут быть весьма печальными. «Страшилки» про сложившиеся при ДТП «домиком» кузова старых автомобилей – как раз из этой «оперы».
Да что там машины! Ржавчина является одной из главных причин аварий таких титанических железных конструкций, как мосты. Так, 28 июня 1983 года в США произошла катастрофа с мостом через реку Мианус (Mianus). В результате падения в воду с высоты 21 метра двух автомобилей и двух тракторных прицепов погибли 3 человека и ещё 3 были серьёзно травмированы.
Участок межштатного 95-го моста длиной 100 футов через реку Мианус в Гринвиче, Коннектикут, рухнул 29 июня 1983 года. Фотография Боба Чайлда
Согласно заключению комиссии Национального совета по безопасности на транспорте, разрушение было вызвано механической поломкой наружного кронштейна, удерживающего пролёт моста, и его обоих штифтов («пальцев»). Ржавчина образовалась в подшипнике «пальца» кронштейна. Ее объем всегда превышает объем исходной металлической детали, что приводит к неравномерному сопряжению друг с другом деталей конструкции. В случае с данным мостом, масса ржавчины отодвинула внутренний кронштейн от конца штифта, скрепляющего между собой наружный и внутренний кронштейны. (При этом возникло усилие, превышающее допустимые проектом пределы для зажимов, удерживающих эти «пальцы»!) В результате вся масса пролета переместилась на внешний кронштейн. Такая непредвиденная нагрузка на него вызвала усталостную трещину в «пальце». Когда два тяжелых грузовика въехали в данную секцию моста, штифты окончательно разрушились, и пролет упал в реку…
Вообще, процесс коррозии и образования ржавчины сопровождает нас с незапамятных времён. Одновременно с открытием железа и началом железного века человечество столкнулось и с возникновением ржавчины на создаваемых им орудиях труда и предметах быта.
Что такое ржавчина?
Что же такое ржавчина? В обычной жизни этим словом обозначают красные оксиды железа, образующимся в ходе его реакции с кислородом в присутствии воды или влажного воздуха. При наличии кислорода, воды и неограниченного времени любое количество железа, в конце концов, полностью разрушается, превратившись в ржавчину. Физически она представляет собой рыхлый порошок светло-коричневого цвета.
Процесс превращения железа в ржавчину называется коррозией – самопроизвольным разрушением металлов и их сплавов в результате химического, электрохимического или физико-химического взаимодействия с окружающей средой. Разрушение металлов и сплавов по физическим причинам не является коррозией, а характеризуется терминами «истирание» и «износ».
С точки зрения химии коррозия металлов чаще представляет собой процесс их окисления и превращения в оксиды. Ржавление железа – также химическая коррозия. В виде упрощенных уравнений она может быть описана так:
4Fe + 3O2 + 2H2O = 2Fe2O3⋅H2O или 4Fe + 3O2 + 6H2O = 4Fe(OH)3
Т.о. ржавчина состоит из гидратированного оксида железа (III) Fe2O3⋅H2O, гидроксида железа (III) Fe(OH)3 и метагидроксида железа FeO(OH).
Интересно, что ржавчиной, как правило, называют продукты коррозии железа и его сплавов, (например, стали), хотя на самом деле целый ряд металлов также подвергается коррозии.
Однако, многие металлы (Cu, Ti, Zn, Cr, Al и др.) при коррозии покрываются плотной, хорошо скрепленной с ними оксидной пленкой (слой пассивации). Он не позволяет кислороду воздуха и воде проникнуть в более глубокие слои металла и потому предохраняет его от дальнейшего окисления (коррозии).
Взять, к примеру, алюминий – в химическом отношении это очень активный металл, хорошо реагирующий с водой с бурным выделением газа водорода:
2Al + 3H2O = Al2O3+ 3H2 ↑
Но, по причине той же высокой активности, чистый алюминий также хорошо реагирует и с кислородом воздуха. В результате этого взаимодействия поверхность металла покрывается прочной плотной плёнкой оксида Al2O3. Оксидная плёнка защищает алюминий от дальнейшего взаимодействия с водой и кислородом. Именно по этой причине нагреваемая в алюминиевой кастрюльке вода хоть и кипит, но не вступает в реакцию с металлом. (Потому такая посуда может служить длительное время.)
Как ни странно, химически чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у алюминия, плотно скреплённое с поверхностью металла оксидное покрытие защищает основную массу железа от дальнейшего окисления.
Однако, надо отметить, что химически чистое железо в своей деятельности человечество практически не применяет. На практике наша цивилизация использует сталь и чугун – сплавы железа с углеродом (и другими химическими элементами), содержащие не менее 45% железа.
В реальной жизни в воздухе наших городов содержатся оксиды серы, азота, углерода и ряд других; а в воде – растворённые газы и соли. Поэтому процесс коррозии металлов и его продукты зачастую выглядят не так просто, как в учебнике химии за 9 класс. Так, бронзовые статуи, корродируя, покрываются слоем хорошо знакомой нам зелёной патины, представляющей собой с точки зрения химии не гидроксид, а основной сульфат меди (II) (CuOH)2SO4.
В отличие от оксида алюминия и появляющейся на бронзовой (медной) поверхности патины, ржавчина, образующаяся на сплавах железа, не создаёт никакой защиты для нижележащего металла.
Усугубляет ситуацию с коррозией железа содержание неметаллических примесей в его сплавах. Например, наличие серы в сплаве лишь способствует развитию ржавчины. Обычно она присутствует, как сульфид FeS, но может быть и в виде других химических соединений. В процессе коррозии сульфид железа разлагается с выделением газа сероводорода (H2S), который сам по себе является хорошим катализатором дальнейшей коррозии железа:
FeS + 2HCl = H2S ↑+ FeCl2
Нас удивляет хорошая сохранность (а значит, устойчивость к коррозии) ряда железных предметов, дошедших из глубины веков до наших дней. Одна из причин этого – низкое содержание в них серы. В сплавы железа сера обычно попадает из каменноугольного кокса при выплавке железа из руды в доменной печи. А вот в древние времена для производства этого металла использовался не каменный, а, практически не содержащий серы, древесный уголь…
По выраженности поражения различают сплошную и местную коррозию металлов. Как ни странно, но сплошная коррозия не представляет большой опасности для металлических конструкций и агрегатов. Считается, что она предсказуема, а ее последствия могут быть относительно легко смоделированы. Поэтому при проектировании металлоконструкций, эксплуатирующихся в водной среде или под открытым небом, в соответствии с технически обоснованными нормами, учитываются и будущие потери металла на коррозию.
Усугубляющие факторы
А вот местная коррозия гораздо опаснее, несмотря на то, что потери металла из-за неё могут быть вполне небольшими. Один из самых опасных видов местной коррозии – точечная. Ведь снижая прочность на отдельных участках, она значительно уменьшает общую надёжность конструкций, сооружений и агрегатов. Суть её заключается в формировании сквозных поражений деталей – образовании в них точечных полостей, называемых питтингами.
Развитию местной коррозии очень способствуют морская вода и растворы солей, в частности хлориды (особенно хлорид натрия – NaCl). Во многих странах его используют для плавления снега и льда, разбрасывая зимой на дорогах и тротуарах. В присутствии NaCl лёд и снег превращаются в воду, с дальнейшим образованием соляных растворов.
При этом не учитывается, что соли (и особенно хлориды) являются активаторами коррозии! Отлично диссоциируя в воде и взаимодействуя с образующейся из-за выбросов предприятий серной кислотой, хлориды образуют соляную кислоту (HCl). А ведь она сама по себе является триггером коррозии! (Вспомним приведенную выше реакцию с входящим в состав стали сульфидом железа.) Какие ещё нужны доказательства, что зимняя соляная «каша» приводит к ускоренному разрушению металла деталей, узлов и агрегатов транспортных средств?
Экономические потери от коррозии металлов
Экономические потери от коррозии металлов огромны. Современная цивилизация тратит значительные материальные и финансовые ресурсы на борьбу с коррозией трубопроводов, мостов и морских конструкций, судов, деталей машин, а также различного технологического оборудования.
Как уже говорилось, из-за планирования возможной коррозии приходится завышать прочность таких важных и нагруженных узлов и агрегатов, как паровые котлы, реакторы, лопатки и роторы турбин, опоры морских буровых платформ. Это автоматически увеличивает расход металла на их изготовление, а, значит, приводит к дополнительным экономическим затратам.
За два века работы металлургической промышленности в мире было выплавлено огромное количество металла. При этом, потери на коррозию составляют около 30% от его годового мирового производства! Более того – около 10% подвергшегося коррозии металла безвозвратно теряется в виде ржавчины.
По оценкам ряда экспертов, ущерб от коррозии металлов бюджету промышленно развитых стран составляет от 2 до 4 % их валового национального продукта. Так, по данным Национальной ассоциации инженеров-коррозионистов (National Association of Corrosion Engineers – NACE) в США потери от коррозии и затраты на борьбу с ней составляют 3,1 % ВВП. Для Германии это обходится в 2,8 % от ВВП.
P.S. Казалось бы, проблемы коррозии автомобильных кузовов, узлов и агрегатов меркнут на фоне вопросов защиты от коррозии таких грандиозных железных сооружений, как мосты и Эйфелева башня. Но, это только на первый взгляд. А если учесть численность мирового автопарка? Так, по данным Международной ассоциации автопроизводителей (OICA), в 2015 году в мире эксплуатировалось 947 млн. легковых и 335 млн. коммерческих автомобилей. Ожидается, что к 2035 году мировой автопарк достигнет 2-миллиардной отметки.
При этом, коррозией в той или иной степени, рано или поздно поражается практически 100% транспортных средств. Кроме того, надо учесть, что кузов – самая дорогая деталь автомобиля, а кузовные работы (и слесарные, и малярные) достаточно материалоёмкие и очень недешёвые.
Поэтому, проблема изыскания новых и совершенствование старых способов защиты от коррозии актуальна, как для всей тяжёлой промышленности в целом, так и для автомобильной отрасли в частности.
___________
KROWN — ЗА НАМИ НЕ ЗАРЖАВЕЕТ
Центр антикоррозийной защиты автомобилей
Почему вода ржавая

Ржавчина — универсальный термин для обозначения окислов железа. Как правило, применяется к наиболее распространенным красным оксидам, с которыми мы чаще сталкиваемся. Ржавчина встречается в различных формах:
- налет;
- хлопья;
- взвесь;
- пленки;
- отдельные кристаллы;
- плитки.
В жидкой среде окисленное железо встречается в форме взвеси, поскольку оно не растворяется при нормальных условиях. Мутная жидкость, содержащая рыжую взвесь и называется «ржавой».
Основные причины появления ржавой воды
Прародитель ржавчины присутствует в жидкости в двух формах: восстановленное (Fe 2+ ) и окисленное (Fe 3+ ). Перевести этот элемент из одной формы в другую могут агенты из класса потребителей электронов: растворенный кислород, перекись водорода, активный хлор, озон.
Важно: если Fe находится в восстановленной форме, его можно не заметить.
Во время трансформации элемента в окисленную форму окраска жидкости становится хорошо заметной, охристо-рыжей. При этом оксиды элемента могут осаждаться в трубах и на поверхностях как самостоятельно, так и вместе с солями жёсткости, со временем образуя мощные труднорастворимые корки, которые трудно не заметить.
Таким образом, для появления ржавой воды необходимо соблюсти два условия:
- высокое содержание железа
- достаточное количество окислителей
Источники железа в воде
Fe — один из самых распространенных элементов на Земле, что, например, обуславливает активное использование красного цвета — практически все его соединения красные и при этом относительно дешёвые. Этот элемент является основой таких минералов, как гематит, магнитит, лимонит, пирит и др., а также относится к числу макроэлементов и входит в состав гемоглобина и сигнальных систем организма. Его соединения часто встречаются в природных водах. Вероятность высокого содержания железа повышают следующие факторы:
- низкое содержание растворенного кислорода (глубокие скважины);
- контакт с железосодержащими породами (скважины, родники);
- кислая реакция среды (колодцы, содержимое которых контактирует с торфами);
- высокое содержание органических веществ (колодцы, некоторые скважины, находящиеся в области кислых почв и хвойных лесов).
Влияние концентрации железа на качество воды
В зависимости от концентрации иона потребитель может столкнуться со следующими последствиями:
Менее 0,2 миллиграмм/литр: негативных последствий нет. Вещество не оказывает негативного влияния на организм. Вода не имеет ржавой окраски. Корректирующих действий не требуется.
0,2-0,4 миллиграмм/литр: в зонах попеременного увлажнения и высыхания образуются ржавые плёнки или налёт — например, на раковине или унитазе. Такая концентрация оказывает негативное влияние на здоровье человека, особенно страдает группа людей с хроническими заболеваниями сосудов. Концентрацию элемента в таком случае снижают, используя фильтры с обменными смолами.
0,4-1,0 миллиграмм/литр: все поверхности, контактирующие с жидкой средой, покрываются ржавой пленкой. Употребление внутрь оказывает негативное влияние на здоровье человека вне зависимости от чувствительности к железу. Жидкость становится ржавой при длительном контакте с воздухом. Быстро забиваются отверстия душа, ржавеет нагревательный элемент стиральной машины. Ион-обменные смолы не могут гарантированно справляться с такой концентрацией, поэтому может потребоваться предварительная аэрация или окисление Fe 3+ для его удаления из раствора.
Более 1 миллиграмм/литр: ржавая жижа течет непосредственно из крана, пока последний не забивается. Все поверхности, контактирующие с жидкостью, покрываются толстым, трудно смываемым слоем ржавчины, периодическое удаление налёта больше не спасает, бельё желтеет после стирки. Пить такую воду категорически запрещено, использовать обслуживания техники — не рекомендуется. Необходимо предварительное окисление или аэрация раствора для удаления ржавчины и последующее использование ион-обменных смол.
Последствия для здоровья
Употребление воды с высоким содержанием железа приводит к развитию атеросклероза сосудов. Ситуацию может усугубить одновременное систематическое употребление витамина C, который способствует улучшению всасывания иона. Возможно ухудшение состояния волос, ногтей и зубов.
Последствия для бытовой техники
В сочетании с высокой жесткостью, элемент способен оказывать «смертельный» эффект на бытовую технику, в особенности, стиральные машины, водонагреватели и приборы с тонкими шлангами и трубками. Выпадая в осадок, может полностью закупоривать трубы маленького диаметра, прекращая ток жидкости в системе.
Способы борьбы
Универсальная система борьбы с железом выглядит следующим образом:
- Аэрация или добавление окисляющего компонента (перекись, гипохлорит, озон);
- Удаление осадка из зоны аэрации;
- Использование ион-обменных смолы для тонкой очистки.
Важно: низкое содержание железа в питьевой воде не несет негативных последствий для организма, поэтому его можно убирать полностью, в отличие от кальция.
Для подбора необходимой системы фильтрации требуется проведение лабораторного анализа. Только после определения точной концентрации можно подобрать правильную систему водоподготовки.
Железо в воде: полезные свойства и опасность

Железо является характерным элементом природных вод зоны избыточного увлажнения. На территории этой природной зоны расположены города Центральной части России, Сибири и Дальнего Востока. В подземных водах Москвы и Московской области содержание железа превышает значение ПДК практически повсеместно.
Железо – один из самых распространенных элементов в природе. Его содержание в земной коре составляет около 4,7 % по массе, поэтому железо, с точки зрения его распространенности в природе, принято называть макроэлементом. Известно свыше 300 минералов, содержащих соединения железа. Среди них – магнитный железняк альфа FеО(ОН), бурый железняк Fе3О4*Н2О, гематит (красный железняк) и другие. Главными источниками соединений железа в поверхностных водах являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состояниях. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и сельскохозяйственными стоками.


Воздействие на организм
Железо является жизненно важным микроэлементом для животных и растений, то есть элементом, необходимым для жизнедеятельности живых организмов в малых количествах. В организме человека железо входит в состав важнейших в биологическом отношении органических соединений – гемоглобина крови и ряда ферментов. Около 70% железа, содержащегося в организме человека, входит в состав гемоглобина. Основным физиологическим назначением железа является участие в процессе кроветворения.
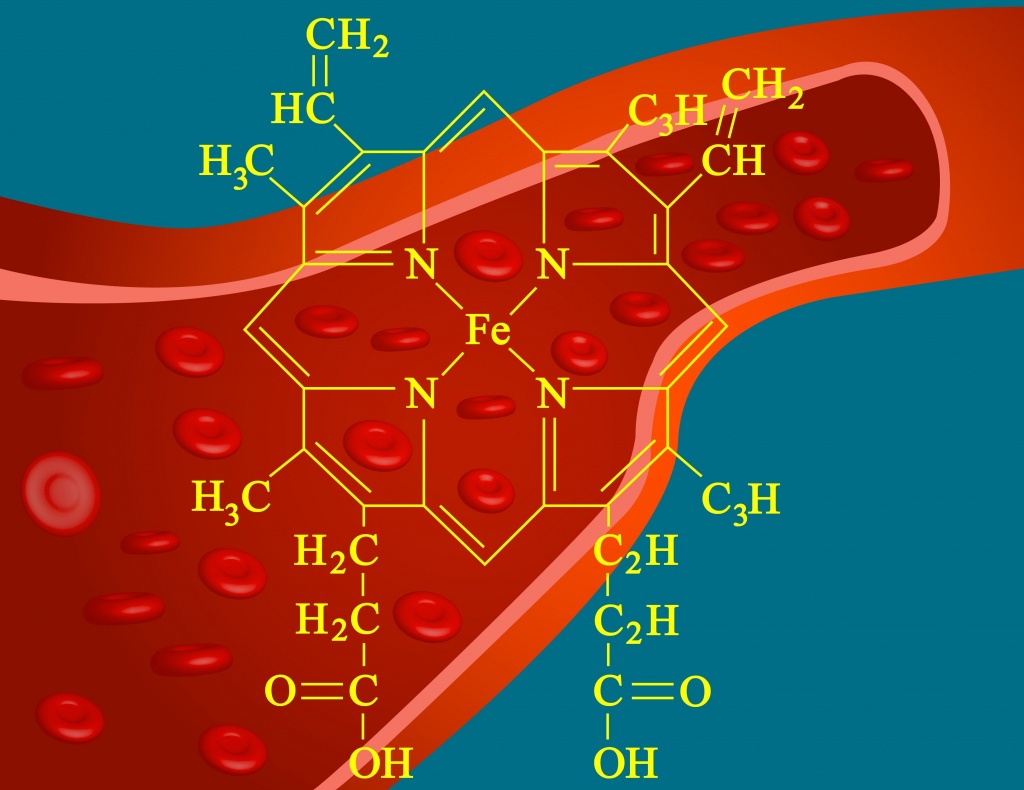
Железо в воде
В природных водах вода может содержать железо в разных формах. Чаще всего встречается двух- и трех- валентное железо. Чистая, прозрачная вода, изливающаяся из скважины, постояв некоторое время на воздухе, буквально на глазах начинает мутнеть, приобретая характерную рыжевато-бурую окраску. Это происходит потому, что соединения двухвалентного железа, вступив в контакт с кислородом воздуха, окисляются и переходят в нерастворимую форму трехвалентного железа - осадок, называемый ржавчиной. Содержание железа в воде выше 1-2 мг Fe /дм 3 значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования даже в технических целях. ПДК железа составляет 0,3 мг Fe /дм 3 (лимитирующий показатель вредности – органолептический).
Ржавчина очень часто встречается в водопроводной воде. Одна из основных причин - устаревшие системы водоснабжения. Пройдя очистку на муниципальных водопроводных очистных сооружениях, вода обычно содержит небольшое количество железа, укладывающиеся в медицинские нормы, но проходя до конечного потребителя через многие километры труб распределительной водопроводной сети, она подвергается вторичному загрязнению, растворяя продукты коррозии стальных труб.
В результате на выходе мы вновь имеем «железистую» воду с желтоватым оттенком. Насыщенная соединениями железа вода имеет не только неприятный вид. Она портит запорную арматуру, оставляет ржавые подтеки на керамических поверхностях сантехники. Кроме того, медиками доказано, что вода с повышенным содержанием железа (свыше 0,3 мг/л) приводит к заболеваниям печени, увеличивает риск инфарктов, негативно влияет на репродуктивную функцию организма, а также служит причиной появления аллергических реакций.
Повышенное содержание железа в воде создает благоприятные условия для развития железобактерий, особенно в подогретой воде. Эти микроорганизмы образуют ветвящиеся колонии, которые осложняют работу гидротехнических сооружений. Продукты жизнедеятельности железобактерий являются канцерогенами. Железообрастания внутри труб – идеальная среда для развития кишечной палочки, гнилостных бактерий, различных других микроорганизмов. Все это ухудшает химические и бактериологические показатели воды.
Очистка воды от железа
В природных водах может присутствовать двухвалентное (закисное) или трехвалентное (окисное) железо. Наиболее часто в воде подземных источников железо встречается в виде бикарбоната закиси железа Fe(HCO3)2, то есть двууглекислого железа. Из подземных вод двухвалентное железо может быть устранено при помощи аэрации воды. Надо отметить, что двууглекислое железо в воде частично гидролизуется, теряя углекислоту. Гидрат закиси железа Fe(OH)2, соединяясь с кислородом, превращается в коллоидную гидроокись железа Fe(OH)3, которая при коагулировании переходит в окись железа Fe2O33H2O, выпадающую в виде бурых хлопьев. Поэтому после аэрации нужно пропускать воду через контактные резервуары и фильтры.
Если в воде содержится сернокислое железо FeSO4, то при аэрации такой воды ее обезжелезивание не достигается, так как при гидролизе растворенной соли железа образуется угольная кислота, понижающая рН воды до величины, меньшей 6,8, при которой гидролиз почти прекращается. Поэтому из воды СО2 удаляется путем ее предварительного известкования, после которого необходимы отстаивание и фильтрование воды.
Чтобы установить наиболее экономичный для данной воды способ обезжелезивания, надо произвести пробное удаление железа. Обезжелезивание воды для хозяйственно-питьевых нужд производят при содержании в исходной воде железа в количестве более 0,3 мг/л, при этом специальные установки предусматриваются только в тех случаях, когда железо не может быть удалено попутно при обработке воды на других очистных сооружениях.
Для того, чтобы решить, какой именно способ обезжелезнивания воды необходим именно вам, нужно понять, в каких формах железо представлено в вашей воде. Для этого рекомендуется обратиться к специалистам-аналитикам, а также профессионалам водоподготовки. Все эти вопросы находятся в компетенции лаборатории MSU LAB.
Читайте также:
