К активным металлам относятся
Обновлено: 04.10.2024

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
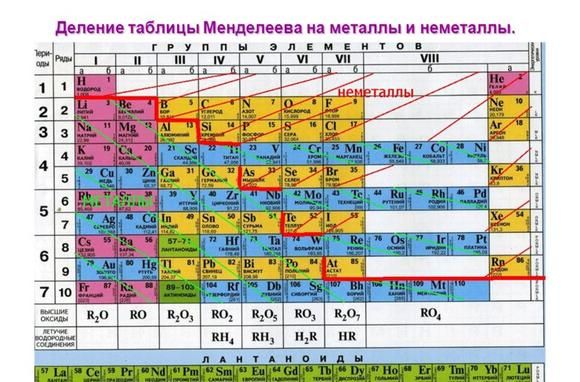
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Активные металлы

Среди всех металлов некоторые отличаются тем, что они очень легко вступают в восстановительные реакции. Такие металлы имеют много схожих свойств и объединяются в класс активных металлов.
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей. Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий. В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.

Электрохимический ряд напряжений металлов
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства щелочных металлов
Цвет всех щелочных металлов – белый, с серебристым оттенком. Исключением является цезий, имеющий серебристо-желтый цвет. Щелочные металлы можно резать простым скальпелем, так как у них низкая твердость. Также они имеют малую плотность – от 534 кг/м 3 у лития до 1900 кг/м 3 у цезия. Литий, калий и натрий настолько легкие, что они плавают в воде, но построить корабль из них не получится, так как вода быстро окисляет и разрушает эти металлы. Франций и цезий плавятся уже при комнатной температуре, а самый тугоплавкий щелочной металл – это литий, плавящийся при 180,6°С.
Для защиты щелочных металлов от воздуха и волы их хранят в керосине. При реагировании лития с водой выделяется водород, а натрий и особенно калий просто взрываются в воде. При взаимодействии с кислородом образуются оксиды.
Свойства щелочноземельных металлов
Щелочноземельные металлы значительно тверже щелочных, их нельзя просто взять и разрежать ножом. Также они тяжелее – их плотность колеблется от 1550 кг/м 3 у кальция до 5500 кг/м 3 у радия. Цвет щелочноземельных металлов – серый. Температуры плавления этих элементов находятся в диапазоне 650-840°С. Исключение – бериллий, плавящийся лишь при 1278°С.
Чем больше порядковый номер щелочноземельного металла в таблице Менделеева, тем выше его химическая активность. Например, бериллий вообще не взаимодействует с кислородом и по своим свойствам напоминает алюминий. Наиболее активные стронций, барий и радий приходится хранить в керосине, также как и щелочные металлы.
Подведение итогов
Активные металлы отличаются тем, что имеют лишь один-два валентных электрона, которые они легко отдают. Поэтому эти элементы очень быстро вступают в химические реакции, а в природе в чистом виде не встречаются.
Активные металлы – список в химии, таблица ряда


Рис. 1. Активные металлы в таблице Менделеева.

Рис. 2. Электрохимический ряд напряжений металлов.
– Ca + Br2 → CaBr2;
– 2Al + 3S → Al2S3
– 2Na + 2H2O → 2NaOH + H2;
– Ca + 2H2O → Ca(OH)2 + H2
– Ca + 2HCl → CaCl2 + H2;
– 2K + 2HMnO4 → 2KMnO4 + H2
2Na + CuCl2 + 2H2O:
– 2Na + 2H2O → 2NaOH + H2;
– 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl





Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s
. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3 и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).

Активные металлы в таблице Менделеева

Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Электрохимический ряд напряжений металлов (ряд Бекетова)


Рис. 1. Активные металлы в таблице Менделеева.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.

Литий

При внесении уточнений и рассмотрения наиболее электрохимически активного элемента становится очевидно, что лидирующее положение в плане активности займет литий. Название данного элемента переводится как «камень» – связано это с тем, что он был обнаружен в петалите (минерал). Металл, обладающий серебристым цветом, тонет в воде, но уверенно держится на поверхности керосина. По электрохимической активности данный элемент превосходит все остальные щелочные элементы, вытесняя другие металлы при химических реакциях. Это главное свойство лития является определяющим для остальных его характеристик.

– 2Na + 2H2O → 2NaOH + H2; – 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl

Рис. 3. Минералы и чистые металлы.




История открытия
Его открытие принадлежит немецким исследователям Р. Бунзену и Г. Кирхгофу. Уже тогда ученые интересовались, какие металлы активные, а какие – нет. В 1860 году исследователи изучали состав воды из Дюркгеймского водохранилища. Делали они это при помощи спектрального анализа. В образце воды ученые обнаружили такие элементы, как стронций, магний, литий, кальций.
Затем они решили проанализировать каплю воды при помощи спектроскопа. Тогда они и увидели две ярко-голубые линии, находящиеся недалеко друг от друга. Одна из них по своему положению практически совпадала с линией металла стронция. Ученые решили, что выявленное ими вещество является неизвестным и отнесли его к группе щелочных металлов.
В том же году Бунзен написал письмо своему коллеге-фотохимику Г. Роско, в котором рассказывал об этом открытии. А официально о цезии было сообщено 10 мая 1860 года на заседании ученых Берлинской академии. Через шесть месяцев Бунзен смог выделить около 50 граммов хлороплатинита цезия. Ученые переработали 300 тонн минеральной воды и выделили порядка 1 кг хлорида лития в качестве побочного продукта, чтобы в конечном счете получить самый активный металл. Это говорит о том, что цезия в минеральных водах содержится очень мало.

Сложность получения цезия постоянно толкает ученых на поиск содержащих его минералов, одним из которых является поллуцит. Но извлечение цезия из руд всегда оказывается неполным, в процессе эксплуатации цезий очень быстро рассеивается. Это делает его одним из самых труднодоступных веществ в металлургии. В земной коре, к примеру, содержится 3,7 граммов цезия на одну тонну. А в одном литре морской воды лишь 0,5 мкг вещества представляют собой самый активный металл. Это приводит к тому, что извлечение цезия является одним из самых трудоемких процессов.
Каким способом был открыт цезий?
Самый активный металл был первым химическим элементом, наличие которого в поверхности земной коры было обнаружено при помощи метода спектрального анализа. Когда ученые получили спектр металла, то в нем они увидели две линии небесно-голубого цвета. Таким образом и получил свое название этот элемент. Слово caesius в переводе с латинского языка значит «небесно-голубой».

Сравнение самых активных металлов
Унуненний – это пока еще не открытый металл. Он будет занимать первое место в восьмой строке периодической системы. Разработка и исследования этого элемента проводятся в России в Объединенном институте ядерных исследований. Этот металл должен будет обладать также очень высокой активностью. Если же сравнивать уже известные франций и цезий, то самым высоким потенциалом ионизации – 380 кДж/моль – будет обладать франций.
У цезия этот показатель составляет 375 кДж/моль. Но реагирует франций все же не так быстро, как цезий. Таким образом, цезий – самый активный металл. Это – ответ (химия чаще всего является тем предметом, в программе которого можно встретить подобный вопрос), который может быть полезным как на уроке в школе, так и в профессионально-техническом училище.
Тест по теме
Какой из металлов наиболее активный?
Чтобы попасть сюда — пройдите тест.
Получение в России
Как было указано, главным минералом, из которого получают цезий, является поллуцит. А также этот наиболее активный металл можно получить из редкого авогадрита. В промышленности используется именно поллуцит. Добыча его после распада Советского Союза в России не велась, несмотря на то что еще в те времена были обнаружены гигантские запасы цезия в Вороньей тундре под Мурманском.
К тому моменту, когда отечественная промышленность смогла позволить себе добычу цезия, лицензия на разработку этого месторождения была приобретена компанией из Канады. Сейчас извлечение цезия производит новосибирская .

Применение
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
| Отрасль | Производство | Металлы |
| Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
| Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
| Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
| Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
| Ювелирная промышленность | Украшения | Au, Pt, Ag |
| Медицина | Протезы | Ti, Ni, Au |

Рис. 3. Висмут.
Металл франций
Еще одним из металлов с самыми интенсивными свойствами является франций. Он получил свое название в честь родины первооткрывательницы металла. М. Пере, родившаяся во Франции, открыла новый химический элемент в 1939 году. Он принадлежит к числу таких элементов, о которых даже сами исследователи-химики затрудняются делать какие-либо выводы.
Франций является самым тяжелым металлом. При этом и самый активный металл – это франций, наряду с цезием. Этим редким сочетанием – высокой химической активностью и низкой ядерной устойчивостью и обладает франций. У его самого долгоживущего изотопа период полураспада составляет всего лишь 22 минуты. Франций используется для обнаружения другого элемента – актиния. А также соли франция раньше предлагалось применять для обнаружения раковых опухолей. Однако из-за высокой стоимости эту соль невыгодно производить.

Использование цезия
Этот металл используется для изготовления различных фотоэлементов. А также соединения цезия применяются в специальных отраслях оптики – в изготовлении инфракрасных приборов, биноклей ночного видения. Цезий используют в изготовлении прицелов, которые позволяют заметить технику и живую силу врага. Также его применяют для изготовления особых металлогалогенных ламп.
Но этим не исчерпывается круг его применения. На основе цезия был создан также ряд медицинских препаратов. Это лекарства для лечения дифтерии, язвенных болезней, шоков и шизофрении. Как и соли лития, соли цезия обладают нормотимическими свойствами – или, попросту, способны стабилизировать эмоциональный фон.
Читайте также:
