Качественные реакции на катионы металлов
Обновлено: 07.05.2024
Допустим, человек трудиться в лаборатории. Учёный задумал осуществить эксперимент. С этой целью открывается шкаф с химическими реактивами. Неожиданно замечается, что у двух рядом стоящих емкостей с реактивами отклеены информационные этикетки. Чтобы установить, какие вещества находятся там и используются качественные реакции в химии.
Понятие и суть
Качественные реакции – это реакции, позволяющие отличать вещества и успешно определять качественный состав у неизвестных веществ. Анализ может проводится для веществ с разными агрегатными состояниями (газообразным, жидком и твердым). Зависимо от наблюдаемых эффектов выделяют группы реакций:
- Образовываются характерные осадки.
- Выделяются газы.
- Меняется запах.
- Окрашивается пламя.
- Появляется или изменяется окрас.
- Растворяется само вещество.
Например, если катионы определённых металлов смешать с их же солями, то пламя горелки окрашивает вещество в специфический цвет. Только этим дело не ограничивается, идентификация веществ проводится посредством иных реагентов и подходов для определения.
Качественные реакции, позволяющие определить катионы
Для представления веществ, факторов воздействия и протекания реакции используется таблица:
Качественные реакции, позволяющие определить катионы
Используемое вещество (Катион)
Используемый реактив или оказываемое физическое воздействие
Проявление идущей реакции
Выпадает черный осадок
Появляется белый осадок. Не растворяется в кислотах
Появляется белый осадок. В аммиаке растворяется, но не растворяется в HNO3
Выпадает осадок бурого цвета; выпадает синий осадок; появляется кроваво-красный окрас
Появляется осадок белого цвета – на воздухе зеленеет; выпадает синий осадок
Выпадает осадок голубого цвета; выпадает осадок черного цвета
Метиловый оранжевый; лакмус
Происходит красное окрашивание
Выпадает гидроксида алюминия в виде белого осадка при использовании небольшого малого реактива. Дополнительное добавление щелочи ведёт к растворению
Синеет влажная лакмусовая бумажка; выделяется газ, обладающий резким запахом
Качественные реакции, позволяющие определить анионы
Для их отображения также подойдёт таблица:
Используемое вещество (Анион)
Добавление H2SO4 и Cu с последующим нагревом; H2SO4 + FeSO4
Образовывается раствор синего цвета и выделяется газ бурой окраски; цвет меняется на диапазон от фиолетового до коричневого
Выпадает желтый осадок. Не растворяется в уксусной кислоте, но растворим в хлорной кислоте
Появляется белый осадок. Не растворяется в кислотах.
Выделяется газ SO2 и вода. Характерная особенность газа – резкий неприятный запах
В нейтральной среде выпадает светло-желтый осадок
Появляется белый осадок, растворяемый в кислотах; выделяется бесцветный газ, сопровождаемый «вскипанием», из-за чего мутнеет известковая вода
Появляется белый осадок. В дальнейшем растворяется.
Появляется белый осадок
Выпадает белый осадок с лёгким желтоватым оттенком, похожий на цвет свежего творога. Растворяется в NH3·H2O, но не растворим в HNO3
Выпадает желтый осадок. Под влиянием света темнеет. Не растворяется в NH3·H2O и HNO3
Выпадает светло-желтый осадок. Под влиянием света темнеет. Не растворяется в HNO3
Изменение цвета на малиновый; окрашивается в синий
Качественные реакции: определение неорганических вещества
Для отображения процессов также подойдёт таблица, хотя уже на два столбца:
Химическое соединение
Действие и реакция
Если горящую лучинку приблизить к водороду, возникают хлопки
Тлеющая лучинка при попадании в азотную атмосферу гаснет
Горящая лучинка при попадании в кислородную атмосферу начинает гореть
Химическая реакция с участием растворов иодидов приводит к появлению кристаллического осадока
При прохождении газа через раствор дихлорид палладия (II) происходит помутнение раствора
В газе тушится горящая лучинка. Если пропустить углекислый газ через раствор гашенной извести, то появляются осадки, в дальнейшем растворяющиеся
Эти качественные реакции позволяют установить, какое вещество осталось без наклейки.
Качественные реакции помогают установить качественный состав веществ взятых, или полученных в результате того, или иного химического процесса. При помощи качественных реакций можно определить правильность протекания химического процесса, или количественный состав продуктов той или иной реакции.
Аналитическая классификация катионов по группам (Таблица)
Справочные таблицы, в которых даны сероводородная, кислотно-основная и аммиачно-фосфатная аналитическая классификация катионов 1-5 групп, качественные реакциии и групповые реагенты, а также аналитические сигналы на катионы.
Сероводородная аналитическая классификация катионов таблица
Классическая сероводородная аналитическая классификация катионов включает 5 групп катионов.
Катионы, относящиеся к данной группе
K + , Na + , NH4 + ,Mg +2
Хлориды, карбонаты и сульфиды растворимы в воде, MgCO3 растворима в солях амония
Карбонаты в воде нерастворимы
Карбонаты аммония в аммиачном буфере (NH4)2CO3
Fe +3 , Fe +2 , Co +2 , Mn +2 , Zn +2 , Al +3 , Cr +3 , Ni +2
Карбонаты сульфиды и гидроксиды нерастворимы в воде, но растворимы в разбавленных кислотах
1 подгруппа: Hg + , Hg +2 , Ag + , Pb +2 , Cu +2
2 подгруппа: As(III, V), Sb(III, V), Sn(II, IV)
1 подгруппа: сульфиды нерастворимы в воде
2 подгруппа: сульфиды растворимы в полисульфиде амония с образованием тиоанионов
Сероводород в кислой среде H2S
Sn +2 , Sn +4 , As +3 , As +5 , Sb +3 , Sb +5
Сульфиды нерастворимы в разбавленных кислотах, но растворимы в сульфиде аммония
Сероводород в кислой среде HCl
Таблица аналитические сигналы на катионы первой группы
Аналитические сигналы на катионы
гексанитрокобальтат - II натрия Na 3[ Co ( NO 2)6]
Желтый кристаллический осадок K 2 Na [ Co ( NO 2)6]
гексагидроксостибиат- V калия - K [ Sb ( OH )6]
Белый кристалличосадок Na [ Sb ( OH )6]
Белый аморфн. осадок
Белый кристаллич осадок Mg [ Sb ( OH )6]
Щелочи N а OH или КОН
выделение аммиака, запах
Таблица аналитические сигналы на катионы второй группы
щелочь( N а OH , КОН)
Кислотно-основная аналитическая классификация катионов таблица
Кислотно-основная аналитическая классификация включает 6 групп катионов: растворимая, сульфатная, хлоридная, амфотерная, гидроксидная и аммиакатная.
Групповой реактив (реагент)
К + , Na + , NH4 + , Li +
Почти все соединения растворимы в воде
Ca 2+ , Ва 2+ , Sr 2+
Сульфаты нерастворимы в воде и разбавленных растворах кислот и щелочей
Хлориды нерастворимы в воде и разбавленных растворах кислот и щелочен
Al 3+ , Cr 3+ , Zn 2+ , Sn 4+ , As +3
Гидроксиды растворимы в избытке щелочи
Mg 2+ , Mn 2+ , Fe 2+ , Fe 3+ , Bi 3+ , Sb 5+ , Ti +4
Гидроксиды нерастворимы в избытке щелочи и аммиаке, растворимы в рабавленных кислотах
Cu 2+ , Co 2+ , Ni 2+ , Hg 2+ , Cd 2+
Гидроксиды нерастворимы в щелочи, но растворимы в избытке водного раствора аммиака
Аммиачно-фосфатная аналитическая классификация катионов таблица
Аммиачно-фосфатная аналитическая классификация включает в себя 5 групп катионов
Фосфаты pастворимы в воде
1 подгруппа: Li + , Mg 2+ , Ca 2+ , Ba 2+ , Sr 2 , Mn 2 , Fe 2+
2 подгруппа: Al 3+ , Cr 3+ , Fe 3+ , Bi 3+
Фосфаты нерастворимы в воде и NH4OH.
Фосфаты 1 подгруппы pастворимы в СН3СООН.
Фосфаты 2 подгруппы нерастворимы в СН3СООН, pастворимы в НСl
Co 2+ , Ni 2+ , Cu 2+ , Zn 2+ , Cd 2+ , Hg 2+
Фосфаты pастворимы в NH4OH
As(III, V), Sb(III, V), Sn(II, IV)
Метаоловянная и метасурьмяная кислоты нерастворимы и адсорбируют мышьяковую кислоту H3AsO4
Ag + , Hg 2 , Pb 2+
Хлориды нерастворимы в воде и разбавленных кислотах
Схема анализа смеси катионов аммиачно-фосфатным методом
Ос. 1: Хлориды V группы
Р-р 1: Катионы IV—I групп, (РЬ 2+ )
Ос. 1 анализируют, как в сероводородной схеме
Р-р 2: Катионы I—III групп, (РЬ 2+ )
Р-р 1 выпарив, с HNO3 досуха на водяной бане. При отсутствии олова добавляют SnCl4 и 0,5 н. Na2HPO4. Сухой остаток р-ют в 2 н. HNO3
В растворе проверяют присутствие AsO 3 . Ос. 3 после р-ния в 2 М НСl анализируют, как в сероводородной схеме
Общая таблица аналитической классификации катионов

Поделитесь ссылкой с друзьями:
Похожие таблицы
Комментарии:
4.1.5. Качественные реакции органических соединений.
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции:
Водные растворы аммиачных комплексов Ag(I), например, аммиачный раствор оксида серебра
Алкины с тройной связью на конце молекулы дают желтый осадок:
Алкины, у который при тройной связи нет атомов водорода в такую реакцию не вступают
Водный раствор аммиачных комплексов одновалентной меди Cu(I), например, аммиачный раствор оксида меди (I)
Алкины с тройной связью на конце молекулы дают красный осадок :
Алкины, у которых при тройной связи нет атомов водорода в такую реакцию не вступают, что позволяет отличить их друг от друга
Образование желтой жидкости с запахом горького миндаля на дне реакционной смеси
При кипячении с каким-либо гомологом бензола водный раствор перманганата калия обесцвечивается и выпадает бурый осадок оксида марганца (IV). На примере с толуолом и этилбензолом реакции выглядят следующим образом:
Постепенное обесцвечивание подкисленного раствора KMnO4. Выпадения бурого осадка MnO2 не наблюдается, поскольку марганец восстанавливается до практически бесцветной соли двухвалентного марганца. Чаще всего в качестве подкислителя изпользуют серную кислоту. На примере с толуолом реакция выглядит следующим образом:
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка трибромфенола:
Разбавленный водный раствор соли железа (III), например,
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка триброманилина:
Одноатомные первичные и вторичные спирты
Черный CuO при нагревании со спиртом изменяет свою окраску на красную в связи с восстановлением до Cu 0 . Первичный спирт при этом превращается в альдегид:
R-CH2-OH + CuO =t o => R-CHO + Cu + H2O,
вторичный — в кетон:
R-C(OH)-R’+ CuO =t o => R-C(O)-R’ + Cu + H2O,
В случае метанола появляется легко узнаваемый запах формальдегида (естественно, чтобы он был узнаваемым, нужно до этого быть знакомым с его запахом:-) )
В случае реакции с CuO этилового спирта чувствуется специфический запах ацетальдегида, схожий с ароматом прелых яблок сорта «антоновка»
Растворение голубого осадка Cu(OH)2 с образование ярко-синего раствора комплексного соединения меди. На примере с глицерином уравнение реакции выглядит следующим образом:
Альдегиды,
—CHO
Аммиачный раствор оксида серебра
Так называемая реакция серебряного зеркала. В результате восстановления Ag +1 в металлическое серебро Ag 0 на стенках сосуда образуется зеркало. При небрежном смешении реагентов или в недостаточно чистом сосуде вместо серебряного зеркала может образоваться черный осадок, состоящий из мелкодисперсных частиц металлического серебра. В обоих случаях наблюдаемые явления описываются уравнением в общем виде:
Образование оранжево-красного осадка Cu2O при нагревании в результате реакции:
Карбоновые кислоты,
-COOH
Выделение углекислого газа в результате разложения образующейся нестойкой угольной кислоты H2CO3:
Появление запаха сложного эфира, образующегося в результате реакции:
R-COOH + R’-OH → R-COO-R’ + H2O
Запахи эфиров весьма разнообразны, но общим является ярко выраженная пахучесть, нередко, могут напоминать ароматы различных фруктов.
Муравиная кислота
-СНО
и
-СООН
Окрашивание лакмуса в красный цвет, по причине кислой среды, создаваемой муравьиной кислотой:
HCOOH ↔ HCOO — + H +
Молекуле муравьиной кислоты, не смотря на ее малый размер удается сочетать в себе помимо карбоксильной группы также и карбонильную, которая позволяет вступать муравьиной кислоте в реакцию серебряного зеркала подобно альдегидам:
Растворимые соли жирных карб. кислот, например, стеарат натрия
Выпадение хлопьевидного белого осадка малорастворимой жирной кислоты:
Выпадение белого осадка нерастворимой кальциевой или магниевой соли жирной кислоты. Ионное уравнение в общем виде:
где R-длинный углеводородный радикал.
На примере, стеарата натрия и хлорида кальция молекулярное уравнение реакции выглядит так:
Окрашивание фенолфталеина в малиновый цвет как в щелочах, ввиду того, что соли жирных кислот гидролизуются по аниону:
Олеиновая кислота,
-COOH;
Водный раствор KMnO4(водн.)
Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка оксида марганца бурого цвета MnO2
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции (указан структурный фрагмент молекулы олеиновой кислоты):
Олеиновая кислота, будучи практически нерастворимой в воде жирной кислотой, растворяется в водных растворах щелочей:
Глюкоза,
-CHO
-C(OH)-C(OH)-
Появление синей окраски
концентрированная азотная кислота
Появление ярко-желтого окрашивания по причине нитрования бензольных колец молекул белка
4.1.4. Качественные реакции на неорганические вещества и ионы.
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:

Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
а с нитратом серебра с образованием белого творожистого осадка AgCl
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
Выпадение белого осадка, не растворимого в кислотах:
1) Выпадение осадка голубого цвета:
2) Выпадение осадка черного цвета:
Выпадение осадка черного цвета:
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O:
2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6]
1) Выпадение белого осадка, зеленеющего на воздухе:
2) Выпадение синего осадка (турнбулева синь):
2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6]
3) Роданид-ион SCN −
1) Выпадение осадка бурого цвета:
2) Выпадение синего осадка (берлинская лазурь):
3) Появление интенсивно-красного (кроваво-красного) окрашивания:
Fe 3+ + 3SCN − = Fe(SCN)3
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи:
и его растворение при дальнейшем приливании:
Выделение газа с резким запахом:
Посинение влажной лакмусовой бумажки
Качественные реакции на анионы
1) Образование раствора синего цвета, содержащего ионы Cu 2+ , выделение газа бурого цвета (NO2)
2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO] 2+ . Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
Выпадение светло-желтого осадка в нейтральной среде:
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl:
Выпадение черного осадка:
1) Выпадение белого осадка, растворимого в кислотах:
2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды:
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2:
Выделение газа SO2 с характерным резким запахом (SO2):
Выпадение белого осадка:
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.):
Качественные реакции

Как отличить одно сложное вещество от другого, если они внешне выглядят одинаково? Для этого есть качественные реакции, которые также называют аналитическими. Они сопровождаются каким-либо внешним эффектом, по которому и опознают состав вещества. В этом материале мы рассмотрим качественные реакции органических и неорганических соединений.
О чем эта статья:
Что такое качественная реакция
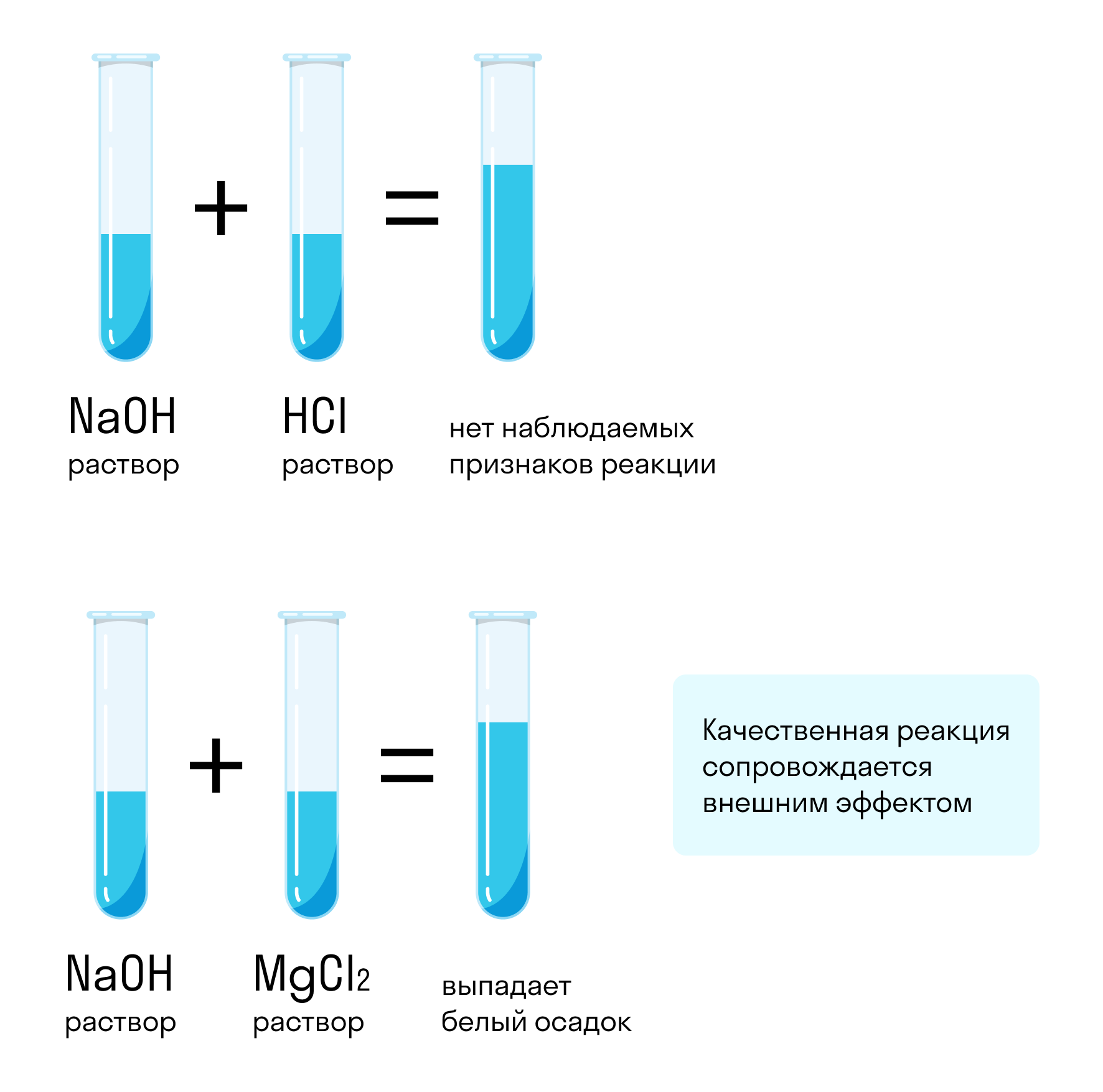
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
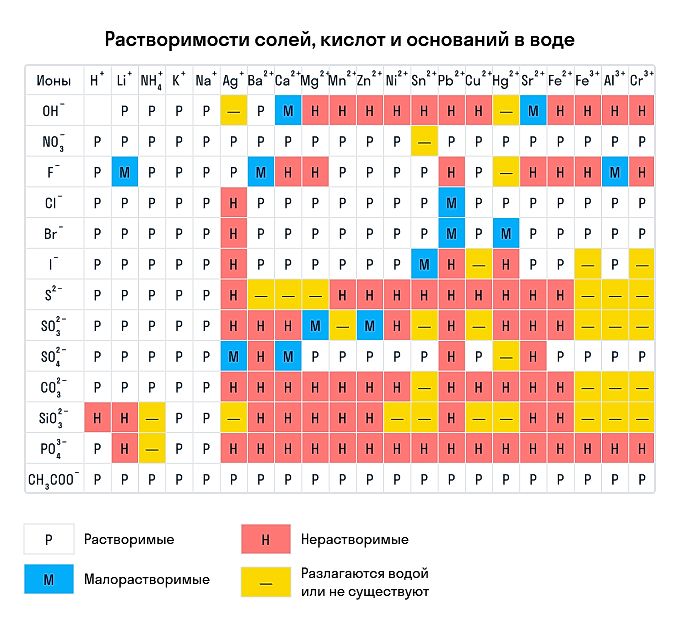
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
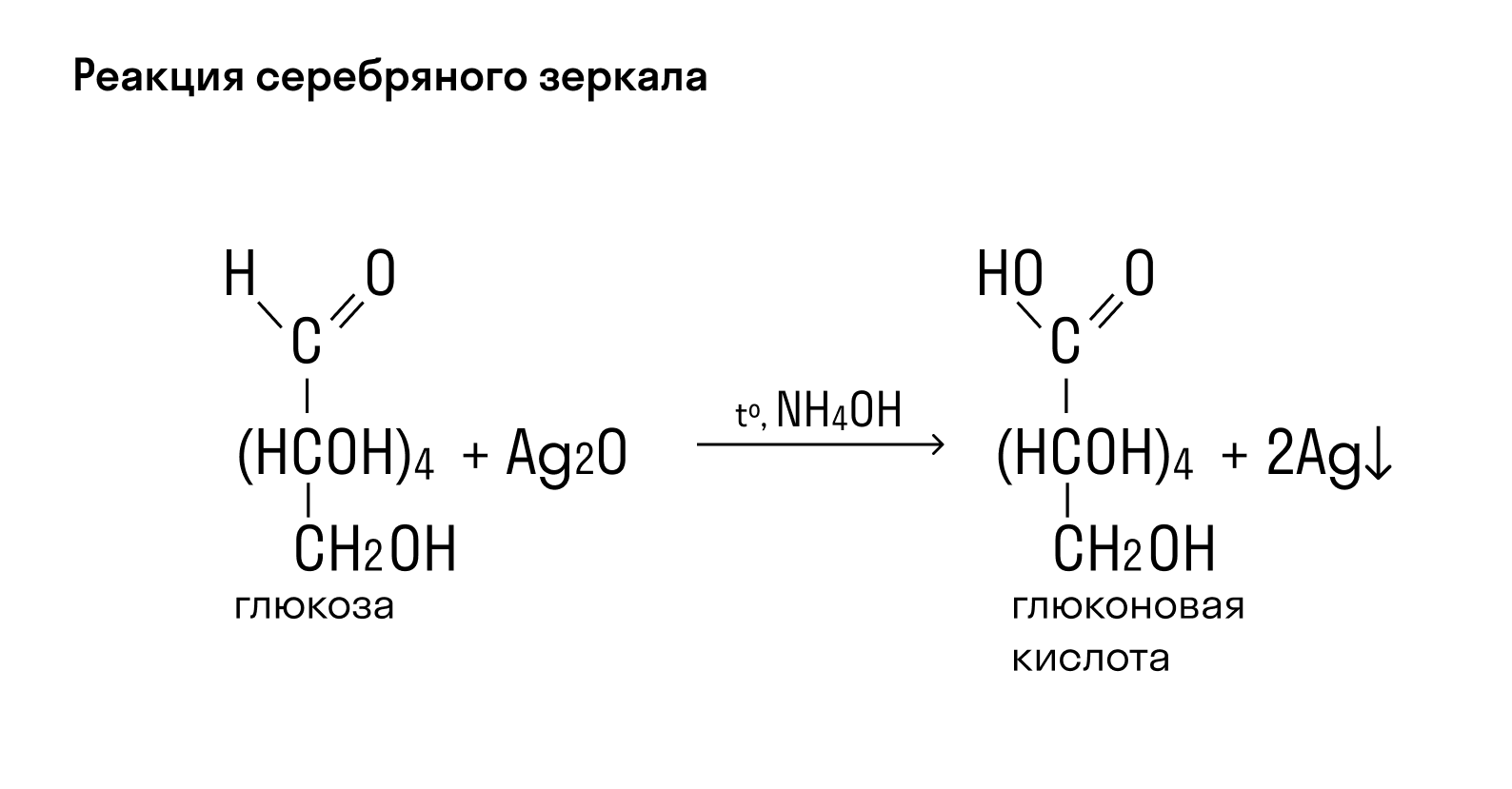
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
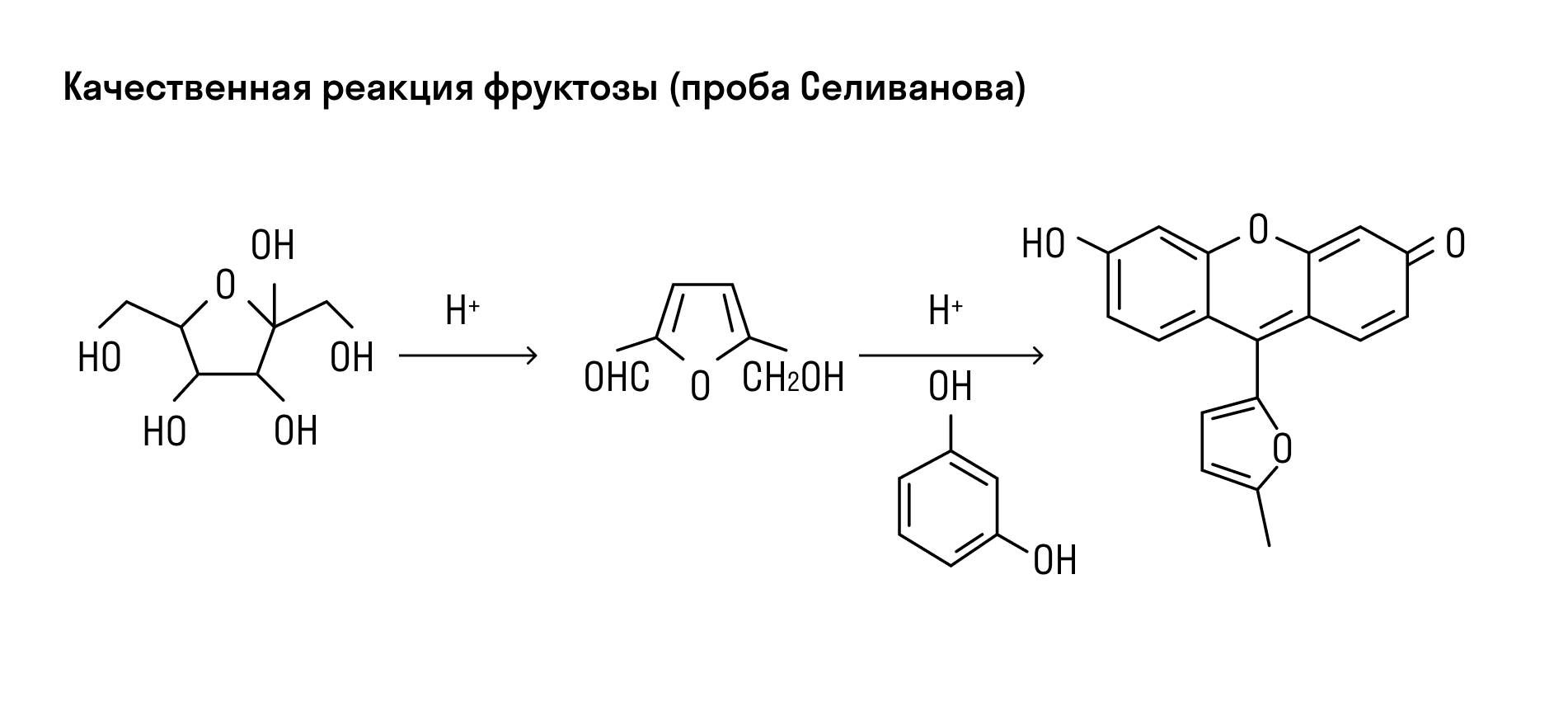
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Читайте также:
