Как добывают металлы в природе
Обновлено: 17.05.2024
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

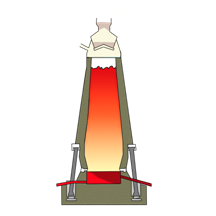
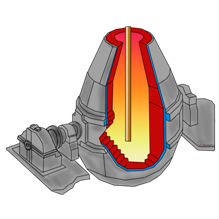
1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
"Металлы в природе. Общие способы получения металлов"

Презентация предназначена для учащихся 9 класса, ее можно использовать при изучение темы "Металлы", а так же при подготовке к ОГЭ. В презентации рассматривается вопрос о нахождении металлов в природе и общих способах получения металлов - прирометаллургии, гидрометаллургии, электрометаллургии и микробиологической способе.
Содержимое разработки

Металлы в природе.
Общие способы получения металлов.
Презентация к уроку. 9 класс .Химия. Антонова Ирина Павловна . Учитель химии и биологии МБОУ СОШ№8

ЦЕЛЬ УРОКА :
- Познакомиться с природными соединениями металлов и с самородными металлами; получить понятие о рудах и металлургии, рассмотреть такие ее разновидности, как пиро–, гидро–, электрометаллургия, термическое разложение соединений металлов, продемонстрировать лабораторные способы получения металлов и ознакомиться с промышленным производством металлов.
РАСПРОСТРАНЕННОСТЬ МЕТАЛЛОВ В ПРИРОДЕ
Процентное содержание металлов в морской воде:
В ПРИРОДЕ МЕТАЛЛЫ МОГУТ ВСТРЕЧАТЬСЯ
Железный метеорит




KCl • MgCl 2 • 6H 2 O


СУЛЬФАТЫ, ФОСФАТЫ, КАРБОНАТЫ

Черная- получение
железа и его
сплавов (сталь, чугун)
Цветная- получение
остальных металлов
и их сплавов

- Восстановление металлов из руд при высоких температурах с помощью восстановителей.
Соль → оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO 3 = CuO + CO 2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО 2 = 2ZnО + 2SО 2

Пирометаллургия
Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO + CO → Cu + CO 2
Водородотермия:
Cr 2 O 3 + H 2 → Cr + H 2 O
Металлотермия:
Fe 2 O 3 + Al → Fe + Al 2 O 3

- Получение металлов израстворових солей.
- Перевод нерастворимого соединения в раствор:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuSO 4 + Fe = FeSO 4 + Cu.
2NaCl → 2Na + Cl 2
MgBr 2 → Mg + Br 2
- Микробиологические методы получения металлов.

-82%
Получение металлов. Нахождение их в природе
Этот видеофрагмент даёт возможность учащимся вместе с путешественником побывать в местах, где были найдены самые большие самородки металлов, он расскажет о распространённости металлов в земной коре, о некоторых исторических фактах, касающихся металлов, а также о рудах и минералах. Вместе с ним ребята побывают на дне водоёма и увидят отложения металлов, смогут представить себя в роли геолога и сравнить такие минералы, как красный, бурый и магнитный железняк. Путешественник расскажет им об основных методах получения металлов и затронет некоторые вопросы охраны окружающей среды, связанные с получением металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Получение металлов. Нахождение их в природе"
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.
В самородном состоянии в природе встречаются золото, серебро, медь, платина и ртуть. Эти металлы обычно содержатся в небольших количествах в виде зёрен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов – самородки. Одним из самых больших месторождений чистого серебра был так называемый «серебряный тротуар» в Канаде. Он представлял собой глыбу почти чистого серебра длиной тридцать м, уходящую в землю на восемнадцать м. Выработка этого месторождения дала около двадцать т металла. А один из крупнейших самородков серебра весил почти сто девять кг. Самый крупный самородок меди весил четыреста двадцать т, а золота – сто двенадцать кг.

А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.
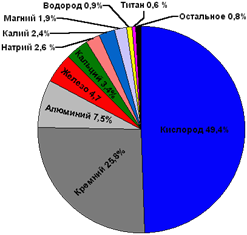
Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na + , K + , Mg 2+ , Ca 2+ в организме человека приходится 99% всех ионов металлов.
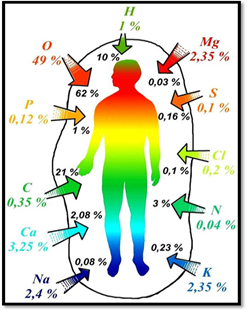
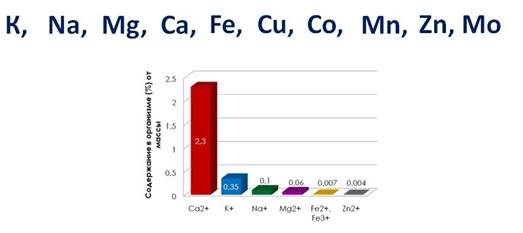
К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
Химический состав
Красный железняк (гематит)
Магнитный железняк (магнетит)
Железный колчедан (пирит)
Медный колчедан (халькопирит)
Свинцовый блеск (галенит)













К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.

А теперь представьте, что на дне водоёмов тоже есть соединения металлов, эти отложения – конкреции – представляют собой грозди, клубни или лепёшки, густо усеивающие дно. Плоские озёрные и болотные конкреции величиной с мелкую монету были известны ещё в средние века, поэтому их и называли «копеечной рудой». В настоящее время железомарганцевые конкреции, покрывающие огромные площади на дне океанов, называют полезными ископаемыми XXI века. Это богатейший источник не только железа и марганца, но и кобальта, никеля, меди и молибдена.
Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.

Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.

Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.

Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.

Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.

Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м 3 . Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.
Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.
Для получения некоторых металлов в качестве восстановителя используют водород.

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.

Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.

При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна. Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Горная добыча металлов

Горное дело подразумевает использование недр нашей Земли. Люди добывают из нее различные полезные ископаемые, которые необходимы для использования в качестве топлива или сырья. Эта область возникла еще в глубокой древности и развивалось согласно социально-экономической ситуации на земле. Люди совершенствовали орудия, с помощью которых можно было добывать полезные ископаемые, методы обнаружения месторождений, а также придумывали все новое применение найденных материалов. Площадь исследования источников сырья постоянно увеличивалась и распространялась на разные страны. С каждым периодом люди усовершенствовали свои навыки, орудия, развивая тем самым местность, на которой они проживали, а также их социально-экономический статус.
Одним из важных и необходимых полезных ископаемых является металл, который входит в состав руд. Металлы обладают несколькими свойствами: они твердые и плотные (за исключением ртути), являются проводниками электричества и тепла, а также звука. Температура плавления и кипения твердых металлов довольно высока (от 28 до 3000 ºС и выше). Имея такой полезный набор свойств, они находят широкое применение в различных сферах человеческой деятельности. Их используют для изготовления электрических кабелей, ювелирных изделий, посуды, различных деталей в строительстве, а также в авиационной и автомобильной промышленности. И это не полный список сфер, где люди используют металл. Главным преимуществом таких изделий являются прочность, а также его способность принимать любую форму под воздействием давящего на него инструмента.
Строение металлов
Все металлы состоят из частиц, между которыми существует химическая связь. Количество электронов между ними очень мало и на внешних оболочках они имеют очень слабую связь с ядром. Атомы этого материала расположены в определенном порядке и образуют собой кристаллическую решетку. Если через каждый атом мысленно провести линию, то в итоге мы получим набор правильных геометрических фигур. Но что касается расстояния между ними, то оно не одинаково, и зависит это от самого металла, его температуры, а также давления.
Типы металлов
Согласно их промышленному употреблению, металлы делятся на черные и цветные. Как это видно из названия, различаются они по цвету. Но кроме цветовых оттенков они имеют другие отличительные свойства: черные металлы более твердые и плотные, цветные же пластичнее и мягки по своей структуре. К первой группе относятся железо, его сплавы, а также марганец и иногда хром. Они используются в промышленности более чем на 90%, в отличие от цветных. Из черных металлов в основном изготавливают чугун и сталь. Для их изготовления используется сплав железа и углерода, но в разных пропорциях. Сталь содержит меньше углерода, чем чугун, не более 2,14 %. Но это процентное соотношение может варьироваться. Иногда нужно произвести сталь с содержанием углерода меньше, чем 1%. В таком случае на производстве данную смесь кипятят до тех пор, пока углерод не испарится до нужного количества.
К цветным относятся все остальные нежелезные металлы. К таковым относятся медь, алюминий, никель, свинец, цинк, олово и многие другие. Кроме того, цветные металлы подразделяются на две группы: легкие и тяжелые. Производство и тех, и других подразумевает затрату энергии. На легкие ее требуется гораздо больше. К легким обычно относят магний, алюминий, титан, а к тяжелым – свинец, олово, медь, никель, цинк. Так как способ производства данных материалов различается, то и промышленность было решено поделить на тяжелую и легкую металлургию. Причем заводы первой отрасли располагаются непосредственно около источника добычи подобного сырья, а второй – находятся у источников недорогой энергии.
Месторождения руд в России
Наша страна занимает первое место по запасам железной руды. В России существует множество месторождений этого сырья. Таковыми областями являются Курская аномалия, которая является самым мощным в мире железорудным бассейном, Карельское и Костомукшское месторождения, гора Магнитная (Челябинская область), Кузбасс, Красноярский край и др. В данных районах в основном добывают ископаемые для черной металлургии. Что касается цветной, то их месторождения сосредоточены на Уральском районе, Северный Кавказ, Дальний восток, Западная и Восточная Сибирь. Как правило, базы по переработки подобного сырья расположены вблизи от каждого месторождения.
Способы добычи руд
Для изготовления металла используются различного типа руды. Для каждого вида такого сырья в природе существуют разные руды. Есть руда медно-никелевая, железная, свинцово-цинковая и другие. Кроме того, например, из железной руды добывается не только железо, но и другие металлы, так как в ней могут содержаться их примеси.
Так как металлы добываются в природе из руд, то для установления их нахождения используются несколько способов добычи: открытый(карьерный) и подземный (шахтный). Иногда можно встретить комбинированный подход – открыто-подземный. Открытые горные работы ведутся на поверхности земли под открытым небом. Прежде чем приступить к самой добыче, производится подготовка горных пород к выемке. При данном процессе происходит отделение этих пород от массивов, а затем происходит рыхление. Если добыча осуществляется из скал, то в ход идут буро-взрывные работы. Для взрыва используются грамониты, гранулированные аммиачно-селитренные гранулиты и водонаполненные ВВ. Затем добытую массу грузят в транспортные средства с помощью различных подъемно-транспортных механизмов и транспортируют, а используемая земля рекультивируется.
Подземные горные работы осуществляются без нарушения поверхности земли. Они проводятся в ее недрах. Несмотря на популярность использования открытых работам, подземная добыча остается важным способом нахождения полезных ископаемых. Сначала месторождение вскрывают, затем, как и при открытых работах происходит подготовка ископаемых к выемке. После всего этого осуществляются очистные работы, которые заключаются в выемке сырья валовым способом, либо по отдельности, что называется селективной выемкой. Таким образом полезные ископаемые добываются из недр земли.
Кроме тяжелой техники в современном мире для добычи металлов используются компьютерные технологии, с помощью которых становится возможным планировать, проектировать все виды будущих работ.
Обработка металла
Когда местонахождение устанавливается, добытые руды подвергаются обогащению. Это способ разделения образований на металлы и минералы. Затем полезные ископаемые сортируются по качеству. После процесса обогащения, из руды извлекается металл при помощи электролитического и химического восстановления. Далее металлы обрабатываются и нередко шлифуются до блеска.
Все побочные мероприятия с сырьем проводятся на специальных металлургических комбинатах. Таковых предприятий в России очень много. Существуют главные комбинаты, а также их филиалы, расположенные как вблизи основного завода, так и вдалеке, в других регионах. Каждая крупная промышленность разделена на несколько цехов, в которых с металлом производят различные действия. Сначала его обрабатывают и прессуют в большие слитки. В другом цехе его прокатывают до размера меньше. После того, если металл идет, например, на изготовление проволоки, его прокатывают до такого диаметра, чтобы он соответствовал заказанным требованиям. Затем его отправляют в специальные лаборатории для исследования качества. В этих лабораториях специалисты исследует химический состав продукта с помощью спектрального оборудования. Материал проверяют на прочность, испытывают на растяжение, пластичность, разрушение, на изгиб, перегиб, осадку, оправку и многое другое. Если обнаружен брак, то металл такого рода не используется. Для деталей, проволоки, запчастей и прочего используют только качественный продукт без примесей. Далее этот материал отправляется в другие цеха на изготовление всего возможного, где он может понадобиться. Так как в России большие запасы железной руды, то обработанный материал распространяется не только по нашей стране, но и по другим странам. Этот продукт очень популярен, ведь его используют в изготовлении большинства станков, оборудований, машин и прочего.
Современная ситуация на рынке металлургии
Если обратиться к конкретным предприятиям, то можно заметить, что их работа не всегда стабильно направлена лишь в одну сторону. Многое зависит от запасов руды и от потребности людей. Так, например, в местах, где большие запасы руд исчерпаны, нередко предприятиям приходится закрываться из-за отсутствия нужды в них.
Кроме того, бывают случаи, когда какой-либо завод решают перепрофилировать. Так, например, планировали сделать с Надвоицким алюминиевым заводом. Но, из-за нестабильной ситуации на рынке алюминиевой фольги, данный проект был отложен.
Ситуация на рынке по мимо всего прочего влияет не только на объем производства продукции, но и на себестоимость изготавливаемых материалов. Примером может послужить предприятие «Березитовый рудник», расположенный в Амурской области. На данный момент заводы вынуждены снижать себестоимость золотодобычи, но, при этом им удается сохранить свою финансовую устойчивость. Кроме того, в планах данного предприятия расширение своего производства. Данная компания желает заняться резкой металла посредством лазерных оборудований.
Что касается добычи некоторых видов металлов, например, золота, то в нынешнем году, в России добыча данного сырья увеличилась в разы. Главными районами с богатым запасом желтого металла названы Красноярский край и Кемеровский регион. Данный материал был получен не только путем добычи, но и во время изготовления других металлов, посредством переработки лома и отходов.
Таким, образом, добыча металла является самой важной отраслью в нашем мире. Этот материал используется с давних времен и не прекращает быть популярным, ведь изделия из металла окружают каждого из нас. Поэтому горное дело является ведущей областью в изготовлении многих продукции.
Читайте также:
