Как растворить оксиды металлов
Обновлено: 17.05.2024
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4 + и анионы NO2 — , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 о С. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4] — и [Zn(OH)4] 2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Теоретические основы химической технологии, 2021, T. 55, № 4, стр. 480-488
Предложен глубокий эвтектический растворитель (DES) хлорид холина–сульфосалициловая кислота для растворения оксидов Co(II), Cu(II), Zn(II), Fe(III), Ni(III) и Mn(III). Проведено экспериментальное исследование влияния времени растворения, массового соотношения твердое : жидкость, температуры и мольного соотношения хлорида холина и сульфосалициловой кислоты на растворение оксидов металлов в предложенном DES. Установлен механизм растворения исследуемых оксидов металлов. Показано, что DES хлорид холина–сульфосалициловая кислота может быть потенциально использован для эффективного выщелачивания металлов из компонентов отработанных химических источников тока.
Ключевые слова: глубокий эвтектический растворитель (DES), оксиды металлов, растворение, хлорид холина, сульфосалициловая кислота
ВВЕДЕНИЕ
Возрастающее количество металлсодержащих отходов, являющихся источником широкого круга стратегически важных и ценных элементов, побуждает научное сообщество уделять все больше внимания разработке экономически выгодных и ресурсосберегающих технологий. Экстракция является хорошо известным эффективным методом извлечения, разделения и очистки металлов [1–6]. Традиционно в гидрометаллургическом методе для извлечения металлов из твердого в качестве выщелачивающих агентов применяют водные растворы неорганических (соляная, серная, азотная и др.), органических (лимонная, янтарная, винная, молочная, яблочная, аскорбиновая) кислот, щелочей (например, гидроксид натрия) и солей (например, оксалаты, тартраты и др.). В настоящее время уделяют большое внимание применению в качестве выщелачивающих агентов неводных растворителей, таких как молекулярные органические растворители, ионные жидкости и глубокие эвтектические растворители. Предварительные исследования показали, что глубокие эвтектические растворители позволяют эффективно извлекать металлы из природных руд (например, гетит), отработанных аккумуляторов (Li-ion, Ni-MH и др.), магнитов (NdFeB, SmCo), флуоресцентных ламп и других металлсодержащих отходов [7–11]. Поскольку металлы в твердых компонентах вышеперечисленных источников содержатся чаще всего в форме оксидов, в работах [12–16] проведено исследование растворения различных оксидов металлов с использованием DES. Более высокой растворяющей способностью обладают DES, где одним из компонентов является карбоновая кислота, поскольку повышенная кислотность среды способствует разрыву связи Me–O. Ранее было показано, что DES хлорид холина–этиленгликоль проявляет слабые растворяющие свойства по отношению к оксидам кобальта, марганца, никеля, железа и др. Однако введение в DES хлорид холина–этиленгликоль 0.1 М раствора трифторметансульфокислоты увеличивает эффективность растворения ряда оксидов металлов более чем в 10 раз [12]. При этом растворимость оксидов металлов в DES зависит от значения энергии кристаллической решетки и чем она выше, тем меньше растворимость оксида металла. Также было установлено, что замещение гидроксильных групп на тиольные в структуре донора водородной связи приводит к улучшению физических свойств DES и увеличению их растворяющей способности. DES хлорид холина–п-толуолсульфоновая кислота показал себя эффективным растворителем для оксидов металлов по сравнению с DES на основе мочевины, малоновой кислоты и в ряде случаев с соляной кислотой. В работе [17] показано, что DES на основе п-толуолсульфоновой кислоты способен количественно извлекать литий и кобальт из катода Li-ion батарейки при температуре 90°С за 15 мин. Однако стоит отметить, что количество работ по изучению выщелачивания оксидов металлов с использованием DES на основе органических кислот невелико.
Ранее нами был изучен DES хлорид холина–сульфосалициловая кислота и опробован для извлечения металлов из их оксидов [18]. Настоящая работа является продолжением исследования растворения оксидов металлов с использованием предложенного DES. В качестве модельных объектов были выбраны оксиды Co(II), Zn(II), Cu(II), Fe(III), Ni(III), Mn(III), которые имеют наибольшее экономическое значение и широко используются в компонентах химических источников тока.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хлорид холина (Acros Organics, чистота 99%) и сульфосалициловая кислота квалификации “х. ч.” были использованы без дополнительной очистки. Оксиды кобальта (II), меди (II), цинка(II), железа(III), никеля(III) и марганца(III) использовали со степенью чистоты >99%.
В качестве растворителя был использован DES на основе хлорида холина и сульфосалициловой кислоты эвтектического состава в мольном соотношении 7 : 3. Взвешенные на аналитических весах AND HR-100AZ (Япония) реагенты помещали в стеклянные виалы объемом 10 мл. Для образования глубокого эвтектического растворителя виалы помещали в термостатированную глицериновую баню при температуре 90°С и перемешивали при 1250 об./мин в течение 120 мин на магнитной мешалке IKA C-MAG HS 4 (Германия).
Исследование растворения оксидов Cu(II), Co(II), Zn(II), Fe(III), Ni(III) и Mn(III) в DES проводили в стеклянных виалах при массовом соотношении твердой и жидкой фазы 1 : 25. Эксперименты проводили в термостатированных условиях при температуре 80°С и постоянном перемешивании 1250 об./мин. Время, при котором достигается максимальная растворимость оксидов металлов в DES, было определено и в большинстве экспериментов составляло 120 мин.
Концентрацию ионов металлов в DES после растворения оксидов определяли спектрофотометрическим методом с использованием 4-(2-пиридилазо)резорцина, образующего комплексы с металлами, которые поглощают в видимой области спектра на следующих длинах волн, нм: Zn (492), Ni (495), Cu (496), Mn (499), Co (510). Содержание Fe(III) в жидкой фазе после экстракции определяли методом спектрофотометрии в видимой области (λ = 420 нм) с использованием в качестве индикатора сульфосалициловой кислоты относительно холостых растворов. Измерение оптической плотности проводили на приборе Экросхим ПЭ-5400УФ (Россия).
Для установления состава комплексов металлов после растворения были записаны спектры поглощения в области длин волн от 190 до 1000 нм на приборе Cary-60 Agilent Tech. (США) в кварцевых кюветах толщиной 1 мм.
Спектры ядерного магнитного резонанса для чистого и содержащих металлы DES были записаны в дейтерированном растворителе (D3С)2SO) на спектрометре Bruker Fourier 300 HD (Швейцария) с рабочей частотой 300 МГц при температуре 25°С.
Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Впервые проведено исследование растворения ряда оксидов металлов с использованием DES на основе хлорида холина и сульфосалициловой кислоты.
На рис. 1 представлены результаты растворения оксидов металлов во времени в диапазоне от 5 до 300 мин. Постоянное значение содержания металлов в растворе устанавливается после 120 мин растворения для всех исследуемых оксидов. Из полученных результатов видно, что максимальная растворимость оксидов металлов в предложенном DES достигается достаточно быстро по сравнению с ранее изученными DES на основе левулиновой и щавелевой кислот, где время, за которое растворимость оксидов металлов достигает максимального значения, составляет более 10 ч [15].
Рис. 1.
Зависимость содержания металлов в DES хлорид холина–сульфосалициловая кислота (7 : 3) от времени проведения процесса: T = 80°C; соотношение твердое : жидкость = 1 : 25.
Для установления состава извлеченных соединений металлов были получены электронные спектры поглощения глубокого эвтектического растворителя после растворения оксидов кобальта(II) и меди(II) в видимой области спектра (рис. 2). Видно, что в DES металлы существуют в виде тетрахлоридных комплексов. На основе полученных результатов процесс растворения, протекающий с участием DES хлорид холина–сульфосалициловая кислота можно описать следующим уравнением:
Рис. 2.
Электронные спектры поглощения DES хлорид холина–сульфосалициловая кислота после растворения: (а) – CuO, (б) – CoO.
Растворение оксидов железа(III) и цинка(II) протекает по схожему механизму ввиду возможного образования устойчивых анионных хлорокомплексов [FeCl4] – и [ZnCl4] 2– . Кроме того, электронные спектры поглощения в видимой области спектра подтверждают отсутствие сульфосалицилатных комплексов для железа(III), существующие при 540 нм. Тем не менее косвенным подтверждением соответствия механизма растворения вышеприведенному уравнению является спектр электронного поглощения, полученный для раствора железа(III), разбавленного этиловым спиртом и снятый относительно чистого DES с соответствующей концентрацией также в этиловом спирте. На рис. 3 помимо максимума поглощения на длине волны 306 нм, относящейся к сульфосалициловой кислоте, виден характерный максимум поглощения на длине волны 365 нм, который соответствует иону [FeCl4] – .
Рис. 3.
Электронный спектр поглощения DES после растворения Fe2O3.
Особый интерес представляет изучение механизма растворения Ni2O3 и Mn2O3. На рис. 4 представлен электронный спектр поглощения DES после растворения оксида никеля(III) с максимумами поглощения на 657 и 708 нм, подтверждающий образованием анионного хлорокомплекса Ni(II). Таким образом, процесс растворения оксидов никеля и марганца сопровождается окислительно-восстановительной реакцией и его можно представить следующим уравнением:
Рис. 4.
Электронный спектр поглощения DES хлорид холина–сульфосалициловая кислота после растворения Ni2O3.
На примере растворения оксида кобальта(II) показано, что введение дополнительного количества воды в DES до 40% не влияет на механизм растворения, что подтверждается электронными спектрами DES, записанными после растворения (рис. 5).
Рис. 5.
Электронные спектры DES хлорид холина–сульфосалициловая кислота после растворения CoO при различном содержании воды.
Для подтверждения существования в комплексе катиона холина была снята серия 1 H ЯМР-спектров для растворов кобальта(II), меди(II) и цинка(II). На рис. 6 видно, что сигнал метильных групп, связанных с атомом азота в ионе холина, на спектрах растворов металлов в DES имеет сдвиг, отличный от соответствующего на спектре чистого DES. Данный факт говорит о встраивании в координационную сферу холина хлорных анионных комплексов металлов.
Рис. 6.
ЯМР-спектры: 1 – исходный DES, 2 – раствор Zn 2+ , 3 – раствор Cu 2+ , 4 – раствор Co 2+ .
На рис. 7 схематично представлен механизм растворения исследуемых оксидов металлов в предложенном DES.
Рис. 7.
Схематичное представление растворения оксида металла в системе с DES хлорид холина–сульфосалициловая кислота.
Проведено исследование зависимости растворения оксидов металлов от температуры в диапазоне от 60 до 100°С. Результаты, представленные на рис. 8, показывают, что содержание металлов в системе с DES возрастает с увеличением температуры практически линейно. Максимальные значения для всех исследуемых металлов достигаются при 100°С. Таким образом, DES хлорид холина–сульфосалициловая кислота может быть использован для комплексного извлечения металлов из их оксидов.
Рис. 8.
Влияние температуры на растворение оксидов металлов в DES хлорид холина–сульфосалициловая кислота (7 : 3).
Были проведены исследования влияния массового соотношения твердой и жидкой фазы на растворение оксидов металлов в DES. Исследуемые соотношения составляли 1 : 15, 1 : 25, 1 : 50, 1 : 100 и 1 : 150. Результаты исследования зависимости содержания металлов в DES представлены на рис. 9.
Рис. 9.
Влияние соотношения твердое : жидкость на растворение оксидов металлов в DES хлорид холина–сульфосалициловая кислота (7 : 3): Т = 80°С.
Варьирование массового соотношения оксида металла к DES позволило выявить наиболее оптимальные условия проведения процесса их растворения. Анализ полученных зависимостей показал, что рост содержания Co(II), Cu(II), Zn(II) и Fe(III) наблюдается во всем исследуемом диапазоне соотношений твердое : жидкость, достигая максимального значения при 1 : 200. Однако скорость роста концентрации с изменением соотношения твердое : жидкость минимальна в диапазоне 1 : 50–1 : 200. Таким образом, соотношение 1 : 50 является оптимальным с точки зрения эффективности и экономичности. Растворимость оксида марганца(III) и никеля(III) при разных соотношениях твердое : жидкость изменяется незначительно.
Известно, что концентрация ионов Cl – является определяющим фактором в образовании преобладающих форм хлорокомплексов металлов в растворе. Нами было изучено влияние соотношения хлорида холина и сульфосалициловой кислоты на содержание металлов в системе с предложенным DES (рис. 10). Как и предполагалось, с возрастанием содержания хлорида холина в DES растворимость оксидов металлов увеличивается ввиду повышения количества ионов Сl – , благоприятствуя образованию хлоридных комплексов. Для всех исследуемых оксидов металлов растворяющая способность DES увеличивается в следующем ряду соотношений HBA : HBD: (3 : 7) < < (1 : 1) < (7 : 3) < (4 : 1). В случае с оксидами железа(III), кобальта (II) и цинка (II) при использовании DES хлорид холина–сульфосалициловая кислота при мольном соотношении HBA : HBD, равном 4 : 1, наблюдается количественное растворение.
Рис. 10.
Влияние соотношения хлорида холина и сульфосалициловой кислоты в DES на растворение оксидов металлов.
ЗАКЛЮЧЕНИЕ
В настоящей работе для растворения оксидов металлов был предложен DES хлорид холина–сульфосалициловая кислота. Установлен механизм растворения оксидов металлов в DES. Металлы переходят в раствор в виде анионных комплексов $>_^>.$ Изучено влияние температуры, соотношения твердое : жидкость, времени проведения процесса и соотношения HBA : HBD на растворение оксидов металлов. Исходя из полученных результатов, можно сделать вывод, что предложенный DES позволяет эффективно растворять оксиды металлов.
Исследование выполнено за счет гранта Российского научного фонда (проект № 20-13-00387).
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Оксиды

Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
18 декабря 2021
· Обновлено 12 июля 2022
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Виды оксидов
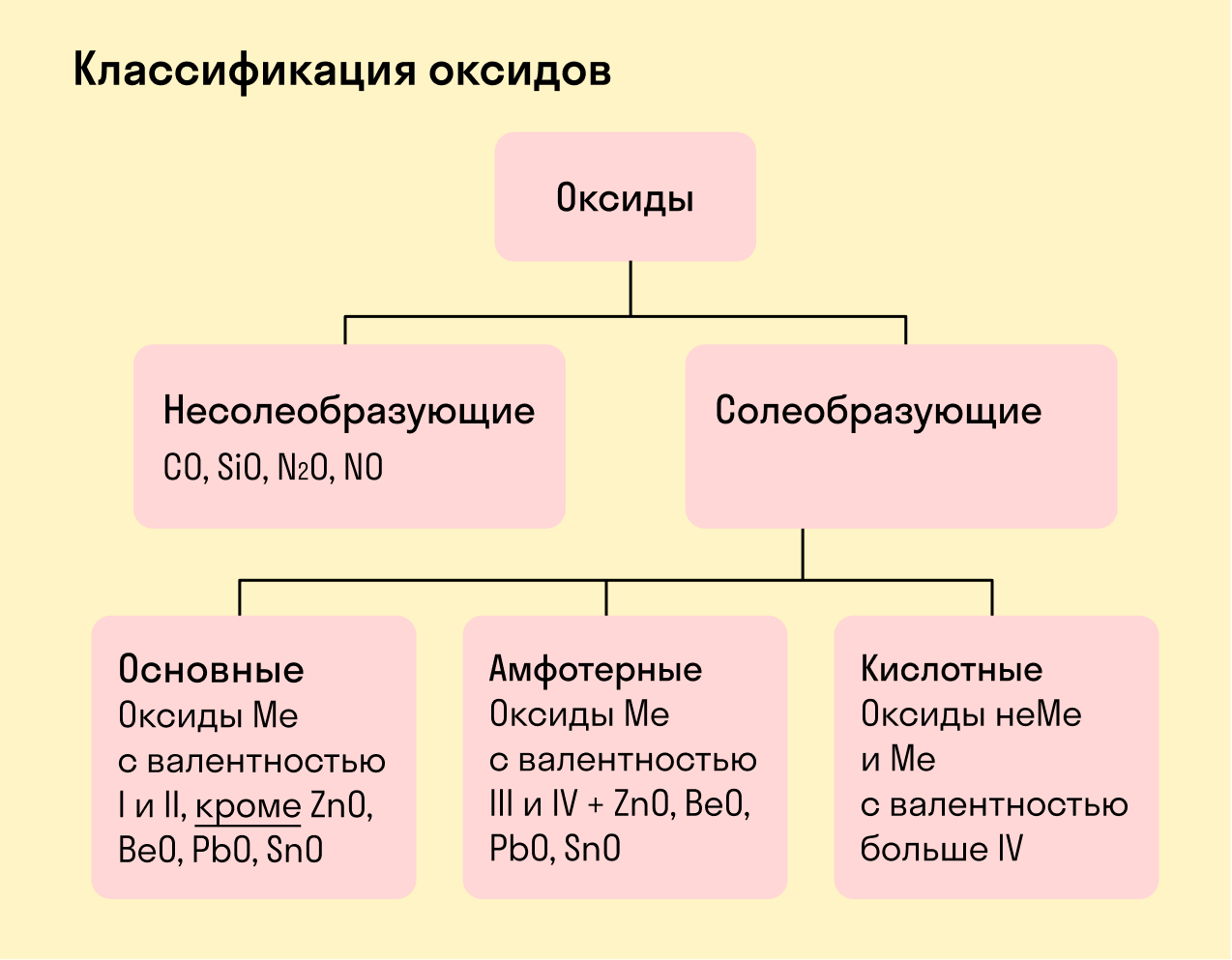
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
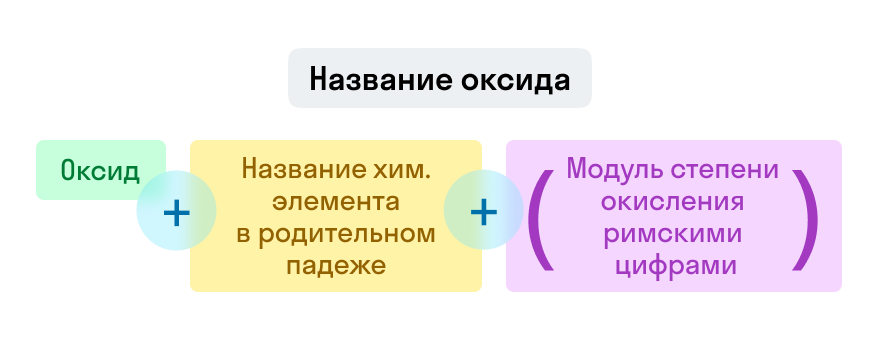
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.

Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
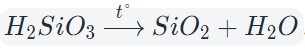
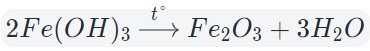
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!

Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:

Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe 2+ можно окислить до иона Fe 3+ ).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
CuO + CO = Cu + CO2

4.2. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например , оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO

Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
Читайте также:
