Как выглядит металлическая связь
Обновлено: 02.07.2024
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
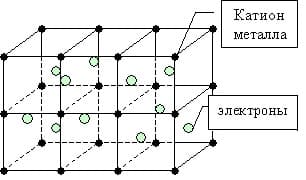
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Виды металлических связей и как они образуются
Все вещества во Вселенной имеют свою структуру строения, а следовательно — и свои свойства. Об особой связи частиц веществ впервые написал Уильям Хиггинс в XVIII веке. Тогда в своем научном труде ученый описал «особую соединительную силу», которая стала основой для возникновения теории о валентности, а позже — теории о химических связях.
Современная химия описывает существование нескольких типов химических связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Атомы металлов между собой объединяются в вещества с появлением новых свойств. При этом связь между атомами-металлами отличается свойствами от ковалентной и ионной связей.
Металлическая связь — особый вид химической связи, возникающий между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов. Металлическая связь встречается в простых веществах металлах и их сплавах.
Металлическая связь формируется за счет частиц двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Вещества с металлической связью чаще всего представляют собой чистые соединения и сплавы различных металлов, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Атомы металлов имеют ряд особенностей:
- небольшое количество электронов на внешнем электронном уровне;
- большие радиусы.
Благодаря данным характеристикам соединения металлов легко отдают внешние электроны, что позволяет им становиться ионами с положительным зарядом.
По природе происхождения металлическая связь близка к ковалентной, а также к ионным соединениям, но в силу ряда отличий представляет собой отдельный тип химических связей.
Сходства и отличия металлической химической связи от ионной и ковалентной
Все виды связи переплетаются между собой и имеют сходные черты. Более того, некоторые соединения могут иметь сразу несколько видов связи в одной молекуле.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию катионов металлов.
Обобществление отрицательно заряженных электронов по системе частично перекрывающихся орбиталей металлов приводит к формированию прочной химической связи, что напоминает по механизму образования ковалентную связь.
Каждый из видов связи имеет свои особенности построения решеток, взаимодействия частиц, а также характерные свойства.
Несмотря на схожесть металлической связи с ковалентной и ионной, каждая из них имеет ряд характерных черт, благодаря которым можно легко определить вид связи в соединении.
Металлическая связь в отличие от ковалентной имеет высокую концентрацию электронов проводимости в атомах металлов. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема— объединяет большое количество атомов;
- ненаправлена и делокализирована и электроны в связи обобществляются всеми атомами соединения.
В отличие от ионной связи металлическая образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному атомному ядру, а свободно движутся по кристаллической решетке.
Виды, особенности образования, как происходит, схема
Металлическая связь не может существовать между отдельными соединенными между собой атомами. Она появляется только в веществах.
При этом связи в этих веществах не отличаются постоянством. Электроны, отделившиеся от атомов металлов, превращаются в «электронный газ», благодаря чему они могут спокойно путешествовать по кристаллической решетке.
Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
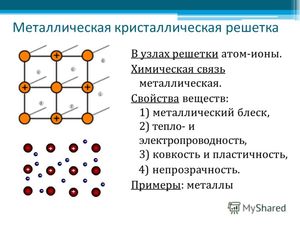
Характерные кристаллические решетки
Кристаллическая решетка в веществах с металлической связью является основой, неким каркасом кристалла, в узлах которой находятся ионы металла, а между ними в виде «электронного газа» перемещаются отрицательно заряженные электроны, периодически присоединяющиеся к ионам металлов, превращая их в атомы.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелочноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдрическую решетку.
Физические свойства металлов
Почти все металлы и их сплавы имеют сходные физические свойства:
Ионная и металлическая связь
До появления знания об электроне, в науке главенствовала теория о валентности как о скрепляющей атомы внутри вещества силе.
Ее предвестником стала научная работа Уильяма Хиггинса, ирландского химика конца XVIII века, который описал существование неких связей между частицами веществ.
В начале прошлого века, когда появилась модель атомного ядра и выяснилось, что оно состоит из частиц трех видов: электронов, протонов и нейтронов — теория о валентности сменилась теорией о химических связях.
Феномен химических связей объясняется стремлением всего к упорядочиванию. Частицы веществ стремятся к наиболее стабильным и устойчивым формам с минимальным расходом энергии, благодаря чему появляется множество соединений.
Современная химия различает до шести видов связей, но чаще всего рассматривает только первые четыре из них:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова;
- двухэлектронная трехцентровая химическая.
От типа химической связи зависят ее свойства, а также строение химических решеток, структура и способы взаимодействия атомов и частиц.
Самой распространенной химической связью является ковалентная полярная, а остальные чаще всего являются либо крайними ее формами, либо вариациями с металлическими и нехарактерными неметаллическими химическими элементами в соединениях.
Ионная химическая связь
Ионная связь получила свое название от «иона» — частицы, вступающей в связь в соединении.
Ионная химическая связь — особый вид химической связи между частицами, основное действие которого направленно на заряженные частицы — ионы.
Ионная связь является крайней формой ковалентной полярной связи. При образовании, происходит поляризация атомов, в следствии чего образуются ионы.
Ионы — одноатомные или многоатомные частицы, имеющие ярко выраженный электрический заряд. Делятся на катионы — положительно заряженные атомы, и анионы — отрицательно заряженные.
Ионы могут иметь разный заряд и классифицируются по значению заряда на:
- однозарядную ( K + );
- двузарядную ( O 2 + );
- трехзарядную ( A l 3 + ) группы.
Частицы, вступающие в ионную связь, должны иметь большую разницу в 2 определение — электроотрицательности — способности притягивать электронные пары к себе. По Полингу для образования ионной связи необходима разница в 1,7 и более.
При таком виде химической связи происходит почти полный переход одного электрона к другому атому. Частицы с меньшей ЭО практически полностью переходят во владения частицы с большей ЭО, однако полного перехода никогда не случается.
Отчуждение электронов называется окислением, а присоединение — восстановлением.
Полного разделения на + и – заряженные частицы нет, так как частицы пересекаются своим электронными орбиталями и связываются очень прочной связью, а также имеют сильное электростатическое взаимодействие между частицами.
Ионная связь характерна для соединений металлов и неметаллов, реже для соединений неметаллов с неметаллами, присутствует в оксидах, гидроксидах, гидридах щелочных и щелочноземельных металлов, в солях, соединениях металлов с галогенами.
Ионная связь характеризуется двумя главными чертами:
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Металлическая связь
Атомы металлов имеют возможность соединяться не только с неметаллами, но и между собой. В таком случае происходит формирование металлической связи.
Металлическая химическая связь — особый вид химической связи, образующийся между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов.
В металлическую связь вступают частицы двух видов:
Металлическая связь образуется только в веществах, а не между отдельными атомами. При этом связи внутри вещества связи не перманенты и не отличаются постоянством.
Кристаллическая решетка в веществах с металлической связью образуется в виде некого каркаса, в узлах которого находятся ионы металлов, а между ними в свободной форме путешествует «электронный газ», состоящий из свободных электронов.
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелоноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдричсекую решетку.
Соединения, обладающие металлической связью, представляют собой либо чистые соединения металлов, либо их сплавы, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Все металлы и их сплавы имеют сходные физические свойства:
- металлический блеск;
- теплопроводность материала;
- высокая ковкость, пластичность материала;
- хорошая электропроводность;
- твердое агрегатное состояние в нормальных условиях среды;
- высокая плотность материала.
Чем отличаются друг от друга и от ковалентной, что общего
Основные виды химической связи имеют довольно сходный принцип строения по природе происхождения. Они переплетаются между собой и имеют общие признаки. Более того, внутри одной молекулы нередко бывают сразу несколько видов химических связей.
Металлическая и ионная связь сходны между собой, а также сходны с ковалентной связью.
Металлическая и ковалентная связи сходны тем, что электроны, вступающие в связь обоих видах, становятся общими и принадлежат всем атомам либо в виде электронных пар, либо в виде электронного газа.
Ионная и ковалентная связи имеют сходство принципом строения. По сути происхождения, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию ионизированных катионов металлов.
Однако отличия между связями все же есть. Именно по ним можно определить тип химической связи в соединении.
Металлическая от ковалентной связи отличается, в первую очередь, тем, что происходит между двумя атомами металлов, а не неметаллов. Благодаря этому она имеет высокую концентрацию электронов проводимости в своих атомах. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
- ненасыщаема — объединяет большое количество атомов;
- ненаправлена — из-за сферической формы орбиталей;
- делокализирована — электроны в связи обобществляются всеми атомами соединения.
Ионная связь в отличие от ковалентной происходит между атомами металлов и неметаллов, реже между неметаллами. Она образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному ядру, а свободно движутся по кристаллической решетке.
Металлическая от ионной связи отличается:
- типом связываемых частиц — у металлической связи нет как такового аниона, вместо него катионы притягивают электронный газ;
- прочностью связи при ударе — взаимное смещение катионов не приводит к разрыву, но если в связи находятся катион и анион, то связь может быть разорвана.
Как образуется ионная и металлическая связь, примеры
Ионная связь образуется между металлом и неметаллом (иногда неметаллом и неметаллом) с разным уровнем электроотрицательности. Ионы могут быть простыми и иметь только один атом, как, например, C l - , N a + , так и сложными и иметь несколько атомов и общий уровень заряда при них, как, например, N H 4 - .
Графически образование ионной связи можно проследить на схеме образования соединения натрия и хлора:
По принципу ионной связи образуются также хлороводород HCl, оксид кальция CaO, фторид натрия NaF, бромид серебра AgBr и другие.
Металлическая связь образуется между двумя неметаллами. В связь вступают ионы металла и свободные электроны. Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи одной формулой можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Металлическая связь: механизм образования и примеры
В одноатомном состоянии при обычных условиях находятся только благородные газы. Остальные же элементы не существуют в виде индивидуальном, так как имеют возможность взаимодействовать между собой или с другими атомами. При этом образуются более сложные частицы.
Совокупность атомов может образовать следующие частицы:
- молекулы;
- молекулярные ионы;
- свободные радикалы.
Типы химического взаимодействия
Взаимодействие между атомами называют химической связью. Основой являются электростатические силы (силы взаимодействия электрических зарядов), которые действуют между атомами, носителями этих сил являются ядро атома и электроны.
Это интересно: полярная и неполярная ковалентная связь — что это?
Электронам, находящимся на внешнем энергетическом уровне, отведена основная роль в образовании химических связей между атомами. Они наиболее удалены от ядра, а, следовательно, связаны с ним наименее прочно. Их называют валентными электронами.
Частицы взаимодействуют между собой различными способами, что приводит к образованию молекул (и веществ) разного строения. Различают следующие типы химической связи:
- ионная;
- ковалентная; ;
- вандерваальсова;
- металлическая.
Говоря о различных типах химического взаимодействия между атомами, стоит помнить о том, что все типы одинаково основаны на электростатическом взаимодействии частиц.
Металлическая химическая связь
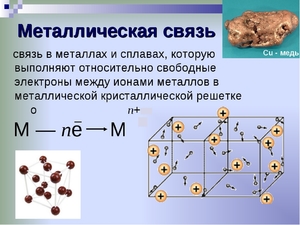
Как видно из положения металлов в таблице химических элементов, они, в большинстве своём, обладают небольшим числом валентных электронов. Электроны связаны со своими ядрами достаточно слабо и легко отрываются от них. В результате этого образуются положительно заряженные ионы металла и свободные электроны.
Эти электроны, свободно перемещающиеся в кристаллической решётке, называют «электронным газом».
На рисунке схематично изображено строение вещества металла.
То есть в объёме металла атомы постоянно превращаются в ионы (их называют атом-ионами) и наоборот ионы постоянно принимают электроны из «электронного газа».
Механизм образования металлической связи можно записать в виде формулы:
атом M 0 — ne ↔ ион M n+
Таким образом, металлы представляют собой положительные ионы, которые расположены в кристаллической решётке в определённых положениях, и электроны, которые могут достаточно свободно перемещаться между атом-ионами.
Кристаллическая решётка представляет «скелет», остов вещества, а электроны перемещаются между её узлами. Формы кристаллических решёток металлов могут быть различными, например:
- объёмно-центрическая кубическая решётка характерна для щелочных металлов;
- гранецентрическую кубическую решётку имеют, например, цинк, алюминий, медь, другие переходные элементы;
- гексагональная форма типична для щёлочноземельных элементов (исключением является барий);
- тетрагональная структура — у индия;
- ромбоэдрическая — у ртути.
Пример кристаллической решётки металла показан на картинке ниже.
Отличия от других видов

Отличается металлическая связь от ковалентной по прочности. Энергия металлических связей меньше, чем ковалентных в 3−4 раза и меньше энергии ионной связи.
В случае с металлической связью, нельзя говорить и о направленности, ковалентная связь строго направлена в пространстве.
Такая характеристика, как насыщаемость также не характерна для взаимодействия между атомами металлов. В то время как ковалентные связи являются насыщаемыми, то есть количество атомов, с которыми может произойти взаимодействие, строго ограничено количеством валентных электронов.
Схема связи и примеры
Процесс, происходящий в металле можно записать с помощью формулы:
Если описывать более подробно, металлическую связь, как образуется этот тип связи, необходимо рассматривать строение внешних энергетических уровней элемента.
В качестве примера можно рассмотреть натрий. Имеющийся на внешнем уровне единственный валентный 3s электрон может свободно перемещаться по свободным орбиталям третьего энергетического уровня. При сближении атомов натрия, происходит перекрывание орбиталей. Теперь уже все электроны могут перемещаться между атом-ионами в пределах всех пререкрывшихся орбиталей.
У цинка на 2 валентных электрона приходится целых 15 свободных орбиталей на четвёртом энергетическом уровне. При взаимодействии атомов эти свободные орбитали будут перекрываться, как бы обобществляя электроны, которые по ним перемещаются.
У атомов хрома валентных электронов 6 и все они будут участвовать в образовании электронного газа и связывать атом-ионы.
Свойства металлов

Особый вид взаимодействия, который характерен для атомов металлов, определяет ряд объединяющих их свойств и отличающих металлы от других веществ. Примерами таких свойств являются высокие температуры плавления, высокие температуры кипения, ковкость, способность отражать свет, высокая электропроводность и теплопроводность.
Высокие температуры плавления и кипения объясняются тем, что катионы металла прочно связаны электронным газом. При этом прослеживается закономерность, что прочность связи увеличивается с увеличением количества валентных электронов. Например, рубидий и калий являются легкоплавкими веществами (температуры плавления 39 и 63 градуса Цельсия, соответственно), по сравнению с, например, хромом (1615 градусов Цельсия).
Равномерностью распределения валентных электронов по кристаллу объясняется, например, такое свойство металлов, как пластичность — смещение ионов и атомов в любых направлениях без разрушения взаимодействия между ними.
Свободное перемещение электронов по атомным орбиталям объясняет и электропроводность металлов. Электронный газ при наложении разности потенциалов переходит из хаотического движения к движению направленному.
В промышленности часто используют не чистые металлы, а их смеси, называемые сплавами. В сплаве свойства одного компонента обычно удачно дополняют свойства другого.
Металлический тип взаимодействия характерен как для чистых металлов, так и для их смесей — сплавов, находящихся в твёрдом и жидком состояниях. Однако, если металл перевести в газообразное состояние, то связь между его атомами будет ковалентная. Металл в виде пара состоит и отдельных молекул (одно- или двухатомных).
Читайте также:
