Как выглядит молекула металла
Обновлено: 04.10.2024
Основными элементарными частицами, из которых строятся все вещества, являются протоны, нейтроны и электроны. Протоны имеют положительный заряд, электроны – отрицательный, нейтроны являются нейтральными частицами, не имеющими заряда. Согласно упрощенной модели Нильса Бора атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, компенсируя положительный заряд ядра. Ядро состоит из протонов и нейтронов. Электроны располагаются вокруг ядра несколькими слоями – оболочками.
Газы, жидкие и твердые тела состоят из атомов, молекул или ионов. Молекулами называют электрически нейтральные частицы, образованные из двух или более связанных ковалентными связями атомов (часто к молекулам причисляют также и свободные атомы). Ион – это электрически заряженная частица (атом или молекула), получаемая в процессе ионизации.
В зависимости от строения внешних электронных оболочек атомов в молекулах могут образовываться различные виды связей.
Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. Иными словами происходит образование общей пары электронов, которые ранее принадлежали отдельным атомам. При образовании общей одной пары электронов от каждого объединяемого атома вносится по одному валентному электрону. Например:
Молекулы, в которых центры положительных и отрицательных зарядов совпадают, являются неполярными. Если же в отдельных молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называются полярными или дипольными.
Ионная связь определяется силами притяжения между положительными и отрицательными ионами.
Металлическая связь. Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов
Молекулярная связь (связь Вандер-Вальса). Такая связь существует в некоторых веществах между молекулами с ковалентными внутримолекулярными связями. Межмолекулярное притяжение в этом случае обусловливается согла сованным движением валентных электронов в соседних молекулах. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит.
Раздела 1. Конструкционные материалы.
Тема №1. Строение и свойства металлов.
Металлы обычно имеют кристаллическое строение. В узлах кристаллической решетки металлов расположены положительно заряженные ионы, а часть валентных электронов, отщепившихся от атомов, становятся свободными. Свободные электроны обобществляются, образуя электронный газ, который взаимодействует с положительными ионами металла и связывает их в прочную систему.
Наиболее распространенными являются три типа кристаллической решетки: кубическая объемноцентрированная (о.ц.к.), кубическая гранецентрированная (г.ц.к.) и гексагональная плотноупакованная (г.п.у.)
Чистые металлы обладают низкой прочностью, поэтому в технике используют редко. Наиболее широко применяют в технике в качестве конструкционных материалов металлические сплавы.
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Большинство сплавов, кроме сплавов с неорганической растворимостью компонентов в твердом состоянии, можно представить как систему, состоящую из нескольких фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Фазой называют однородную по химическому составу и строению часть системы, отделенную от другой части системы поверхностью раздела, при переходе через которую изменяются состав, строение и свойства сплава.
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы:
1. Механические смеси (гетерогенная структура) – образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Каждая фаза имеет кристаллическую решетку, соответствующую данному компоненту.
2. Химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
3. Твердые растворы – это сплавы, в которых кристаллическая решетка построена из атомов двух или большего числа компонентов, при этом один из них является растворителем, а другой – растворимым. Твердый раствор имеет сильно деформированную кристаллическую решетку, тип которой соответствует типу решетки одному из образующих компонентов.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Различные кристаллические формы одного вещества называются полиморфными модификациями. Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ.
Железо с углеродом образует сплавы: твердые растворы внедрения и химические соединения, которые, в свою очередь, образуют сплавы гетерогенной структуры. В зависимости от содержания углерода С в Fe получают стали (содержание С до 2,14%) или чугуны (С от 2,14% и более).
В углеродистых сталях эти компоненты взаимодействуют, образуя, в зависимости от их количественного соотношения и температуры, разные фазы, представляющие собой однородные части сплава. Это взаимодействие заключается том, что углерод может растворяться как в жидком (расплавленном) железе, так и в различных его модификациях в твердом состоянии.
Кроме того, он может образовывать с железом химическое соединение. Таким образом, в углеродистых сталях различают следующие фазы:
Феррит – твердый раствор углерода и других примесей в α-железе (кристаллическая решетка – о.ц.к.). Предельная растворимость углерода – 0,02% в низкотемпературном феррите и 0,1% в высокотемпературном. Имеет невысокую прочность и твердость (НВ=800 МПа; σ = 250 МПа) и высокую пластичность.
Аустенит – твердый раствор углерода и других примесей в γ-железе (кристаллическая решетка – г.ц.к.). Предельная растворимость углерода – 2,14%. Механические свойства: НВ=1600-2000 МПа; σ = 500-800 МПа; δ = 40-50%.
Цементит – химическое соединение железа с углеродом – карбид железа Fe3C2, содержащий 6,67% углерода. Имеет очень высокую твердость (НВ=8000 Мпа) и очень малую пластичность.
Перлит – эвтектоидная механическая смесь двух фаз: феррита и цементита, которая образуется из аустенита с содержанием С 0,8 % при постоянной температуре t = 727 о С.
Как следует из приведенных выше характеристик, главной составляющей стали, определяющей ее свойства, является углерод. С увеличением содержания углерода возрастают прочность и твердость стали, снижаются показатели пластичности (относительное удлинение и относительное сужение), а также ударная вязкость. При 0,8 % углерода прочность стали достигает максимального значения, после чего она начинает снижаться.
ACD – линия ликвидуса. Показывает температуру начала затвердевания сталей и чугунов.
AECF – линия солидуса. Показывает температуру конца затвердевания сплавов.
При охлаждении твердых сплавов в них происходят фазовые и структурные изменения, связанные с аллотропическими превращениями Fe и изменением растворимости в нем углерода. Эти изменения (фазовые превращения) в сплавах Fe-С характеризуют линии GSE, PSK, GPQ.
Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекулой называют наименьшую электронейтральную частицу вещества, способную к самостоятельному существованию и обладающую его химическими свойствами. Молекула представляет собой систему взаимодействующих между собой атомов, образующих определённую структуру с помощью химических связей.
Химический элемент — совокупность атомов, характеризующихся одинаковым значением (величиной) заряда ядра.
Ионами называют электрически заряженные частицы, возникающие при потере или присоединении электронов атомами или молекулами.
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
Вещество — любая совокупность атомов и молекул.
Свойства веществ (температуры плавления и кипения, плотность, цвет и т. д.) относятся к совокупности атомов или молекул.
По химическому составу неорганические вещества делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента (например, H2, O2).
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В периодической таблице Д.И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведённой через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Сложными называют вещества, которые состоят из атомов двух и более элементов (например, H2S, NO2).
Для выражения состава вещества используют различные химические формулы. При их написании используют общепринятые символы химических элементов. Символ элемента состоит из первой буквы или первой и одной из последующих букв латинского названия элемента, при этом первая буква всегда прописная, а вторая — строчная.
Названия и обозначения атомов совпадают с символами химических элементов. Например, О — атом кислорода, 2О — два атома кислорода, О2 — молекула кислорода, О3 — молекула озона.
Сложные вещества разделяют на условно электроположительную (катион) и условно электроотрицательную (анион) составляющие. В формуле сложного вещества вначале ставят катион, а затем — анион, например KBr, CuSO4. Названия сложного вещества читают справа налево, т. е. вначале называют его электроотрицательную составляющую в именительном падеже, а затем электроположительную в родительном падеже.
Для бинарных, т. е. состоящих из двух элементов соединений, действуют следующие правила. Если соединение состоит из металла и неметалла, то на первом месте всегда ставят металл (как более электроположительный элемент): K2S, BaCl2.
В формулах соединений, состоящих только из неметаллов, на первом месте всегда ставят элемент, находящийся левее в условном ряду неметаллов, построенном по их возрастающей электроотрицательности:
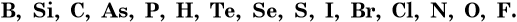
Например, IBr — бромид йода, CS2 — дисульфид углерода.
Формула молекулярная (брутто-формула) включает символы всех химических элементов, входящих в состав соединений. Около каждого символа ставят числовой индекс, показывающий, сколько атомов данного вида входит в состав соединения. Таким образом, молекулярная формула показывает качественный и количественный состав молекулы. Например, формула KNO3 показывает, что вещество состоит из 1 атома калия (индекс, равный 1, не ставится), 1 атома азота и 3 атомов кислорода.
Чтобы правильно прочитать формулу, надо знать как русские, так и латинские обозначения элементов. Называя вещество «вода», мы говорим, что его формула H2O (читается «аш два о»). Данное вещество состоит из двух атомов водорода и одного атома кислорода.
Называя вещество сульфат калия, K2SO4, мы читаем его формулу «калий два эс о четыре». Данное вещество состоит из двух атомов калия, одного атома серы и четырех атомов кислорода.
Если в формуле структурный фрагмент повторяется несколько раз, его заключают в круглые скобки и за скобками ставят числовой индекс, который произносят «дважды», «трижды», например, Ca(NO3)2 читается «кальций эн о три дважды», Mg3(PO4)2 читается «магний три пэ о четыре дважды».
Коэффициент, стоящий перед формулой вещества в уравнении реакции, читают как число, например: 3HNO2 — «три аш эн о два».
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и атома кислорода со степенью окисления –2.
Называют оксиды, руководствуясь следующими правилами:
- Вначале указывают слово оксид, а затем в родительном падеже название второго элемента;
- Если элемент может образовать несколько оксидов, то после названия элемента в скобках указывают его валентность;
- При написании формул оксидов кислород всегда ставят на втором месте.
Примеры: K2O — оксид калия, N2O5 — оксид азота (V), CrO3 — оксид хрома (IV).
Для некоторых распространённых оксидов используют тривиальные названия, например CaO — негашеная известь, N2O — веселящий газ, CO — угарный газ, CO2 — углекислый газ.
Оксиды классифицируют так.
Низшими называют оксиды, в которых элемент проявляет низшую степень окисления, например MnO — оксид марганца (II).
Высшими называют оксиды, в которых элемент проявляет высшую степень окисления, например Mn2O7 — оксид марганца (VII).
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни основные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, Rb2O, Cs2O, MgO, CaO, SrO, BaO, Cu2O, Ag2O, HgO, CrO, FeO.
Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства, в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Существует несколько способов получения оксидов.
Реакции простых веществ с кислородом:
При взаимодействии сложных веществ с кислородом часто образуется смесь оксидов элементов:
Оксиды металлов реагируют с химически более активными металлами. При этом образуется новый оксид и новый металл:
Некоторые высшие оксиды получают доокислением низших оксидов, а ряд низших оксидов получают разложением высших оксидов:
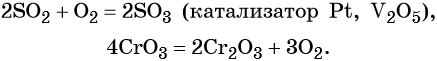
Иногда для получения оксидов используют реакции разложения солей и гидроксидов:
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания, например: NaOH — однокислотное, Mg(OH)2 — двухкислотное и т. д.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щёлочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Называют основания следующим образом:
- Вначале указывают слово гидроксид, а затем добавляют название металла в родительном падеже;
- Если элемент может образовывать несколько оснований, то после его названия в круглых скобках римской цифрой указывают валентность: KOH — гидроксид калия, Fe(OH)2 — гидроксид железа (II), Fe(OH)3 — гидроксид железа (III);
- При написании формул гидроксидов гидроксильную группу всегда ставят на втором месте.
Для некоторых распространённых гидрокидов используют тривиальные названия, например: Ca(OH)2 — гашёная известь; NaOH — едкий натр, или каустик.
Существуют следующие способы получения оснований:
Реакция основных оксидов с водой:
Взаимодействие некоторых металлов с водой:
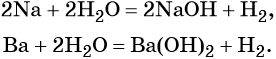
Реакция обмена между солями и основаниями:
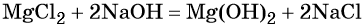
Первые два способа применяют для получения растворимых, а последний — для получения нерастворимых в воде оснований. Существуют и иные способы получения оснований.
Все растворы щелочей имеют pH > 7. При этих значениях pH происходит изменение окраски индикаторов: лакмуса — на синюю, фенолфталеина — на малиновую, метилового оранжевого — на жёлтую, что является качественным методом обнаружения щелочей. Более подробный материал о показателе pH будет изложен в уроке 24.
Кислотами называют класс химических соединений, которые содержат в своём составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
Основностью кислоты называют число способных замещаться на металл атомов водорода в её молекуле. По основности кислоты делят на одно-, двух- и трёхосновные, например HBr, H2S и H3PO4 соответственно.
В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3. Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
В таблице 4 приведены формулы и названия наиболее распространенных кислот и их солей.
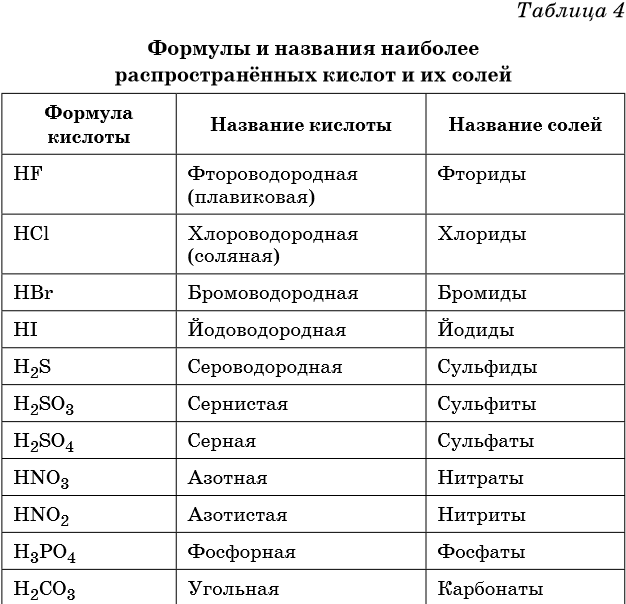

Сильные кислоты: HI, HBr, HCl, HClO3, HClO4, H2SO4, HNO3.
Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2. Некоторые гидроксиды, например Cu(OH)2, Fe(OH)3, проявляют амфотерные свойства с преобладанием основных.
Большинство кислородных кислот получают реакцией соответствующих оксидов с водой:
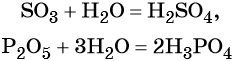
Некоторые кислоты получают из солей путём вытеснения более сильной кислотой, например:
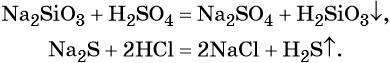
Бескислородные кислоты получают прямым взаимодействием неметалла с водородом либо действием более сильных кислот на соответствующие соли:
Солями называют класс химических соединений, которые представляют собой продукты взаимодействия кислот с основаниями.
По составу соли классифицируют на средние, кислые и основные.
Средними называют соли, которые состоят только из катиона металла или иона аммония и аниона кислотного остатка, например: CsBr, MgSO4.
Кислыми называют соли, которые наряду с катионом металла содержат катионы водорода, способные замещаться на другие катионы в ходе обменных реакций, например: LiHCO3 (гидрокарбонат лития), CaHPO4 (гидрофосфат кальция).
Основными называют соли, которые наряду с анионом кислотного остатка содержат одну или несколько гидроксильных групп, способных замещаться на анионы в ходе реакций обмена, например: Al(OH)2Br, Cu(OH)I.
При написании формул солей на первом месте ставят катион, а при написании названий — анион. Названия солей состоят из названия аниона в именительном падеже и названия катиона в родительном. Например, NaBr — бромид натрия, BaCO3 — карбонат бария. Если металл проявляет различные степени окисления, то в названиях степень окисления указывается римской цифрой: FeCl2 — хлорид железа (II), FeCl3 — хлорид железа (III). Кислые соли называют добавлением к аниону приставки гидро-, а если необходимо, то и соответствующего числительного, например: NaHCO3 — гидрокарбонат натрия, КH2PO4 — дигидрофосфат калия, Al(OH)2Br — дигидроксобромид алюминия, Cu(OH)I — гидроксойодид меди (II).
Основные соли называют добавлением приставки гидроксо- к названию кислотного остатка, указывая, если необходимо, соответствующее числительное: Mg(OH)Cl — гидроксохлорид магния, Al(OH)2Cl — дигидроксохлорид алюминия.
Существует множество путей получения солей. Приведём наиболее важные из них.
Реакция нейтрализации, т. е. взаимодействие кислот и оснований, взаимодействие кислот с основными и амфотерными оксидами и реакция оснований с кислотными оксидами:
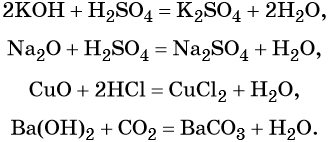
Взаимодействие кислот или щелочей с солями:
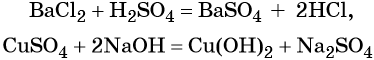
Взаимодействие металлов с неметаллами, кислотами, солями:
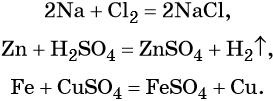
Взаимодействие основных и кислотных оксидов:
По своим физическим свойствам соли — твёрдые кристаллические вещества, часто имеющие высокие температуры плавления. По растворимости в воде соли делятся на растворимые (более 1 г вещества на 100 г воды), малорастворимые (от 0,1 до 1 г вещества на 100 г воды) и нерастворимые (менее 0,1 г вещества на 100 г воды). В воде растворимы все соли азотной и уксусной кислот.
Тренировочные задания
1. Кислотой и амфотерным гидроксидом соответственно являются
2. Основанием и кислотным оксидом соответственно являются
3. Кислой солью и несолеобразующим оксидом соответственно являются
4. Гидроксидом и щёлочью соответственно являются
5. Вещество, химическая формула которого Cr2(SO4)3, имеет название
1) сульфат хрома (III)
2) сульфит хрома (III)
3) сульфат хрома (II)
4) сульфит хрома (II)
6. Вещество, химическая формула которого CaHPO4, называется
1) фосфат кальция
2) гидрофосфат кальция
3) дигидрофосфат кальция
4) фосфид кальция
7. К простым веществам относится
1) поваренная соль
2) кислород
3) оксид кремния
4) пищевая сода
8. К простым веществам относится
1) поташ
2) углекислый газ
3) веселящий газ
4) бром
9. К сложным веществам относится
1) поташ
2) сера
3) озон
4) бром
10. К сложным веществам относится
1) фтор
2) фосфор
3) углекислый газ
4) бром
11. Только основные оксиды приведены в списке
12. Только несолеобразующие оксиды приведены в списке
13. В перечне веществ, формулы которых: А) H2O В) HNO3 Д) CaO Б) N2O Г) H2SO4 Е) NaOH к оксидам относятся
1) АБВ
2) АБД
3) БВД
4) БДЕ
14. В перечне веществ, формулы которых: А) CaO В) Cr2O3 Д) SrO Б) Fe2O3 Г) NO Е) Li2O к основным оксидам относятся
1) АБВ
2) АБД
3) БВД
4) АДЕ
15. В перечне веществ, формулы которых: А) CO2 В) SO2 Д) SrO Б) CrO3 Г) Cr2O3 Е) CrO к кислотным оксидам относятся
16. В перечне веществ, формулы которых: А) CrO В) ZnO Д) Al2O3 Б) CrO3 Г) Cr2O3 Е) NO к амфотерным оксидам относятся
1) АБВ
2) АВД
3) ВГД
4) АДЕ
1) АБВ
2) БВГ
3) БВД
4) АБД
18. В перечне веществ, формулы которых: А) HCl В) (NH4)2HPO4 Д) H3PO4 Б) HNO3 Г) NH4HSO4 Е) Ca(HCO3)2 к кислотам относятся
Значение слова МОЛЕКУЛА. Что такое МОЛЕКУЛА?
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.

Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода. Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40). Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.

Видео
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.

Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Металлическая — ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Ионная — имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
Ковалентная — может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.

Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.

Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим — расчётные методы квантовой химии.
Типы химической связи
- Металлическая — расположенные в узлах кристаллических решеток ядра атомов металла объединены единым массивом электронов.
- Водородная — обусловлена возможностью атома водорода формировать при смещении от него электронной плотности дополнительные связи.
- Ионная — носит электрическую сущность. Она высоко поляризована. Формируется за счет присоединения ионов, которые несут противоположный заряд.
- Ковалентная — бывает как полярной, так и неполярной. Она состоит из пары электронов, которые принадлежат двум атомам. Данная связь примечательна наивысшей стабильностью и энергетической ёмкостью.
Связи обозначаются нижеуказанными признаками:
- длина — степень, в которой ядра атомов, образовавших связь, удаляются друг от друга;
- энергия — величина силы, приложенной к разрыву соединения;
- полярность — сдвиг облака электронов в сторону одного из атомов;
- порядок или кратность — число электронных пар, которые образовали связь.
Структура молекул может быть представлена графически (структурной формулой). Главные взаимосвязи атомов в формуле обозначаются штрихами. В подобных структурах связи формируют целостную цепь и демонстрируют валентность элементов (атомов), которые их образовывали.

Структурные формулы также демонстрируют, каков внешний вид молекулы (линейный, циклический, наличие радикалов и т.д.).
В настоящее время интенсивно изучается структура частицы вещества. С этой целью применяются различные эксперименты и теоретические методы. Экспериментальные методы включают рентгеновский структурный анализ, спектроскопию, масс-спектрометрию и др. Теоретические методы включают методы расчета квантовой химии.
Что такое молекула в химии
Для химической дисциплины изучение молекул играет одну из самых важных ролей. Благодаря химическим исследованиям была получена важнейшая информация о составе и характеристиках этой крошечной единицы материи.
- наименьшей частью одного вещества;
- наименьшим электрически нейтральным множеством атомов, которые образуют определенную структуру посредством химических связей;
- может представлять собой один, несколько или множество, как одинаковых, так и разнообразных атомов.
Когда молекулы проходят через химические превращения, они обмениваются атомами и распадаются. Именно поэтому знания о строении и состоянии данных частиц являются основой для изучения химии веществ и их преобразования.
Основываясь на имеющихся знаниях о происходящих химических реакциях, мы имеем возможность прогнозировать структуру молекул задействованных в них веществ. Верен и обратный вывод: на основании знаний о структуре молекулы вещества вполне реально прогнозировать его поведенческие характеристики в ходе химической реакции.
Из чего состоит молекула?

Как здание состоит из кирпичиков, а любой механизм, сделанный человеком – из деталей, так и молекула состоит из простых «кирпичиков» – атомов химических элементов. Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Строение любой молекулы можно записать в виде химической формулы, которая указывает, из атомов каких химических элементов состоит вещество и сколько атомов каждого вещества содержится в одной молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
Всем известна формула воды: H2O, которая означает, что каждая молекула воды содержит один атом кислорода и два атома водорода. Еще одна известная буквально всем формула – С2Н5ОН, формула этилового спирта, которая показывает, что это вещество состоит из двух атомов углерода (С), шести атомов водорода (Н) и одного атома кислорода (О).
В процессе взаимодействия друг с другом вещества обмениваются химическими элементами, вступая в реакции. При этом образуются новые вещества, обладающие новыми свойствами, отличными от свойств исходных веществ.

Так, уголь (практически полностью состоящий из углерода), сгорая (взаимодействуя с кислородом, содержащимся в воздухе), образует углекислый газ – вещество, непригодное для дыхания, в отличие от кислорода. Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин «атомос», имея в виду «мельчайшие неделимые части материи», от которых мы получаем современный термин «атом».
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием «Скептический химик» утверждал, что материя состоит из различных комбинаций «корпускул» (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.

Сканирующий туннельный микроскоп
Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.
Урок 3. Молекулы и простые вещества
В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.

Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов. Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния. Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Что такое молекула?
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
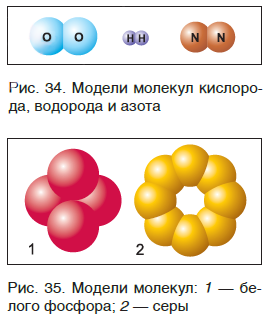
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
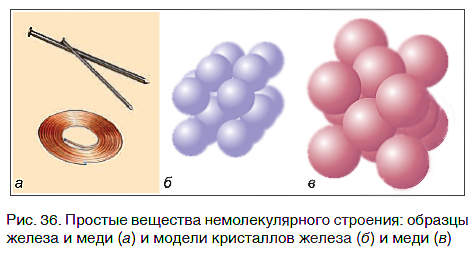
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Металлы и неметаллы

Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.

Названия простых веществ
В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
Краткие выводы урока:
- Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
- Простые вещества состоят из атомов одного химического элемента.
- Простые вещества имеют молекулярное или немолекулярное строение.
- Простые вещества делят на металлы и неметаллы.
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Читайте также:
