Какая структура белка разрушается под действием солей тяжелых металлов
Обновлено: 04.10.2024
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
1) яичный белок, 1% раствор;
2) сульфат меди, 10% раствор;
3) ацетат свинца, 5% раствор;
4) нитрат серебра, 5% раствор.
Классификация белков в зависимости от выполняемых функций:
- ферменты – (от лат. «fermentum» - брожение, закваска) – группа специфических белков, увеличивающих скорость протекания химических реакций в клетках всех живых организмов.
- транспортные – группа белков, выполняющих функцию переноса различных атомов, молекул, ионов как внутри клетки, так и между клетками в многоклеточных организмах.
- структурные – группа белков, отвечающих за поддержание формы и стабильности клеток и тканей.
- регуляторные (гормональные) – группа белков, осуществляющих функции сигнальных веществ (гормонов).
- защитные – группа белков, предохраняющих организм от вторжения других организмов и повреждений.
- запасающие (резервные, пищевые) – группа белков, являющихся ценными пищевыми веществами. У животных – мышечные белки служат резервными питательными веществами, которые мобилизируются при крайней необходимости.
- сократительные (дигательные) – группа белков, ответственных за мышечное сокращение и другие формы биологической подвижности.
16.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от bqcx остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций.
Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандомвысокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
А. Активный центр белков и избирательность связывания его с лигандом
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25).
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.

Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом.
1. Характеристика активного центра
Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует "рельеф" активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют "ансамблем" аминокислот.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа в составе тема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным.
Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85).
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в "ловушке", что облегчает его дальнейшее фосфорилирование.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
- Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
- существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
- существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют "простатическая группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо (более подробно гемсодержащие белки описаны в разделе 4, а кофакторы и коферменты - в разделе 2).
Соединение протомеров в олигомерном белке - пример взаимодействия высокомолекулярныхлигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са 2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.

Рис. 1-26. Связывание гексокиназы с глюкозой.
3. Сродство активного центра лиганду
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации - характеристика сродства активного центра лиганду.
· Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением:
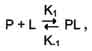
где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости связывания белка с лигандом, К-1 - константа скорости распада комплекса PL.
Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия:
Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [PL]. Чем меньше Кдисс , тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиганда к белку имеется обратно пропорциональная связь.
Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс, называемую константой связывания (Ксв) или ассоциации.
Между Ксв. и сродством лиганда к белку существует прямо пропорциональная зависимость.
Зависимость насыщения белка лигандом от концентрации лиганда при постоянной концентрации белка
· При постоянной концентрации белка увеличение концентрации лиганда приводит к росту концентрации комплекса [PL]. Эта зависимость носит характер гиперболической кривой (рис. 1-27). Кривая стремится к максимуму, когда при некоторой концентрации лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом). Степень насыщения белка лигандом можно выразить следующим уравнением: степень насыщения = [PL]/[P0]?100 (где Р0 - концентрация белка до добавления лиганда).
· При полунасыщении белка лигандом концентрации [PL] и [Р] равны, и из уравнения Кдисс, приведённого выше, следует, что Кдисс = [L], т.е. Кдисс численно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. Поэтому по кривой насыщения можно найти Кдисс и оценить сродство данного белка лиганду.
Зависимость между образованием комплекса [PL] и концентрацией белка при избытке лиганда
· Как было сказано выше, при возрастающей концентрации лиганда насыщение белка ограничено его концентрацией. При избытке лиганда все молекулы белка находятся в составе комплекса [PL]. Однако, если увеличивать концентрацию белка, то количество [PL] начнёт увеличиваться пропорционально концентрации белка. Концентрацию комплекса [PL] можно регистрировать, например

Рис. 1-27. График насыщения белка лигандом.
· с помощью измерения поглощения света. Учитывая, что его количество пропорционально концентрации белка, можно на основании построенного графика определять концентрацию белка в растворе (рис. 1-28).
В основе функционирования любого белка лежит его способность к избирательному взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе другой белок. Лиганд присоединяется к определенному участку на поверхности белковой молекулы — центру связывания (активный центр).
Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка и структуры лиганда.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка, активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структуройпо отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
19.Четвертичная структура белков
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков".Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
1. Количество протомеров в структуре
олигомерных белков
В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа - 4 протомера; Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. Олигомерные белки имеют большую молекулярную массу. Белки с молекулярной массой более 50 000 Д практически всегда содержат несколько мономерных полипептидных цепей. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции.
2. Сборка протомеров в олигомерный белок.
Комплементарность протомеров
"Узнавание" и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом. Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены. Комплементарность - универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул.
Кооперативность
Кооперативное связывание
Когда субстрат связывается с активным центром одной субъединицы фермента, остальные субъединицы активируются. Лиганды могут иметь некооперативный, положительный или отрицательный кооперативный эффект.(Примером положительной кооперативности может служить связывание кислорода гемоглобином.)Отрицательная кооперативность означает противоположное — в момент связывания лиганда белком, сродство белка к лиганду снижается. Примером может служить взаимодействие между глицеральдегид-3-фосфатом и ферментом глицеральдегид-3-фосфат дегидрогеназой.
Кооперативность, явление кооперативности — это такие изменения состояния системы, взаимодействие элементов которой усиливается с течением процесса изменения так, что существенно ускоряет его ход в целом (положительная кооперативность). Таким образом, сила взаимодействия атомов или молекул возрастает по мере нарастания изменений в системе, делая их коллективно согласованными
3. ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА.
Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
Белки

. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации - свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Для белков известны несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина) дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция) .
Биологическое значение белков чрезвычайно велико. Упомянем только важнейшие функции белков в живых организмах.
1. Абсолютно все химические реакции в организме протекают в присутствии катализаторов — ферментов. Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой. Все известные ферменты представляют собой белковые молекулы. Белки — это очень мощные и, самое главное, селективные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой единственный фермент.
2. Некоторые белки выполняют транспортные функции и переносят молекулы или ионы в места синтеза или накопления. Например, содержащийся в крови белок гемоглобин переносит кислород к тканям, а белок миоглобин запасает кислород в мышцах.
3. Белки — это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
4. Белки играют важную роль в иммунной системе организма.
Существуют специфические белки (антитела) , которые способны распознавать и связывать чужеродные объекты - вирусы, бактерии, чужие клетки.
5. Белкирецепторы воспринимают и передают сигналы, поступающие от соседних клеток или из окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Из приведенного перечня функций белков ясно, что белки жизненно необходимы любому организму и являются, следовательно, важнейшей составной частью продуктов питания. В процессе пищеварения белки гидролизуются до аминокислот, которые служат исходным сырьем для синтеза белков, необходимых данному организму. Существуют аминокислоты, которые организм не в состоянии синтезировать сам и приобретает их только с пищей. Эти аминокислоты называются незаменимыми. Для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин.
Тест по теме « Белки».

1. Определите признак, по которому все нижеперечисленные соединения, кроме одного, объединены в одну группу. Укажите «лишние» среди них химическое соединение.
1) пепсин 5) каталаза
2) коллаген 6) мальтаза
3) кератин 7) гемоглобин
2. Соли тяжелых металлов (ртути, мышьяка, свинца) являются ядами для организма. Они связываются с сульфидными группировками белков. Назовите структуру белков, которая разрушается под действием солей тяжелых металлов.
1) первичная 3) третичная
3. Назовите белок, выполняющий ферментативную функцию.
1) гормон роста 4) актин
2) фибрин 5) трипсин
4. В каком ответе все названные химические соединения относятся к
1) тубулин, коллаген, лизоцим
2) лизин, триптофан, аланин
3) холестерин, прогестерон, стеариновая кислота
4) валин, мальтаза, кератин
5) сахароза, лактоза, глицин
6) аденин, тимин, гуанин
5. Белки как полимеры имеют особенности, по которым существенно отличаются от
каких полисахаридов, как гликоген и крахмал. Найдите эти особенности среди
и укажите признак, который такой особенностью НЕ является.
1) очень большое число мономеров
2) являются линейными полимерами
3) иная структура мономеров
4) мономеры белка отличаются друг от друга
1) количество аминокислот
2) количественное соотношение аминокислот разных видов
3) последовательность соединения аминокислот друг с другом
4) структура химических связей, участвующих в формировании
7. Назовите органические соединения, которые содержатся в клетке в наибольшем
количестве (в % на сырую массу).
- 1) углеводы
- 2) липиды
- 3) белки
- 4) нуклеиновые кислоты
- 5) низкомолекулярные органические вещества
8. Назовите функциональные группы соседних аминокислот в белке, между
которыми образуется пептидная связь.
- 1) радикалы 4) карбоксильные группы
- 2) карбоксильная группа и аминогруппа 5) карбоксильная группа и радикал
- 3) радикал и ион водорода 6) аминогруппа и радикал
9. Назовите белок, выполняющий рецепторную функцию.
1) лизоцим 3) протромбин
2) пепсин 4) родопсин
10. Назовите белок, выполняющий рецепторную функцию.
1) коллаген 3) гемоглобин
3) фибрин 4) инсулин
Просмотр содержимого документа
«Тест по теме « Белки».»
Тест по теме « Белки».
Выберите один правильный ответ:
4) нуклеиновые кислоты
5) низкомолекулярные органические вещества
1) радикалы 4) карбоксильные группы
2) карбоксильная группа и аминогруппа 5) карбоксильная группа и радикал
3) радикал и ион водорода 6) аминогруппа и радикал
11. Назовите белок, выполняющий в основном структурную функцию.
1) кератин 4) липаза
2) каталаза 5) гормон роста
12. Назовите белок, выполняющий в основном транспортную функцию.
1) коллаген 4)гемоглобин
2) кератин 5) миоглобин
13. Назовите основную функцию, которую выполняют такие белки, кератин,
1) двигательная 4) транспортная
2) защитная 5) строительная
14. Назовите белок, выполняющий в основном двигательную функцию.
1) актин 4) каталаза
2) фибрин 5) липаза
3) тромбин 6) миоглобин
15. Назовите функцию, которую выполняет основная масса белков семян растений и
1) защитная 4) двигательная
2) строительная 5) ферментативная
16. В каком ответе все названные химические соединения являются белками?
1) сахароза, инсулин, урацил
2) фенилаланин, глюкагон, пепсин
3) глюкоза, фруктоза, гликоген
4) каталаза, глюкагон, кератин 5) рибоза, тимин, актин
17. Определите признак, по которому все нижеперечисленные химические
соединения, кроме одного, объединены в одну группу. Укажите это «лишнее»
среди них химическое соединение.
1) аланин 5) актин
2) валин 6) лейцин
3) глицин 7) цистеин
18. Назовите белок, выполняющий ферментативную функцию.
1) каталаза 4) глюкагон
2) протромбин 5) кератин
19. Назовите белок, входящий в состав микротрубочек жгутиков и ресничек,
центриолей и веретина движения.
1) кератин 3) миозин
2) тубулин 4) коллаген
20. Назовите белок волос.
1) кератин 3) миозин 5) актин
2) тубулин 4) коллаген 6) фибрин
21. Что является мономером белков?
1) глюкоза 4) нуклеиновая кислота
2) нуклеотид 5) азотистое основание
22. Сколько видов аминокислот входит в состав природных белков?
23. Что происходит с третичной структурой транспортных и ферментативных белков
в момент выполнения ими своих функций
1) не изменяется
3) слегка видоизменяется
5) приобретает четвертичную структуру
6) переходит во вторичную структуру
24. Назовите белок, из которого состоят рога, копыта, когти, перья и волоса
1) коллаген 3) тубулин
2) кератин 4) миозин
25. Назовите белок, который был первым из синтезирован искусственно.
1) инсулин 3) каталаза
2) гемоглобин 4) интерферон
26. Приведите пример белка, состоящего из нескольких полипептидных цепей.
1) трипсин 3) миоглобин
2) пепсин 4) коллаген
27. Назовите все химические группировки, одинаковые у всех аминокислот,
входящих в состав природных белков.
1) только аминогруппа и карбоксильная группа
2) водород и радикал
3) водород, аминогруппа и карбоксильная группа
4) радикал, аминогруппа и карбоксильная группа
28. Каким терминам называется потеря белком своей естественной пространственной
1) спирализация 4) дисперсия
2) конденсация 5) репарация
3) денатурация 6) дегенерация
29. Назовите белок, составляющий основу сухожилий, связок и межклеточного
вещества костной ткани.
1) кератин 4) коллаген
2) тубулин 5) актин
3) миозин 6) фибрин
30. Приведите пример белка, состоящего из нескольких полипептидных цепей.
1) миоглобин 3) трипсин
2) гемоглобин 4) пепсин
31. Какие химические соединения в обязательном порядке имеют следующие
химические группировки: аминогруппу и карбоксильную группу?
1) азотистые основания 4) аминокислоты
2) нуклеотиды 5) жирные кислоты
3) нуклеиновые кислоты 6) полисахариды
32. К какому виду химических связей относят пептидную связь?
1)ионные 3) ковалентные
2) водородные 4) гидрофобные
33. Назовите белок, выполняющий в основном структурную (строительную) функцию.
1) пепсин 3) инсулин
2) коллаген 4) миозин
34. Каким термином называется процесс образования первичной структуры белка?
1) транскрипция 4) диссимиляция
2) трансляция 5) полимеризация
35. Назовите белки, выполняющие в основном структурную ( строительную) функцию.
1) пепсин, трипсин 4) коллаген
2) гемоглобин, карбоангидраза 5) актин, миозин
3) инсулин, глюкагон
36. Как называется структура белка, представляющая собой спираль, в которую
свёрнута цепочка из аминокислот?
2) вторичная 4) четвертичная
37. К какой группе органических соединений относят аланин, валин, лизин, триптофан?
3) нуклеиновые кислоты
38. Назовите белки-гормоны, выполняющие регуляторные функции.
1) пепсин, трипсин 4) коллаген, кератин
39. Укажите химическую группировку, которая НЕ входит в качестве радикала ни в
одну из аминокислот, встречающихся в природных белках.
40. Назовите в молекуле аминокислот химическую группировку, которая придаёт
Процесс необратимого осаждения белков. Денатурация, обратимость процесса.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
(При действии солей тяжелых металлов происходит денатурация белковой молекулы. Осаждение денатурированного белка происходит из-за адсорбции частиц металла на поверхности белковой частицы. Свойства белков осаждаться солями тяжелых металлов используется в медицинской практике. Белки (в составе молока, яйца) применяют в качестве противоядия при отравлении солями тяжелых металлов. Белок ограничивает всасывание ионов металла, образуя с ними нерастворимые комплексы.)
Денатурация белков (лат. denaturatus — лишенный природных свойств; от de- — приставка, означающая отделение, удаление + natura — природа, естество) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Ренатурация — процесс, обратный денатурации, при котором белки возвращают свою природную структуру.(При нагревании двухцепочечных молекул ДНК до темп-ры ок. 100°С водородные связи между основаниями разрываются, и комплементарные цепи расходятся — ДНК денатурирует. Однако при медленном охлаждении комплементарные цепи могут вновь соединяться в регулярную двойную спираль. Эта способность ДНК к Р. используется для получения искусств, гибридных молекул ДНК (т. н. молекулярная гибридизация)
Нативная структура белка и ее разрушения. Признаки денатурации.
Функционально активную конформацию белка называют "нативная структура".
Денатурация белков - это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов. Денатурация сопровождается потерей биологической активности белка.
Признаки денатурации:
1.Уникальная трехмерная структура каждого белка разрушается, и все молекулы одного белка приобретают случайную конформацию, т. е. отличную от других таких же молекул.
2. Радикалы аминокислот, формирующие активный центр белка, оказываются пространственно удаленными друг от друга, т. е. разрушается специфический центр связывания белка с лигандом.
3. Гидрофобные радикалы, обычно находящиеся в гидрофобном ядре глобулярных белков, при денатурации оказываются на поверхности молекулы, тем самым создаются условия для агрегации белков. Агрегаты белков выпадают в осадок.
4. При денатурации белков не происходит разрушения их первичной структуры. Вспомните условия, в которых происходит гидролиз пептидных связей.
Осаждение белков солями тяжелых металлов, механизм, особенности, значение для клиники.
При действии солей тяжелых металлов происходит денатурация белковой молекулы. Осаждение денатурированного белка происходит из-за адсорбции частиц металла (свинца, меди, ртути, серебра и других) на поверхности белковой частицы.
Особенности:Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
В клинике:свойства белков осаждаться солями тяжелых металлов используется в медицинской практике. Белки (в составе молока, яйца) применяют в качестве противоядия при отравлении солями тяжелых металлов. Белок ограничивает всасывание ионов металла, образуя с ними нерастворимые комплексы.
Денатурация: особенности процесса, влияющие факторы, механизмы и последствия

Человеческий организм нуждается в различных типах молекул, и наиболее важными являются молекулы белков, которые содержат азот и состоят из аминокислот. Молекулы белка образуют основной строительный блок мышц и других тканей в организме человека. Их название указывает на то, что они имеют решающее значение для здоровья человека. Слово «белок» происходит от греческого «протеос», что означает «первый» или «первом месте». Каждый белок имеет свое место действия и задачи, которые он выполняет. Функции белка можно разделить на 9 основных:
- рост и сохранение тканей
- биохимические реакции
- передача связи между клетками
- структура ткани
- поддержание правильного pH
- баланс жидкости
- укрепление иммунной системы
- передача и поставка питательных веществ
- обеспечение энергии
Молекулы белка имеют разные размеры, в зависимости от количества аминокислот. Малые молекулы включают, например, инсулин из 51 аминокислоты, в то время как очень большие молекулы включают титан из почти 27 000 аминокислот.Однако размер молекул не имеет значения, для правильного функционирования они должны быть в подходящей форме. Каждый тип белка имеет уникальную форму, которая определяет роль белка в организме. Попробуйте представить белки как ключи, которые принадлежат только определенным дверям в человеческом организме.
Человеческий метаболизм расщепляет белки на более простые частицы – аминокислоты. 20 аминокислот необходимы для роста мышц и обмена веществ, 11 из которых не являются необходимыми. Это означает, что наш организм может создавать их сам, и их не нужно употреблять в пищу. Остальные аминокислоты помечены как незаменимые, и организм человека получает их из пищи и пищевых добавок. Мышечная ткань не может расти или регенерировать без них.
Что такое денатурация белка?

Денатурация – это процесс, при котором структура белковой молекулы нарушается, тем самым теряя свою функцию. Различия в форме белка могут быть вызвать:
- изменение температуры
- изменение pH
- воздействие химических веществ
Денатурация меняет форму белка, но последовательность аминокислот остается прежней. Цель протеина в форме пищевой добавки состоит в том, чтобы восполнить достаточное количество белка, и чтобы пищеварительная система могла разрушиться, тем самым снабжая мышечную ткань. Эта функция не теряется при термообработке белков.
Хорошим примером также является белок пепсин, который действует как фермент и расщепляет белки в желудке. Он работает только при низком pH, теряет свою функцию в среде с высоким pH и денатурирует. По этой причине pH желудка поддерживается на очень низком уровне, чтобы обеспечить правильное функционирование пепсина.
Тепло используется для разрыва водородных связей и неполярных гидрофобных взаимодействий в молекуле белка. Более высокая температура увеличивает кинетическую энергию и заставит молекулы вибрировать очень быстро, пока связи между ними не будут разрушены. Молекула белка разворачивается из своей трехмерной структуры, обеспечивая лучший доступ пищеварительного фермента к белковым связям.
Вот почему мы готовим продукты, чтобы изменить структуру белка и облегчить его переваривание. Например, этот процесс происходит, когда вы готовите яйца. В это время белок из яиц денатурируется и во время варки. После употребления вареных яиц переваривание и усвоение содержащихся в них питательных веществ происходит быстрее. Вы можете быть удивлены тем, что такой же процесс происходит при стерилизации медицинских инструментов. Тепло денатурирует белки в бактериях, которые затем уничтожают бактерии и дезинфицируют объекты.
Особенности процесса
Он сопровождается разворачиванием полипептидной связи, которая в растворе изначально представлена в виде беспорядочного клубка.
Процесс денатурации белка сопровождается утрачиванием гидратной оболочки, выпадением белка в осадок, утрачиванием им нативных свойств.
Среди основных факторов, которые провоцируют процесс денатурации, выделим физические параметры: давление, температуру, механическое действие, ионизирующее и ультразвуковое излучение.
Денатурация белка происходит под воздействием органических растворителей, минеральных кислот, щелочей, солей тяжелых металлов, алкалоидов.

Свойства денатурированных белков, виды денатурации
При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Различают 2 вида денатурации:
- Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
- необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Свойства денатурированных белков:
- Увеличение числа реактивных или функциональных групп по сравнению с нативной молекулой белка (это группы COOH, NH2, SH, OH, группы боковых радикалов аминокислот).
- Уменьшение растворимости и осаждение белка (связано с потерей гидратной оболочки), развертыванием молекулы белка, с «обнаружением» гидрофобных радикалов и нейтрализации зарядов полярных групп.
- Изменение конфигурации молекулы белка.
- Потеря биологической активности, вызванная нарушением нативной структуры.
- Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
Ферментные методы гидролиза основаны на избирательности действия протеолитических ферментов расщепляющих пептидные связи между определенными аминокислотами.
Пепсин расщепляет связи, образованные остатками фенилаланина, тирозина и глутаминовой кислоты.
Трипсин расщепляет связи между аргинином и лизином.
Химотрипсин гидролизует связи триптофана, тирозина и фенилаланина.
Гидрофобные взаимодействия, а также ионные и водородные связи относятся к числу слабых, тк энергия их лишь ненамного превосходит энергию теплового движения атомов при комнатной температуре(т е уже при данной температуре возможен разрыв связей ).
Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Однако, белки состоят из огромного числа атомов , находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи , которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью – склонностью к небольшим изменениям конформации за счет разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических средств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют роль огромную в функционировании белков в клетке живой.
Факторы, вызывающие денатурацию белков
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-500С. Такие белки называют термолабильными. Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными.
Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
Что происходит в процессе денатурации белков

Особенности и преимущества профессионального кухонного оборудования
В процессе денатурации белка имеет место разрыв химических связей (дисульфидных, водородных, ван-дер-ваальсовых, электростатических и др.), которые стабилизируют высшие уровни организации белковой молекулы, что обуславливает изменение пространственной структуры белка. Следует отметить, то в большинстве случаев первичная структура белка в процессе денатурации не нарушается, поэтому после раскрутки цепи полипептидов (стадия нити), протеин может снова стихийно скручиваться, при этом образуя «случайный клубок», то есть переходит к хаотическому состоянию, отличного от нативной конформации.
Процесс денатруации белков происходит при температуре выше, чем 56 °С.
Типичными признаками необратимой денатурации белков является снижение гидрофильности и растворимости белков, увеличение оптической активности, изменение изоэлектрической точки, уменьшение устойчивости белковых растворов и молекулярной массы и изменение формы белковых молекул, увеличение вязкости и усиление способности к расщеплению ферментами, переход молекулы в хаотическое состояние, при котором наблюдается агрегация частиц белка и выпадение их в осадок.
Схема денатурации белка: а — нативная молекула; б — развертывание полипептидной цепи; в — стадия нити; г — случайный клубок
При непродолжительном действии денатурирующего агента (например, органического растворителя) возможно восстановление нативной структуры белка. Этот процесс называется ренатурацией. При ренатурации происходит восстанавлениене только структуры, но и биологических функций белка. С денатурацией связаны процессы переработки продуктов питания, изготовления одежды, обуви, консервирования и сушки овощей и фруктов. Результатом необратимой денатурацией протеинов является потеря способности к прорастанию семян при длительном хранении, особенно при неблагоприятных условиях. Процесс денатурации белков широко применяется в медицине, ветеринарии, фармации, клинике и биохимических исследованиях с целью осаждения протеина в биологическом материале с целью дальнейшей идентификации в нем низкомолекулярных и небелковых субстанций, с целью как установления наличия протеина, так и его количественного определения, для обеззараживания слизистых покровов и кожи, для конъюгации солей тяжелых металлов при терапии отравлений солями свинца, ртути, меди и т.п. или с целью профилактики подобных токсикозов на предприятии.
Процесс денатурации белков происходит также при приеме фармакологических препаратов танальбина и танина, на чем базируются их противовоспалительное и вяжущее действие. Вяжущие свойства танина базируются на его способности осаждать протеины с синтезом плотных альбуминатов, защищающих от раздражения тканей, в частности чувствительные нервные окончания. При этом уменьшается проявление воспалительной реакции, а также снижаются болевые ощущения и происходит непосредственное уплотнение мембран клеток. Препарат танальбин представляет собой продукт взаимодействия белка казеина с танином — в отличие от танина, данный препарат не оказывает вяжущего действия на слизистую оболочку желудка и ротовой полости. Только после попадания в кишечник он поддается процессу расщепления, выделяя при этом свободный танин. Применяется в медицине и ветеринарии как вяжущее лекарственное средство при хронических и острых болезнях кишечника, в частности у детей.
В практике фармацевтики использование процессов денатурации белка дает возможность контролировать качество протеиновых препаратов, например, в ампулах.
Последствия
После денатурации происходит переход нативной компактной структуры в рыхлую развернутую форму, упрощается проникновение к пептидным связям ферментов, необходимых для разрушения.
Конформация белковых молекул определяется возникновением достаточного количества связей между разными участками определенной полипептидной цепочки.
Белки, состоящие из достаточного количества атомов, которые находятся в непрерывном хаотичном движении, способствует определенным перемещениям частей полипептидной цепи, что вызывает нарушение общей структуры белков, снижение его физиологических функций.
Белки имеют конформационную лабильность, то есть предрасположенность к незначительным изменениям конформации, происходящим в результате обрыва одних и образования других связей.
Денатурация белка приводит к изменениям его химических свойств, способности вступать во взаимодействие с другими веществами. Наблюдается изменение пространственной структуры и участка, непосредственно контактирующего с иной молекулой, и всей конформацией в целом. Наблюдаемые конформационные изменения имеют значение для функционирования белков в живой клетке.
Механизмы денатурации
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Читайте также:
