Какая связь называется металлической
Обновлено: 17.05.2024
химическая связь, обусловленная взаимодействием «электронного газа» (валентные электроны) металлов с остовом положительно заряженных ионов кристаллической решётки. По природе близка к ковалентной связи. Характерна для металлов, их сплавов, металлидов; сохраняется не только в твердых кристаллах, но и в расплавах и аморфном состоянии.
МЕТАЛЛИ́ЧЕСКАЯ СВЯЗЬ, вид химической связи атомов в веществах, обладающих металлическими свойствами.
Кристалл с металлической связью можно представить себе как решетку из положительно заряженных атомных ядер, погруженных в отрицательно заряженный «газ», состоящий из свободных электронов, который удерживает положительно заряженные ионы на определенных расстояниях друг от друга. От каждого атома может оторваться несколько свободных электронов и все эти электроны обобществляются.
Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла, и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри решетки, т. е. они уже принадлежат не одному атому, как в случае ионной связи (см. ИОННАЯ СВЯЗЬ) , и не паре соседних атомов, как в случае ковалентной связи (см. КОВАЛЕНТНАЯ СВЯЗЬ) , а всему кристаллу в целом. Не имея локализованных связей, металлические кристаллы ( в отличие от ионных) не разрушаются при изменении положения атомов, т. е. им свойственна пластичность (ковкость) при деформациях.
Металлическая связь сферически симметрична. Для металлических кристаллов характерны большие координационные числа (см. КООРДИНАЦИОННОЕ ЧИСЛО) , плотные упаковки частиц.. Благодаря наличию свободных электронов металлы обладают высокими электро- и теплопроводностью.
Энциклопедический словарь . 2009 .
Полезное
Смотреть что такое "металлическая связь" в других словарях:
Металлическая связь — Металлическая связь это одновременное существование положительно заряженных атомов и свободного электронного газа. Содержание 1 Механизм металлической связи 2 Характерные кристаллические решётки … Википедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — тип хим. связи атомов в в вах, обладающих металлич. св вами. М. с. обусловлена большой концентрацией в таких кристаллах эл нов проводимости. Отрицательно заряженный «электронный газ» удерживает положительно заряженные ионы на определённых… … Физическая энциклопедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, в химии связь, удерживающая вместе атомы МЕТАЛЛА. Внутри кристаллов металлов положительно заряженные ионы держаться посредством электростатического притяжения облака окружающих электронов, которые могут двигаться под… … Научно-технический энциклопедический словарь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — особый тип хим. связи атомов в металлах и интерметаллических соединениях, обусловленный высокой концентрацией в кристаллах электронов проводимости. Отрицательно заряженное электронное облако удерживает положительно заряженные ионы на определённых … Большая политехническая энциклопедия
металлическая связь — [metal bond] межатомная связь, характерная для металлов с равномерной плотностью электронного газа. Металлическая связь обусловлена взаимодействием отрицательно заряженного электронного газа и положительно заряженных ионных остовов,… … Энциклопедический словарь по металлургии
металлическая связь — metališkasis ryšys statusas T sritis chemija apibrėžtis Delokalizuoto cheminio ryšio tipas, esantis visuose metaluose. atitikmenys: angl. metallic bond rus. металлическая связь … Chemijos terminų aiškinamasis žodynas
металлическая связь — metališkasis ryšys statusas T sritis fizika atitikmenys: angl. metallic bond vok. metallische Bindung, f rus. металлическая связь, f pranc. liaison métallique, f … Fizikos terminų žodynas
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь, возникающая при образовании химического соединения из металлических элементов. Химический состав этих соединений из за нежесткой металлической связи непостоянен и не соответствует стехиометрическому соотношению элементов по формуле данного … Металлургический словарь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель М. с. отвечает образованию частично заполненных валентными электронами металла зон … Химическая энциклопедия
Металлическая связь — тип связи атомов в кристаллических веществах, обладающих металлическими свойствами (металлах (См. Металлы), металлидах (См. Металлиды)). М. с. обусловлена большой концентрацией в таких кристаллах квазисвободных электронов (электронов… … Большая советская энциклопедия
Ионная и металлическая связь
До появления знания об электроне, в науке главенствовала теория о валентности как о скрепляющей атомы внутри вещества силе.
Ее предвестником стала научная работа Уильяма Хиггинса, ирландского химика конца XVIII века, который описал существование неких связей между частицами веществ.
В начале прошлого века, когда появилась модель атомного ядра и выяснилось, что оно состоит из частиц трех видов: электронов, протонов и нейтронов — теория о валентности сменилась теорией о химических связях.
Феномен химических связей объясняется стремлением всего к упорядочиванию. Частицы веществ стремятся к наиболее стабильным и устойчивым формам с минимальным расходом энергии, благодаря чему появляется множество соединений.
Современная химия различает до шести видов связей, но чаще всего рассматривает только первые четыре из них:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова;
- двухэлектронная трехцентровая химическая.
От типа химической связи зависят ее свойства, а также строение химических решеток, структура и способы взаимодействия атомов и частиц.
Самой распространенной химической связью является ковалентная полярная, а остальные чаще всего являются либо крайними ее формами, либо вариациями с металлическими и нехарактерными неметаллическими химическими элементами в соединениях.
Ионная химическая связь
Ионная связь получила свое название от «иона» — частицы, вступающей в связь в соединении.
Ионная химическая связь — особый вид химической связи между частицами, основное действие которого направленно на заряженные частицы — ионы.
Ионная связь является крайней формой ковалентной полярной связи. При образовании, происходит поляризация атомов, в следствии чего образуются ионы.
Ионы — одноатомные или многоатомные частицы, имеющие ярко выраженный электрический заряд. Делятся на катионы — положительно заряженные атомы, и анионы — отрицательно заряженные.
Ионы могут иметь разный заряд и классифицируются по значению заряда на:
- однозарядную ( K + );
- двузарядную ( O 2 + );
- трехзарядную ( A l 3 + ) группы.
Частицы, вступающие в ионную связь, должны иметь большую разницу в 2 определение — электроотрицательности — способности притягивать электронные пары к себе. По Полингу для образования ионной связи необходима разница в 1,7 и более.
При таком виде химической связи происходит почти полный переход одного электрона к другому атому. Частицы с меньшей ЭО практически полностью переходят во владения частицы с большей ЭО, однако полного перехода никогда не случается.
Отчуждение электронов называется окислением, а присоединение — восстановлением.
Полного разделения на + и – заряженные частицы нет, так как частицы пересекаются своим электронными орбиталями и связываются очень прочной связью, а также имеют сильное электростатическое взаимодействие между частицами.
Ионная связь характерна для соединений металлов и неметаллов, реже для соединений неметаллов с неметаллами, присутствует в оксидах, гидроксидах, гидридах щелочных и щелочноземельных металлов, в солях, соединениях металлов с галогенами.
Ионная связь характеризуется двумя главными чертами:
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Металлическая связь
Атомы металлов имеют возможность соединяться не только с неметаллами, но и между собой. В таком случае происходит формирование металлической связи.
Металлическая химическая связь — особый вид химической связи, образующийся между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов.
В металлическую связь вступают частицы двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Металлическая связь образуется только в веществах, а не между отдельными атомами. При этом связи внутри вещества связи не перманенты и не отличаются постоянством.
Кристаллическая решетка в веществах с металлической связью образуется в виде некого каркаса, в узлах которого находятся ионы металлов, а между ними в свободной форме путешествует «электронный газ», состоящий из свободных электронов.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелоноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдричсекую решетку.
Соединения, обладающие металлической связью, представляют собой либо чистые соединения металлов, либо их сплавы, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Все металлы и их сплавы имеют сходные физические свойства:
- металлический блеск;
- теплопроводность материала;
- высокая ковкость, пластичность материала;
- хорошая электропроводность;
- твердое агрегатное состояние в нормальных условиях среды;
- высокая плотность материала.
Чем отличаются друг от друга и от ковалентной, что общего
Основные виды химической связи имеют довольно сходный принцип строения по природе происхождения. Они переплетаются между собой и имеют общие признаки. Более того, внутри одной молекулы нередко бывают сразу несколько видов химических связей.
Металлическая и ионная связь сходны между собой, а также сходны с ковалентной связью.
Металлическая и ковалентная связи сходны тем, что электроны, вступающие в связь обоих видах, становятся общими и принадлежат всем атомам либо в виде электронных пар, либо в виде электронного газа.
Ионная и ковалентная связи имеют сходство принципом строения. По сути происхождения, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию ионизированных катионов металлов.
Однако отличия между связями все же есть. Именно по ним можно определить тип химической связи в соединении.
Металлическая от ковалентной связи отличается, в первую очередь, тем, что происходит между двумя атомами металлов, а не неметаллов. Благодаря этому она имеет высокую концентрацию электронов проводимости в своих атомах. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема — объединяет большое количество атомов;
- ненаправлена — из-за сферической формы орбиталей;
- делокализирована — электроны в связи обобществляются всеми атомами соединения.
Ионная связь в отличие от ковалентной происходит между атомами металлов и неметаллов, реже между неметаллами. Она образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному ядру, а свободно движутся по кристаллической решетке.
Металлическая от ионной связи отличается:
- типом связываемых частиц — у металлической связи нет как такового аниона, вместо него катионы притягивают электронный газ;
- прочностью связи при ударе — взаимное смещение катионов не приводит к разрыву, но если в связи находятся катион и анион, то связь может быть разорвана.
Как образуется ионная и металлическая связь, примеры
Ионная связь образуется между металлом и неметаллом (иногда неметаллом и неметаллом) с разным уровнем электроотрицательности. Ионы могут быть простыми и иметь только один атом, как, например, C l - , N a + , так и сложными и иметь несколько атомов и общий уровень заряда при них, как, например, N H 4 - .
Графически образование ионной связи можно проследить на схеме образования соединения натрия и хлора:
По принципу ионной связи образуются также хлороводород HCl, оксид кальция CaO, фторид натрия NaF, бромид серебра AgBr и другие.
Металлическая связь образуется между двумя неметаллами. В связь вступают ионы металла и свободные электроны. Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи одной формулой можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Виды металлических связей и как они образуются
Все вещества во Вселенной имеют свою структуру строения, а следовательно — и свои свойства. Об особой связи частиц веществ впервые написал Уильям Хиггинс в XVIII веке. Тогда в своем научном труде ученый описал «особую соединительную силу», которая стала основой для возникновения теории о валентности, а позже — теории о химических связях.
Современная химия описывает существование нескольких типов химических связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Атомы металлов между собой объединяются в вещества с появлением новых свойств. При этом связь между атомами-металлами отличается свойствами от ковалентной и ионной связей.
Металлическая связь — особый вид химической связи, возникающий между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов. Металлическая связь встречается в простых веществах металлах и их сплавах.
Металлическая связь формируется за счет частиц двух видов:
Вещества с металлической связью чаще всего представляют собой чистые соединения и сплавы различных металлов, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Атомы металлов имеют ряд особенностей:
- небольшое количество электронов на внешнем электронном уровне;
- большие радиусы.
Благодаря данным характеристикам соединения металлов легко отдают внешние электроны, что позволяет им становиться ионами с положительным зарядом.
По природе происхождения металлическая связь близка к ковалентной, а также к ионным соединениям, но в силу ряда отличий представляет собой отдельный тип химических связей.
Сходства и отличия металлической химической связи от ионной и ковалентной
Все виды связи переплетаются между собой и имеют сходные черты. Более того, некоторые соединения могут иметь сразу несколько видов связи в одной молекуле.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию катионов металлов.
Обобществление отрицательно заряженных электронов по системе частично перекрывающихся орбиталей металлов приводит к формированию прочной химической связи, что напоминает по механизму образования ковалентную связь.
Каждый из видов связи имеет свои особенности построения решеток, взаимодействия частиц, а также характерные свойства.
Несмотря на схожесть металлической связи с ковалентной и ионной, каждая из них имеет ряд характерных черт, благодаря которым можно легко определить вид связи в соединении.
Металлическая связь в отличие от ковалентной имеет высокую концентрацию электронов проводимости в атомах металлов. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
- ненасыщаема— объединяет большое количество атомов;
- ненаправлена и делокализирована и электроны в связи обобществляются всеми атомами соединения.
В отличие от ионной связи металлическая образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному атомному ядру, а свободно движутся по кристаллической решетке.
Виды, особенности образования, как происходит, схема
Металлическая связь не может существовать между отдельными соединенными между собой атомами. Она появляется только в веществах.
При этом связи в этих веществах не отличаются постоянством. Электроны, отделившиеся от атомов металлов, превращаются в «электронный газ», благодаря чему они могут спокойно путешествовать по кристаллической решетке.
Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Характерные кристаллические решетки
Кристаллическая решетка в веществах с металлической связью является основой, неким каркасом кристалла, в узлах которой находятся ионы металла, а между ними в виде «электронного газа» перемещаются отрицательно заряженные электроны, периодически присоединяющиеся к ионам металлов, превращая их в атомы.
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелочноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдрическую решетку.
Физические свойства металлов
Почти все металлы и их сплавы имеют сходные физические свойства:
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
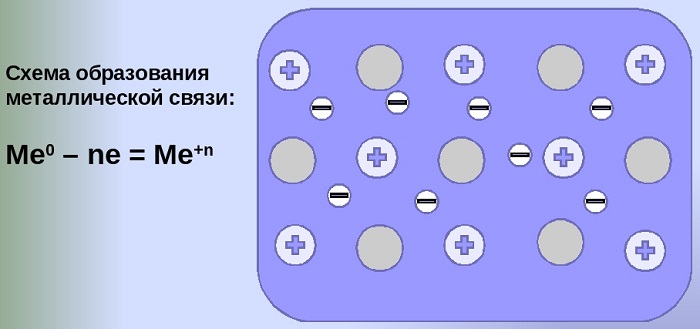
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
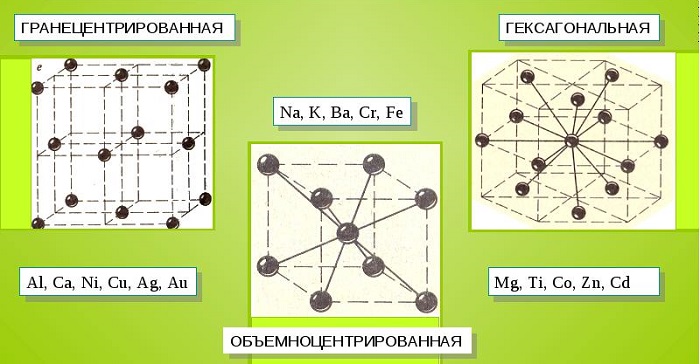
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
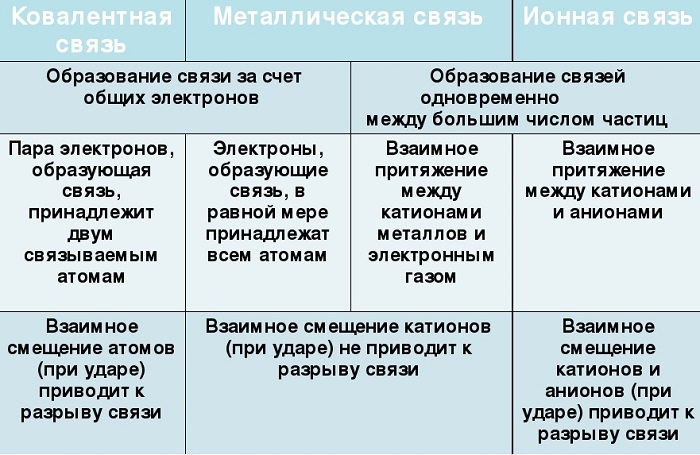
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Металлическая связь
Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа.
Содержание
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).



Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей – положительно заряженных ионов щелочного металла (рис.1). Кулоновское отталкивание одноимённо-заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра – квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной трансляционной решётке aw кристалла щелочного металла (рис.2).
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляцонной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щёлочный металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Постоянная решётка aw,Å [1] | 3,5021 | 4,2820 | 5,247 | 5,69 | 6,084 |
| Длина ковалентной связи, Me2, Å [2] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место, где пребывают электроны, обеспечивая основное свойство металла – проводить электрический ток [3] . Таким образом, электрический ток в металлах – это движение сорванных с орбитального радиуса электронов в поле положительно заряженных ионов, находящихся в узлах кристаллической решётки металла. Выход и вход свободных электронов в связывающее звено кристалла осуществляется через точки «0», равноудалённые от положительных ионов атомов (рис.2).
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом – свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебания ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла. В настоящее время важнейшим признаком металлов считается отрицательный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры. С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости. В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия.»
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары – коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ – Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике “За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Читайте также:
