Какие особенности строения атомов присущи металлам побочных подгрупп
Обновлено: 20.05.2024
1. Особенности d-элементов по сравнению с элементами главных подгрупп.
2. Элементы подгруппы марганца.
3. Элементы подгруппы хрома.
4. Макро- и микроэлементы в земледелии.
15.1 Особенности d-элементов по сравнению с элементами главных подгрупп.
Всего известно 35 d-элементов, из них 30 есть в земной коре, а 5 искусственные и радиоактивные. Все эти элементы называют переходными металлами
d-элементы расположены в периодической системе в больших периодах между s- и p-элементами. Характерной особенностью переходных элементов является то, что в их атомах заполняются орбитали не внешнего слоя, а предвнешнего слоя. У d-элементов валентными являются энергетически близкие девять орбиталей – одна ns-орбиталь, три np-орбитали и пять (n-1) d-орбиталей.
Во внешнем слое у атомов d-элементов находятся 1 – 2 электрона. Остальные валентные электроны расположены в (n-1) d-состоянии, т. е. в предвнешнем слое.
Подобное строение электронных оболочек атомов определяет ряд общих свойств d-элементов:
1. все d-элементы – металлы, отличающиеся от s-металлов меньшей восстановительной способностью и иногда химической инертностью;
2. для большинства d-элементов характерно проявление нескольких степеней окисления, сравнимых по термодинамической устойчивости в обычных условиях. Это значит, что для них характерно большое число окислительно-восстановительных реакций;
3. многие d-элементы в высших степенях окисления проявляют кислотные свойства, в промежуточных амфотерные, а в низших основные;
4. d-элементы способны образовывать разнообразные комплексные соединения;
5. в отличие от соединений s-металлов большинство соединения d-элементов имеют характерные окраски.
15.2 Элементы подгруппы марганца.
В состав этой подгруппы входят марганец Mn, технеций Tc и рений Re.
Валентные орбитали ns 2 (n-1)d 5
Оксид и гидроксид марганца(II) - MnO (серо-зеленые кристаллы) и Mn(OH)2 (осадок телесного цвета) обладают основными свойствами. Оксид марганца (III) Mn2O3 (бурые кристаллы) тоже основной. Ему соответствует гидроксид Mn(OH)3 (черно-коричневого цвета).
Оксид и гидроксид марганца(IV) – MnO2 (черные кристаллы) и Mn(OH)4 – амфотерны, со слабо выраженными основными и кислотными свойствами.
Оксид марганца (VI) MnO3 и, соответствующая ему марганцовистая кислота H2MnO4, в свободном состоянии не получены. Соли этой кислоты (манганаты) в водных раствора окрашены в зеленый цвет.
Mn2O7 (зеленовато-бурая маслянистая жидкость) и HMnO4 (известна только в водных растворах и относится к сильным кислотам) это кислотные соединения. Ангидрид, кислота и ее соли пермаганаты - сильные окислители. Соединения марганца(IV) проявляют окислительно-восстановительную двойственность, а соединения марганца(II) – восстановители.
Элементы подгуппы марганца образуют комплексные соединения: K2[Mn(OH)6], Na2[ReF8], [Mn2(CO)10].
Марганец входит в состав многих металлоферментов растений и животных, без которых не может работать цикл Кребса. Это один из важнейших биохимических циклов любой живой клетки, вырабатывающий энергию и запасащий её в аденозинтрифосфате (АТФ). В качестве марганцевого микроудобрения используют MnSO4 ×H2O.
15.3 Элементы подгруппы хрома.
Шестую побочную подгруппу образуют металлы: хром Cr, молибден Mo, вольфрам W. Валентные орбитали ns 1 (n-1)d 5 .
Степени окисления у хрома +2, +3, +6, 0.
В степени окисления +2 хром образует CrO и Cr(OH)2 основного характера, крайне неустойчивые соединения – сильные восстановители. Самая устойчивая степень окисления для хрома +3. Оксид хрома Cr2O3 и гидроксид Cr(OH)3 – амфотерны. Эти соединения под действием сильных окислителей проявляют восстановительные свойства.
Соединения хрома(VI) – CrO3 и его гидратные формы H2Cr2O7 – дихромовая кислота и H2CrO4 - хромовая кислота проявляют кислотные свойства. Обе кислоты существуют в водном растворе и, при попытке выделить их из раствора, распадаются на хромовый ангидрид и воду. Устойчивы их соли – дихроматы и хроматы. Хроматы устойчивы в щелочной, а дихроматы в кислой среде.
Соединения хрома(VI) являются сильными окислителями.
Для молибдена и вольфрама наиболее характерна степень окисления +6, поэтому их соединения устойчивы, проявляют кислотные свойства (менее выраженные по сравнению с соединениями хрома) и не проявляют окислительных свойств.
Для хрома, молибдена и вольфрама характерно образование комплексных соединений: K3[Сr(OH)6], [Cr(H2O)6]Cl3, H2[WF8], K2[MoCl8] и т.д.
Как микроэлемент хром изучен недостаточно, но его биогенная роль не вызывает сомнений. Он входит в состав некоторых ферментов, осуществляющих окислительно-восстановительные реакции в клетках. Хром входит в состав пепсина, расщепляющего белки в пищеварительном тракте животных, участвуют в регуляции усвоения глюкозы тканями животных.
15.4 Макро- и микроэлементы в земледелии.
Макроэлементы это биогенные элементы, необходимые для нормального функционирования клетки. К ним относятся O, H, N, C. Фосфор и калий не входят в их число, но играют очень важную роль в нормальной жизнедеятельности растительных и животных организмов. Азотные, калийные и фосфорные удобрения необходимо вносить в почву центнерами на гектар, так как азот, фосфор и калий это не восполняемые элементы и то количество, которое есть в природе, не может удовлетворить потребности сельского хозяйства. Кислород, водород, углерод, азот, фосфор и калий получили названия макроэлементов, поскольку они в больших количествах входят в состав живых организмов, а удобрения, в которые они входят, получили названия макроудобрений.
Металлы, которые необходимы для всех живых организмов и содержание которых не превышает 10 -5 %, называют микроэлементами. К микроэлементам относят Mn, Co, Ni, Zn, Mo и в меньшей мере V и Cr. К микроэлементам относится бор.
Металлы-микроэлементы должны обладать определенными свойствами: они должны быть достаточно распространенными и достаточно рассеянными, т.е. быть доступными для усвоения из почв; они должны обладать изменчивостью химических свойств т.е. образовывать комплексы с различными лигандами, иметь различные степени окисления и легко переходить из одной степени окисления в другую. Этими свойствами в полной мере обладают d-элементы. Эти свойства позволяют микроэлементам активизировать ферменты. Микроэлементы подходят к ферментам как ключ к замку. Они комплементарныферментам.
Микроэлементы входят в состав микроудобрений (соли d-элементов), которые вносят в почву килограммами на гектар. Например: кобальт вносят в почву в виде соли CoSO4 ×7H2O и CoCl2 ×6H2O; медь в виде CuSO4 ×5H2O; цинк в виде ZnSO4 ×7H2O; молибден в виде раствора молибдата аммония (NH4)2MoO4.
Роль кобальта: образует каталитически активные центры многих ферментов, необходимые для синтеза ДНК и метаболизма аминокислот.
Роль никеля: стимулирует синтез аминокислот в клетке, ускоряет регенерацию белков плазмы крови, нормализует содержание гемоглобина у больных.
Роль меди: медь входит в состав голубых белков, которые являются переносчиками и хранителями запасов молекулярного кислорода. В растительных организмах усиливает фотосинтез и углеводный обмен.
Роль цинка: известно более ста цинксодержащих ферментов, без которых не возможен гидролиз белков, полисахаридов, липидов, эфиров фосфорной кислоты, АТФ и других биологически важных органических веществ любой клетки.
Молибден – один из важнейших микроэлементов. Он входит во многие ферменты, осуществляющие окислительно-восстановительные превращения в клетке. При недостатке молибдена в почве растения не плодоносят и погибают в результате разнообразных заболеваний.
Лекция 16. Предмет аналитической химии. Качественный и количественный анализ. Аналитический сигнал. Химические, физические и физико-химические методы анализа(самостоятельно)
1. Предмет аналитической химии. Качественный и количественный анализ.
2. Аналитический сигнал. Методы анализа в аналитической химии (химические, физические и физико-химические).
Положение в ПСХЭ. Электронное строение атомов
Находясь только в больших периодах (IV, V, VI), d-элементы образуют «вставные декады» (по 10 элементов) между s- и р- элементами, поэтому имеют общее название - переходные элементы.
Кроме этих 30 d-элементов, имеющих стабильные изотопы, искусственно синтезированы несколько радиоактивных d- элементов, занимающих свои места внезавершенном VII периоде.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока е-) электрона на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах d -элементов.

Сравнение d -металлов с щел. Me и щел.-зем. Me
В каждом большом периоде d-элементы располагаются после двух s-элементов, которые являются щелочным и щелочноземельным металлами:
Радиусы атомов уменьшаются
Заряды ядер атомов увеличиваются
Поэтому d-металлы являются менее активными, чем щелочные и щелочноземельные металлы.
Возможные валентности и степени окисления
Вотличие от щелочных и щелочноземельных Me, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементовявляются не только s-электроны внешнего слоя, но и все или некоторые d -электроны предвнешнего слоя.
Положение в ПСЭ. Электронное строение атомов
Для d-металлов III - VII групп высшая Ви высшая С.О. равны номеру группы, т. е. суммарному числу е - на (n -1)d и ns-подуровнях; например у d -элементов четвертого периода:
Высшая степень окисления
Для d-металлов VIII группы высшая В и высшая с о., как правило, меньше суммарного числа е - на (n - 1)d и ns -подуровнях;
d-Металлы II группы, атомы которых имеют завершенную структуру d-подуровня (n -1)d10, проявляют в своих соединениях постоянную В = II и постоянную с.о. = +2.
Наиболее характерными валентностями и степенями окисления для d-металлов I группы являются: Сu - II и +2; Ag - I и +1; Au - III и +3.
Способность к комплексообразованию
Важной особенностью атомов d-металлов является наличие свободных орбиталей (на (n - 1)d -, ns - образованию и nр-подуровнях), что позволяет им образовывать донорно-акцепторные (координационные) связи с различными донорами неподеленных электронных пар (молекулы NH3, Н2O, ионы ОН - , CN - и др.).
Вследствие этого d-металлы образуют многочисленные и разнообразные комплексные соединения; например:
В свободном состоянии d -металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d - металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода (Fe, Cr , Zn , Mn и др.); малоактивные металлы (Сu, Нg и др.) и благородные металлы (Au , Pt и др.), располагающиеся в ряду напряжений после водорода.
Окислительно-восстановительные свойства d-металлов и их соединений
Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с невысокими степенями окисления являются восстановителями, а соединения с высокими степенями окисления - окислителями;
Кислотно-основные свойства оксидов и гидроксидов d-металлов
При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается:
Положение металов в переодической таблице особенности строения атомов металов? Физические св-ва?
Большинство эл-тов табл. Менделеева - металлы.
Металлические свойства усиливаются сверху вниз и справа налево.
Самый активный металл - франций.
На внешнем уровне обычно 1-2 электрона, которые атомы металлов могут отдавать. Чем легче их отдать - тем активнее металл.
Металлы главной подгруппы 1 группы - щелочные. Литий, натрий, калий, цезий, рубидий, франций. Очень активны.
Кальций, стронций, барий, радий - щелочноземельные.
Физ. св=ва: металл. блеск, ковкость, тепло- и электропроводность
ПОЛОЖЕНИЕ МЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ
Если в периодической таблице элементов Д. И. Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп) , а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.) , обладают двойственным характером.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора) , IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго) .
ОСОБЕННОСТИ СТРОЕНИЯ АТОМОВ МЕТАЛЛОВ
Кристаллические решетки металлического типа содержат в узлах положительно заряженные ионы и нейтральные атомы; между ними передвигаются относительно свободные электроны.
ФИЗИЧЕСКИЕ СВОЙСТВА
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
1) Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду ––Au,Ag,Cu,Sn,Pb,Zn,Fe® уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность.
Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду ––Ag,Cu,Al,Fe® уменьшается.
При нагревании электропроводность уменьшается, т. к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло) ; самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т. пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Построение структурно-электронной формулы элементов B-подгрупп
Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
Количество электронов на внешнем уровне
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds
Все остальные элементы B-подгрупп, кроме палладия.
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
3s 2 3p 6 3d 5 4s 1
3s 2 3p 6 3d 6 4s 2
3s 2 3p 6 3d 5 4s 2
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s 2 3p 6 4s 2 3d 5 . s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns 2 (n-1) d 10
Решение задания:
Для начала разберемся со страшной формулой ns 2 (n-1) d 10 . Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s 2 (4-1)d 10 или 4s 2 3d 10 . Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d 10 4s 2 . Получившаяся формула приблизительна, вместо нее может быть 4d 10 5s 2 или 5d 10 6s 2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s 2 5p 3 , что соответствует структурно-электронной формуле:
Элемент имеет три неспаренных p-электрона.
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
Особенности строения атомов металлов побочных подгрупп



Последний Элементы вторичной подгруппы 4-го цикла-электроны Zn по уровню энергии распределяются следующим образом: + 3озн 2, 8, 18, 2 Среди металлов подгруппы Cr является наиболее важным. Местоположение хрома в периодической системе и строение его атомов. Хром лидирует в боковой подгруппе группы VI. энергетические уровни атомов хрома и расположение электронов по орбиталям являются: + 2 * Cg2ë,8ё,13ё,1ëIs2 2s22рб3s2Зр6__3d5bs1 24Cg(W [Y1ShSCH ISHShBZHSh
Согласно закону, регулирующему заполнение энергетического уровня и подуровня (орбитали), атому хрома на 4-м энергетическом уровне (подуровне s) требуется 2 электрона. Однако 2 из 1 электрона перемещаются на 3-й энергетический уровень по незаполненной D-орбите. Это явление наблюдается в атомах многих элементов и называется»провалом»электронов.
Атомы хрома имеют 6 неспаренных электронов (см. Рисунок).Это объясняет, что хром может показать степень окисления от+1 до+6. Наиболее важными являются соединения хрома со степенями окисления+ 2,+ 3 и+ 6. Ответьте на вопросы 1 и 2 (стр. 121). Быть внутри nature. In в нашей стране наиболее распространенной хромовой рудой является хромовая железная руда, или железная хромовая железная руда FeO * Cr203.
Оксид хрома (III) Cr203 и некоторые другие соединения хрома также присутствуют в природе. Мы получили ваши отзывы. Когда хромовая железная руда сильно нагревается углем, хром и железо уменьшаются. «2 +3 ’0 0 0 +2 FeO * Cr203 + 4C 4«2Cg + Fe + 4C В результате этой реакции образуется сплав хрома и железа-феррохром. formed.
- To получают чистый хром, его восстанавливают из оксида алюминия. О Компании Tz / + Cr2Os + равен 2ai-я А1203 + 2Cg Физические характеристики. Хром-это серовато-белый металл, блестящий на вид, похожий на железо. Его плотность составляет 7,19 г / см3, а температура плавления-1890°С. Отличительной особенностью хрома является его высокая твердость(с. 87).
Это объясняется тем, что в металлической сетке имеется 1, 6 относительно свободных электронов на электрон, которые относительно малы по отношению к ионам хрома. Металлический хром может «резать» стекло. Химическое свойство. Поверхность хрома покрыта очень тонким (и поэтому прозрачным) оксидом film.
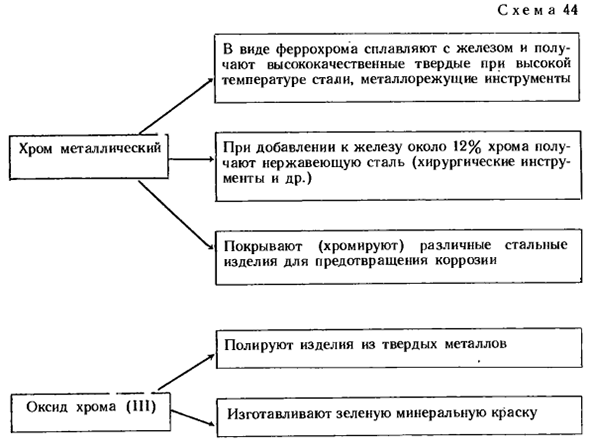
Благодаря этой пленке хром является одним из самых коррозионно-стойких металлов. Даже при высокой влажности она не меняется совсем. Соляная и серная кислоты, разбавленные хромом, начинают реагировать через некоторое время (после разрушения пленки). Cr + H2S04 -» — CrS04 + * H, f Азотная кислота пассивирует хром(иммобилизирует оксидную пленку). Применение хрома показано на схеме 44. Вопросы 3 и 4 (стр. 122), задача 1(стр. 122).
Образовательный сайт для студентов и школьников
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Читайте также:
