Какой металл может болеть чумой
Обновлено: 08.07.2024
- систематизировать знания учащихся по теме "Металлы";
- продолжить работу по развитию познавательной активности учеников;
- вырабатывать умения и навыки наблюдать, делать выводы, объяснять ход эксперимента.
Подготовка к уроку: класс делится на три команды. В каждой команде выбирается "вратарь" (ученик с глубокими знаниями), "защитники" (ученики с глубокими и средними знаниями), а также "нападающие" (ученики со слабыми знаниями).
С первого урока изучения темы " Металлы" школьники готовятся к семинару. " Вратари" готовят свои команды. Учитель работает с " вратарями". Подготовка идет по вопросам, которые учитель вывешивает в классе.
Правила игры: матч состоит из разминки, теоретического тайма, личного зачета - тестирования, тайма загадок, практического тайма, расчетного тайма. Учитель задает вопросы, учащиеся отвечают на них. На заданный вопрос первыми в команде отвечают "нападающие" и получают за правильный ответ 4 балла. Если "нападающие" не смогут ответить на данный вопрос, он передается "защитникам" (за ответ -3 балла), а если и они не ответили, то на вопрос отвечает уже "вратарь", но получает за ответ 2 балла.
За дополнения команда может получить 1 балл. Если на вопрос никто в команде не ответил, ей засчитывается гол. Каждая команда сидит отдельно, за своим столом.
Для проведения урока - соревнования представляется жюри из старшеклассников.
Ход урока
1. Организационный момент
2. "Разминка"
"Разминка" проводится в виде викторины одновременно со всеми командами. В "разминке" за правильный ответ любой игрок получает 1 балл, за дополнение - 0,5 балла. Кто быстрее поднимет руку, тот и получает право ответа.
- Если бы существовал приз за активность, то атомам какого металла его присудили бы?
- Какой из металлов в глубокой древности называли "небесной медью" и почему?
- Почему во время похода Александра Македонского в Индию офицеры его армии реже болели желудочно - кишечными заболеваниями, чем солдаты?
- На какой особенности ртути был основан древний способ золочения?
- Что означает выражение: "Металл, принесенный в жертву рыжему дьяволу"?
- Какой из металлов может " болеть чумой"? Что вам известно об этом?
- Гуси спасли Рим, а погубил Рим по мнению токсикологов, металл. Какой это металл? Что вы об этом знаете?
- Однажды к римскому императору Тиберию пришел незнакомец, принеся ему в дар изготовленную им из блестящего , как серебро, легкого металла, полученного из глинистой земли. Должно быть, чувство благодарности редко обременяло императора, да и правителем он был недальновидным. Боясь, что новый металл с его прекрасными свойствами обесценит хранившееся в казне золото и серебро, он отрубил изобретателю голову, а его мастерскую разрушил, чтобы никому было неповадно производством "опасного" металла. Из какого металла была изготовлена чаша?
- В начале века из Нью-Йоркского порта вышла в открытый океан красавица - яхта. Ее владелец, американский миллионер, не пожалел денег, чтобы увидеть свет. Корпус яхты был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклепками. Это было красиво - сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако через несколько дней обшивка корпуса начала расходиться и яхта быстро пошла ко дну. Почему?
- Алхимики утверждали:
"Семь металлов создал свет
По числу семи планет:"
Назовите эту "великолепную семерку".
Ответы на вопросы.1.Цезий. 2.Железо. 3. Посуда офицеров была изготовлена из серебра. 4. Ртуть обладает способностью растворять металлы, в том числе и золото. 5. Железо и сталь превращаются в ржавчину в процессе коррозии. 6. Олово "болеет" "оловянной чумой". 7. Свинец. 8. Алюминий. 9. Произошла химическая коррозия.10. Солнце - золото, Луна - серебро, Марс - железо, Меркурий - ртуть, Юпитер - олово, Венера - медь, Сатурн - свинец.
Теоретический тайм
1. Как металлы расположены в периодической системе химических элементов Д.И. Менделеева?
2. В чем состоит сходство атомов металлов? В чем различие атомов металлов? (Общие черты и различия покажите на примере металлов I группы главной подгруппы периодической системы химических элементов Д.И. Менделеева).
3. Какой тип связи характерен для металлов?
4. Что вы знаете о кристаллических решетках металлов?
5. На основании знаний о кристаллическом строении металлов объясните, почему металлы:
а) проводят электрический ток;
б) хорошо проводят теплоту;
в) обладают пластичностью;
г) обладают металлическим блеском?
6. Какие виды сплавов вам известны? Почему сплавы существенно отличаются свойствами от составляющих их металлов?
7. Какие общие химические свойства характерны для металлов?
8. Что показывает электрохимический ряд напряжений металлов? Почему в этот ряд включен водород?
9. Какой из металлов - медь, цинк или ртуть - может вытеснить свинец из раствора его соли?
10. В каком виде металлы находятся в природе?
11. Даны пары соприкасающихся металлов: медь и железо, цинк и медь, железо и цинк, опущенные в раствор соляной кислоты. Какой из металлов в каждой паре будет разрушаться? Напишите уравнения реакций,
12. Какие реакции являются качественными на ионы железа Fе2+ и Fе3+?
Личный зачет - тестирование
Выполняет каждый участник команды
Тест проверяет и оценивает жюри.
Баллы, набранные участниками команды суммируются и засчитываются команде
1 вариант
1. Тип связи в металлах:
1. ионная 2. ковалетная 3. металлическая 4.водородная
2. Выбрать щелочной металл:
1.калий 2.кальций 3.железо 4.алюминий
3. Выбрать самый легкий металл:
4. Выбрать жидкий металл:
5. Выбрать правильное утверждение:
1.металлы - восстановители
2.металлы - окислители
3.металлы окислители и восстановители
2 вариант
1.Кристаллическая решетка металлов:
1.атомная 2.ионная 3.молекулярная 4.металлическая
2.Выбрать щелочноземельный металл:
1.магний 2.алюминий 3.кальций 4.железо
3.Выбрать самый тяжелый металл:
4.Выбрать самый пластичный металл:
5.Частицы в узлах кристаллической решетки металлов:
1.атомы 2.катионы 3.атомы и катионы
3 вариант
1. Частицы в узлах кристаллической решетки металлов:
1.алюминий 2.кальций 3.натрий 4.магний
3. Выбрать наиболее электропроводный металл:
1.магний 2.алюминий 3.золото 4.железо
4. Выбрать самый твердый металл:
1.вольфрам 2.железо 3.алюминий 4.магний
1.металлы имеют сравнительно большой радиус
2.металлы имеют сравнительно маленький радиус
Ответы:
1 - 3,2 - 1,3 - 3,4 - 3,5 - 1
1 - 4,2 - 3,3 - 1,4 - 4,5 - 3
1 - 3,2 -3,3 - 3,4 - 1,5 - 1.
Загадки
Среди металлов самый славный
Важнейший древний элемент,
В тяжелой индустрии главный,
Знаком с ним школьник и студент.
Родился в огненной стихии,
А сплав его течет рекой
Важнее нет в металлургии,
Он нужен всей стране родной. (Железо.)
Прославлен всеми письменами
Металл, испытанный огнем.
Манил к себе людей веками.
Алхимик жил мечтой о нем.
Но как кумир отвергнут нами,
И блеск его нас не манит,
Ведь хорошо мы знаем с вами:
Не все что ценно, что блестит. (Золото.)
Если его соединенья
В воде бывают иногда,
Не вызывает то сомненья,
Что это жесткая вода.
В Финляндии и на Урале
Цветные карбонаты есть
И белоснежные в кристалле,
Таким в дворцах почет и честь. (Кальций.)
Давно известно человеку:
Она тягуча и красна,
Еще по бронзовому веку
Знакома в сплавах всем она.
С горячей серной кислотой
Дает нам синий купорос,
Но может побелеть порой,
Когда? Ответьте на вопрос. (Медь.)
Находится в морской воде.
Он - спутник кальция везде.
Свободный, легкий и горючий.
Фотографам известен он.
Не очень твердый и тягучий,
Он - главный в сплаве электрон. (Магний)
Живет в обычном керосине
И бегает он по воде,
В природе, в комнате - отныне
Свободным нет его нигде.
В солях открыть его возможно:
Желтеет пламя от него.
И получить из соли можно,
Как Дэви получил его. (Натрий.)
Типичен в сплавах как металл,
А соль его - цветной кристалл,
Который цвет легко меняет,
Ожоги, раны заживляет. (Марганец)
Прошу назвать этот металл,
Который в ряд важнейших стал.
Он удивленье в человеке
Своими свойствами рождал.
Из глины был получен в прошлом веке,
Девиль же серебром его назвал. (Алюминий)
Практический тайм.
Каждой команде дается задание.
- Опыт 1. Взаимодействие натрия с водой
- Опыт 2. Взаимодействие цинка с серной кислотой
Расчетный тайм.
Каждая команда получает текст задачи, которую решает на время.
4 балла получает та команда, которая первой правильно решит задачу, следующая - 3 балла и последняя - 2 балла
Задача.
Какой объем водорода может быть получен при растворении в воде 5 г металлического натрия, содержащего 5% примеси?
Подведение итогов урока.
Проводится путем подсчета баллов, заработанных командой. Это делает жюри и объявляет победителей.
«Оловянная чума» прошлого, от которой пострадало немало людей

Принято считать, что олово было известно человечеству еще в первом тысячелетии до нашей эры. О его удивительных свойствах во все времена слагались легенды, объяснить которые ученые смогли лишь в XX веке, когда стали использовать для изучения свойств металлов рентгеновский анализ. Издревле люди замечали, что изделия из олова, например посуда, на холоде вдруг начинали «заболевать»: покрывались пятнами, а потом и «язвами», которые, разрастаясь, превращали вещь в серый порошок. Если «простудившийся» оловянный предмет прислоняли к «здоровому», тот тоже начинал «болеть». Вот так родилось понятие под названием «оловянная чума», от которой порою страдали не только сами вещи, но и люди.
Много позже ученые выяснили, что при температуре ниже 13 градусов по Цельсию олово из пластичного металла белого цвета постепенно превращается в «грязный» порошок. Новая его модификация, о чем исследователям «рассказал» рентгеновский анализ, имеет кристаллическую решетку, в которой атомы связаны менее плотно. Чем ниже температура воздуха, тем «оловянная чума» протекает интенсивнее и быстрее, достигая максимальной скорости при 33 градусах мороза.

Считается, что «оловянная чума» немало поспособствовала гибели британской экспедиции «Терра Нова» под руководством Роберта Скотта, организованной в 1911-1912 годах к Южному полюсу. Продвигаясь по антарктическим льдам к своей цели, полярники оставляли склады с запасами продовольствия и керосина. На обратном пути команда обнаружила, что емкости с горючим пусты, поскольку они были запаяны оловом, а его поразило загадочное разрушение. Без керосина же измученные члены экспедиции не могли согреться и приготовить себе горячую пищу…
Еще более впечатляет легенда о том, что и армия Наполеона Бонапарта потерпела в России полное поражение, оттого что на мундирах солдат и офицеров были оловянные пуговицы. Конечно, данное обстоятельство не могло сыграть решающую роль в трагедии французов, но ощутимо увеличило страдания и потери наполеоновской армии во время отступления при сильных российских морозах. Эту легенду очень любят рассказывать в университетах преподаватели химии, хотя у нее, как считают историки, есть немало слабых мест. Например, неоспоримым является факт, что к тому времени «оловянная чума» была хорошо известна в северных странах Европы и не учесть этого великий стратег Наполеон просто не мог. Но, с другой стороны, он многого не предвидел, а иначе просто не пошел бы на Россию. Так что, как говорится, дыма без огня не бывает.

Многочисленные легенды о «коварстве» металла подтверждают задокументированные случаи. Так, в конце XIX века из Голландии в Москву отправилось несколько вагонов с оловянными слитками. Но по прибытии в Россию вместо брусков белого металла в вагонах оказался лишь серый, ни на что не годный порошок. Или еще такой факт: в начале XX столетия вокруг военных складов Санкт-Петербурга разгорелся настоящий скандал, когда в ходе ревизии выяснилось, что на всех формах и мундирах нет пуговиц. Складских работников даже хотели отдать под суд, но экспертиза странного серого порошка на одежде подтвердила, что это и есть олово, из которого были изготовлены пуговицы, – опять поработала «оловянная чума».
В конце концов человечество справилось с этим «недугом» металла. Попробуйте сегодня найти изделие из чистого олова – у вас ничего не получится. И даже оловянный припой содержит примеси других металлов, которые легко предотвращают эту удивительную метаморфозу, свойственную только олову. Самым стойким сплавом считается пьютер, который состоит из 93 процентов олова, 2 процентов меди и 5 – сурьмы. Из пьютера изготавливают предметы быта, посуду, украшения и так далее. И даже знаменитые оскаровские статуэтки и «Кубок Америки» отлиты из пьютера и только потом покрыты серебром и золотом. Вот так была побеждена предательская «оловянная чума»»…
И не слова о причинах, ради этого только читал и такой облом.
Самое главное забыли написать:
Простое вещество олово полиморфно. В обычных условиях оно существует в виде β-модификации (белое олово), устойчивой выше +13,2 °C. Белое олово — серебристо-белый, мягкий, пластичный металл, образующий кристаллы тетрагональной сингонии, пространственная группа I4/amd, параметры ячейки a = 0,58197 нм, c = 0,3175 нм, Z = 4. Координационное окружение каждого атома олова в нём — октаэдр. Плотность β-Sn равна 7,228 г/см3. При сгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов[8].
При охлаждении белое олово переходит в α-модификацию (серое олово). Серое олово образует кристаллы кубической сингонии, пространственная группа Fd3m, параметры ячейки a = 0,646 нм, Z = 8 со структурой типа алмаза. В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β-Sn в α-Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α-Sn составляет 5,75 г/см3), что приводит к рассыпанию олова в порошок. Энтальпия перехода α → β ΔH = 2,08 кДж/моль. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Тем не менее белое олово можно переохладить до гелиевых температур. Белое олово превращается в серое также под действием ионизирующего излучения[9].
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β-Sn — металл, а α-Sn относится к числу полупроводников. Ниже 3,72 К α-Sn переходит в сверхпроводящее состояние. Атомы в кристаллической решётке белого олова находятся в электронном s2p2-состоянии. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием. Белое олово слабо парамагнитно, атомная магнитная восприимчивость χ = +4,5·10−6 (при 303 К), при температуре плавления становится диамагнитным, χ = −5,1·10−6. Серое олово диамагнитно, χ = −3,7·10−5 (при 293 К).
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Оловянная чума
полиморфное превращение т. н. белого олова в серое (β → α), при котором металл рассыпается в серый порошок. Причина разрушения состоит в резком увеличении удельного объёма металла (плотность (β-Sn больше, чем α-Sn). Переход облегчается при контакте олова с частицами α-Sn и распространяется подобно «болезни». Наибольшую скорость распространения О. ч. имеет при температуре —33 °С; свинец и многие др. примеси её задерживают. В результате разрушения «чумой» паянных оловом сосудов с жидким топливом в 1912 погибла экспедиция Р. Скотта к Южному полюсу.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Смотреть что такое "Оловянная чума" в других словарях:
«ОЛОВЯННАЯ ЧУМА» — явление разрушения изделий, изготовленных из (см.), вызываемое аллотропным превращением белого олова в серое при температуре ниже +13,2°С. Процесс ускоряется с понижением температуры и достигает максимума при 33 °С, когда оловянное изделие… … Большая политехническая энциклопедия
Оловянная чума — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
Оловянная чума — Tin pest Оловянная чума. Полиморфное превращение олова, при котором образуется порошок, известный как серое олово. Максимальная скорость превращения при приблизительно минус 40 °С, но превращение может идти и при приблизительно минус 13 °С.… … Словарь металлургических терминов
оловянная чума — alavo maras statusas T sritis chemija apibrėžtis Greitas baltojo alavo virtimas labai trapiu pilkuoju Sn. atitikmenys: angl. tin disease; tin plague rus. оловянная чума … Chemijos terminų aiškinamasis žodynas
ОЛОВЯННАЯ ЧУМА — разрушение оловянных предметов, обусловленное аллотропич. превращением белого олова (бета модификация) в серое (а). Уд. объём олова при этом переходе резко увеличивается (примерно на 25% ), вследствие чего изделия рассыпаются в порошок.… … Большой энциклопедический политехнический словарь
Оловянная чума — (жарг) разупрочнение оловянных предметов из за аллотропии,превращений белого олова в серое. Объем при этом увеличивается на 25% и изделие рассыпается в порошок. Превращение начинается при 13,2°С и достигает максимума, при 33°С. Переходу в α… … Энциклопедический словарь по металлургии
«ОЛОВЯННАЯ ЧУМА» — (жаргон ) разупрочнение оловянных предметов из за аллотропических превращений белого олова в серое (из β в α модификацию). Объем при этом увеличивается на 25%, и изделие рассыпается в порошок. Превращение начинается при 13,2°С и… … Металлургический словарь
Олово — 50 Индий ← Олово → Сурьма … Википедия
Sn — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
Химические элементы на защите Родины
Ведущий: День победы – наш великий, всенародный праздник. Дорогой ценой досталось нашему народу Победа. Это были годы лишений, горя, тяжелого труда. Разорены города и села, выжжены нивы, оборваны мечты и надежды людей. Вместе с тем, это были годы мужества, беззаветной любви к Родине.
Звучит песня «День Победы»
День Победы как он был от нас далек
Как в огне потухший таял уголёк
Были версты, обгоревшие, в пыли
Этот день мы приближали, как могли…
Ведущий: И действительно, этот день приближали все как могли.
Вместе со всеми трудящимися нашей страны советские ученые принимали
Самое активное участие в обеспечении победы над фашисткой Германией в годы Великой Отечественной войны. Геологи, ученый химики должны были создавать новые способы производства самых разных материалов, чаще всего на основе еще не освоенных, нетрадиционных сырьевых источников. Безотлагательно требовались взрывчатые вещества большой взрывной силы, топливо для реактивных снарядов «катюш», высокооктановые бензины, каучук, легирующие материалы для изготовления броневой стали легкие сплавы для авиационной техники, лекарственные препараты для госпиталей… не менее важным, чем в довоенный период, оказались задачи производства строительных материалов, волокон, удобрений, красителей, кислот и щелочей.
Решать все эти задачи было крайне трудно.
Во-первых, весьма значительными были потери источников сырья и мощностей по производству химической продукции на оккупированных фашистскими войсками территориях.
Так, например, в начале войны были потеряны 50% мощностей по производству синтетического каучука, 88% - кальцинированной соды, 77% - серной кислоты, 66% синтетических красителей. Оккупированными оказались Донбасс, И Криворожский железорудный бассейн с их шахтами и заводами, производящими металлургическую коксохимическую продукцию.
Во-вторых, в связи с приближением военных действий к Москве и Ленинграду все ведущие научные учреждения, в том числе и химические, были эвакуированы на восток страны, где для исследовательской работы не было необходимых условий.
Однако, несмотря на все эти трудности. Химики, ученые и работники промышленности, справились со стоящими перед ними задачами и внесли свой достойный вклад в победу над гитлеровской Германией.
Успехи в решение задач, вставших перед химиками во время Великой Отечественной войны, были во многом обусловлены также и тем высоким уровнем развития химических знаний в нашей стране, достижение которого связано с именами Д.И. Менделеева и А.М. Бутлерова и который постоянно поддерживался их учениками и последователями – крупнейшими советскими химиками.
Сегодня учащиеся расскажут о деятельности некоторых ученых – химиков в годы войны. Открываем 1 страницу журнала.
«Химические элементы таблицы Д.И.Менделеева на защите Родины»
Выступление учащихся по элементам.
Литий № 3. В годы Великой Отечественной войны гидрид лития стал стратегическим. Он бурно реагирует с водой, при этом выделяется большой объем водорода, которым заполняют аэростаты и спасательное снаряжение при авариях самолетов и судов в открытом море. Добавка гидроксида лития в щелочные аккумуляторы увеличивала срок их службы в 2-3 раза, что очень нужно было для партизанских отрядов. Трассирующие пули с добавкой лития при полете оставляли сине-зеленый след. Соединения лития используются на подводных лодках для очистки воздуха.
Бериллий № 4. Бериллиевая бронза (сплав и 1% Ве) используется в самолетостроении. А сплав Be, Mg, AI, Ti, необходим для создании ракет и скорострельных авиационных пулеметов, впервые примененных в Великой Отечественной войне.
Углерод № 6. Углерод называют миллионером, так как уже известно около 5 мил., его соединений: все виды топлива, горючие и смазочные взрывчатые вещества, лаки, краски, мыла, лекарственные препараты, строительные материалы, одежда, обувь, жилье, продукты питания, спирты, каучук, резина, парашютный шелк, пороховые мешочки для снарядов и др.
Углерод – восстановитель при выплавке чугуна, стали цветных металлов, адсорбент в противогазах.
Азот № 7. Азот обязательно входит в состав взрывчатых веществ. Ни одно взрывчатое вещество нельзя приготовить без азотной кислоты или ее солей. Нитраты Ba, Sr, Pb использовались в пиротехнике (сигнальные огни, цветные ракеты, салют).
Гелий № 10. Гелий используют для установки маяков, указывающих красно – оранжевым цветом путь морским и воздушным кораблям.
Натрий № 11. Натрий применяется в авиамоторах для отводки тепла от клапанов, в сигнальных огнях.
Магний № 12. На основе магния и алюминия изготовлялись прочные, сверхлегкие сплавы для самолетостроения
Магний использовался для сигнальных и осветительных, ракет, трассирующих пуль и снарядов, зажигательных бомб.
Алюминий № 13. Алюминий называют «крылатым» металлом, так как его сплавы с Be, Mg, Mn, Na, Si, используются в самолетостроении. Тончайший алюминиевый порошок использовался для получения горючих и взрывчатых смесей.
Кремний № 14. Кремний основа производства стекла, которое использовалось для различных оптических приборов (бинокли, перископы, прожекторы, прицелы)
Фосфор № 15. Фосфор входит в состав зажигательных смесей, дымовых шашек, спичек
Хлор № 17. На основе хлора изготовляли большинство боевых отравляющих веществ.
Кальций № 20. Соединение кальция – прекрасный строительный материал.
Титан № 22. Сплав титана (до 88%) с другими металлами идет на изготовление танковой брони; другие сплавы используют для изготовления винтов вертолетов, самолетов. Титан применяют в радиотехнике. Соединения TiCL4, используют для дымовых завес.
Ванадий № 23. Ванадий называют «автомобильным металлом». Из ванадиевой стали изготовляют солдатские каски, шлемы, броневые плиты на пушках, бронебойные снаряды, паровозные цилиндры, тормозные колодки, глиссеры, гидросамолеты, морские корабли.
Хром № 24. Хромовые стали нужны для изготовления огнестрельных орудий, броневых плит, корпусов подводных лодок, рессор, пружин, шарикоподшипников.
Марганец № 25. Марганец используется в составе ферромарганца, как раскислитель при производстве чугуна и стали.
Железо № 26. Более 90№ всех металлов, которые использовались в Великой Отечественной войне, приходятся на железо. Железо – главная часть чугунной стали, а по их выплавке судят о мощности государства. Сколько этого металла было выброшено в снарядах, бомбах, минах, гранатах! Чтобы судить о масштабах расхода железа в минувшей войне, назовем одну цифру: миллион бомб сброшено фашисткой авиацией на Сталинград.
Кобальт № 27. кобальт называют металлом чудесных сплавов (жаропрочных, быстрорежущих ). Кобальтовая сталь использовалась для изготовления магнитных мин.
Никель № 28. Из сплава никеля с железом изготовляли сердечники для телефонных аппаратов. Сплавы Ni с Fe, Co, Cr, Zn, Mn, C- корабельная броня.
Медь № 29. В годы Великой Отечественной войны главным потребителем меди была военная промышленность. Сплавы Cu 90% и Sn10% пушечный металл. Сплав Cu 68% и Zn32%- латунь, которая использовалась для изготовления гильз артиллерийских снарядов и патронов. Сплав Cu, Zn, Sn- морские латуни.
Цинк № 30. Более половины добываемого цинка расходуется на изготовление оцинкованного железа и оцинкованной проволоки для канатов. Сплавы Баббит гарт используются в полиграфической промышленности. Соединения цинка используется в фармацевтической и лакокрасочной промышленности.
Германий №32. Без Германия не было бы радиолокаторов. В начале Великой Отечественной войны советские ученые создали генераторы для питания раций партизанских отрядов (на основе германия превращать тепловую энергию в электрическую).
Мышьяк № 33. Мышьяк – составная часть боевых орудий ОВ. Соединения мышьяка используются в фармацевтической промышленности.
Бром №35. Бром является составной частью покрытия фотопленки, соединения брома входит в состав лекарственных препаратов.
Стронций № 38. Стронций окрашивает пламя в красный цвет, поэтому использовался в сигнальных огнях, ракетах; «участник» салютов, фейерверков. При взрыве атомной или водородной бомбы образуется радиоактивный изотоп Sr-90, который вызывает тяжелое заболевание организма.
Цирконий № 40. Смесь металлического порошка циркония с горючими веществами применяются для изготовления осветительных ракет. Циркониевая сталь используется для изготовления броневых плит и щитов.
Молибден № 42. Молибден называют «военным» металлом, так как 90% его используется на военные нужды. Стали с добавкой Мо (и другие микродобавки) очень прочны, из них готовят стволы орудий, винтовок, орудий, детали самолетов, автомобилей. Введение Мо в состав сталей в сочетании с Cr или W необычайно повышает их твердость (танковая броня).
Молибденовая сталь прочна, остра, тверда, гибка, из неё готовили клинки, сабли, мечи, ножи.
Серебро №47. Серебро в сплавах с индием использовалось для изготовления прожекторов (для противовоздушной обороны); зеркала применяли врачи, сигнальщики, подводники. Обеззараживающие свойства серебра и его соединений используются в медицине, соединений серебра с бромом в фотографии.
Олово № 50. Олово называют металлом «консервной банки», Сплав олова с другими металлами используется для изготовления подшипников. Хлорид олова – жидкость, использовалась для образования дымовых завес.
Йод №53. Йод применяется в медицине, фармацевтике.
Барий №56. Соединения бария входит в состав для изготовления смесей зеленых сигнальных ракет, салютов.
Лантан № 57. Сплав лантана, церия и железа дает так называемый «кремень», который использовался в солдатских зажигалках. Из него же изготовляли специальные артиллерийские снаряды, который во время полета при трении о воздух искрят (можно и ночью наблюдать за их полетом). Лантановые стекла применяются в полевых оптических приборах.
Тантал № 73. Тантал – важнейший стратегический металл для изготовления радарных установок, передаточных радиостанций, металл восстановительной хирургии.
Вольфрам № 74. Из вольфрамовых сталей и сплавов изготавливают танковую броню, оболочки торпед и снарядов, наиболее важнейшие детали самодельных двигателей.
Платина №78. Платина – один из самых активных катализаторов для различных химических процессов. Особое значение имеет платина для синтетического получения азотной кислоты путем окисления аммиака (HNO3- основа производства взрывчатых веществ).
Свинец №82. С тех пор как изобрели огнестрельное оружие, из свинца начали отливать дробь, пули для ружей, винтовок. Пистолетов. Свинец не раз решал исход грандиозных военных баталий, за что его стали называть «смертоносным» металлом. Азид свинца Pb(N3)2 – взрывчатое вещество.
Этилированный бензин содержит тетраэтилсвинец. Соединения свинца используется в лакокрасочной и фармацевтической промышленности.
Уран № 92. Величайшее достижение науки (овладение человеком атомной энергией) породило величайшую трагедию человечества Первая атомная (урановая) бомба была создана в США и 6 августа 1945 года сброшена на г. Хиросиму. Безгранична перспектива использования урана: атомные электростанции, ледоколы, подводные лодки т.д.
Всем народам надо бороться за то, чтобы с уверенностью можно было сказать: уран – это счастье и мир на Земле!
Плутоний №94. Первая плутониевая бомба бала изготовлена в США. 9 августа 1945 года она была сброшена на Г. Нагасаки. Её взрыв повлек десятки тысяч смертей и сотни тысяч тяжелых увечий. Последствия взрыва сказываются и сейчас на новых поколениях.
Ведущий: открываем 3 страницу нашего журнала А на ней Викторина для наших гостей. Предлагается учащимся ответить на следующие вопросы.
Вопросы для викторины.
- Какие металлы содержатся в гильзе артиллерийского снаряда?
- Как используется магний в военном деле?
- Почему хранилища с жидким горючим окрашивают белой краской или серебрянкой?
- Как использовалось стекло на войне?
- Атом на службе мира и войны.
1. Какой металл называют воплощением надежд и тревог?
2. В чем секрет самурайских мечей?
3. Какой элемент называют «светоносцем» и почему?
4. Какой металл может «болеть чумой»?
5. Какой металл и почему называют крылаты.
Ведущий: 4 страница нашего журнала «Давайте люди никогда об этом не забудем»
«Прошла война, прошла страда,
Но боль взывает к людям:
Давайте, люди, никогда об этом не забудемПусть память верную о ней
Хранят об этой муке,
И дети нынешних детей,
И наших внуков внуки…»
На фоне песни «День Победы» Заключительное слово преподавателя.
Мне и всем преподавателям школы хочется, чтобы вы сохранили и пронесли сквозь годы благодарную память о тех, кто защищал нас, спас от фашизма, принес мир народам, чтобы вы учились у них стойкости верности Родине.
«Сегодня праздник входит в каждый дом,
И радость к людям с ним приходит следом
Мы поздравляем всех с великим днем,
С днем нашей Славы!
С днем Победы».
Учащиеся берут корзину с цветами и идут к памятнику погибшим воинам для возложения цветов.
Нестойкий оловянный припой. О чуме, погубившей Роберта Скотта, и о других заразных болезнях

Дорогая, любимая. Мне непросто писать из-за холода — 70 градусов ниже ноля и только палатка защищает… Мы оказались в тупике, и я не уверен, что мы справимся. Во время короткого завтрака я пользуюсь небольшой толикой тепла, чтобы написать письма, готовясь к возможной кончине. Если с мной что-то случится, я бы хотел, чтобы ты знала, как много ты значила для меня. Заинтересуй сына естественными науками, если сможешь. О, моя дорогая, моя дорогая, как я мечтал о его будущем. И все же, моя девочка, я знаю, что ты справишься. Ваши портреты найдут у меня на груди. Я мог бы многое рассказать тебе об этом путешествии. Какие истории ты смогла бы поведать нашему мальчику, но, ох, какой ценой. Лишиться возможности увидеть твое милое, милое лицо. Я думаю, что шансов нет. Мы решили не убивать себя, и бороться до конца, чтобы добраться до лагеря. Смерть в борьбе безболезненна, так что не волнуйся за меня.
Это знаменитое письмо написал в Антарктиде замерзающий Роберт Скотт в конце марта 1912 года. 17 января 1912 года, в ходе второй антарктической экспедиции под названием «Терра Нова», Скотту и горстке его соратников (Эдгару Эвансу, Лоуренсу Отсу, Эдварду Уилсону и Генри Боуэрсу) удалось достичь Южного Полюса, где они обнаружили норвежский флаг и множество собачьих следов (14 декабря 1911 года к полюсу пришла группа Руаля Амундсена, в которой кроме Амундсена были Оскар Вистинг, Хелмер Хансен, Сверре Хассель, Олаф Бьяланд).
Соперничество Амундсена и Скотта, фамилии которых теперь навечно сцеплены дефисом в названии американской антарктической станции «Амундсен-Скотт» прямо на Южном Полюсе — это редкостной выразительности пример, демонстрирующий сокрушительную победу эффективного менеджера над прекраснодушным героем. Амундсен (которого завистники звали «Рекламундсен») продумал свою экспедицию до таких мелочей как закупка варежек. Его палатки не продувались, так как были оснащены ультрасовременными застежками-молниями (которые, кстати, на антарктическом морозе иногда так замерзали, что из палатки было невозможно выбраться без ножа, либо молнию приходилось отогревать снаружи). Расходуя груз и провиант, Амундсен методично расстреливал ездовых собак, оставляя ровно столько, сколько нужно было, чтобы тащить полегчавшие сани, скармливая убитых собак живым. Он называл ледники в честь своих спонсоров и за всю экспедицию не потерял ни одного человека.
Скотт при движении на юг также оставлял «базовые лагеря» с топливом и провиантом для обратного пути. Были там и запасы керосина в канистрах, запаянных оловом. На свою беду полярники не учли феномена оловянной чумы.
Аллотропия
Для химических элементов характерны так называемые «аллотропные изменения» (модификации). В зависимости от условий окружающей среды физические свойства элемента, а также его наблюдаемое состояние, могут сильно меняться. Это связано с переупорядочиванием атомов и, следовательно, с изменением силы связей между ними.
Рассмотрим три характерных примера аллотропной модификации:
Озон и кислород

Обе этих молекулы состоят из атомов кислорода, но плотность озона в 1,5 раза больше, чем у кислорода, и химическая активность также выше. Например, возможна прямая реакция озона с серебром, которая между кислородом и серебром происходить не будет:
Кислород жизненно необходим для человека, а озон в больших концентрациях вреден, хотя, в малых полезен. Озон обладает сильным приятным запахом, а кислород нет.
Графит и алмаз
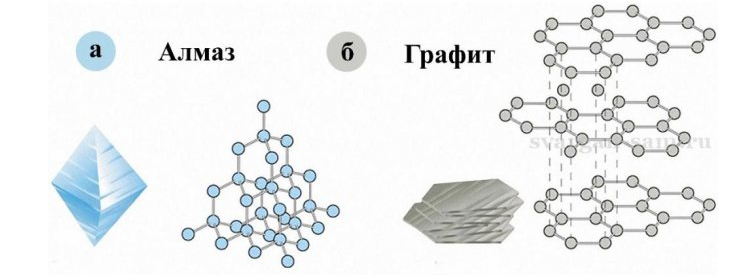
Как известно, алмаз имеет максимальную твердость по шкале Мооса (10), а графит минимальную (1). Из иллюстрации понятно, что связи между атомами углерода в горизонтальных слоях графита остаются сильными, а в вертикальном разрезе очень слабые, благодаря чему графит снимается послойно, и им удобно писать.
Белый и красный фосфор

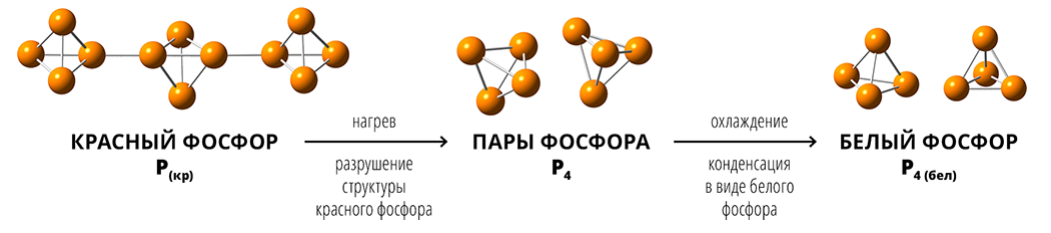
Температура плавления красного фосфора составляет 600 °C, тогда как температура плавления белого – всего 44 °C. При этом красный фосфор не воспламеняется до 250 °C, а белый фосфор воспламеняется уже при 45 °C, а при трении – и при более низких температурах.
Таким образом, поразительные отличия разных аллотропных модификаций у фосфора и углерода связаны с тем, что кристаллическая решетка этих элементов может упорядочиваться принципиально разным образом. Фосфор и углерод находятся в центральной части своих периодов в таблице Менделеева, однако являются полноценными неметаллами, будучи расположены в правом верхнем углу таблицы, где сосредоточены элементы с неметаллическими свойствами:

Здесь желтым цветом обозначены неметаллы, зеленым – переходные металлы, розово-желтым – полуметаллы. И также есть олово, которое, в отличие от сурьмы и германия, правильнее считать полноценным металлом. Но оно находится на три периода ниже углерода, поэтому тоже проявляет ярко выраженные аллотропные свойства.
Белое олово – это типичный металл, напоминающий свинец, но легче и тверже. Олово известно с глубокой древности и входит в состав бронзы – одного из первых сплавов, изобретенным человеком (олово + медь). Как олово, так и медь – достаточно мягкие и легкоплавкие металлы, а бронза гораздо прочнее, благодаря чему отлично подошла для изготовления оружия, посуды и инструментов, дав начало Бронзовому Веку. Тем не менее, белое олово существует в достаточно узком температурном режиме, между 161 и 13,2 °C. При более низких температурах олово начинает спонтанно переходить в серую аллотропную форму, напоминающую порошок или даже пыль. Максимальной интенсивности этот процесс достигает примерно при -39 °C, и от металлического олова ничего не остается.

Наиболее опасной чертой такой аллотропной модификации олова является заразность. Серое олово при контакте превращает белое олово в серое, если температура остается достаточно низкой. Так, принесенная с мороза оловянная миска, поставленная в шкаф в неотапливаемом помещении, может заразить всю остальную оловянную посуду.
Очень странно, что Роберт Скотт не учел этого обстоятельства – ведь оловянная чума известна давно; есть даже предположение, что именно из-за оловянной чумы, поразившей пуговицы наполеоновской армии в ходе отступления из Москвы, французы оказались в особенно незавидном положении.
Оказывается, что оловянная чума характерна только для химически чистого олова, для защиты от нее достаточно правильно подобрать сплав на основе олова. Например, в наше время широко известен сплав пьютер, предметы из которого были найдены даже в раскопках древнеегипетского культурного слоя. Наиболее качественный пьютер состоит из 95% олова, 2% меди и 3% сурьмы. Именно из такого сплава выполнена статуэтка «Оскар».
Поразительно, но в недавнем прошлом для оловянной чумы нашлось практическое применение, связанное с очисткой лабораторной и промышленной оптики от капелек олова. Капельки чистейшего олова используются в качестве мишеней для плазмы, которая применяется для получения глубокого ультрафиолета, а глубокий ультрафиолет – для вытравливания микросхем. При этом для сборки ультрафиолета в действующий луч используется тончайшая оптика, которая быстро тускнеет, так как на ней конденсируется олово. Оказалось, что именно обработка оптики серым оловом позволяет полностью очистить стекло, не оставив на нем ни малейших царапин. В результате срок службы такого собирающего зеркала значительно увеличивается.

Но оловянная чума – лишь наиболее известная аллотропная болезнь металла. Есть и значительно более экзотические и не менее опасные метаморфозы, о которых я также хочу здесь рассказать.
Цинковая чума

Это явление во многом подобно оловянной чуме и изучено гораздо хуже. Впервые описано примерно в 1920-е годы в среде мастеров и коллекционеров, увлекающихся миниатюрными моделями машин. В чистом виде цинк в производстве практически не используется, а в промышленности применяется как основа сплава «цамак», содержащего также алюминий, магний и медь. Цамак был разработан в США в 1929 году, в СССР и России более употребительно название «ЦАМ» (цинк, алюминий, медь). Правильное соотношение металлов в ЦАМ: цинк 95%, алюминий 4%, медь 1%.
Чума, подобная оловянной, поражает такой сплав не просто при изменении физических условий, но и, по-видимому, неизбежно, если доли металлов в ЦАМ отмерены неправильно. Цинковая чума начинается с характерных вздутий на поверхности металла.

Затем микроструктурные изменения проникают в глубину металла, и он крошится.
Прямая аналогия таких повреждений с оловянной чумой не доказана, хотя, по данным частных экспериментов, прочность металлических моделей после замораживания действительно падает в разы. Согласно другой версии (изложенной здесь, где показаны фотографии с последовательной деградацией модели), ЦАМ заболевает чумой, если в его составе оказывается хотя бы минимальное количество олова или свинца. Если бы эта версия подтвердилась, то означала бы, что оловянная чума заразна даже для цинка, являющегося переходным металлом.
Чаще цинковую чуму связывают с технологическим браком при производстве. Например, в сплаве может быть слишком велика доля алюминия, как в китайских моделях, либо в него могут попадать примеси никеля или сурьмы. То есть, такой сплав уже нельзя считать ЦАМ.
Пурпурная чума
Основной недостаток таких сплавов – хрупкость и низкая прочность. Контакт просто отламывается от транзистора. Наиболее распространенное соединение золота и алюминия – AuAl2, где золото составляет по массе примерно 78,5%, а алюминий – 21,5%. Это соединение имеет яркий фиолетовый цвет, почему и получило название «пурпурная чума».
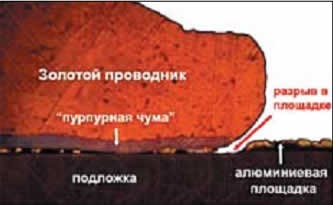
Пурпурная чума возникает при температурах свыше 1000 °C, то есть, близко к температуре плавления золота (1064 °C). Пурпурная чума образуется неравномерно, поэтому конструкция долго сохраняет механическую плотность, пока не станет слишком поздно. Но уже при остывании до 624 °C пурпурная чума сменяется коричневой, гораздо более хрупким соединением Au2Al. А при температурах 100 °C и ниже начинается диффузия: слои с содержанием алюминия начинают проникать вглубь золота, и пурпурная чума охватывает весь образец, а не только стык (это явление называется «эффект Киркендалла»). При этом уменьшается общий объем вещества, и разрушительное воздействие пурпурной чумы становится фатальным.
Опять же, эта болезнь устраняется достаточно легко: проводник нужно легировать, достаточно 1% платины или палладия.
Интересно, что и пурпурная чума нашла своих ценителей. Соединения золота и алюминия эстетично выглядят, а интерметаллид AuAl2 даже был получен ювелирами в 1930 году и запатентован под названием «аметистовое золото». Уже тогда было замечено, что этот сплав очень хрупкий, поэтому его нельзя ковать или вытягивать, но можно осторожно гранить и оправлять как драгоценные камни. Открыв пурпурную чуму, ювелиры продолжили эксперименты, легируя золото, в частности, галлием и индием. Получались сплавы, близкие по свойствам к золоту, но тяготеющие по цвету к синей части спектра, также очень красивые.
Вместо заключения
Процессы, рассмотренные в статье, можно считать специфическими случаями коррозии. Пример истинной коррозии, напоминающий «металлическую чуму» — это образование дикой патины. В отличие от ровной и плотной благородной патины, которая возникает при медленном окислении меди на воздухе, дикая патина является рыхлой, поэтому не только разрушается вместе с поверхностным слоем медного изделия, но и проникает внутрь него, заражая металл ионами хлора. В Санкт-Петербурге, где атмосфера в конце XX века стала гораздо агрессивнее из-за выхлопных газов, усугубивших высокую влажность, дикая патина серьезно поразила скульптуры «Укрощение коня» на Аничковом Мосту.

Чтобы продлить жизнь этих скульптур, их пришлось искусственно покрывать очень тонким слоем закиси меди, имитирующей благородную патину. Возможно, она позволит продлить жизнь этим красавцам.
Вышеизложенный экскурс при всей пестроте приведенных примеров был подготовлен, чтобы продемонстрировать, насколько больно бывает учиться на ошибках. Я не симпатизирую Скотту, который при всей отваге и силе духа последовательно действовал как карьерист и увел с собой в могилу еще нескольких людей, при этом вдохновив своим примером целое поколение полярников. Но мне кажется очень странной гримасой судьбы, что смерть Скотта, напрасная с точки зрения географического подвижничества, могла настолько подстегнуть развитие металлургии и химии металлов, именно в силу своей нелепости и неизбежности.
Читайте также:
