Какой металл плавится на руке
Обновлено: 02.07.2024
Галлий – невероятный металл, который разбивается, как стекло, плавится в руке человека, атакует другие металлы, но не токсичен для людей и действует как инопланетная форма жизни при воздействии серной кислоты и раствора дихромата. Звучит слишком удивительно, чтобы быть правдой, но галлий – это абсолютно реальный химический элемент, который содержится в некоторых гаджетах, которые мы используем каждый день.
Но, что, пожалуй, еще интереснее, ученые проводят массу безумных экспериментов с галлием. Благодаря своим странным свойствам и поведению галлий может творить довольно странные вещи в лаборатории. На видео выше показано, что происходит, когда галлий «атакует» алюминий.
Популярный эксперимент с «бьющимся сердцем галлия» показывает, что галлий может действовать как живое существо, будучи погруженным в серную кислоту и раствор дихромата. Изменяя поверхностное натяжение галлия, ученые могут сделать металл похожим на органическое бьющееся сердце, что показано на видео выше.
Жидкая ложка из галлия – это забавная демонстрация, в которой хорошо используется температура плавления галлия 30 градусов по Цельсию. Ложка галлия перемешивает горячую воду и тут же тает в лужу на дне кружки, что вы можете наблюдать на видео ниже.


@Mircenall, тебя тут постов лишают)
Ну вот что за изверги такие видео делают. Включил первый видос и сразу подумал, что очередные нашуники погибли, а тут просто звук только на один канал идет
В первом видео такая реакция за какое время проходит? Непонятно. Может оно год стояло так.
Почему звук только слева?
Блин, круто звучит, как ругательство "дихромат калия")
Дык про галлий миллиард постов было. Автор, вот честно - чего конкретно нового про него вы внесли? Тип я понимаю это было бы более менее как статья. Пояснение с и физической точки зрения почему так происходит, а не то что все уже знают.
Вывод: галлий нельзя перевозить в алюминиевой лодке
А если скушать его?

Научное открытие

Всё ради получения прибыли


Общий объём всей воды и всей атмосферы нашей планеты

К последним новостям мира науки
Один из крупнейших научных издательских домов Elsevier начал отправлять рецензентам анкеты с вопросами о. гендерной и расовой принадлежности.
Делается это, по словам редакции «для поддержки инклюзивности науки». В частности, инклюзивность решили внезапно поддержать в таких журналах, как Chemical engineering journal и Journal of Alloys and Compounds (само собой, никоим образом не связанных с исследованиями гендерных и расовых вопросов)


Кроме того, забавно видеть от научного издательства постановку вопроса «Каким бы расовым термином вы бы себя определили?»
И далее идёт перечисление «рас»:
Азиаты или жители Океании
Черные
Испанцы или латиноамериканцы
Коренные народы (североамериканские индейцы, южноамериканские индейцы и т.п.)
Ближневосточные или североафриканские жители
Белые
Собственное описание
Толерантность, инклюзивность и всё такое — это, конечно, хорошо, однако расоведение (раздел антропологии, изучающий человеческие расы) выделяет всего четыре расы человека (европеоидная, монголоидная, негроидная, австралоидная) и десятки малых антропологических типов. В списке же намешаны расы, народы, языковые группы и даже возможность самоопределить себя в отдельную расу.
Извините, другой науки у нас для вас нет 🌚
Мечехвосты

Правда ли, что употребление соли вредно?

Один из самых популярных мифов о питании гласит, что соль — это белая смерть, она вредна для здоровья. Мы решили проверить, правда ли это.
(Специально для любителей расширения сознания — речь идет про поваренную соль, которая хлорид натрия)
(Самое важное для ЛЛ: утверждение, что соль вредна, абсолютно некорректно. При этом к проблемам со здоровьем может привести как ее дефицит, так и избыток в суточном рационе)
Информацию о том, насколько соль опасна для нашего организма, можно найти на сайтах медицинских учреждений, например больниц. Об этом пишут СМИ, даже специалисты ООН бьют тревогу. Рассуждения о том, стоит ли полностью отказываться от соли, можно найти на порталах о диетологии и здоровом образе жизни. Стереотип о том, что соль — это яд, настолько распространён, что его можно встретить даже в кино.
1. Дефицит соли
Соль на 97% состоит из хлорида натрия и служит одним из основных источников этих элементов для нашего организма. Натрий — электролит, который играет важную роль в поддержании водно-солевого баланса (логично), а также обеспечивает передачу нервных импульсов.
Сама по себе нехватка натрия в крови — уже достаточно серьёзное заболевание, гипонатриемия. Оно может привести к тяжёлым неврологическим и психическим нарушениям, судорогам, коме и даже смерти. Ещё одна опасность низкого содержания натрия в организме — обезвоживание, которое тоже может привести к тяжёлым последствиям для здоровья. И обезвоживание, и гипонатриемия особенно опасны для людей старшего возраста. Натрий выводится из нашего организма естественным образом с мочой и потом. Именно поэтому спортсмены после тяжёлых тренировок могут ощутить нехватку натрия, один из её симптомов — мышечные спазмы.
В 2016 году специалисты Кокрановской библиотеки изучили результаты различных исследований о взаимосвязи потребления соли, давления и холестерина и выяснили, что диета с пониженным содержанием соли способствует некоторому повышению холестерина и триглицеридов в крови. А это, в свою очередь, может привести к заболеваниям сердца. Кроме того, пищевую соль часто обогащают железом, йодом и фолиевой кислотой, поэтому её употребление может восполнить и нехватку этих веществ в организме.
Американская кардиологическая ассоциация рекомендует потреблять в день 1,5 г натрия — это примерно 3/4 чайных ложки соли. Однако, согласно проведенным ими исследованиям, средний американец съедает примерно полторы, превышая норму в два раза. То же самое обнаружили и диетологи Австралии.
2. Негативные последствия избытка соли
Многочисленные исследования врачей показали, что переедание соли способствует развитию гипертонии, что, в свою очередь, может привести к инфарктам и инсультам. В 2020 году учёные заявили, что увеличение ежедневного употребления натрия всего на 1 г приводит к повышению риска смерти от сердечно-сосудистых заболеваний на 6%. Кровяное давление влияет и на здоровье почек, поэтому сильно солёная пища может отрицательно сказаться и на них.
Впрочем, на этот счёт учёные пока не смогли прийти к единому мнению. Некоторые из них считают, что доказательств влияния потребления соли на кровяное давление недостаточно. В любом случае паниковать и полностью отказываться от соли не стоит: доказано, что употребление в пределах одной-двух чайных ложек точно не способствует повышению давления.
Кроме того, обзор 2014 года показал, что сокращение количества соли в рационе на 2 г способствует снижению систолического артериального давления всего на 3,82 мм ртутного столба. При средних значениях в 125–144 мм ртутного столба такое снижение представляется не особенно значимым.
Между делом учёные выяснили, что одни люди более чувствительны к соли, чем другие. Вероятно, именно им стоит более пристально следить за соблюдением нормы потребления натрия. Но зато и сокращение соли в рационе для них будет более эффективным, чем для тех, кто не так чувствителен. В группу риска, по мнению учёных, входят пожилые люди, гипертоники, афроамериканцы, люди с хроническими заболеваниями почек, те, у кого был низкий вес при рождении.
3. Соль и рак желудка
Некоторые исследования связывают диеты с повышенным содержанием соли с риском развития рака желудка. Так, одно из исследований, проведённых в Японии, с участием более чем 40 000 человек показало, что этот риск выше аж на 30% у тех, кто предпочитает сильно солёную пищу.
При этом учёные пока не пришли к единому мнению, как конкретно соль может вызвать рак. По одной из версий, она способствует размножению бактерий, провоцирующих язвенную болезнь, которая может перерасти в рак. По другой — диета с высоким содержанием соли может вызвать клеточные мутации, которые в конечном счёте и приводят к раку.
4. Остеопороз
Ещё одна опасность избыточного потребления соли — остеопороз. Организм выводит излишки натрия через мочу, а вместе с ней выводится и кальций. Соответственно, чем больше соли необходимо вывести организму, тем больше он вымоет и кальция, что может стать причиной костных нарушений.
5. Контроль количества потребляемой соли
Ограничивать соль в рационе действительно есть смысл, поскольку следить за ее количеством не так просто, особенно если вы употребляете готовые продукты, например соусы. Соль содержится практически во всех продуктах питания, но оценить её количество не всегда можно на глаз.
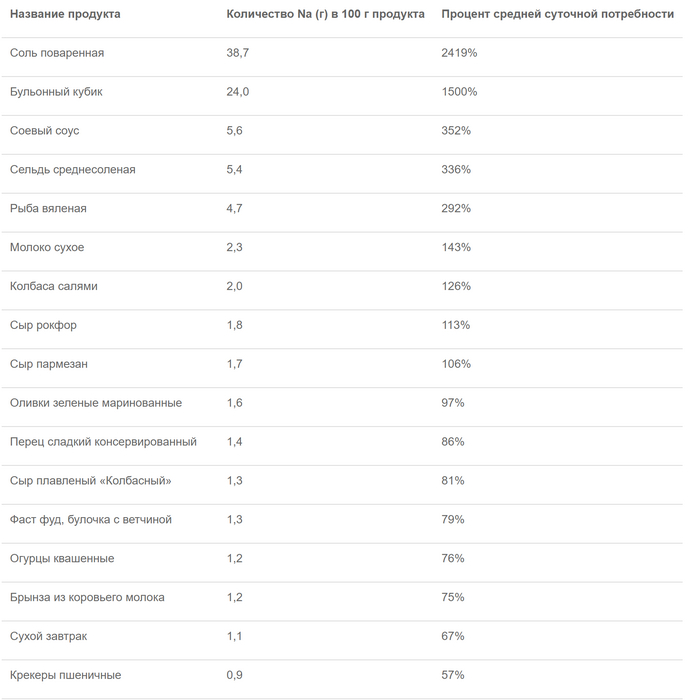
Роспотребнадзор приводит таблицу содержания соли в различных продуктах. По их данным, в 100 г среднесолёной сельди содержится 336% дневной нормы натрия, в 100 г пармезана — 106%, а в таком же количестве оливок — 97%. Таким образом, чтобы не превысить норму, вам не только нужно выбрать в день что-то одно, но и совсем не употреблять соль в других продуктах, что практически невозможно.
Таким образом, избыточное потребление соли может быть опасно для здоровья, хотя учёные до сих пор не смогли прийти к единому мнению на этот счёт. Тем не менее полностью отказываться от неё нельзя, поскольку она — источник натрия, который необходим организму для нормальной жизнедеятельности, а его нехватка может привести к печальным последствиям для здоровья.
Поэтому, как и со многими другими продуктами, с солью всё хорошо в меру, однако утверждать, что её употребление в любых количествах приближает смерть, — несправедливо.

Наш вердикт: полуправда (проверяемый факт или утверждение представляет собой смесь правды и лжи примерно в равных пропорциях)
Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла).
Аудиоверсии проверок в виде подкастов c «Коммерсантъ FM» доступны в Simplecast, «Яндекс.Подкасты», Apple Podcasts, «ЛитРес», Soundstream и Google.Подкасты.
12 физ. и хим. характеристик металла, что плавится в руках
Металл который плавится в руке: понятие легкоплавкости + характеристика галлия + разбор термодинамических свойств химического элемента + физические/химические свойства металла + его область применения.

Многие из нас видели в интернете фото металла, который плавится в руке. Единственный химический элемент в природе, который может безопасно для здоровья человека, провернуть подобный трюк – галлий.
В сегодняшней статье мы разберем отличительные свойства группы легкоплавких металлов + предоставим характеристику элемента, тающего в руках его владельца.
Понятие легкоплавких металлов/сплавов
Легкоплавкость – понятие растяжимое, особенно это актуально для промышленности. В химии легкоплавкими считаются элементы группы металлов + их сплавы, температура плавления которых ниже порога в 1000 градусов Цельсия.

Если температура плавления металла превышает 1 500 градусов Цельсия – его принято выделять в группу тугоплавких. Диаграмма выше четко дает понять, куда какой металл следует относить.
Обратите внимание: минимальная температура плавления у ртути — 39 градусов. Именно благодаря такому физическому свойству, мы можем наблюдать химический элемент в постоянно жидком состоянии.
Теперь пройдемся по легкоплавким сплавам. В своем большинстве – это сплавы эвтектического типа, пиковая температура плавления которых не превышает 232 градусов по Цельсию. В основе производства легкоплавких сплавов лежат легкоплавкие металлы – олово, висмут, таллий, галлий и другие.

Ученым удалось добиться -78 градусов в качестве минимальной температуры плавления для советского сплава, который состоит на 12% из натрия, 47% калия и 41% цезия. Недостаток сплава — реакция с водой. Ближайший конкурент – амальгама. Токсичный сплав из ртути с таллием, сохраняющий жидкое состояние до температуры -61 градус по Цельсию.
Область применения легкоплавких металлов/сплавов:
- энергетическая промышленность и машиностроение. Основное направление – создание тепловых носителей с жидкометаллического типа;
- литьевая промышленность;
- как основа для датчиков температуры, что актуально в системах пожарной безопасности;
- как основа для разработки термометров;
- как ремонтный материал в вакуумных технологиях;
- припои, предохранители и прочие мелочи в микроэлектронике;
- медицинское направление. То же протезирование;
- как металлическая смазка.
Низкая температура плавления является базовых свойством, которое требуется от легкоплавких металлов и сплавов. Вторичные параметры, которые берутся во внимание в различных областях использования – плотность, прочность на разрыв и инертность в химическом плане.
Галлий: металл, который плавится в руках
Поистине, занимательный химический элемент, который имеется в любом школьном кабинете химии. Благодаря демонстрационной наглядности, галлий считается лучшим вариантом донесения до умов учащихся тепловых свойств химических элементов.

Gallium (Ga) – металл, который плавится в руках при достижении температуры в 29.8 градуса по Цельсию . Учитывая стандартные 36.6 в организме человека, чтобы получить желаемый эффект, достаточно кусочек галлия положить на ладошку и наблюдать как тот медленно по ней растекается в разные стороны.
1) Общая информация по элементу
В периодической системе химических элементов галлий находится на 31 позиции. Его латинское обозначение – «Ga». Металл принадлежит к группе легких металлов, куда также входит алюминий, индий, олово, таллий, свинец и висмут.

Внешне, галлий представляет собой мягкий или хрупкий металл (в зависимости от температуры), имеющий белый + серебристый оттенки. Иногда можно заметить синеватые отблески на поверхности чистого вещества.

Великий Менделеев заранее знал о данном химическом элементе. Впервые он просчитал некоторые свойства галлия еще в 1871 году. Изначальное название, присвоенное химиком, звучало как «экаалюминий».
К предугаданным свойствам галлия Менделеевым относились:
- оксидный тип;
- варианты связи с хлором;
- медленная растворимость при соприкасании с щелочами/кислотами;
- галлий не будет реагировать с кислородом;
- возможность легкоплавкого металла образовывать основные соли;
- химический элемент будет открыт при использовании спектроскопии.
Непосредственное выделение металла в чистом виде пришлось на француза Буабодраном. Открытие приходится на 1875 год. Из-за малого долевого содержания галлия в руде (менее 0.2%), пришлось потратить пару месяцев на получение минимального запаса чистого вещества для полноценного исследования его физических/химических свойств.
| Физика галлия | Химия галлия |
|---|---|
| Наличие нескольких модификаций полиморфного типа. | Низкая химическая активность замедляет протекание химических реакций металла в твердом состоянии. |
| При нормальных условиях кристаллическая решетка имеет орторомбическую структуру. При повышении давления наблюдается образование 2 структур полиморфного типа с кубической и тетрагональной решетками. | На воздухе галлий покрывается оксидной пленкой, которая предохраняет его от дальнейших реакций окисления. |
| Плотность галлия – 5.9 грамма на сантиметр кубический, а в жидком состоянии плотность увеличивается до 6.1 грамма на сантиметр кубический. | В контакте с горячей водой, он вытесняет из нее водород, в результате чего образуется гидроксид галлия. |
| Сопротивление электричеству у галлия в твердом и жидком состояниях одинаковы и равны 0.5 на 10-8 Ом*см при температурном режиме в 0 градусов по Цельсию. | Вступает в реакцию с паром (выше 340 градусов) и образует метагаллиевую кислоту. |
| Вязкость галлия колеблется в зависимости от температурного режима. При температуре в 100 градусов – 1.6 сантипуаз, а при 1000 градусов С – 0.6 сантипуаз. | Может взаимодействовать с кислотами минерального типа – происходит выделение Н и образование солевых веществ. |
| Поверхностное натяжение составляет 0.74 ньютона на метр, а отражательный коэффициент от 71% до 76% при разной длине волн. | Галлий инертен по отношению к водороду, азоту, углероду и кремнию. |
В земной коре металл, который плавится в руках, встречается довольно часто. На 1 тонну земли приходится 19 грамм чистого вещества. В химическом аспекте, галлий – элемент рассеянного типа, располагающий двойной природой по геохимии. Хотя кларки вещества и большие, из-за его сильной склонности к изоморфизму, больших скоплений чистого галлия в природе не найти.

К основным минералам, где сравнительно высокое содержание галлия в чистом виде относят сфалерит (до 0.1%), биотит (до 0.1%) и натролит (до 0.1%). В остальных 10+ минералах, которые также применяются для добычи галлия, долевое содержание чистого вещества менее 0.1%. В морской воде галлий также присутствует, но его содержание крайне мало – всего 30 на 10-6 миллиграммов на литр жидкости.
2) Почему галлий – это металл, который плавится в руке?
Обратимся к тепловым свойствам металла, и полностью разберем их при различных уровнях, хотя ответ на вопрос очевиден уже из базового понятия, температуры плавления, которая приравнивается к 29 градусам по Цельсию.
Термодинамические свойства чистого галлия:
- металл переходит из твердого в жидкое состояние при достижении температуры в 29.8 С или 302 градуса Кельвина;
- металл закипает при достижении температуры в 2 448 градусов Кельвина;
- удельная теплота плавления чистого галлия составляет 5600 Джоулей на моль;
- удельная теплота по испарению составляет 270 000 джоулей на моль;
- молярная теплоемкость составляет 26 джоулей, деленных на Кельвины, перемноженные на моли.
Главными поставщиками галлия на мировой рынок являются государства из Юго-Запада Африки, Российская Федерация и большинство стран СНГ. Галлий – металл, который не только плавится в руке, но и вещество, способное менять плотность при смене температурного режима на основании данного свойства можно провести интересный опыт.

Эксперимент: переводим галлий в жидкое состояние, а далее загоняем его в маленький стеклянный пузырек. По мере охлаждения емкости, металл станет постепенно превращаться в твердую субстанцию. Постепенно образующиеся кристаллы начнут расширяться, за счет чего колба рано или поздно треснет.
Во избежание повреждений со стороны зрителей, демонстрация должна проходить в изолированном пространстве с защитной перегородкой. Если слишком резко переохладить колбу, осколки могут разлететься в разные стороны в радиусе нескольких десятков метров.
Обзор свойств и характеристик плавящегося в руке металла, галлия:
3) Получение галлия + области применения металла в промышленности/быту
В основе добычи чистого вещества лежит галлит – редкий минерал, который является смесью галлия и сульфида меди. Наиболее часто он встречается в совокупности с такими минералами как сфалерит и германит. Странный факт, но в залежах каменных углей иногда реально найти галлит в размере 1.5% от всего объема добычи, что делает такие месторождения крайне важными стратегическими запасами для промышленного производства галлия.
Основные методы получения металлического галлия – это переработка боксита, нефелина и некоторые типы полиметаллических руд/угля.
Алгоритм извлечения галлия из руд:
- Электролиз с участием щелочных жидкостей, которые в свою очередь являются промежуточным продуктом с переработки бокситов в глинозем технического применения.
- Получение концентрированных растворов по методу спекания или через процесс Байера. В первом случае получаем до 70 миллиграмм на литр, а во втором до 160 миллиграмм на литр концентрата.
- Дальнейшая очистка галлия путем карбонизации.
- Обогащенный осадок отправляют в емкость с известью, вследствие чего получаем раствор.
- При помощи электролиза раствора получаем черновой вариант металла.
- Черновой галлий прогоняют через водяной напор.
- Смесь фильтруют при помощи пористых пластинок и греют в вакууме, из-за чего из чернового металла удаляются примеси летучего типа.
- В зависимости от степени чистоты конечного продукта, используют химический, электрохимический, либо физический методы разложения.
Эталонный вариант чистки может предоставить галлий с чистотой в 99.9%. В данном случае используется метод электрохимического рафинирования и восстановление с помощью очищенного водорода.

В промышленном плане у галлия нет широкого распространения. Металл сравнительно дорогой для металлургии + его физические/химические свойства редко где могут пригодиться для массового использования.
Где применяется галлий:
- в соединениях с натрием металл применяют при создании лазеров полупроводникового типа с ультрафиолетовым и синим диапазонами;
- как присадка к германию/кремнию;
- как отражающий элемент для зеркал среднего качества. В чистом виде материал способен отражать порядка 89% света. Достоинства подобных изделий обусловливаются способностью металл к пропуску ультрафиолетовых лучей;
- как компонент в смазочных материалах. Клеи с добавкой жидкого галлия весьма популярны и сегодня;
- как замена ртути в кварцевых термометрах;
- оксид галлия – это стратегически важный объект в производстве лазерных материалов.
Иногда галлий применяют как компонент для светящихся красок, а соли на основе металла являются катализаторами в аналитической химии, медицине и органическом синтезе. Чтобы купить 1 килограмма металла, который плавится в руках, потребуется выложить от 250 до 400 американских долларов в зависимости от степени чистоты химического элемента.
Галлий
Галлий — это серебристо-серый металл с синеватым отливом, достаточно хрупкий. В природе в чистом виде он не встречается и является рассеянным элементом. Среднее содержание галлия в земной коре составляет 19 г/т. Галлий содержится в минералах, преимущественно это сфалерит, магнетит, касситерит, гранат, берилл, турмалин, сподумен, флогопит, биотит, мусковит, серицит, лепидолит, хлорит, полевые шпаты, нефелин, гекманит и натролит. Достаточно редкий минерал галлит CuGaS₂ используют для выделения чистого галлия. Кроме того, галлий может быть получен в качестве побочного продукта переработки бокситов.
Галлий плавится всего при 29,76 °C, поэтому он тает даже в руке. При температуре, близкой к комнатной, плавятся еще три металла: ртуть, цезий и рубидий. Но из-за высокой токсичности или реакционной способности их, в отличие от галлия, нельзя брать в руки.
Как был открыт галлий
Существование галлия было предсказано Д. И. Менделеевым в 1871 на основании сформулированного им Периодического закона. Менделеев дал этому элементу название «экаалюминий» и предсказал у него такие свойства как плотность, температуру плавления. Также Менделеев предсказал:
- характер оксида,
- связь в соединениях с хлором.
- что металл будет медленно растворяться в кислотах и щелочах;
- он не будет реагировать с воздухом;
- оксид экаалюминия M₂O₃ должен реагировать с кислотами с образованием солей MX₃;
- что он должен образовывать основные соли;
- хлорид обладает большей летучестью, чем ZnCl₂;
- что этот элемент откроют с помощью спектроскопии.
Менделеев оказался Ностардамусом в химии: когда галлий был получен, все предсказанные ученым свойства подтвердились!
В 1875 году французский химик Поль Эмиль Лекок де Буабодран изучал сфалерит с помощью спектроскопии и обнаружил две фиолетовые линии, принадлежащие новому элементу. Год спустя ученый выделил новый элемент с помощью электролиза. Этот элемент Буабодран назвал в честь латинского названия Франции — Gallia. Существует легенда, что в это название ученый вкладывал и другой смысл. Лекок созвучно с французским le coq, т.е. «петух» (на латыни gallus). Буабодран как бы ненароком увековечил свое имя в названии нового элемента.
Изучая полученный галлий, Буабодран определил, что плотность отличается от предсказанной Менделеевым. Когда Менделеев узнал об этом, то написал французскому коллеге с рекомендацией перепроверить результаты. И как оказалось, не напрасно: первые данные Буабодрана действительно были неверными.
Области применения галлия
Бóльшая часть добываемого галлия используется для производства полупроводников. Арсенид (GaAs) и нитрид галлия (GaN) используются в электронных компонентах многих устройств, для создания интегральных схем, высокопроизводительных процессоров, микроволновых усилителей. Арсенид галлия используется в различных электрооптических инфракрасных приборах. Арсенид галлия-алюминия применяется для создания инфракрасных лазерных диодов высокой мощности. На основе нитрида галлия и нитрида индия-галлия производят синие и фиолетовые лазерные диоды. Кстати, лазер на нитриде галлия применяется в приводах Blu-ray дисков.
Фотоэлементы на основе арсенида галлия, фосфида и арсенида индия-галлия установлены на космических спутниках и марсоходах.
Галлий имеет интересную особенность: он сильно понижает температуру плавления сплавов, в которых содержится. При этом температура опускается ниже, чем у каждого компонента сплава по отдельности (эвтектические составы). Так, сплав Галинстан (68,5 % галлия, 21,5 % индия и 10 % олова) имеет температуру плавления -19 °С и используется в некоторых термометрах вместо ртути.
Галлий применяется и в медицине. В целом металл характеризуется низкой токсичностью и не выполняет естественной биологической функции. Поэтому препараты на основе галлия могут применяться при лечении и диагностике раковых заболеваний (изотопы галлий-67 и -68). Также галлий используется при лечении некоторых бактериальных инфекций: ион Ga³⁺ замещает Fe³⁺ в метаболических путях дыхания бактерий, вызывая их гибель. Препараты на основе галлия могут применяться при лечении малярии.
Еще галлий помогает обнаружить нейтрино-частицы, исходящие от Солнца. Как правило, выявление таких частиц — это весьма сложный и трудоемкий процесс. Галлий в составе регистрационной смеси повышает чувствительность анализа, а соответственно, и помогает зафиксировать нейтрино. Детекторы GALLEX Национальной лаборатории Гран-Сассо содержат 12,2 тонны галлия-71. Они улавливают нейтрино, исходящие от Солнца, и превращают его в радиоактивный изотоп, излучение которого можно зафиксировать. Подобные исследования также проводят в Баксанской нейтринной обсерватории (Кабардино-Балкария), где нейтрино-детекторы содержат 5 тонн жидкого галлия.
По температуре плавления галлия можно проверять термометры! Эта величина — 302,9146 K (29,7646 °C) – признана стандартом Международного бюро мер и весов.
В 2007 году с помощью пучков ионов галлия толщиной 7 нм в Simon Fraser University напечатали самую маленькую в мире книгу – Teeny Ted from Turnip Town. Книга получилась размером 0,07x 0,10 мм.
У галлия есть еще одно забавное применение: ложки из галлия, по виду не отличимые от алюминиевых, используют для фокуса с исчезающей ложкой. В горячем чае или кофе такая ложка попросту расплавится!
Удивительные вещества, смеющиеся в лицо науке
Сейчас мы, конечно, можем посмеяться над нашими предками, которые считали, что порох – это происки нечистого, но в мире и по сей день существуют материалы, созданные научным путем, проявление свойств которых смахивает на гребаное колдовство. Их трудно достать, а некоторые даже чертовски опасны, но это делает их еще более крутыми.
1. Галлий – металл, который плавится в руках
Ты, конечно, в курсе про существование жидкого металла – ртути. И, конечно, тебе известно, что любой металл плавится при высокой температуре. Но наш мир горазд на удивительные выдумки и полон необыкновенных вещей, например, существует твёрдый металл, который способен растаять, словно мороженое, у тебя в руке. Знакомься – галлий. Этот металл даже при небольшой термической обработке превращается в неопасную версию Роберта Патрика из «Терминатора 2».
Галлий легко плавится при комнатной температуре, так что для строительства чего бы там ни было он совершенно не годится. Разве что ты решил создать что-нибудь ради шутки. Очень короткой шутки. Ну, и еще с помощью галлия ты сможешь снискать себе славу великого фокусника, например, если размешаешь галлиевую ложку в горячей воде, то она раствориться за считанные секунды. И это еще не все. На Youtube можно найти кучу роликов, где люди издеваются над алюминиевыми предметами, ведь по какой-то причине галлий не очень ладит с алюминием и способен превратить баночку Pepsi или компьютерный радиатор в бумажную салфетку. Лично мы бы придумали более эпичный розыгрыш, например, капнули бы немного этой хрени на соседский велосипед, перед тем как сосед решит немного прокатиться вечерком по парковой зоне, но, возможно, именно поэтому закон запрещает нам приближаться к химикатам.
2. Газ, способный удерживать предметы
«Это вещество тяжелее воздуха.» Мда… Согласись, эта фраза способна вызвать легкий зевок. Давай по-новой? «Ты только посмотри, на что способно это дерьмо под названием гексафторид серы!»
Хоть раз в своей жизни ты баловался шариками с гелием, и в итоге твой голос походил на писк бурундука, особенно забавно говорить таким голосом грязные ругательства. Но не только гелий может изменять голос. Гексафторид серы можно назвать злобным братом-близнецом гелия. Вдохни шарик, наполненный этим газом, и ты заговоришь так, словно помимо глистов в тебе поселился еще и демон.
Полюбуйся на Нила Патрика Харриса
Причина подобного преображения заключается в том, что гексафторид серы в несколько раз тяжелее воздуха, в результате чего он понижает частоту любого звука, проходящего через него. По такому же принципу, но наоборот, работает гелий. А теперь представь, что ты можешь вытворить с этим газом, обладая такой ценной информацией. Например, если вылить газ в стеклянный контейнер, то он пройдёт через воздух и осядет на дне. Этот газ, как и вода, способен выдержать вес менее плотных предметов. Например, лодку из алюминия, которая будет парить в воздухе, как по волшебству.
Можешь глянуть и этот ролик, где парень берет стакан, черпает что-то невидимое глазу, на чем держится лодка, и выливает это нечто прямо на лодку. Лодка тонет.
3. Вещество, не переносящее воду
Звучит не так круто, как выглядит на деле. Видишь эту зеленую массу? Это не яблочное желе и не прямоугольный леденец, а вода на стеклянной плитке, окрашенная в зеленый цвет. Даже если ты размажешь ее по поверхности, она все равно примет свою изначальную форму. Это происходит, потому что края плиты обработаны гидрофобным материалом, с помощью которого поверхность буквально отталкивает капли. В середине плита не обработана, поэтому вся жидкость стекает туда. Если ты капнешь каплю воды на обработанную поверхность, то можешь воочию увидеть, как она удирает в сторону, где отсутствует гидрофобный материал.
Если намажешь этой дрянью палец и окунешь его в воду, он останется абсолютно сухим, а вокруг него образуется своеобразная пленка, по текстуре похожая на крошечный гандон, при этом вода в отчаянии убежит прочь от твоего пальца.
И еще один занимательный опыт можешь посмотреть на видео ниже: ложку опускают в воду, насыпают в нее песок, он превращается в нечто отвратное, похожее на кишки, а после ложку достают с идеально сухим песком.
4. Горячий лед
Горячий лёд, или ацетат натрия – это жидкость, которая затвердевает при малейшей стрессовой ситуации. Дотронься до него пальцем или крикни пару бранных слов, как вещество из жидкого состояния преобразуется в субстанцию из твердых ледяных кристаллов. Например, ты можешь вылить эту штуковину в контейнер, дотронуться до него пальцем или членом, смотря как тебе больше нравится, а после наблюдать, как белые кристаллы хаотично распределяются по всей поверхности, чтобы через несколько секунд превратиться в лед.
Ацетат натрия очень медленно остывает и способен сохранять жидкое состояние даже при минусовой температуре. Но если его «разбудить», то он понимает, что «проспал» все на свете, и начинает заниматься очень активной деятельностью, а именно, его частицы начинают быстро затвердевать.
5. Металл, обладающий памятью
Теперь полюбуйся на металл, который имеет память. Посмотрев ролик, размещенный ниже, ты увидишь, как небольшой моток проволоки, на первый взгляд самой обычной, при контакте с кипятком образует слово HOT ( «горячий»). Это нитинол, сплав титана и никеля, который способен принимать свою изначальную форму даже после деформации до неузнаваемости. Всё, что нужно, это вылить на него кипяток, и не важно, как сильно запутан и скручен провод, «запоминающий металл» приобретёт первоначальную форму. Как говорится, просто добавь воды. Современные инженеры на данном этапе изучения этого материала додумались создать лишь очки с оправой из нитинола. Интересно, доживем ли мы до момента, когда из него начнут делать машины.
6. Взрывной порошок
Йодистый азот немного похож на кучу грязи или порцию огородных удобрений, но только не вздумай использовать эту штуку на своем заднем дворе. Только если ты не любитель суперского хардкора. Эта субстанция крайне нестабильна, и даже легкого дуновения ветерка хватит, чтобы устроить мощный взрыв. Йодистый азот не нашел широкого практического применения, кроме как в сфере больных розыгрышей. После взрыва этот порошок оставляет красивое фиолетовое облачко.
Кроме того, в первом сезоне сериала «Во все тяжкие» его использует Уолт, чтобы взорвать притон наркодилера. Единственная промашка режиссера заключается в том, что Уолтер погиб, даже не дойдя до места, с подобным ядреным веществом в сумке.
Галлий - металл, который плавится в руке
если достать галлия, можно в маркетах устраивать веселье - по крупинке оставлять на алюминиевых баночках с пивом-колой. а если банки большие, типа бочек - то вообще будет весело! галлий растворяет алюминий и происходит бадабум! все в коле-пиве, весело и сладко!
а плавать в нем можно?=)
А где его можно приобрести? о.о
А что будет если магнит поднести?
фигня это, вот цыганий это реальня тема!
а если его пустить по вене , то метал будет у тебя в крови , ффффак йееаа \m/
Напомнило видос. Мб тот чел с Ga баловался?
что с голосом? он хорошенько пыхнул перед съемкой?)
просто было в тексте
очень красиво очень красиво очень красиво очень красиво очень красиво
Если он используется в мобильных телефонах. Получается что в жару, в нем все расплавиться?
Перепутал галий с ртутью :D
гхААлий, метхААллааа, тхелефооооне. Интонация как у гомосека

Галлий в гифках
Температура плавления галлия всего 29,8°C - он легко плавится от тепла рук

В отличие от ртути, жидкий галлий хорошо смачивает поверхность и оставляет следы (однако совершенно не токсичен)

Галлиевые капельки в воде из-за высокого поверхностного натяжения не сразу слипаются

Если в жидкий галлий поместить твердый кусочек, то через некоторое время вырастет красивый кристалл

Галлий, как типичный металл реагирует с кислотами, образуя бесцветные растворимые соли

Жидкий галлий способен сплавляться с некоторым металлами (например с алюминием). По итогу деталь, содержащая галлий становится чрезвычайно хрупкой

Жидкий галлий при контакте с алюминием ведет себя подобно ртути - образуется кашеподобная амальгама

Алюминий в амальгаме будет взаимодействовать с водой, поскольку галлий препятствует образованию защитной оксидной пленки

Опыт "Сердце" (галлиевая капля заряжается при контакте с раствором электролита (дихромат калия + серная кислота), вследствие чего уменьшается её поверхностное натяжение и она, слегка сплющиваясь под действием силы тяжести, начинает совершать колебания. Аналогичное происходит и с каплей ртути)
Читайте также:
