Какой самый сильный металл в таблице менделеева
Обновлено: 06.07.2024

Можете ли вы представить, что произошло, если бы наши предки не обнаружили важные металлы, такие как серебро, золото, медь и железо? Наверное, мы бы до сих пор жили в хижинах, используя камень в качестве основного инструмента. Именно крепость металла сыграла важную роль в формировании нашего прошлого и теперь работают как основа, на которой мы строим будущее.
Некоторые из них очень мягкие и буквально тают в руках, как самый активный металл в мире. Другие - настолько твердые, что их невозможно согнуть, поцарапать или сломать без применения спецсредств.
А если вам интересно, какие металлы самые твердые и прочные в мире, мы ответим на этот вопрос, учитывая различные оценки относительной твердости материалов (шкала Мооса, метод Бринелля), а также такие параметры как:
- Модуль Юнга: учитывает эластичность элемента при растяжении, то есть способность объекта к сопротивлению при упругой деформации.
- Предел текучести: определяет максимальный предел прочности материала, после которого он начинает проявлять пластичное поведение.
- Предел прочности при растяжении: предельное механическое напряжение, после которого материал начинает разрушаться.
10. Тантал

У этого металла сразу три достоинства: он прочный, плотный и очень устойчив к коррозии. Кроме того, этот элемент относится к группе тугоплавких металлов, таких как вольфрам. Чтобы расплавить тантал вам придется развести огонь температурой 3 017 °C.
Тантал в основном используется в секторе электроники для производства долговечных, сверхмощных конденсаторов для телефонов, домашних компьютеров, камер и даже для электронных устройств в автомобилях.
9. Бериллий

А вот к этому металлическому красавцу лучше не приближаться без средств защиты. Потому что бериллий высокотоксичен, и обладает канцерогенным и аллергическим действием. Если вдыхать воздух, содержащий пыль или пары бериллия, то возникнет заболевание бериллиоз, поражающее легкие.
Однако бериллий несет не только вред, но и благо. Например, добавьте всего 0,5 % бериллия в сталь и получите пружины, которые будут упругими даже если довести их до температуры красного каления. Они выдерживают миллиарды циклов нагрузки.
Бериллий применяют в аэрокосмической промышленности для создания тепловых экранов и систем наведения, для создания огнеупорных материалов. И даже вакуумная труба Большого Адронного Коллайдера сделана из бериллия.
8. Уран

Это естественное радиоактивное вещество очень широко распространено в земной коре, но сконцентрировано в определенных твердых скальных образованиях.
Один из самых твердых металлов в мире имеет два коммерчески значимых применения - ядерное оружие и ядерные реакторы. Таким образом, конечной продукцией урановой промышленности являются бомбы и радиоактивные отходы.
7. Железо и сталь

Как чистое вещество железо не такое твердое по сравнению с другими участниками рейтинга. Но из-за минимальных затрат на добычу оно часто комбинируется с другими элементами для производства стали.
Сталь - это очень прочный сплав из железа и других элементов, таких как углерод. Это наиболее часто используемый материал в строительстве, машиностроении и других отраслях промышленности. И даже если вы не имеете к ним никакого отношения, то все равно используете сталь каждый раз, когда режете продукты ножом (если он, конечно, не керамический).
6. Титан

Титан - это практически синоним прочности. Он обладает впечатляющей удельной прочностью (30-35 км), что почти вдвое выше, чем аналогичная характеристика легированных сталей.
Будучи тугоплавким металлом, титан обладает высокой устойчивостью к нагреву и истиранию, поэтому является одним из самых популярным сплавов. Например, он может быть легирован железом и углеродом.
Если вам нужна очень твердая и при этом очень легкая конструкция, то лучше чем титан металла не найти. Это делает его выбором номер один для создания различных деталей в авиа- и ракетостроении и судостроении.
5. Рений

Это очень редкий и дорогой металл, который хотя и встречается в природе в чистом виде, обычно идет «довеском»-примесью к молибдениту.
Если бы костюм Железного человека был сделан из рения, он мог бы выдержать температуру в 2000 ° C без потери прочности. О том, что стало бы с самим Железным человеком внутри костюма после такого «фаер-шоу» мы умолчим.
Россия - третья страна в мире по природным запасам рения. Этот металл используется в нефтехимической промышленности, электронике и электротехнике, а также для создания двигателей самолетов и ракет.
4. Хром

По шкале Мооса, которая измеряет устойчивость химических элементов к царапинам, хром находится в пятерке лучших, уступая лишь бору, алмазу и вольфраму.
Хром ценится за высокую коррозионную стойкость и твердость. С ним легче обращаться, чем с металлами платиновой группы, к тому же он более распространен, поэтому хром является популярным элементом, используемым в сплавах, таких, как нержавеющая сталь.
А еще один из прочнейших металлов на Земле используется при создании диетических добавок. Конечно, вы будете принимать внутрь не чистый хром, а его пищевое соединение с другими веществами (например, пиколинат хрома).
3. Иридий

Как и его «собрат» осмий, иридий относится к металлам платиновой группы, и по внешнему виду напоминает платину. Он очень твердый и тугоплавкий. Чтобы расплавить иридий, вам придется развести костер температурой выше 2000 °C.
Иридий считается одним из самых тяжелых металлов на Земле, а также одним из самых устойчивых к коррозии элементов.
2. Осмий

Этот «крепкий орешек» в мире металлов относится к платиновой группе и обладает высокой плотностью. Фактически это самый плотный природный элемент на Земле (22,61 г/см3). По этой же причине осмий не плавится до 3033 ° C.
Когда он легирован другими металлами платиновой группы (такими как иридий, платина и палладий), он может использоваться во многих различных областях, где необходимы твердость и долговечность. Например, для создания емкостей для хранения ядерных отходов.
1. Вольфрам

Самый прочный металл, который только есть в природе. Этот редкий химический элемент также самый тугоплавкий из металлов (3422 ° C).
Впервые он был обнаружен в форме кислоты (триоксида вольфрама) в 1781 году шведским химиком Карлом Шееле. Дальнейшие исследования привели двух испанских ученых - Хуана Хосе и Фаусто д'Эльхуяра - к открытию кислоты из минерала вольфрамита, из которого они впоследствии изолировали вольфрам с помощью древесного угля.
Помимо широкого применения в лампах накаливания, способность вольфрама работать в условиях сильной жары делает его одним из наиболее привлекательных элементов для оружейной промышленности. Во время Второй мировой войны этот металл сыграл важную роль в инициировании экономических и политических отношений между европейскими странами.
Вольфрам также используется для изготовления твердых сплавов, а в аэрокосмической промышленности - для изготовления ракетных сопел.
Таблица предела прочности металлов
| Металл | Обозначение | Предел прочности, МПа |
|---|---|---|
| Свинец | Pb | 18 |
| Олово | Sn | 20 |
| Кадмий | Cd | 62 |
| Алюминий | Al | 80 |
| Бериллий | Be | 140 |
| Магний | Mg | 170 |
| Медь | Cu | 220 |
| Кобальт | Co | 240 |
| Железо | Fe | 250 |
| Ниобий | Nb | 340 |
| Никель | Ni | 400 |
| Титан | Ti | 600 |
| Молибден | Mo | 700 |
| Цирконий | Zr | 950 |
| Вольфрам | W | 1200 |
Сплавы против металлов

Сплавы представляют собой комбинации металлов, и основной причиной их создания является получение более прочного материала. Наиболее важным сплавом является сталь, которая представляет собой комбинацию железа и углерода.
Чем выше прочность сплава - тем лучше. И обычная сталь тут не является «чемпионом». Особенно перспективными представляются металлургам сплавы на основе ванадиевой стали: несколько компаний выпускают варианты с пределом прочности до 5205 МПа.
А самым прочным и твердым из биосовместимых материалов на данный момент является сплав титана с золотом β-Ti3Au.
10 самых тяжелых металлов в мире по плотности
Мы все любим металлы. Машины, велосипеды, кухонная техника, банки для напитков и множество других вещей - все они состоят из металла. Металл - краеугольный камень нашей жизни. Но иногда он бывает очень тяжелым.
Когда мы говорим о тяжести того или иного метала, то обычно имеем в виде его плотность, то есть соотношение массы к занимаемому объёму.
Еще одним способом измерения «веса» металлов является их относительная атомная масса. Самыми тяжелыми металлами по относительной атомной массе являются плутоний и уран.
Если вы хотите узнать, какой металл самый тяжелый, если рассматривать его плотность, то мы рады вам помочь. Вот топ-10 самых тяжелых металлов на Земле с указанием их плотности на кубический см.
10. Тантал - 16,67 г/см³

Десятую строчку в рейтинге занимает синевато-серый, очень твердый металл со сверхвысокой температурой плавления. Несмотря на свою твердость он пластичен, как золото.
Тантал является важным компонентом во многих современных технологиях. В частности, он используется для производства конденсаторов, которые применяются в компьютерной технике и мобильных телефонах.
9. Уран - 19,05 г/см³

Это самый тяжелый элемент на Земле, если учитывать его атомную массу - 238,0289 г/моль. В чистом виде уран представляет собой серебристо-коричневый тяжелый металл, который почти вдвое плотнее свинца.
Как и плутоний, уран служит необходимым компонентом для создания ядерного оружия.
8. Вольфрам - 19,29 г/см³

Считается одним из самых плотных элементов в мире. В дополнение к своим исключительным свойствам (высокая теплопроводность и электропроводность, очень высокая стойкость к воздействию кислот и истиранию) вольфрам также отличается тремя уникальными свойствами:
- После углерода он имеет самую высокую температуру плавления - плюс 3422 ° C. А его температура кипения - плюс 5555 ° C, эта температура примерно сопоставима с температурой поверхности Солнца.
- Сопровождает оловянные руды, однако препятствует выплавке олова, переводя его в пену шлаков. За это и получил свое название, которое в переводе с немецкого означает «волчьи сливки».
- Вольфрам имеет самый низкий коэффициент линейного расширения при нагревании из всех металлов.
7. Золото - 19,29 г/см³

С давних времен люди покупают, продают и даже убивают за этот драгоценный металл. Да что люди, целые страны занимаются скупкой золота. Лидером государств с самыми крупными запасами золота на данный момент является Америка. И вряд ли наступит пора, когда в золоте не будет нужды.
Говорят, что деньги не растут на деревьях, но золото - растет! Небольшое количество золота можно найти в листьях эвкалипта, если тот находится на золотоносной почве.
6. Плутоний - 19,80 г/см³
Шестой самый тяжелый металл в мире - один из самых нужных компонентов для ядерных держав мира. А еще он - настоящий хамелеон в мире элементов. Плутоний демонстрирует красочное состояние окисления в водных растворах, при этом их цвет варьируется от светло-фиолетового и шоколадного до светло-оранжевого и зеленого. Цвет зависит от степени окисления плутония и солей кислот.
5. Нептуний - 20,47 г/см³

Этот металл с серебристым блеском, названный в честь планеты Нептун, был открыт химиком Эдвином Макмилланом и геохимиком Филиппом Абельсоном в 1940 году. Он используется для получения шестого номера в нашем списке, плутония.
4. Рений - 21,01 г/см³

Слово «Рений» происходит от латинского Rhenus, что означает «Рейн». Нетрудно догадаться, что этот металл был обнаружен в Германии. Честь его открытия принадлежит немецким химикам Иде и Вальтеру Ноддакам. Это последний из открытых элементов, у которого есть стабильный изотоп.
Из-за очень высокой температуры плавления рений (в виде сплавов с молибденом, вольфрамом и другими металлами) применяется для создания компонентов ракетной техники и авиации.
3. Платина - 21,40 г/см³

Один из самых драгоценных металлов в этом списке (кроме Осмия и Калифорния-252) используется в самых разных областях - от ювелирного дела до химической промышленности и космической техники. В России лидером по добыче платинового металла является ГМК «Норильский никель». В год в стране добывается около 25 тонн платины.
2. Осмий - 22,61 г/см³

Хрупкий и при этом крайне твердый металл редко используется в чистом виде. В основном его смешивают с другими плотными металлами, такими как платина, для создания очень сложного и дорогого хирургического оборудования.
Название «осмий» происходит от древнегреческого слова «запах». При растворении щелочного сплава осмиридия в жидкости появляется резкое амбре, похожее на запах хлора или подгнившей редьки.
И осмий и иридий (первое место рейтинга) весят примерно в два раза больше свинца (11,34 г/см³).
1. Иридий - 22,65 г/см³ – самый тяжелый металл

Этот металл с полным правом может претендовать на звание элемента с наибольшей плотностью. Однако споры о том, какой же металл тяжелее - иридий или осмий, все-таки ведутся. А все дело в том, что любая примесь может снизить плотность этих металлов, а их получение в чистом виде - очень тяжелая задача.
Теоретическая расчетная плотность иридия составляет 22,65 г/см³. Он почти втрое тяжелее, чем железо (7,8 г/см³). И почти вдвое тяжелее, чем самый тяжелый жидкий металл - ртуть (13,6 г/см³).

Как и осмий, иридий был открыт английским химиком Смитсоном Теннантом в начале 19 века. Любопытно, что Теннант нашел иридий вовсе не целенаправленно, а случайно. Он был обнаружен в примеси, оставшейся после растворения платины.
Иридий в основном используется в качестве отвердителя платиновых сплавов для оборудования, которое должно выдерживать высокие температуры. Он перерабатывается из платиновой руды и является побочным продуктом при добыче никеля.

Название «иридий» переводится с древнегреческого как «радуга». Это объясняется наличием в металле солей разнообразной окраски.
Самый тяжелый металл в периодической таблице Менделеева очень редко встречается в земных веществах. Поэтому его высокая концентрация в образцах породы - маркер их метеоритного происхождения. За год во всем мире добывают около 10 тысяч килограмм иридия. Крупнейший его поставщик - Южная Африка.
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
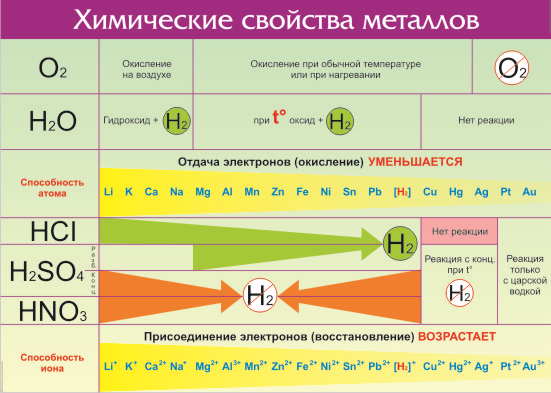
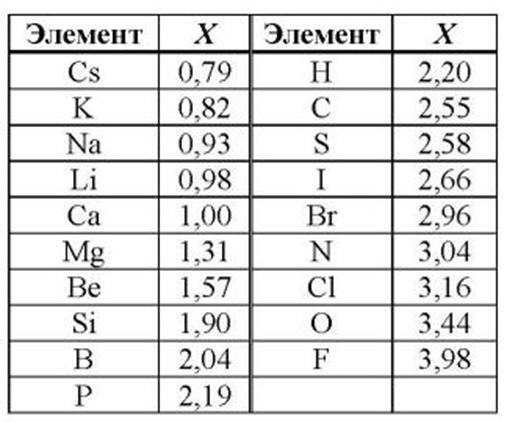
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в "строки и столбцы" - периоды и группы.
Период - ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 - называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов ("→" слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде "←" справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер - сверху вниз "↓". Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается - снизу вверх "↑". Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия - тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует - там нужно считать электроны "вручную", располагая их на электронных орбиталях.
- B5 - 1s 2 2s 2 2p 1
- Al13 - 1s 2 2s 2 2p 6 3s 2 3p 1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns 2 np 1 . Это будет работать для бора, внешний уровень которого 2s 2 2p 1 , алюминия - 3s 2 3p 1 , галия - 4s 2 4p 1 , индия - 5s 2 5p 1 и таллия - 6s 2 6p 1 . За "n" мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода - и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже :)

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных - только "вручную".
Длина связи
Длина связи - расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические - усиливаются (слева направо "→"). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические - ослабевают (сверху вниз "↓").

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны - у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера - самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева - металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные - возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные - ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые - убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF - самая слабая из этих кислот, а HI - самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные - усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные - ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные - с неметаллическими и кислотными. Так гораздо проще запомнить ;-)

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность - способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус "-".
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева - это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости "синонимичны" также понятия сродства к электрону - энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации - количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы - R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми "высшими" оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в "-" отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы - 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы - H2S, H2Se, H2Te, H2Po.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
