Каковы особенности строения металлов
Обновлено: 18.05.2024
Образовательная - рассмотреть положение металлов в системе элементов Д.И. Менделеева, познакомить обучающихся с основными физическими свойствами металлов, выяснить, чем они обусловлены; выявить закономерности проявления металлами физических свойств; ввести понятие о сплавах и их свойствах.
Развивающая - развивать теоретическое мышление обучающихся и их умение прогнозировать физические свойства металлов на основе их строения атома.
Воспитательная - способствовать развитию познавательного интереса обучающихся к изучению химии
Задачи урока:
- Обучающиеся должны изучить положение металлов в Периодической системе элементов,
- Выяснить особенности строения их атомов и кристаллов; физические свойства металлов; отличие свойств металлов от свойств их сплавов.
- Уметь применять полученные знания при выполнении заданий, упражнений по данной теме.
Тип урока: урок изучения нового материала.
Оборудование:
- коллекция металлов и сплавов; таблицы "Виды химической связи", "Типы кристаллических решеток" и "Общие физические свойства металлов",
- две стеклянные пластинки и вода для проведения опыта.
I. Организационный момент
(преподаватель знакомит обучающихся с темой урока, записанной на доске, планом проведения урока).
II. Новый материал
Преподаватель задает вопросы обучающимся :
1. Как изменяются в периодах периодической системы свойства химических элементов?
2. Как изменяются свойства химических элементов в главных подгруппах?
3. Где располагаются металлы в периодической системе?
Обучающиеся делают выводы:
- Металлами называют химические элементы и простые вещества.
- Металлы занимают левую нижнюю часть периодической системы. А, следовательно, их атомы имеют большие радиусы и, как правило, небольшое количество валентных электронов. Для их ионизации требуется относительно небольшая энергия. Возникающие положительные ионы металла удерживаются все вместе за счет притяжения ко всем свободно движущимся в металле электронам.
Преподаватель демонстрирует таблицу "Виды химической связи", задает вопрос : в чем сходство и различия между металлической связью и ковалентной? ?(сходство с ковалентной: валентные электроны находятся в общем пользовании, но в случае ковалентной в общем пользовании только двух атомов, а в случае металлической связи эти электроны связывают все атомы куска металла, создают "электронный газ".)
В чем сходство и различия между металлической и ионной связью? ( с ионной связью металлическая сходна наличием ионов, но в металлической положительные ионы удерживаются "электронным газом", а в ионной - положительными ионами)
Преподаватель демонстрирует таблицу "Типы кристаллических решеток":
Благодаря притяжению всех свободных электронов всеми положительными ионами металлическая связь очень прочна, поэтому для металлов характерны кристаллические решетки с плотной упаковкой ионов: гексагональная (цинк, магний), кубическая гранецентрированная (медь, серебро, алюминий) и менее плотная - кубическая объемноцентрированная (железо, натрий, барий).
Преподаватель: И так, металл - это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами.
Рассмотрите образцы металлов и назовите, какими общими физическими свойствами они обладают?
Обучающиеся называют: электропроводность, теплопроводность, металлический блеск, твердость, пластичность.
Преподаватель: Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
Обучающиеся делают вывод: причина в особенностях металлической связи, структуре кристаллов металлического типа.
Преподаватель: демонстрирует таблицу "Общие физические свойства металлов"
Преподаватель: Действительно, электрическая проводимость металлов объясняется движением свободных электронов. Почему при нагревании электрическая проводимость металлов уменьшается? Чем обусловлена теплопроводность, и как она изменяется при нагревании? (отвечать на вопросы помогает таблица).
Пластичность - способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов?
В этом нам поможет разобраться следующий опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они легко скользят друг по другу, но их трудно разъединить. Прослойка воды имитирует свободные электроны, а значит причина пластичности - также особое строение кристаллической решетки.
Металлический блеск также обусловлен особым строением металлов (благодаря свободным электронам металлы хорошо отражают световые лучи).
Преподаватель: Да, металлы обладают общими физическими свойствами, которые обусловлены их особым строением, но у разных металлов степень проявления каждого свойства различна. Так, лучшей электропроводностью обладает серебро, на втором месте - медь, а на третьем - золото.
Такие различия в проявлении физических свойств связаны с тем, как плотно упакованы ионы в кристаллической решетке металла, каковы их размеры и сколько валентных электронов у каждого атома обобществляется. Например, чем большее число атомов металла находиться в единице объема металла, тем большей плотностью он будет обладать. Наиболее плотная упаковка ионов в кристаллах гексагонального вида. Однако плотность вещества зависит не только от вида кристаллической решетки, но и от массы составляющих его ионов и от их радиусов. Поэтому наименьшей плотностью обладают щелочные металлы. Самый тяжелый из всех металлов - осмий.
Если металлы образуют кристаллы одного вида (например, щелочные металлы), то возрастание плотности по ряду от лития до цезия объясняется увеличением их атомных масс и масс образуемых ионов, т.к. массы возрастают в большей степени, чем атомные радиусы. Если металлы образуют кристаллы разного вида, то закономерность более сложная, и ее описанием занимается больше физика, чем химия.
В зависимости от плотности металлы принято делить на легкие (их плотность менее 5 г/см 3 ) и тяжелые (их плотность более 5 г/см 3 ). Так у алюминия плотность - 2, 7 г/см 3 - металл легкий.
Пластичность металлов также зависит от вида кристалла и от количества связывающих электронов, от размеров ионов.
Самый пластичный - золото. Кусочек золота величиной со спичечную головку можно расплющить в просвечивающий голубовато-зеленым светом лист площадью 50 квадратных метров. Образец золота весом 1г можно протянуть в проволоку длиной 2 км. Исстари на Руси выделывали "сусальное золото": сначала его прокатывали в вальцах до толщины листа писчей бумаги, затем укладывали между тонкими пленками, снятыми со слепой кишки коровы и прокатывали на наковальне деревянными молоточками. Повторяя эту операцию неоднократно, получали листочки золота толщиной всего в десятую долю микрона, т.е. 500 атомов. "Сусальное золото" шло на покрытие деревянных предметов, кожи и т.п.
Самые хрупкие металлы V, VI, VII групп. У них от 5 до 7 валентных электронов, следовательно, очень крепкая связь ионов между собой, что препятствует их скольжению друг относительно друга, снижает пластичность. Этим же объясняется их тугоплавкость и твердость.
Чем меньше количество свободных электронов, чем больше размеры ионов, чем слабее связи ионов, тем мягче металлы. Самые мягкие - щелочные металлы, самый твердый - хром.
Температуры плавления металлов изменяются в очень широких пределах: от минус 39°С до 3410 у вольфрама. Ртуть единственный жидкий при обычных условиях металл.
Следует еще раз обратить внимание , что степень проявления физических свойств у разных металлов зависит не только от количества валентных электронов, но и от вида кристаллической решетки, размеров атомов и ионов, т.е. причины проявления металлами физических свойств многообразны.
Самостоятельная работа обучающихся:
1.Заполните таблицу: «Физические свойства металлов»
используя таблицу приложения: «Справочные данные о физических свойствах металлов»
Конспект лекции по теме "Металлы - особенности строения атомов, способы получения и свойства" дисциплины ОУД.10 Химия, специальности Фармация, СПО
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s -элементы I и II групп (исключение — водород), все d - и f - элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
♦ небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
♦ малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
♦ сравнительно слабая связь валентных электронов с ядром;
♦ низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. м еталлы - восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Me n + + пе - = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
2. Способы получения металлов
Пирометаллургия — восстановление безводных соединений при высокой температуре
С или СО (карботермия)
Сульфиды предварительно обжигают:
2 = 2 ZnO + 2 S 02
ZnO + С = Zn + 2СО
Fe, Cu, Pb, Sn, Cd, Zn
Mn, Cr, W, Mo, Ti, V
H 2 (водородотермия)
Оксиды активных металлов (МgО, СаО, А1203 и др.) водородом не восстанавливаются
Cu, Ni, W, Fe, Mo, Cd, Pb
Электрометаллургия – восстановление электрическим током
2 1
электролиз 2 Na + Cl 2
Щелочные металлы, Be , Mg , Ca (из расплавленных хлоридов), Al – из расплавленного оксида
К Ni 2+ + 2е - = Ni 2
А 2Н2О - 4е - = O 2 + 4Н + 1
4 + 2Н2О электролиз 2 Ni + О2 + Н2 SO 4
Гидрометаллургия – восстановление из растворов солей
Металл, входящий в состав руды, переводят в раствор, затем восстанавливают более активным металлом:
Задания для самостоятельной работы
1. Атому магния в степени окисления +2 соответствует электронная конфигурация:
а ) 1s 2 2s 2 2 р 6 3s 2 3 р 6 ; в ) 1s 2 2s 2 2 р 4 ;
б) 1 s 2 2 s 2 2р 6 ; г ) 1 s 2 2 s 2 2р 6 3 s 2 ;
2. При частичном восстановлении водородом 30 г оксида кобальта. В получили смесь оксида и металла массой 26,8 г. Определите количество вещества водорода, вступившего в реакцию, и массовую долю кобальта в полученной смеси.
3. При электролизе раствора сульфата меди ( II ) в растворе образовалась кислота (около анода), на нейтрализацию которой затрачен раствор объемом 16 см (р = 1,05 г/см 3 ) с массовой долей гидроксида калия 6%. Вычислите массу меди, которая выделилась на катоде.
4. Для восстановления марганца из оксида марганца(1\/) путем алюмотермии было смешано 10,8 г алюминия и 26,2 г оксида. Определите, какое из исходных веществ осталось и какова его масса.
3. Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1). Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блеск и непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см 3 ): Na , Са , Mg , Al , Ti — и тяжелые (плотность больше 5 г/см 3 ): Zn , Cr , Sn , Mn , Ni , С u , Ag , Pb , Hg , Аи, W , Os - самый тяжелый ;
2). по значению температуры плавления — на легкоплавкие ( t пл < 1000 °С): Hg , Na , Sn , Pb , Zn , Mg , Al , Ca , Ag — и тугоплавкие ( t пл > 1000 ° C ): Au , Cu , Mn , Ni , Fe , Ti , Cr , Os , W - самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей ( Fe , Со, Ni );
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях ( Al , Cr , Ti );
в) диамагнитные — не притягиваются к магниту ( Sn , С u , Bi ).
4. Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me - пе - = Me п+ (окисление)
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
1). Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
Основной продукт окисления натрия — пероксид:
При горении других щелочных металлов образуются супероксиды, например:
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
На реакции пероксида натрия с оксидом углерода (1 V ) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
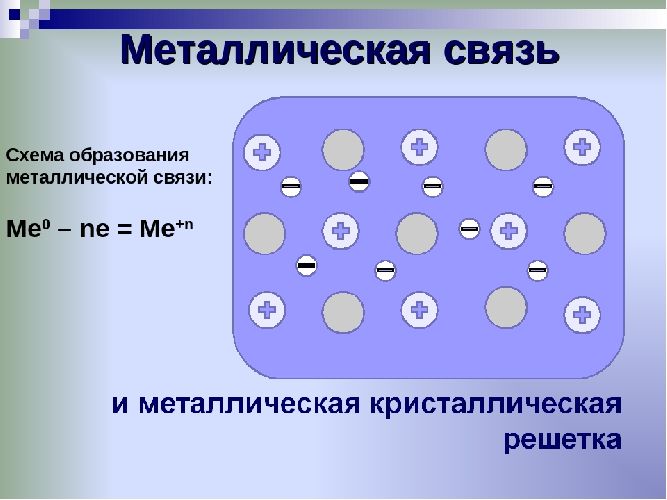
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
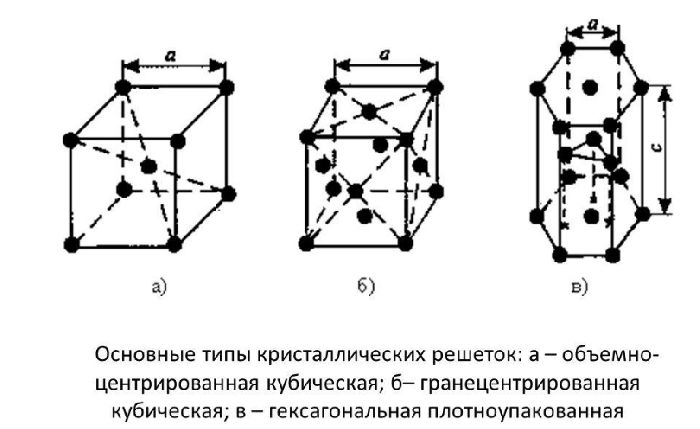
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
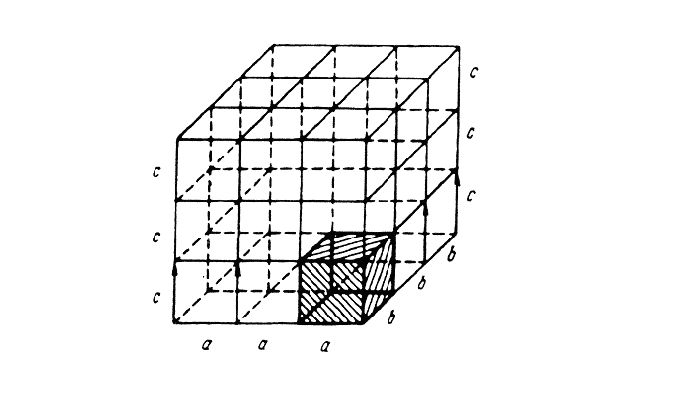
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Физические свойства металлов

Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства
Особенности
Примеры
Применение
Способность отражать солнечный свет
Наиболее блестящими металлами являются Hg, Ag, Pd
Лёгкие – имеют плотность меньше 5 г/см 3
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см 3
Изготовление облицовки, деталей самолётов
Тяжёлые – имеют плотность больше 5 г/см 3
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см 3
Использование в сплавах
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу)
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn
Формовка, сгибание труб, изготовление проволоки
Мягкие – режутся ножом
Изготовление мыла, стекла, удобрений
Твёрдые – сравнимы по твёрдости с алмазом
Самый твёрдый – хром, режет стекло
Изготовление несущих конструкций
Легкоплавкие – температура плавления ниже 1000°С
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C)
Производство радиотехники, жести
Тугоплавкие – температура плавления выше 1000°С
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С)
Изготовление ламп накаливания
Способность передавать тепло другим телам
Лучше всего проводят ток и тепло Ag, Cu, Au, Al
Приготовление пищи в металлической посуде
Способность проводить электрический ток за счёт свободных электронов
Передача электричества по проводам
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Читайте также:
