Катодное покрытие металла это
Обновлено: 19.05.2024
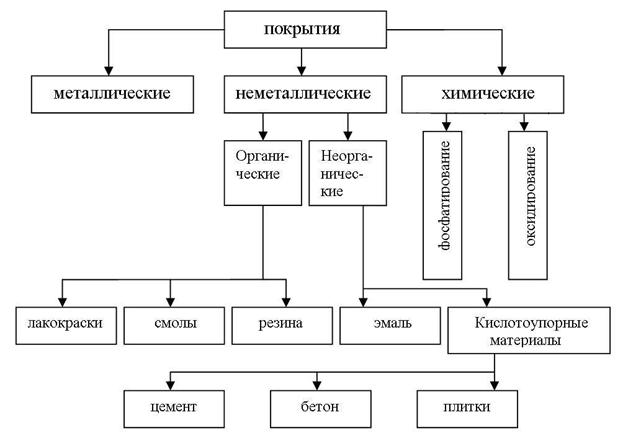
Изоляцию защищаемого металла от окружающей среды производят, используя различные покрытия (рис. 10), которые либо наносятся на поверхность металла (металлические и неметаллические), либо образуются при химической обработке поверхности (химические покрытия).
Металлические покрытия слоем более химически стойкого металла являются одним из наиболее распространенных способов защиты металлов от коррозии.
Способы нанесения металлических покрытий. В зависимости от способа получения металлического покрытия различают: 1) гальванические покрытия, 2) горячие покрытия, 3) металлизацию, 4) контактные покрытия.
Получение гальванических покрытий происходит в процессе электролиза. Покрытия получаются наиболее равномерными, что улучшает стойкость против коррозии. Используя гальванические покрытия, можно улучшить декоративные качества изделия.
Издавна известны горячее лужение и цинкование стали. Например, при горячем цинковании стальное изделие погружают в ванну с расплавленным цинком. После охлаждения цинк кристаллизуется на поверхности стального изделия красивыми узорами.
 |
| Рис. 10. Защитные покрытия |
Метод металлизации используют с целью экономии металла. Распыление расплавленного металла на защищаемую поверхность производят с помощью струи сжатого воздуха из распыляющего устройства. Этот метод позволяет защищать от коррозии крупногабаритные изделия.
Контактные покрытия получаются в ходе химических реакций в растворе солей на поверхности защищаемого металла,
например:
Железо, как более активный металл, восстанавливает ионы меди из раствора. Однако использование этого метода не гарантирует надежной защиты, так как покрытия получаются неплотные, неравномерные.
Анодные и катодные покрытия. Это деление основано на том, как ведут себя металлические покрытия при электрохимической коррозии.
К катодным относятся покрытия, выполненные из тех металлов, электродные потенциалы которых имеют более положительное значение, чем у защищаемого металла, например, медь, никель, серебро. При повреждении покрытия возникает гальванопара, в которой основной материал является анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород. Поэтому катодные покрытия, обеспечивающие хорошую защиту при газовой коррозии, ненадежны в электропроводящих средах, так как повреждение покрытия приводит к усиленной коррозии.
Например, лужение железных изделий заключается в нанесении слоя малоактивного, и потому устойчивого к коррозии олова. При повреждении покрытия образуется гальванопара:
Стандартный электродный потенциал железа Е 0 Fe 2+ /Fe= – 0,44 B, олова Е 0 Sn 2+ /Sn = – 0,136 B. Роль анода в данной коррозионной гальванопаре играет железо как более электроотрицательный (более активный) металл, а роль катода — олово. В процессе работы гальванопары железо окисляется, а на олове (на катоде) в кислой среде происходит восстановление ионов водорода из раствора:
Анод: Fe – 2ē = Fe 2+ (окисление);
Катод: 2H + + 2ē = H2 (восстановление).
Суммарное уравнение: Fe + 2H + = Fe 2+ +H2.
Продукт коррозии: FeCl2.
Чтобы удостовериться в протекании коррозии лужёного железа по указанной схеме, в раствор добавляют гексацианоферрат (III) калия K3[Fe(CN)6]. Это характерный реактив для обнаружения ионов Fe 2+ , с которыми гексацианоферрат-ион образует окрашенное в темно-синий цвет комплексное соединение (тривиальное название турнбулева синь):
В случае нарушения покрытия в месте повреждения появляется темно-синее окрашивание, свидетельствующее, что в растворе в результате коррозии появляются ионы Fe 2+ , а значит, коррозии подвергается железо, а не олово.
Анодные покрытия изготавливаются из металлов, Е 0 которых имеют более положительное значение, чем у защищаемого металла, например, цинк на железе. В этом случае основной металл является катодом и не корродирует до тех пор, пока не окислится весь цинк. Таким образом, слой цинка работает сначала как изолирующее покрытие, а при повреждении еще и как протектор.
Стандартный электродный потенциал железа Е 0 Fe 2+ /Fe= – 0,44 B, олова Е 0 Zn 2+ /Zn = – 0,76 B. Роль анода выполняет цинк, как более электроотрицательный металл, роль катода — железо.
В кислой среде образуется гальванопара:
Анод: Zn – 2ē = Zn 2+ (окисление);
Суммарное уравнение: Zn + 2H + = Zn 2+ +H2.
Продукт коррозии: ZnCl2.
Неметаллические покрытия могут быть по своей природе как 1) неорганическими, так и 2) органическими. Защитное действие этих покрытий сводится, в основном, к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора, кислотоупорные материалы (цемент, бетон, плитки) и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Химические покрытия получают в ходе процессов фосфатирования и оксидирования (для второго процесса часто используют термин пассивирование) защищаемой поверхности металла.
Перед окрашиванием железных предметов их подвергают фосфатированию — обработке кислыми растворами солей фосфорной кислоты, например дигидрофосфатов железа (II) и марганца (II). В результате окисления железа на его поверхности появляется прочно с ним связанная пористая пленка фосфата железа (III), являющаяся хорошим грунтом для масляных красок.
Оксидирование металлов заключается в создании на поверхности плотных пленок их оксидов, что осуществляется 1) химическим или 2) электрохимическим путем.
В случае химической обработки очищенную от продуктов коррозии и обезжиренную деталь погружают на определенное время враствор окислителя, который вызывает пассивацию металла за счет образования на поверхности металла слоя продуктов окисления (пассивной плёнки)Так, железо пассивируется серной кислотой, если её концентрация превышает 75%. Также, используя способ химического оксидирования, проводят воронение стали, для чего стальной предмет выдерживают в растворе (г/л): 50 NaNO3, 200 NaNO2, NaOH в течение 90 мин. Затем изделие подвергается термической обработке при температуре 140°С.
В случае электрохимической обработки металл помещают в окислительный раствор и для интенсификации его окисления подключают к положительному полюсу (аноду) источника тока. Так, например, получают оксидированный (также используют термин анодированный) алюминий.
Катодное покрытие

Катодное покрытие относится к электрохимическим методам защиты металла и находит широкое применение в различных отраслях: от газо- и нефетпроводов до корабельного и автомобильного производства.
Существует несколько технологий нанесения катодного покрытия в зависимости от объекта защиты и условий его эксплуатации. В нашей статье мы расскажем о них, поговорим о сферах применения катодных покрытий и разберемся в устройстве специальных станций для их нанесения.
Понятие и способы нанесения катодных покрытий
Коррозия всех типов – настоящий бич изделий, как из железа, так и из иных металлов (например, меди). Катодное покрытие – это универсальный, наиболее дешевый и эффективный метод электрохимической защиты таких объектов. В основе принципа защиты лежит минимизация контакта защищаемого металлического изделия с агрессивной средой.
Достигается это путем наведения на поверхность изделия отрицательного электрического потенциала. Этот заряд взаимодействует с ионами окружающей среды, отталкивая их и тем самым оберегая от реакции саму металлическую поверхность.
Данный способ защиты был изобретен англичанином Гемфри Дэви еще на заре появления электро-магнитной теории поля (примерно 200 лет назад). Его доклады, переданные английскому правительству, достигли своей цели. На основании выводов, содержащихся в них, была проведена первая в мире успешная процедура электрохимической защиты крупного стального судна.
VT-metall предлагает услуги:
Лазерная резка металла Гибка металла Порошковая покраска металла Сварочные работы
Использование подстанции
Чтобы осуществить наведение электрического заряда на поверхность защищаемого изделия, его необходимо подключить к источнику электрического напряжения (сейчас для этого используют специальные подстанции с контролируемым уровнем разности потенциалов). В таком случае защищаемый объект – это катод, а сама подстанция – анод.
Через объект протекает электрический ток, поляризуя атомы и наводя на них перманентное электрическое поле. Активные частицы внешней среды, имеющие свой заряд (ионы), при этом будут отталкиваться от поверхности, не достигая атомов оберегаемого объекта и, как следствие, не вступая с ним в химическую реакцию окисления. В этом суть катодного покрытия.
Следует обратить внимание, что такая технология не требует никаких дорогостоящих материалов – всю работу выполняет только электрический ток. Поэтому этот способ защиты особенно востребован среди масштабных объектов – огромных как по своей массе, так и по площади поверхности, а также объектов повышенной ответственности (под последними подразумеваются мосты, фермы промышленных конструкций, оборудование дорог).
Недостатки технологии являются продолжением ее преимуществ: для того чтобы такую защиту организовать, нужно иметь источник электрической энергии. И если мы говорим об инфраструктурных проектах (трубопроводах или дорогах), то обеспечить наличие электропитания в таких случаях бывает довольно трудно, если не невозможно. Здесь прибегают к строительству автономных источников энергии.
Гальваническая поляризация
Этот способ представляет собой весьма оригинальный метод решения проблемы наличия автономного электропитания. Защищаемый объект в этом случае присоединяется к другому металлу, обладающему отрицательным зарядом (здесь металлы катодного покрытия – это алюминий, цинк или магний). Однако следует помнить, что благодаря так называемому стеканию заряда будет происходить постепенное размагничивание защищаемой поверхности, и источник электромагнитного поля будет разряжаться.
Чтобы максимально продлить работу системы, на защищаемый объект необходимо нанести дополнительный слой защитного покрытия. Описываемая технология весьма популярна в Америке, но не в России, где нет традиции наносить, к примеру, на трубопроводы какие-либо защитные слои (отчасти из-за огромной протяженности объектов).
Технология катодной поляризации
Катодная поляризация предусматривает использование наложенного тока. Здесь уже требуется внешний источник энергии или, как компромисс, внешний проводник. Ионизированная частица попадает под действие кулоновской силы притяжения к отрицательно заряженному защитному элементу. В результате «коррозийная» частица утилизируется на этом защитном элементе.

Минусом технологии является то, что эти элементы постепенно приходят в негодность, покрываясь ржавчиной. Они расходуются, приносятся в жертву для того, чтобы не корродировала защищаемая поверхность. Поэтому данная технология по-другому называется методом «жертвенного электрода».
Также необходимо учитывать фактор напряжения. Со временем расходуется не только электрод, но и стекает заряд, эффективность защиты падает еще больше. Для того чтобы максимально возможно сохранить функциональность системы, стараются минимизировать разницу уровня электрической мощности в контуре, в защищаемой поверхности и в жертвенном материале.
Сферы применения катодных покрытий
Для каких металлических изделий эффективно катодное покрытие от коррозии? Оно продуктивно для таких металлов, как:
- все виды черных сталей;
- цинк;
- олово;
- алюминий;
- титан;
- медь.
А теперь более подробно перечислим защищаемые таким способом объекты:
- металлические резервуары (особенно, для горюче-смазочных материалов);
- свайные фундаменты (а точнее, арматура для них, да и для всех массивных конструкций из бетона в целом);
- фундаменты и элементы конструкций для мостов и причалов;
- днища судов (и кораблей);
- классические нефте- и газопроводы, а также водопроводы.
Нюансы использования катодных покрытий для трубопроводов
Источниками больших аварий на трубопроводах, как правило, служат маленькие коррозии: трещины, микроразрывы, образование щелей и пр. Все это ведет к одному – к нарушению герметичности внутренней полости. Больше всего риску подвержены трубопроводы, расположенные под землей. И здесь дело совсем не в «сырости подземелья» и не в том, что трудно выявить дефект.

Массив земли является огромным проводником с уже давно наведенными и устоявшимися электрическими полями со своими электрическими потенциалами на разных участках.
Трубопровод проходит сквозь множество участков (электрических полей), в результате чего в нем создается перетекание заряженных частиц вследствие разности потенциалов – электролитическая диссоциация на микроуровнях. Ионы вступают в реакцию с металлом трубопровода – в результате образуется классическая ржавчина, то есть та самая коррозия.
Трубопровод – промышленный объект большой протяженности, а потому его катодные защитные покрытия должны отличаться надежностью и стабильной работой. Как правило, задействуются две стандартные схемы:
- метод катодной поляризации;
- создание внешних подстанций.
Для защиты металлических элементов трубопровода от коррозии его электрический потенциал должен быть уменьшен в сравнении с потенциалом земли и поддерживаться на этом уровне. При этом:
- современные трубы обладают потенциалом на уровне 0,8–0,9 вольт.
- у большинства грунтовых пород потенциал составляет от 0,5 до 0,6 вольт.
Таким образом, для обеспечения эффективной защиты нужно уменьшить потенциал трубы всего лишь на 0,3–0,4 вольта. И если все будет сделано правильно (а особое внимание нужно уделить корректному формированию контура), то скорость прироста ржавчины не превысит 1 мм в год.
Внешние подстанции – самый распространенный метод обеспечения питания системы электрохимической защиты для трубопроводных объектов. Но подстанция – это преобразователь, а вовсе не источник энергии, поэтому для ее запитки обычно используют параллельно проходящие ЛЭП с напряжением от 0,5 до 10 кВ.
Получается, что при укладке трубы нужно еще тянуть и линию электропередач, чтобы труба не разрушилась под землей через десяток лет. На больших расстояниях это становится слишком дорого, а потому в таких случаях прибегают к строительству локальных источников генерации.
Другой проблемой подстанций является то, что сами они становятся источниками наведенных электромагнитных полей большой напряженности. Это само по себе приводит к нарушению катодного покрытия, в частности, к «водородному растрескиванию» труб. Поэтому требуется производить очень аккуратную, а потому крайне дорогостоящую электрическую разводку, что также приводит к удорожанию всего объекта в целом.
Совокупность минусов подталкивает разработчиков к тому, чтобы использовать для поляризации технологию гальванических анодов. Но условием ее применения является относительно низкое удельное сопротивление земельных массивов, в которые укладывается трубопровод (не более 50 Ом на 1 м2). Если будет больше, то выполнить поляризацию станет практически невозможно.
Устройство станций катодной защиты
Станции катодной защиты (или СКЗ) состоят из:
- элемента анодного заземления;
- источника тока;
- пункта измерения и контроля (ПИКа);
- соединительных кабелей.
Под источником тока подразумевается подключение к сети или же к автономному генератору (также для этого задействуются аккумуляторы высокой емкости). Одна СКЗ может обслуживать сразу несколько ниток трубопровода, но так получается дороже в связи с увеличением длины требуемых проводов.

Соединение одной станции с несколькими нитками трубопровода осуществляется с помощью особых блоков, которые препятствуют формированию гальванических пар с сильной напряженностью электрического поля в глухих перемычках между трубами. Блоки как бы изолируют отдельные трубы друг от друга, а значит, можно сформировать потенциал для каждой из них в отдельности. Таким образом, вырабатывается максимально эффективная защита от коррозии.
Регулировка выходного напряжения на станциях осуществляется либо автоматически (с использованием тиристоров), либо вручную оператором. С развитием и удешевлением компьютерной техники предпочтение отдается системам, регулирующим напряжение на каждом участке самостоятельно.
Компьютер в данном случае отслеживает множество параметров: удельное сопротивление грунта, наличие блуждающих токов и прочие факторы, влияющие на общее качество антикоррозионной защиты. Ручная же настройка напряжения используется там, где уровень защитного тока и сопротивление контура неизменны.
Автоматическое регулирование осуществляется по одному из двух показателей:
- уровень тока защиты (гальваностатические преобразователи);
- электрический потенциал защищаемого объекта (потенциостатические преобразователи).
Катодные покрытия для автомобиля
Теперь несколько слов о защите от коррозии автомобильного транспорта. Несмотря на то, что транспортные средства в тысячи раз уступают по массивности таким объектам, как трубопроводы, они также изначально беззащитны перед ржавчиной. И источником коррозии может стать любая, даже совсем незаметная глазу царапина.

Для предохранения от ржавления в таких случаях чаще всего используется катодная технология. Она наиболее эффективна еще и потому, что кузова и другие части машин обычно покрываются защитными грунтовками, мастиками и прочими защитными слоями. Поэтому достаточно подать электрический потенциал на требуемую деталь или элемент кузова, чтобы на несколько порядков замедлить его ржавление.
Катодами в данном случае выступают пластины из проводника, накладываемые на наиболее подверженные коррозии элементы машины. Анодом же является основной корпус автомобиля. В такой системе «жертвенными электродами» становятся именно катодные пластины, а металл кузова остается целым.
Узлами автомобиля, которые нуждаются в защите по катодной технологии, являются:
- днище;
- арки задних колес;
- гнезда фар и подфарников;
- сочленения крыльев и элементов подвески;
- дверные пороги;
- пространство за щитками передних колес.
Для того чтобы собрать такую эффективную долгодействующую электрохимическую защиту, нужно приобрести и установить электронный модуль управления и набор пластин-протекторов. Модуль монтируется внутри кузова и подключается к бортовому питанию (причем он должен функционировать даже при выключенном двигателе). Пластины же закрепляются в указанных в перечне местах и соединяются проводами с модулем управления. При должной сноровке на монтаж системы уйдет не более 15 минут.
Рекомендуем статьи
Пластины («жертвенные электроды») бывают различных размеров – в зависимости от того, насколько сильна потенциальная коррозия в месте эксплуатации автотранспорта. Кроме того, на одну деталь или узел их можно устанавливать сразу несколько – длительность и эффективность защиты будет выше.
Другой пример катодного покрытия касается неподвижно стоящего автомобиля (например, в гараже). Здесь все можно сделать еще проще – достаточно подсоединить плюсовую клемму аккумулятора к… корпусу металлического гаража. Тогда кузов машины определенно будет иметь меньший потенциал (напряженность электрического поля). Однако во избежание образования искры следует в обязательном порядке использовать в цепи резистор.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Маркировка анодных и катодных покрытий. Надежная защита

Как известно, металлы под действием внешней среды могут покрываться ржавчиной. Поэтому их нужно защищать антикоррозионными оболочками. В статье мы хотели бы вам рассказать о том, что такое маркировка анодных и катодных покрытий. Получив эту информацию, вы сможете понять, есть ли на металле защитный слой. И чем он, собственно говоря, покрыт.
Способ получения металла и его функциональные свойства
Итак, существует много методов анодной и катодной защиты. Если говорить об анодировании, то к популярной его разновидности стоит отнести создание оксидной плёнки на металле или сплаве. Делается это через поляризацию металла в проводящей среде. А обозначается такое покрытие маркировкой Ан.Окс. Реечный потолок Бард_многослойное покрытие
Наряду с анодным окислением, конечно, есть и другие методы защиты от коррозии:
- во-первых, катодное восстановление – маркировка у покрытий, прошедших этот вид обработки, отсутствует;
- во-вторых, катодное распыление – Кат-рас.;
- в-третьих, горячий метод (нанесение защиты в ванне с расплавленным металлом) – гор;
- в-четвёртых, диффузия – диф;
- в-пятых, эмалирование – эм;
- а также много других способов.
Как определить, чистый металл перед вами или сплав? Очень просто! Металлы без примесей обозначаются так: А – алюминий, М – медь, Х – хром. А вот компоненты сплавов перечисляются через чёрточку. К примеру, сплав из золота, серебра и меди маркируется как Зл-Ср-М. А сплав, в чьём составе имеется олово и никель, записывается как О – Н.
Ещё есть маркировка металла, которая относится к его функциональным свойствам. Для анодно-оксидных оболочек это следующие обозначения:
- Ан.окс.э – электропроводные;
- Ан.окс.эиз – защита с электроизоляцией;
- Ан.окс.т – твёрдые.
Если на покрытии слово «Аноцвет», то что это означает? Данная запись свидетельствует о том, что это цветной металл. Получают его из ванны расплавленного защитного металла по той же технологии анодного окисления.
Маркировка анодных и катодных покрытий с обработкой
Надо сказать, что иногда в маркировке указывается и дополнительная обработка покрытий. Например, Ан.окс.нв и Ан.окс.нхр – это 2 разных вида анодирования. Первый вариант – это наполнение в воде. Второй – в растворах хроматах.
Вот, кстати, ещё несколько примеров:
- прп – пропитки в виде лаков, эмульсий и клеёв;
- прм – пропитка с помощью масла;
- тн – тонирование изделия;
- т – термическая обработка.
Допустим, маркировка металла содержит цвет. Что это означает? Это признак того, что покрытие – декоративное. К примеру, запись Ан.окс.хром гласит, что изделие получено в электролите с хромом. А Ан.окс.красный – это, соответственно, про покрытия, наполненные в растворах с красным красителем.
Невозможно не сказать и о том, как понять, что за фактура и текстура у покрытия. И есть ли у него блеск… Для того и другого тоже придумали обозначения. Ш – это шероховатое покрытие. С – слоистое. Зк – зеркальное. Б – блестящее.
Если не указана маркировка металла, как понять, есть ли на нём защита?
На вид это, разумеется, не просто. Здесь, как правило, требуются тесты и испытания. Однако мы можем рассказать вам о новых свойствах металлических предметов. После электрохимической обработки они:
- с одной стороны, перестают шелушиться;
- с другой стороны, не трескаются;
- не так интенсивно истираются;
- и, конечно же, не подвергаются коррозии.
Ах, да, вот ещё что… При анодном окислении изделия меняют свои размеры. За счёт защитного слоя их толщина, безусловно, растёт. Таким слоем защищают профиль у павильонов для бассейна.
Металлические защитные покрытия (анодные, катодные).
Неметаллические защитные покрытия. Электрохимические методы защиты от коррозии.
Методы защиты от коррозии можно объединить в следующие группы:
1) нанесение защитных покрытий и пленок;
2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз;
3) модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больший, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей среды. Поэтому свою роль они выполняют только при наличии полной сплошности. Если в катодном покрытии образуется щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла – анодным элементом. Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможных несплошностях катодных покрытий, их делают сравнительно большой толщины.
Анодные покрытия – это покрытия, выполненные из металла, у которого электродный потенциал меньше, чем у защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями являются цинк, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла от коррозионной среды. Они заключаются еще и в электрохимическом воздействии. В случае нарушения покрытия и образования коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие несплошности в анодных покрытиях не опасны.
Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение получает нанесение покрытий в вакууме.
Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих средах. К ним, в частности, относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средами, как, например, краски, лаки и т. п. Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия достаточно стойки к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и низкая стойкость в условиях резких перепадов температуры.
Одним из самых популярных способов защиты металла от коррозии является нанесение неметаллических составов. Это может быть пластик, керамика, каучук, битум, полиуретан, лакокрасочные составы и многое другое. Причем последние представляют собой наиболее широкий ассортимент и могут применяться в зависимости от условий среды, в которых будет использоваться изделие. Так выделяют лакокрасочные покрытия, устойчивые к действиям воды, атмосферы, химическим растворам и т. д.
К органическим покрытиям относятся разнообразные лакокрасочные материалы.
Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и уменьшение агрессивности среды, окружающей металлоконструкцию.
Катодная защита состоит в присоединении к защищаемой конструкции анода-протектора с более отрицательным электрохимическим потенциалом. Протектор (лат. protector – покровитель, защитник) и служит таким анодом, препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается.
Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал. Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе не происходило быстрого разрушения протектора.
Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или болтами. Катодную или протекторную защиту широко применяют при защите от морской и подземной коррозии металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого металла к отрицательному полюсу постоянного тока.
Для уменьшения агрессивности окружающей среды в нее вводят добавки, называемые ингибиторами коррозии, которые или способствуют пассивации металла, или значительно снижают скорость его коррозии. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава.
Различают анодные и катодные ингибиторы. В качестве анодных ингибиторов коррозии используют различные вещества, образующие нерастворимые соединения на анодных участках. Одним из таких пассиваторов является хромпик К2Сr207, вводимый в количестве 2 – 3 г/л в раствор охлаждающей жидкости.
Катодные ингибиторы тормозят катодный процесс. К их числу относятся различные травильные присадки, добавляемые в количестве 1 – 2 % в кислоты для снятия окалины без разрушения основного металла.
Летучие ингибиторы, такие как нитрат натрия NaNO2, применяют для пропитки бумаги, в которую заворачивают детали, подлежащие хранению или транспортировке. Испаряясь, они насыщают окружающее детали пространство, создавая защитную газовую среду. Летучие ингибиторы отличаются высокой эффективностью. Стальные изделия, завернутые в бумагу, обработанную NaNO2, в условиях относительной влажности 85 % не ржавеют в течение 5 лет. Преимуществом летучих ингибиторов является отказ от применения защитных покрытий, удобство расконсервации и постоянная готовность деталей к немедленному использованию без дополнительной обработки.
Суть электрохимической защиты
К готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.
Читайте также:
