Коэффициент поверхностного натяжения металлов
Обновлено: 17.05.2024
При рассмотрении свойств жидкости (а также и твердого тела) следует иметь в виду, что частицы жидкости, расположенные во внутренних и внешних ее слоях, испытывают разное воздействие со стороны окружающих их частиц, поэтому свойства поверхностных слоев вещества всегда несколько отличаются от свойств его внутренних слоев. При увеличении поверхности изобарный потенциал вещества возрастает, в результате чего увеличивается способность вещества к выделению из данной фазы в любом процессе, т. е. увеличиваются давление насыщенного пара, растворимость, химическая активность и пр. Избыток энергии в тонком слое вещества у поверхности соприкосновения веществ (тел) по сравнению с энергией вещества внутри тела называют поверхностной энергией. Полная поверхностная энергия складывается из работы, затрачиваемой на образование поверхности, т. е. работы, необходимой для преодоления сил межмолекулярного (или межатомного) сцепления (когезии 1 ) при перемещении молекул (атомов) из объема фазы в поверхностный слой, и теплового эффекта, связанного с этим процессом.
1 Сцепление (притяжение) молекул (атомов ионов) в физическом теле. (От лат. cohaesus— связанный, сцепленный.) Обусловлена межмолекулярным взаимодействием. Наиболее сильна в твердых телах и жидкостях.
Удельная свободная поверхностная энергия о для подвижных жидкостей тождественно равна поверхностному натяжению. Поверхностное натяжение — важнейшая термодинамическая характеристика поверхности раздела фаз (тел), определяемая как работа, которую необходимо затратить (при данной температуре) для образования единицы площади этой поверхности. В случае жидкой поверхности раздела поверхностное натяжение правомерно рассматривать также как силу, действующую на единицу длины контура поверхности, стремящуюся уменьшить поверхность до минимума при заданных объемах фаз. Поверхностное натяжение выражается в Дж/м 2 (энергия на единицу поверхности) или Н/м (сила на единицу длины).
Как известно, процессы, связанные с уменьшением потенциала, протекают самопроизвольно. Таким образом, процессы, связанные с уменьшением поверхностного натяжения, будут протекать самопроизвольно. Обычно термин «поверхностное натяжение» применяют при рассмотрении свойств жидкого или твердого тела на границе жидкость—газ или твердое тело—газ, т. е. тогда, когда можно практически пренебречь поверхностным натяжением второй фазы. Для случая поверхностного раздела жидкостей (например, металл—шлак) используют термин «межфазное натяжение». Если поверхностное натяжение одной жидкости 1 а другой 2, то в случае идеального взаимного смачивания в соответствии с правилом Антонова межфазное натяжение 1..2 1 - 2 В большинстве случаев межфазное натяжение определяется экспериментально.
При рассмотрении сталеплавильных процессов обычно имеют дело с растворами, в которых силы взаимодействия между их компонентами неодинаковы. Самопроизвольность протекания процессов, сопровождающаяся снижением энергии Гиббса системы (в данном случае связанным с уменьшением поверхностного натяжения), приведет к повышению в поверхностном слое концентрации того из компонентов, поступление которого понижает поверхностное натяжение.
Явление изменения содержания данного компонента в поверхностном слое по сравнению с содержанием его во внутренних слоя называют адсорбцией 1 . Вещества, снижающие поверхностное натяжение растворителя, т. е. вещества, концентрация которых в поверхностном слое выше, чем в растворе, называют поверхностно-активными. Любое вещество в виде компонента жидкого раствора или газа (пара) при соответствующих условиях может проявить поверхностную активность, т. е. адсорбироваться под действием межмолекулярных сил на той или иной поверхности, понижая энергию Гиббса. Однако поверхностно-активными обычно называют лишь те вещества, адсорбция которых уже при очень малой концентрации (десятые и сотые доли процента) приводит к резкому снижению поверхностного натяжения.
1 Поверхностное поглощение, поглощение поверхностным слоем тела или жидкости (адсорбента). Адсорбция —от лат. ad—на, при и sorbeo — поглощаю. Десорбция — явление, обратное адсорбции, т. е. удаление из жидкостей или твердых тел веществ, поглощенных при адсорбции или абсорбции.
В соответствии с уравнением адсорбции Гиббса
где Г—избыток растворенного вещества в поверхностном слое (обычно выражается в моль/см 2 ); Соб — объемная концентрация растворенного вещества в разбавленном растворе; (d /dСоб)t— изменение поверхностного натяжения раствора при изменении концентрации Соб (или активности ооб для неразбавленных растворов).
Если о уменьшается с повышением концентрации (d /dСоб < 0), то Г> 0 и концентрация растворенного вещества в поверхностном слое выше, чем в самом растворе (положительная адсорбция), и наоборот. Уравнение Гиббса — приближенное, так как предполагается, что обогащение растворенным веществом распространяется лишь на мономолекулярный поверхностный слой жидкости. Реально адсорбция распространяется на несколько таких слоев.
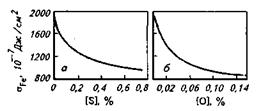
Рис. 8.4.Влияние серы (а) и кислорода (б) на поверхностное натяжение жидкого железа
Поверхностное натяжение 2 расплавов железа составляет ~ 1/8 Н/м, для сталеплавильных шлаков оно значительно ниже; например, для основных мартеновских шлаков поверхностное натяжение 0,4-0,5 Н/м, с повышением температуры оно несколько уменьшается.
Исследования показали, что такие элементы, как кислород, сера, бор, церий, кальций и др., являются по отношению к железу поверхностно-активными (рис. 8.4). Небольшие добавки поверхностно-активных элементов снижают Fe на 20-30 %. При этом содержание данных элементов в поверхностном слое (на границе металл-шлак, металл-под, жидкий металл-растущий кристалл при застывании металла) увеличивается.
Разность концентраций поверхностно-активных веществ в объеме и на поверхности может быть значительной. Например, объемная концентрация серы в металле 0,05 %, а на поверхности ее содержание достигает нескольких процентов. К особенностям поверхностных явлений относится то, что на поверхности проявляется действие даже ничтожных концентраций примесей (такое же содержание примесей, но равномерно распределенных в объеме вещества, не влияет существенно на объемные свойства).
2 Отношение силы, действующей на участок контура поверхности жидкости, к длине этого участка. Для увеличения поверхности жидкости требуется совершить работу против сил поверхностного натяжения. В результате для одной и той же жидкости поверхностное натяжение (Н/м) и удельная поверхностная энергия (Дж/см 2 ) численно равны и получили одно и то же обозначение а (см., например, на рис. 8.4: Ю- 7 Дж/см 2 =10- 3 Н/м).
Роль поверхностных явлений в металлургических процессах очень велика. Большинство металлургических процессов основано на гетерогенных химических реакциях и процессах, связанных с исчезновением одних и появлением других фаз. Поэтому необходимо учитывать, что и свойства, и составы пограничных слоев отличаются от свойств вещества в объеме. Процесс образования новой фазы начинается с того, что под действием флуктуации образуются термодинамически неустойчивые зародыши. Вероятность флуктуации определяется работой, необходимой для ее осуществления. Эта работа связана с наличием у зародыша большей удельной поверхности, поэтому зависит от поверхностного натяжения на границе зародыш—среда. Чем меньше поверхностное натяжение, тем меньшая работа требуется для образования зародыша, тем благоприятнее условия для образования (выделения) новой фазы.
При наличии поверхностно-активных примесей в металле облегчаются условия выделения (образования) новой фазы (образование в металле пузырей газа, неметаллических включений, кристаллов и т. д.). В то же время поверхностно-активные вещества, ад-сорбируясь на поверхности образующейся (новой) фазы, могут тормозить их рост. На этом свойстве поверхностно-активных примесей основаны, например, способы модифицирования чугуна и стали. Небольшая добавка модификатора, например бора, способствует получению мелкозернистой структуры металла.
Поверхностное натяжение железа при 1550 °С, т. е. при небольшом перегреве над линией ликвидуса, составляет -I860 мДж/м 2 . По мере увеличения перегрева (при повышении температуры) поверхностное натяжение большинства металлов линейно снижается:
где - —коэффициент, для железа равный 0,35мДж/(м 2 -К).
Рис. 8.5.Условия равновесия сил поверхностного натяжения в случае расплавления капли шлака на подложке из огнеупора
Поскольку многие процессы идут на границе раздела фаз, необходимо учитывать разную степень смачивания отдельных фаз. Практика показывает, что разделение фаз (например, шлака и металла) сопряжено с затруднениями, так как почти всегда на границе раздела проявляется взаимное притяжение фаз. Это явление называют адгезией 1 . Работу, которую необходимо совершить для разделения двух фаз (обычно рассматривается случай, когда площадь контакта равна 1 см 2 ), называют работой адгезии. Если обозначить работу адгезии РКадг, поверхностное натяжение металла σм-г , поверхностное натяжение шлака σш-г , то
Wадг = σм-г + σш-г - σ м-ш-
Сумма σм-г + σш-г характеризует возрастание энергии, а σ м-ш — «экономию» энергии при разделении фаз. Чем больше Wадг, тем сильнее сцепление двух фаз и тем труднее их разделить. В предельном случае, когда затраты на создание новых поверхностей σм-г + σш-г равны энергии «слипания» σ м-ш , Wадг = 0 и имеет место случай полной несмешиваемости двух жидкостей. Если жидкая фаза (например, шлак) соприкасается с твердой (например, огнеупором), то капля шлака, расплавленная на поверхности огнеупора (рис. 8.5), испытывает одновременно воздействие трех величин: σш-г , σш-огн и σогн-г.
Силы поверхностного натяжения стремятся уменьшить поверхности контактирующих фаз. В результате наступает равновесие трех сил:
σогн-г.= σш-огн + σш-г сosӨ
1 Сцепление поверхностей разнородных тел (от лат. adhaesio — прилипание).
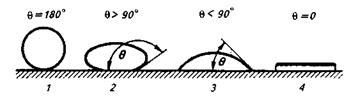
Рис. 8.6.Зависимость степени смачивания каплей жидкости твердого тела от величины угла смачивания 9:
1 — полное несмачивание; 2 — плохое смачивание; 3 — хорошее смачивание; 4— растекание (полное смачивание)
Угол Ө называют краевым углом смачивания. Его величину определяют из соотношения
или в общем случае
В зависимости от природы контактирующих фаз угол смачивания изменяется от 180 до 0°С. При =180° имеет место случай полного несмачивания жидкой каплей твердой «подложки». При = 90 — 180° смачивание имеет место, но его можно считать плохим. При = 0—90° смачивание хорошее, а при = 0 наблюдается (рис. 8.6) полное смачивание поверхности (растекание капли).
Помимо природы контактирующих веществ на угол смачивания влияет температура. В большинстве случаев с повышением температуры угол смачивания уменьшается и жидкость растекается более полно. В случае двух плохо смачивающихся жидкостей (например, когда на поверхности металла плавает шлаковая частица) картина приобретает вид, показанный на рис. 8.7. На практике почти всегда имеет место частичное смачивание.
Рис. 8.7.Характер растекания капли одной жидкости Жг (например, шлака) на поверхности другой жидкости Ж\ (например, металла)
Значение краевого угла смачивания важно для решения многих задач. Если, например, известно, что при соприкосновении жидкого шлака определенного состава с футеровкой краевой угол смачивания невелик ( < 90°), то ожидается проникновение этого шлака в поры, имеющиеся в огнеупорном материале. Если такое проникновение нежелательно, то необходимо подобрать такие составы шлаков (или огнеупоров), при которых краевой угол смачивания возрастет ( > 90°). Если между металлом и находящимся в нем неметаллическим включением смачивание плохое, то это включение быстрее всплывает и его можно быстро удалить в отличие от случая, когда смачивание между включением и металлом хорошее. Силы смачивания мешают полностью разделять шлак и металл. Это можно наблюдать в процессе операции скачивания шлака с поверхности металлической ванны или выпуска металла после окончания плавки. Рис. 8.7 иллюстрирует случай, когда на поверхности металла плавает шлаковая частица. Форма этой частицы, по существу, определяется соотношением работ адгезии и когезии. Если работа адгезии шлака к металлу WАДГ больше работы когезии WKor, то шлак растекается по металлу; если WKOT > WАДГ, то шлак не растекается, а образует на поверхности металла линзу. Разность WАДГ и WKor, иногда называют степенью растекания: Sp = WАДГ — WKOT. При большой степени растекания труднее отделить шлаковые частицы от металла.
Приведенное выше рассмотрение взаимодействия (с учетом лишь сил смачивания) твердой, жидкой и газообразной фаз условно, так как процессы контакта различных фаз и взаимного смачивания сопровождаются процессами химического взаимодействия. Если жидкий металл Me' вступает в контакт с оксидом другого металла Me" (условно обозначим Me" О), то взаимодействие между ними определяется степенью химического сродства металлов Me' и Me" к кислороду. Если химическое сродство к кислороду металла Me", из оксидов которого Ме"О состоит подложка, выше химического сродства к кислороду металла Me', то химического взаимодействия между Ме"О и Ме'О не происходит.
Этому случаю соответствует обычно плохое смачивание ( > 90°). Например, химическое сродство к кислороду таких металлов, как кальций или алюминий, выше химического сродства к кислороду железа; химическое взаимодействие между СаО или А12О3 и железом практически отсутствует и капля жидкого железа на подложке из СаО или А12О3 принимает форму, показанную на рис. 8.6 ( > 90°). В отличие от чистого железа в стали всегда содержится некоторое количество примесей, в том числе таких, химическое сродство к кислороду которых выше, чем железа, (Ti, Mn, V, Si). В присутствии заметного количества таких примесей угол смачивания 6 уменьшается (рис. 8.8).
Присутствие даже небольшого количества поверхностно-активных примесей (например, кислорода или серы) приводит к заметному уменьшению угла . Вместе с тем такие примеси, как никель и молибден, которые не являются поверхностно-активными, не имеют высокого химического сродства к кислороду и практически не влияют на угол смачивания .
Если в расплаве содержится несколько поверхностно-активных компонентов, то между ними возникаеп как бы борьба за поверхность. Так, например, при десульфурации стали если в расплаве много кислород; (02 — поверхностно-активный эле мент), удаление серы через поверх ность контакта металл—десульфуриру ющая добавка затруднено, так как по верхность металла занята кислородом; при уменьшении содержанш кислорода сера из металла начинает интенсивно удаляться. Аналогичная картина наблюдается, например, npи удалении азота из металла в вакуум ной печи. Если в металле много кислорода, то он как поверхностно - активный элемент занимает поверхность и препятствует быстрому удалению азота из металла.
Состав металла влияет также н межфазное натяжение на границе ме талл—шлак (рис. 8.9).
В заключение напомним, что в ме таллургической практике часто ис пользуются следующие понятия (тер мины) из физической химии:
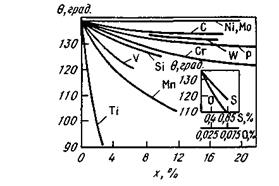
Рис. 8.8.Влияние атомного содержания компонентов х, растворенных в жидком железе, на величину угла смачивания (подложка из А1203)
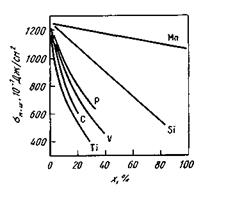
Рис. 8.9.Влияние добавок в металл разных
элементов х (ат.%) на межфазное натяжение
м-ш на границе металл—шлак
абсорбция — поглощение объемом;
адгезия — сцепление поверхностей разнородных тел;
адсорбция — поглощение поверхностью;
десорбция — удаление веществ, поглощенных при адсорбции или абсорбции;
когезия — сцепление (притяжение) молекул (атомов, ионов) в физическом теле;
сорбент — поглощающее тело;
сорбтив (сорбат) — поглощаемое вещество;
сорбция — поглощение;
хемосорбция — поглощение с образованием химических связей.
Угол 0 — краевой угол смачивания ( < 90° — хорошее смачивание, >90" — плохое смачивание, = 0° — полное смачивание (растекание), = 180° — полное несмачивание, т. е. силы коге-зии так велики, что полностью исключают силы адгезии и жидкая капля превращается в шарик).
Поверхностное натяжение стали - коэффициент поверхностного натяжения
Поверхностное натяжение основная характеристика процессов, связанных с участием поверхностей или границ раздела. Поверхностное натяжение определяет свободную энергию (работу), которую необходимо затратить, чтобы образовать единицу площади поверхности раздела.
Наличие поверхностного натяжния обусловлено тем, что атомы на поверхности жидкости или кристалла обладают большей потенциальной энергией, чем атомы или ионы внутри их, поэтому поверхностную энергию обычно рассматривают как избыток энергии, приходящейся на единицу площади. В табл. 1 приведены значения поверхностного натяжения для некоторых металлов при температурах, близких к температуре их плавления.
Табл. 1. Поверхностное натяжение жидких металлов [Вертман А. А., Самарин А. М. Строение и свойства жидких металлов. М.: изд-во АН СССР. 1960. 350 с.]
| Металл | Т, С | σ, мДж/м 2 |
| Fe | 1550 | 1850 |
| Al | 700 | 850 |
| Ni | 1500 | 1750 |
| Ti | 1720 | 1330 |
| Cu | 1100-1630 | 1354 |
| Si | 1410-1800 | 735 |
| Mg | 852-1053 | 583 |
| Mn | 1550 | 1000 |
Влияние поверхностного натяжения на кристаллизацию
Распределение примесей на гранях кристалла в процессе затвердевания оказывает существенное влияние на кристаллическую структуру и свойства слитков. Растущий кристалл промышленных сплавов всегда окружен тонким поверхностным слоем примесей. Рост кристалла, покрытого этим слоем, может происходить только у вершин и выступов его ветвей, где режим питания чистой жидкостью более благоприятен. Адсорбируемые примеси таким образом значительно влияют на форму кристаллов, поэтому, считают, что дендритная форма роста вызывается влиянием блокирующего слоя, нарушающего нормальное питание. Адсорбционная природа образования дендритов доказана экспериментально.
Вообще процесс кристаллизации обычно связывают с двумя параметрами: переохлаждением и межфазным натяжением на границе твердый кристалл - расплав.
Для оценки величины возможного переохлаждения можно принять, что вся выделяющаяся теплота кристаллизации идет на повышение температуры уже образовавшегося кристалла от Т1 до Т2, тогда элементарный баланс тепла при этом имеет вид
M∙L = m∙с∙(T2 - T1) (1)
где M - количество молей вещества, моль;
m - масса кристалла, кг;
С - удельная теплоемкость твердой фазы, Дж/(кг∙К);
Т1 - температура переохлажденного расплава, К;
Т2 - температура разогретого кристалла, К;
L - теплота кристаллизации, Дж/моль.
Переохлаждение dT в этом случае примет вид
При Т2 = Т0 возникает возможность образования стабильного кристаллического зародыша. При подстановке в уравнение (1) T2 = T0 получим:
Теперь для получения значений максимального переохлаждения достаточно подставить в выражение (1) табличные значения теплоты кристаллизации L и теплоемкости при постоянном давлении для твердой фазы при температуре плавления (2).
Влияние состава на поверхностное натяжение
Одним из существенных факторов, определяющих значение поверхностного натяжения является состав металла.
Для расчета поверхностного натяжения стали может быть использована предложенная Попелем [Попель С.И. Теория металлургических процессов. М.: ВИНИТИ. 1971. 132 с.] формула:
σ = σFe - 2000·lgΣFi·xi (3)
где σFe - поверхностное натяжение чистого железа, Дж/м 2 ;
xi - атомная доля i-го компонента в сплаве;
ni - число молей i-го компонента;
Fi - параметр, характеризующий капиллярную активность легирующей добавки.
При 1600 °С значения Fi, для большинства легирующих добавок приведены в табл. 2. Для других температур значение F следует определять из выражения (4):
Табл. 2. Значение параметров капиллярной активности различных элементов
| Элемент | C | Si | Mn | S | Р | Сr | Ni | Мо | Ti | V | О | N | La* | Y* | Ba | Fe |
| F1873 | 2,0 | 2,2 | 5,0 | 500 | 1,5 | 2,5 | 1,4 | 0,45 | 0,12 | 0,6 | 1000 | 150 | 550 | 377 | 1000 | 1 |
* собственные данные (подробнее об этом здесь). На нашем сайте Вы также можете прочесть статью о влиянии селена и теллурга на поверхностное натяжение стали.
Пример расчета поверхностного натяжения стали 35ХН3МФА (при Т = 1873 К) приведен в таблице ниже.
Табл. 3. Расчет поверхностного натяжения капли стали марки 35ХНЗМФА
Используя данные таблицы получаем, что поверхностное натяжение для стали 35ХН3МФА в соответствии с выражением (3) составит σ = 1850 - 2000·lg(1,316) = 1611 мДж/м 2 (изменение поверхностного натяжения чистого железа при снижении температуры с 1600 до 1550 °С не было учтено).
Задать интересующий Вас вопрос или написать комментарий к данной статье Вы можете здесь. Напишите нам и мы обязательно ответим.
Наши партнёры
Спец-предложение
Предлагаем услуги по оптимизации геометрии разливочной оснастки с целью обеспечения повышения коэффициента использования металла и снижения осевой пористости слитков
Поверхностное натяжение жидких металлов Текст научной статьи по специальности «Физика»
С использованием теории размерностей описано поверхностное натяжение жидких металлов в широком интервале температур.
Похожие темы научных работ по физике , автор научной работы — Панфилович К. Б., Валеева Э. Э.
Текст научной работы на тему «Поверхностное натяжение жидких металлов»
ТЕПЛО- И МАССООБМЕННЫЕ ПРОЦЕССЫ, ЭНЕРГЕТИКА
К. Б. Панфилович, Э. Э. Валеева
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКИХ МЕТАЛЛОВ
Теоретические расчеты теплофизических и кинетических характеристик жидких металлов не удовлетворяют потребностям практики. Разработка методов расчета во многом сдерживается отсутствием надежной информации о структуре жидкого состояния. Сочетания нейтроно- , электроно- и рентгеноскопических методов с анализом температурных зависимостей физических и транспортных свойств позволяет полнее судить о строении жидкостей.
В научной литературе накоплено значительное количество экспериментальных данных по поверхностному натяжению жидких металлов. Результаты измерений плохо согласуются между собой. Это связано с трудностью измерения поверхностного натяжения металлов, особенно тугоплавких. Погрешности измерений при исследованиях поверхностного натяжения могут быть связаны с недостаточной чистотой металлов, а также наличием над поверхностью расплава инородной среды.
В работе применена теория размерностей [1] для описания поверхностного натяжения жидких металлов в широком интервале температур. Физическими величинами, определяющими поверхностное натяжение, приняты масса частиц т, температура Дебая расплава 9, постоянные Больцмана к и Планка И, термодинамическая вероятность W и коэффициент поверхностного натяжения о. Основные независимые физические величины - постоянные Больцмана и Планка, масса частиц, температура Дебая и термодинамическая вероятность. Согласно п-теореме составим два безразмерных комплекса. Первый ла=ака0рт^5 содержит коэффициент поверхностного натяжения. Показатели степени а=Р=-2, у=-1, 5=2 обеспечивают его нулевую размерность. Следовательно,
Термодинамическая вероятность и энтропия вещества связаны формулой Больцмана S=k£nW+COnst. Тогда л о=/(3/к) и
Комплекс ае = ^ имеет ту же размерность, что и коэффициент поверхностного натяжения, определяется универсальными постоянными Планка и Больцмана, индивидуальными для каждого расплава массой частиц и температурой Дебая.
Мольная энтропия, взятая из справочных изданий 4, пропорциональна отношению S/k в выражении (2), удобна для расчетов и относится к постоянному числу частиц или при делении на газовую постоянную К - к одной частице. Далее в работе использована величина S/R.
Поверхностное натяжение расплавов относится к 1м поверхности. При изменении температуры изменяется число частиц металла, участвующих в формировании сил поверхностного натяжения. Если коэффициент поверхностного натяжения о (Дж/м2) умно-
жить на отношение (рт/р) , то комплекс о = о(рт/р) будет отнесен к постоянному числу частиц (рт и р - плотности расплава при температуре плавления и текущей температуре соответственно).
Теперь соотношение (2) запишем в виде
Температуры Дебая имеются для ограниченного числа жидких металлов [5]. Их величины, найденные разными методами, могут различаться на 20% и более [5]. Точность расчета масштабных комплексов о9 в выражении (3) будет невелика, к тому же они зависят от температуры Дебая во второй степени. Поэтому целесообразно масштабные комплексы находить непосредственно из опытных данных по поверхностному натяжению расплавов. Согласно (3) линии о = А^/К) для термодинамически подобных веществ должны отличаться постоянным множителем. Следовательно, единая зависимость сохраняется, если использовать масштабные комплексы о 1, равные величине о при каком-либо постоянном значении энтропии. Тогда функциональная зависимость (3) для относительных коэффициентов поверхностного натяжения перепишется так:
где масштабный комплекс а 1 =
и отличается от него
на один и тот же множитель для всех подобных веществ.
Функциональная зависимость (4) применена к опытным данным по коэффициентам поверхностного натяжения в жидких металлах 6.
Отобраны экспериментальные данные по поверхностному натяжению чистых жидких металлов, измеренные в среде инертных газов (гелия или аргона). Относительные коэффициенты поверхностного натяжения тридцати металлов приведены на рис.1. Часть данных для удобства изображения смещена вверх и вниз от начала координат. Каждая линия сдвинута от ближайшей на 0,2 единицы шкалы вертикальной оси. Для усредняющей линии получено уравнение
а * = К а ехр| — 0,05941-1, (6)
Обычный коэффициент поверхностного натяжения будет равен
Рт 3 ехр| — 0,0594 ^ 1. (7)
Масштабные коэффициенты поверхностного натяжения Ко приведены в таблице 1.
Уравнение (5) хорошо описывает поверхностное натяжение большинства жидких металлов. Исключение составляют щелочные металлы при температурах, близких к температуре кипения. Отклонение от усредняющей линии металлов подгруппы лития можно объяснить тем, что при измерении поверхностного натяжения, как правило, используют гелий или аргон, но при высоких температурах неминуемо появляются собственные пары над поверхностью жидкого металла, что может привести к резкому изменению измеряемой величины. Подгруппа лития является химически активной, ее пары способны образовывать сложные ассоциаты и димеры [14]. Анализ измерений, проведенных в вакууме, в среде гелия, аргона и в среде собственных паров, показывает, что коэффициенты поверхностного натяжения щелочных металлов меньше в присутствии собственных паров [7].
Небольшие отклонения от зависимостей (5) - (7) наблюдаются для расплавов сурьмы и висмута вблизи температуры плавления. По классификации Регеля БЬ и Ы плавятся по типу полуметалл-металл [5]. Перестройка структуры в этих металлах не заканчивается в точке плавления, а продолжается и при дальнейшем увеличении температуры. Температура Дебая характеризует прочность химической связи [5]. Изменение структуры должно приводить к изменению температуры Дебая и, следовательно, масштабных коэффициентов поверхностного натяжения. Корректировку масштабных коэффициентов можно сделать по скорости ультразвука. Для жидких металлов она изменяется в зависимости от температуры линейно вплоть до температуры плавления. У сурьмы и висмута эта линейность вблизи температуры плавления нарушается. Скорость ультразвука сурьмы проходит через максимум и затем резко снижается к точке плавления (рис.2). Масштабный коэффициент поверхностного натяжения пропорционален температуре Дебая во второй степени. С другой стороны, температура Дебая по формуле Линдемана пропорциональна скорости ультразвука. Поэтому изменение масштабного коэффициента поверхностного натяжения можно учесть поправочным коэффициентом:
При умножении масштабных коэффициентов поверхностного натяжения на у (таблица 2) экспериментальные и рассчитанные коэффициенты поверхностного натяжения хорошо согласуются (рис.2).
Таблица 1 - Масштабные коэффициенты поверхностного натяжения жидких металлов
Элемент Кс, мН/м Элемент Кс, мН/м
и 589,4 1п 1020,76
Ве 2009,51 Sn 1104,91
В 1822,82 Sb 765,23
Ыа 322,31 Те 466,06
Мд 487,96 Св 138,98
А1 1498,13 Ва 649,02
Si 1427,95 Ьа 1588,64
К 193,41 Се 1299,93
Са 675,13 Рг 1807,76
Sc 1909,5 ЫС 1744,72
Л 2964,3 Sm 1857,46
V 3131,75 Еи 1042,12
Сг 2791,98 ОС 1326,35
Мп 2517,33 ТЬ 2207,59
Ре 3566,73 йу 2212,68
Со 3680,62 Но 2279,91
ЫП 3399,99 Ег 1861,74
Си 2471,27 УЬ 1083,72
7п 1342,41 Ьи 2088,9
Оа 1250,34 НГ 3235,33
Ое 1262,19 Та 4863,44
Ав 1878,96 W 4953,57
Se 247,49 Р1 4301,43
КЬ 154,89 Аи 2263,03
Sг 646,87 Нд 833,05
7г 3055,84 Т1 899,83
ЫЬ 3996,96 РЬ 921,13
Мо 4068,02 Bi 850,77
РС 2932,44 ТИ 2306,31
Ад 1736,74 и 3790,83
Сс1 1118,14 Ри 1189,67
1 и [6] Мп [7] Бп [7] БЬ [7] Те [11] Бе [11] Bi [7]
2 Си [7] Ад [10] Ре [7] № [6]
3 Бг [8] са [7] Мд [8] Са [8] Т1 [7] А1 [12] К [6]
4 N [7] Ва [8] РЬ [6] 1п [7] Се [6]
5 У [9] Со [7] Si [7] Нд [6] иа [7] РЬ [13] 0е [7]
Рис. 2 - Скорость ультразвука (1, 2) и коэффициенты поверхностного натяжения жидкой сурьмы (3,4): 1,3-экспериментальные данные; 2 - линейная экстраполяция скорости ультразвука до температуры плавления; 4-расчет по уравнению (7); 5-расчет по уравнению (7) при скорректированном коэффициенте К
Проведенный анализ показывает, что отклонение относительных коэффициентов поверхностного натяжения от усредняющей прямой является закономерным.
Таблица 2 - Коэффициенты у сурьмы и висмута
0 40 80 120 160 200 240
Sb 0,925 0,941 0,958 0,974 0,988 0,996 1
Bi 0,988 0,994 0,996 1
Комплекс (о-|7ц)0,5 пропорционален по выражению (2) температуре Дебая. Температура Дебая в монографии [5] приводится для ограниченного числа жидких металлов. Определена она из данных по скорости ультразвука и вязкости. Зависимость комплекса (Ко*/ц)0,5 от этих температур Дебая в логарифмических координатах линейна, угловой коэффициент равен единице (рис. 3). Уравнение усредняющей прямой
К0 = 5,89-10'4ц62 . (9)
Рис. 3 - Зависимость комплекса (К0/ц)0,5 от температуры Дебая
Рис. 4 - Периодичность изменения масштабных коэффициентов поверхностного натяжения
Рис. 5 - Поверхностное натяжение жидких металлов. Линии - расчет по уравнению (7); точки - экспериментальные данные
Проведен анализ масштабных коэффициентов поверхностного натяжения жидких металлов в связи с их положением в периодическом законе Д.И. Менделеева. Комплекс (К07ц)0,5 изменяется периодически в соответствии с номером элемента в периодическом законе (рис.4). Аналогичные изменения наблюдаются для температур Дебая жидких металлов [5].
Сравнение рассчитанных по уравнению (7) и экспериментальных коэффициентов поверхностного натяжения жидких металлов при разных температурах показано на рис.5.
Уравнение (7) позволяет производить расчет коэффициентов поверхностного натяжения жидких металлов в интервале от температуры плавления до температуры кипения. По уравнению (9) можно рассчитать температуры Дебая для всех металлов в жидком состоянии.
1. Вулкалович М.П., Новиков И.И. Термодинамика. - М.: Машиностроение. 1972. 672с.
2. Термодинамические свойства индивидуальных веществ: Справочник/ Под ред. В.П. Глушко. М.: Наука, 1982. 623с.
3. Рябин В.А., Остроумов М.А., Свит Т.Ф. Термодинамические свойства веществ: Справочное издание. Л.: Химия, 1977. 392с.
5. Глазов В.М., Айвазов А.А. Энтропия плавления металлов и полупроводников. М.: Металлургия, 1980. 175с.
6. Кириллов П.А., Денискина Н.Б. Теплофизические свойства жидкометаллических теплоносителей. М.: ЦНИИатоминформ, 2000. 42с.
7. Ниженко В.И., Флока Л.И. Поверхностное натяжение жидких металлов и сплавов (одно- и двухкомпонентные системы): Справочник. М.: Металлургия, 1981. 208с.
8. Bondansky J., Schins H.E. The Surface Tension of the Alkali-Earth Metals // Journal of Inorganic and Nuclear Chemistry. 1968. V.30. №9. C.2331-2337.
9. Шпильрайн Э.Э., Фомин В.А., Качалов В.В. Плотность и поверхностное натяжение урана в жидкой фазе // ТВТ. 1988. Т.26. №5. С.892-900.
10. Lauermann J., Metzger G., Sauerwald F. Oberflachenspannungen von schmelzflussigem Silber, Zinn und Sibrer-Zinn-Legierungen // Z. Physic. Chem. 1961. V.216. №1/4. C.42-49.
11. Назаров С., Мавлонов Ш. Влияние различных примесей на политерму поверхностного натяжения селена и теллура // Поверхностные явления в жидкостях и жидких растворах. - Изд-во Ленинградского университета, 1973. № 2. С.63-69.
12. Найдич Ю.В., Еременко В.Н. Метод «большой капли» для определения поверхностного натяжения и плотности расплавленных металлов при высоких температурах // Физика металлов и металловедение. 1961. Т.11. №6. С.883-888.
13. Bondansky J., Schins H.E. The Surface Tension of the Alkali Metals // Journal of Inorganic and Nuclear Chemistry. 1967. V.29. №9. C.2173-2179.
14. Шахпаронов М.И. Введение в современную теорию растворов (Межмолекулярные взаимодействия. Строение. Простые жидкости). М.: Высшая школа, 1976. 296с.
© К. Б. Панфилович - д-р хим. наук, проф. каф. вакуумной техники КГТУ; Э. Э. Валеева
Коэффициент поверхностного натяжения металлов
В работе для 55 элементов периодической системы рассчитаны поверхностное натяжение, критический радиус и постоянная Толмена. Для металлов с низкой температурой плавления величина поверхностного натяжения составляет доли Дж/м2, а для тугоплавких – единицы Дж/м2. Критический радиус d характеризует внутренние размерные эффекты и не превышает 10 нм для исследованных металлов.

Из 118 химических элементов, открытых на сегодняшний день, 96 относятся к металлам. Несмотря на появление большого количества неметаллических материалов, их значение в технике и в жизни человека остается огромным. При работе различных машин и механизмов во многих случаях основную роль играет поверхность металла и физико-химические процессы на его поверхности.
В настоящей работе приведены экспериментальные и теоретические результаты по поверхностному натяжению чистых
металлов.
Постоянная Толмена δ является основным параметром в термодинамике размерных эффектов. Физически она означает расстояние от поверхности натяжения до эквимолекулярной поверхности [1]. В большинстве работ считается, что экспериментальное определение постоянной Толмена принципиально невозможно, поэтому основной упор делается на ее расчетах с использованием численного моделирования [2]. В работе [3] получено выражение для постоянной Толмена:
где h - высота атомного монослоя, α показывает, во сколько раз среднеквадратичное смещение атомов на поверхности отличается от такового в объеме.
Рассчитанная по этой формуле постоянная Толмена для золота оказалась равной 0,275 nm. В настоящей работе мы рассмотрим методы экспериментального определения постоянной Толмена.
Поверхностное натяжение твердых тел
Экспериментальное определение поверхностного натяжения твердых тел затруднено тем, что их молекулы (атомы) лишены возможности свободно перемещаться. Исключение составляет пластическое течение металлов при температурах, близких к точке плавления [4].
Недавно нами были предложены методы экспериментального определения поверхностного натяжения твердых диэлектриков и магнитных материалов, основанные на универсальной зависимости физического свойства твердого тела от его размеров 6. В этой работе мы проводим сравнение нашего метода с методом «нулевой ползучести».
В методе «нулевой ползучести» (метод Таммана-Удина) образец (длинной нити, фольги) нагревают до достаточно высокой температуры, так что он начинает сокращаться по длине под действием поверхностных напряжений. К образцу прикладывается внешняя сила, поддерживающая неизменной форму образца. По величине этой силы определяют величину поверхностного натяжения. Экспериментальные данные для некоторых металлов взяты из работы [8] и приведены в табл. 1.
В работах 9 и ряде других нами получена формула, которая описывает зависимость физического свойства твердого тела от его размера:
(1)
Здесь А0 - физическое свойство массивного образца; A(r) - физическое свойство малой частицы или тонкой пленки; d - критический радиус или критическая толщина пленки, начиная с которого проявляются размерные эффекты. Для критического радиуса нами получена формула:
(2)
Здесь σ - поверхностное натяжение массивного образца; υ - молярный объем; R - газовая постоянная; Т - температура.
В монографии японских и российских физиков [11] считается, что уменьшение температуры плавления малых частиц связано с тем, что атомы на поверхности имеют меньшее число соседей, чем в объеме, следовательно, менее крепко связаны и менее ограничены в своем тепловом движении. Там же отмечается, что обычно уменьшение температуры нанокристалла обратно пропорционально его размеру. Однако теории этого эффекта
пока нет.
Таблица 1
Экспериментальные данные по поверхностному натяжению некоторых металлов в твердой и жидкой фазах и их сравнение с нашим методом
Методы расчета поверхностного натяжения многокомпонентных и бинарных сплавов Текст научной статьи по специальности «Химические технологии»
Аннотация научной статьи по химическим технологиям, автор научной работы — Валеева Э. Э., Панфилович К. Б.
Поверхностное натяжение является одним из важнейших параметров для анализа и проектирования различных технологических процессов. Большинство экспериментальных методов позволяет измерять поверхностное натяжение металлических расплавов с высокой точностью в широком интервале температур, чего нельзя сказать о современных теоретических расчетных методиках. В статье приводится описание теоретических методов расчета коэффициентов поверхностного натяжения бинарных и многокомпонентных сплавов различных авторов.
Похожие темы научных работ по химическим технологиям , автор научной работы — Валеева Э. Э., Панфилович К. Б.
Прибор для изучения поверхностного натяжения жидкометаллических теплоносителей в области низких температур
Surface tension is one of the most important parameters for analysis and design of different technological equipment and processes. Up-to-date experimental methods allow to measure surface tension with high accuracy and in the wide range of temperatures. However calculation methods do not meet the requirements of current technology. Brief review of theoretical calculation methods for surface tension of binary and multicomponent alloys has been presented in the article.
Текст научной работы на тему «Методы расчета поверхностного натяжения многокомпонентных и бинарных сплавов»
Э. Э. Валеева, К. Б. Панфилович
МЕТОДЫ РАСЧЕТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ МНОГОКОМПОНЕНТНЫХ И БИНАРНЫХ СПЛАВОВ
Ключевые слова: поверхностное натяжение, сплав, метал.
Keywords: surface tension, alloy, metal.
Знание свойств поверхности позволяет интенсифицировать существующие технологические процессы. Поверхностное натяжение - одна из важнейших характеристик поверхности вещества. Коэффициенты поверхностного натяжения необходимы для расчета процессов зарождения и роста фаз, адсорбции и других теплофизических свойств веществ, необходимых для осуществления технологических процессов. Поверхностные явления в совокупности с другими физическими свойствами веществ определяют пути получения и долговечность важнейших строительных и конструкционных материалов, эффективность добычи и обогащения полезных ископаемых; качество и свойства продукции, выпускаемой химической, текстильной, пищевой, химико-фармацевтической и многими другими отраслями промышленности. Особый интерес вызывает взаимосвязь поверхностных свойств с особенностями строения и объемными свойствами веществ, что является важным аспектом в вопросах металлургии, сварки и химической технологии.
В статье приводится обзор методов расчета коэффициентов поверхностного натяжения многокомпонентных сплавов. Эмпирический и теоретический анализ поверхностных явлений в жидкостях начат еще в 19 веке. Были разработаны методики нахождения поверхностного натяжения по парахору, расчет по теории подобия и др. Разработаны статически-электронный и молекулярно-термодинамический методы теоретического исследования поверхностного натяжения.
Статически-электронные теории поверхностного натяжения металлических растворов рассматривают составляющие энергии металлической связи (ионные и электронно-ионные взаимодействия).
Более широкое применение для расчета поверхностных свойств жидких металлов и сплавов находят термодинамические теории поверхностного натяжения [1], хотя они не всегда хорошо описывает опытные данные.
Для упрощения расчета сплавы часто рассматривают как идеальные системы. В.В. Павлов и С.И. Попель [2] вывели уравнение для расчета поверхностного натяжения многокомпонентного раствора, принимая, что компонент занимает при заданной температуре такой же объем, как и в растворе, но с отсутствием межчастичного взаимодействия. Конечное уравнение записывается в следующем виде:
а = а, - — InXFNi, (1)
где СТ1 - поверхностное натяжение растворителя, ш - площадь, занимаемая молем раствора, Р|
- отношение коэффициентов активности в объеме и на поверхности, N1 - концентрация 1-го компонента раствора. Уравнение (1) выражает зависимость поверхностного натяжения многокомпонентного раствора от состава. Принятые допущения позволяют использовать уравнение для растворов, близких идеальным.
А.А. Жуховицкий [3] вывел выражение для расчета поверхностного натяжения регулярных растворов. Автор предполагает независимость парциальных молярных площадей компонентов от состава раствора:
qa1| + КТ!п —1— о1ш1 + КТ!п—2—
где здесь и далее СТ1 и СТ2 - поверхностное натяжение чистых компонентов, N1 и N2, N1^ и N2°^ - молярные доли компонентов в объемной фазе и поверхностном слое соответственно, Ш1 и Ш2 - молярные площади чистых компонентов, V и - молярный объем раствора в объемной фазе и поверхностном слое соответственно, а1 и а2 - структурные коэффициенты, Y1 и Y2 - коэффициенты активности компонентов в растворе, а1 и а2 , а/^ и а2(^ - активности компонентов в объемной фазе и поверхностном слое соответственно, К - газовая постоянная, Т - температура.
В уравнении (3) Хора и Мелфорда [4] не учитывается изменение молярного объема раствора в поверхностном слое и объемной фазе, вызванное различием их состава.
а (“) а (ш) ст^ + КТ!п —1— ст2ш2 + КТ!п 2
где О и 02 - парциальные молярные площади компонентов в поверхностном слое.
В работах [5, 6] предложены уравнения для случая, когда поверхностный слой считается идеальным, а объемная фаза представляет собой реальный раствор
а 01, + Кїіп 1 ( , а о + Кїіп 2 ( , 8,У( 0) _ ^ з2У(0)
С“ + Кїіп—1— с2“2 + Кїіп-
Уравнения (6) и (7) С.И. Попеля и В.В. Павлова [7, 8] записаны для двойных систем. Они учитывают изменение молярного объема раствора, активности и парциальные молярные площади компонентов с составом, а также отличие молярного объема в поверхностном слое и объемной фазе, вызванное отличием их состава. Основной трудностью для определения поверхностного натяжения по уравнению (6) является необходимость определить структурный коэффициент а; ( в расчетах использовался а; = 1/6). Для решения уравнения (7) необходимы сведения об активностях компонентов в поверхностном слое.
ст = ст 1о1 - а1Кї^1 + ГСТІп 1 (00 = ст2о2 - а^Дї^2 + Кїіп 2 , (6)
00 + КТ!Па^ 0=°2 + КТ!Па у(щ)
Г.П. Хиля [9] произвел расчет по уравнениям (2 - 7) и сравнил полученные результаты с экспериментальными данными по поверхностному натяжению двойных металлических
расплавов. Расчеты показали, что для большинства металлических систем лучше всего подходят уравнения (6) и (7). Для систем, характеризующихся наличием в твердом состоянии интерметаллических соединений, подходят уравнения (7) и (3). Расчет по уравнению (2) приводит к удовлетворительным результатам лишь для некоторых систем эвтектического типа (Ag-Bi, Co-Al, Ag-Pb, Fe-Cu). Расчеты по уравнениям (4) и (5) подходят для систем близким идеальным, для остальных расплавов эти уравнения даже качественно не описывают экспериментальные изотермы. То есть предположение об идеальности поверхностного слоя нельзя принимать для всех систем. Автор делает вывод, что уравнения (6, 7 и 3) являются наиболее приемлемыми и описывают поверхностное натяжение двойных металлических систем в пределах отклонения от экспериментальных данных 1-20%.
К.Б. Панфилович [10, 11] вывел зависимости для расчета коэффициентов
поверхностного натяжения О бинарных сплавов на основании теории размерностей:
где р и pm - плотность расплава при температуре плавления и текущей температуре, S -энтропия жидкого металла, R - газовая постоянная, Кст - масштабный коэффициент поверхностного натяжения.
Выражение (8) является полуэмпирическим, так как масштабный коэффициент Кст определяется из экспериментальных данных, что может влиять на точность рассчитанных коэффициентов поверхностного натяжения. В пользу данного метода может говорить простота уравнения, не включающего внутренние структурные параметры сплава, и возможность расчета поверхностного натяжения во всем диапазоне жидкого состояния, от температуры плавления до температуры кипения.
Ученые сталкиваются с проблемой нехватки термодинамических параметров для вычисления коэффициентов поверхностного натяжения бинарных и многокомпонентных металлических систем. Для решения этой проблемы создаются различные базы данных термодинамических свойств веществ. Одна из них - база данных, основанная на результатах Европейской ассоциации ученых по термодинамическим свойствам веществ Scientific Group of Thermodata Europe (SGTE) [12]. Р. Пича, Я. Врестал, А. Кроупа [12] использовали подход Бутлера, который базируется на теории капиллярности Гиббса, рассматривающей монослой молекул на поверхности раздела, свойства которого отличаются от свойств объема жидкости. Для определения коэффициента поверхностного натяжения необходимы избыточная энергия Гиббса жидкой фазы, коэффициенты поверхностного натяжения и плотность чистых металлов. Последние выбирались из экспериментальных данных различных авторов. Значения избыточной энергии Гиббса были взяты из выше указанной базы данных по термодинамическим свойствам веществ, созданной для вычисления фазовых диаграмм металлов с низкой температурой плавления. В работе [12] авторы в качестве примеров приводят расчетные изотермы поверхностного натяжения для сплавов Pb-Sb, Ag-Bi, Ag-In, Ag-Sn, Bi-Sn и Sb-Sn.
Существует ряд методов расчета коэффициентов поверхностного натяжения многокомпонентных и бинарных сплавов. Коэффициенты и параметры, входящие в расчетные уравнения, имеют приближенный характер и вносят дополнительные трудности при своем определении. Коэффициенты поверхностного натяжения, рассчитанные по статической теории, имеют расхождения с экспериментальными данными, достигающие 20%. Результаты, полученные с помощью термодинамических методов определения поверхностного натяжения, часто плохо согласуются с экспериментальными данными, и если и имеют хорошее согласование, то только для определенного ряда веществ, объединенных единой внутренней структурой. Простые зависимости поверхностного натяжения от теплофизических параметров, учитывающие фазовые переходы и изменение структуры, применимы лишь к жидкостям при температуре плавления. В литературе принято принимать температурные
коэффициенты поверхностного натяжения независимыми от температуры. Авторы считают, что наиболее точное значение температурного коэффициента поверхностного натяжения можно рассчитать при температуре плавления. Экспериментальные данные, особенно в узком интервале температур, действительно подтверждают это. В уравнении С.Н. Задумкина [13], выведенное для расчета поверхностного натяжения чистых металлов, температурный коэффициент da/dt является функцией от температуры. Кластерная модель Г.К. Моисеева [14] для щелочных металлов также указывает на то, что температурный коэффициент поверхностного натяжения значительно зависит от температуры и принимать его равным величине при температуре плавления для всей области температур неверно.
Развитие баз данных по экспериментальным и расчетным теплофизическим параметрам веществ, более глубокое понимание структурных превращений, происходящих внутри металлических сплавов, позволят усовершенствовать существующие методики расчета поверхностного натяжения, сделав их более простыми и удобными в использовании.
1. Попель, С.И. Поверхностные явления в расплавах / С.И. Попель. - М.: Металлургия, 1994. - 440 с.
2. Павлов, В. В. Зависимость поверхностного натяжения идеальных растворов от концентрации / В. В. Павлов, С. И. Попель // Журнал физической химии. - 1966. - Т. XL, № 10. - С. 2515-2518.
3. Жуховицкий, А. А. Поверхностное натяжение растворов / А. А. Жуховицкий // Журнал физической химии. - 1944. - Т. 18, № 5/6. - С. 214-238.
4. Hoar, T. P. The surface tension of binary mixtures lead+tin and lead+indium alloys / T. P. Hoar, D. A. Melford // Trans.Faraday Soc. - 1953. - V. 53, № 3. - P. 315-329.
5. Sprow, F. B. Surface tensions of simple liquid mixtures / F. B. Sprow, J. M Prausnitz // Trans.Faraday Soc.
- 1966. - V. 62, № 5. - P. 1105-1111.
6. Павлов, В. В. Исследование поверхностных свойств расплавов и коэффициентов переноса с помощью термодинамических функций взаимодействия и метода молекулярной динамики: автореф. дис. . д-ра хим. наук / В. В. Павлов. - Свердловск, 1978. - 47 с.
7. Попель, С. И. Термодинамический расчет поверхностного натяжения растворов / С. И. Попель,
В. В. Павлов // Поверхностные явления в расплавах и возникающих из них твердых фазах. - Нальчик: Кабард.-Балкар. кн. изд-во, 1965. - С. 46-60.
8. Павлов, В. В. Зависимость поверхностного натяжения реальных растворов от состава и температуры / В. В. Павлов, С. И. Попель // Журнал физической химии. - 1965. - Т. 39, № 1/2. - С. 184-186.
9. Хиля, Г. П. Проверка некоторых уравнений изотерм поверхностного натяжения реальных растворов на двойных металлических системах / Г. П. Хиля // Поверхностные свойства расплавов: сб. науч. тр. / под ред. Ю. В. Найдич. - Киев: Наукова думка, 1982. - С. 57-66.
10.Панфилович, К.Б. Поверхностное натяжение жидких бинарных сплавов / К.Б. Панфилович, Э.Э. Валеева // Вестник Казан. технол. ун-та. - 2006. - №4. - С. 106-111.
11.Панфилович, К.Б. Тепловое излучение и поверхностное натяжение жидких металлов и сплавов: монография / К.Б. Панфилович. - Казань: Изд-во Казан. гос. технол. ун-та, 2009. - 256 с.
12.Radim Picha, Jan Vrestal, Ales Kroupa. Prediction of alloy surface tension using a thermodynamic database. Computer Coupling of Phase Diagrams and Thermochemistry, 28, 2004, p. 141-146.
13.Задумкин, С. Н. Современные теории поверхностной энергии чистых металлов / С. Н. Задумкин // Поверхностные явления в расплавах и возникающих из них твердых фазах. - Нальчик: Кабард.-Балкар. кн. изд-во, 1965. - С. 12-29.
14.Моисеев, Г. К. Системы жидкий щелочной металл - газовая фаза с учетом метастабильных «малых» кластеров: компьютерный эксперимент / Г. К. Моисеев, Н. А. Ватолин. - Екатеринбург: Изд-во УрО РАН, 2005. - 183 с.
Читайте также:
