Контрольная работа по химии 9 класс металлы с ответами габриелян
Обновлено: 19.05.2024
Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Post category: Контрольные работы по химии 9 класс
- Reading time: 12 минут чтения
ЗАДАНИЕ 1
Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н2
2Nа + 2НСl = 2NаСl + Н2
2Nа + Cl2 = 2NаСl
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Fe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
Превращение 3 рассмотрите в свете ТЭД.
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2
Fе2++ 2OH- = Fе(ОН)2
Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n (Mg) = 12/24 = 0,5 моль
V (H2) = 10/22,4 = 0,446 моль
n (Mg) = n (H2) по уравнению (теор.)
выход = 0,446 /0,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Li + Cl2 = 2LiCl
2Li + 2H2O = 2LiOH + H2
2Li + 2HCl = 2LiCl + H2
Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
2Li+CL2= 2LiCL
Li- e—> Li+ восстановитель
CL2+2e—-> 2CL- окислитель
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Са →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
Превращение 3 рассмотрите в свете ТЭД.
2Ca+O2=2CaO
CaO+2NaOH=Ca(OH)2+Na2O
2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2H2O
2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2H2O
2H+ + Ca(OH)2 =Ca2+ +2H2O
3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3
При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 = CaO+CO2
n (CaCO3) = 10/100 = 0,1 моль
V (CO2) = 1,68/22,4 = 0,075 моль
n (CaCO3) = n (CO2) по уравнению (теор.)
выход = 0,075/0,1 = 0,75 = 75 %
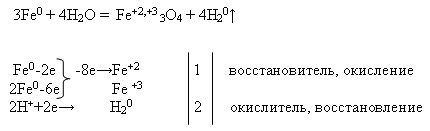
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
Са + Cl2 = CaCl2
Ca + 2HCl = CaCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.
Превращение 3 рассмотрите в свете ТЭД.
4Al + 3O2 = 2 Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
Al3+ +3Cl- + 3NH3 + 3H2O = Al(OH)3 + 3NH4+ +Cl-
Al3+ + 3NH3 + 3H2O = Al(OH)3 + 3NH4+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
V (H2) = 8,96/22,4 = 0,4 моль
n (Na) : n (H2) = 2:1
n (H2) = 1/ 2 = 0,5 моль по уравнению (теор.)
выход = 0,4/0,5 = 0,8 = 80 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
Рассмотрите одну из этих реакций в свете ОВР.
2K + 2H2O = 2KOH + H2.
2К + CI2 = 2КCI
2К + 2HCI = 2КCI + H2
Mg + 2HCl = MgCl2 + H2
Mg + Cl2 = MgCl2
Mg 0 -2e→ Mg 2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Mg+2H2O=Mg(OH)2+H2
ЗАДАНИЕ 2
Напишите уравнения реакций для данных переходов:
Li →Li20 →LiOH →Li2S04.
Превращение 3 рассмотрите в свете ТЭД.
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + Н2SO4 = Li2SO4 + 2Н2О
2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
Са + 2Н2О = Са(ОН)2 + Н2
n (Са) = 60/40= 1,5 моль
V (H2) = 30/22,4 = 1,34 моль
n (Са) = n (H2) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния и алюминия с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Br 2 = Мg Br2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
4Al + 3O2 = 2Al2O3,
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2
n (Mg) = 12/24= 0,5 моль
n (H2) = n (Mg) по уравнению (теор.)
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2Cu + O2 = 2CuO
2Cu + I2 = 2CuI
Cu + H2SO4 = не идет
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
Мg + I 2 = Мg I 2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2
Определите формулы веществ X1 и Х2 в цепочке превращений:
Zn →Х1→ ZnS04 →Х2 →ZnO.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO+H2SO4 —>ZnSO4 + H2O
ZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2
n (CaCO3) = 10/100= 0,1 моль
n (CO2) = n (CaCO3) по уравнению (теор.)
n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Cl2 = 2FeCl3
2Zn + O2 = 2ZnO
Zn 0 -2e→ Zn 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe →Х1 →Fe(OH)2 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe
1. Fe + 2HCl —> FeCl2 + H2
2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaCl
Fe2+ + 2OH- —> Fe (OH)2
3. Fe (OH)2 — t —> FeO + H2O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
2n (H2) = n (Na) по уравнению (теор.)
n (H2) = 0,5 моль теор.
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Br 2 = 2Fe Br3
2 Ве + O2 = 2 ВеО
Ве0 -2e→ Ве 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Ве + Br 2 = Ве Br2
Ве 0 -2e→ Ве 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Ве + Н2SO4 = Ве SО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe → Х1 →Fe(OH)3 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe
1. 2Fe + 3Cl2 t →2FeCl3
2. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
3. 2Fe(OH)3 t → Fe2O3 + H2O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2H2О = Ca(OH)2 + Н2
n (Ca) = 60/40= 1,5 моль
n (H2) = n (Ca) по уравнению (теор.)
n (H2) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + H2
Mg + 2H+ = Mg2+ + H2
Mg0 — 2e = Mg2+ восстановитель
2H+ + 2e= H2 окислитель
Mg + Cl2 = MgCl2
Mg+2H2O=Mg(OH)2+H2
Mg + CuCl2 = MgCl2 + Cu
Mg0 + Cu2+ = Mg2+ + Cu0
Mg0 — 2e = Mg2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ag + 2HCl = не реагирует
2Ag + S = Ag2S
Ag+ H2O = не реагирует
Ag + FeCl3 = AgCl + FeCl2
Ag0 + Fe3+= Ag++ Fe2+
Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
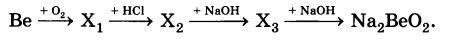
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ве + О2 = 2ВеО
ВеО +2HCl = BeCl2 + H2O
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2H2O
ЗАДАНИЕ 3
При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 моль
n (H2) (теор.) = n(Mg) =0,475 моль
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,475 = 0,92 = 92%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl
2Li + 2H2O = 2LiOH + H2
2Li + 2НСl = 2LiСl + Н2
2Li0 + 2Н+ = 2Li+ + Н02
Li0 – 1e = Li+ восстановитель
2Н+ + 2e= Н02 окислитель
2Li + CuСl 2= 2LiС1 + Cu
2Li0 + Cu2+ = 2Li+ + Cu0
Li0 – 1e = Li+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ва + 2HCl = ВаCl2 + H2
Ва + 2H+ = Ва 2+ + H2
Ва 0 — 2e = Ва 2+ восстановитель
2H+ + 2e= H2 окислитель
Ва + Cl2 = ВаCl2
Ва +2H2O= Ва(OH)2+H2
Ва + CuCl2 = ВаCl2 + Cu
Ва + Cu2+ = Ва 2+ + Cu0
Ва 0 — 2e = Ва 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
4. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
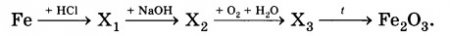
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe + 2HСl → FeCl2 + H2↑
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3H2O
ЗАДАНИЕ 3
При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2
n (CaCO3) = 20-20*0,1/100= 18/100=0,18 моль
V (CO2) = 3,23/22,4 = 0,145 моль (практ.)
n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
выход = 0,145/0,18 = 0,801 = 80,1 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + H2
Са0 + 2H+ = Са 2+ + H2
Са 0 — 2e = Са 2+ восстановитель
2H+ + 2e= H2 окислитель
Са + Cl2 = СаCl2
Са +2H2O= Са(OH)2+H2
Са + CuCl2 = СаCl2 + Cu
Са + Cu2+ = Са 2+ + Cu0
Са 0 — 2e = Са 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2.
2Fe + 3Cl2 t →2FeCl3
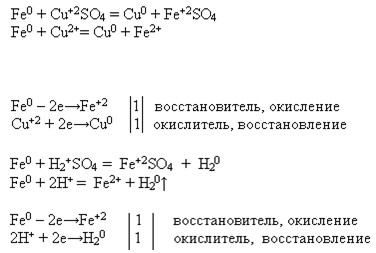
3. 2Zn + O2 = 2ZnO
Zn + H2O = ZnO + H2
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
Zn 0 + 2H+ = Zn 2+ + H02
Zn 0 — 2e = Zn 2+ восстановитель
2H+ + 2e= H2 окислитель
Zn + CuSO4 = Cu + ZnSO4
Zn 0 + Cu2+ = Zn 2+ + Cu0
Zn 0 — 2e = Zn 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
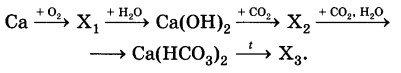
2Ca+O2=2CaO
CaО+H2O=Ca(OH)2
Ca(OH)2+H2CO3=CaCO3+2H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
Ca(HCO3)2 t →CaCO3↓ + CO2 + H2O
ЗАДАНИЕ 3
Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2
n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 моль
n (H2) (теор.) = 0,5 n(Mg) =0,5 моль
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеО
Ве + Н2SO4 = ВеSО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
2. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3

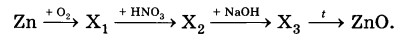
2Zn + O2 = 2ZnO
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Ca + 2H2О = Ca(OH)2 + Н2
n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 моль
n (H2) (теор.) = n(Ca) =1,47 моль
n (H2) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,47 = 0,91 = 91%
Химия 9. Контрольная работа Металлы
Контрольная работа по химии № 1 «Металлы» в 9 классе с решениями и ответами (в 3-х вариантах) к учебнику О. С. Габриеляна «Химия 9 класс». Ответы адресованы родителям. Контрольная работа Металлы.
Химия 9 класс (УМК Габриелян)
Контрольная работа Металлы (Павлова)
КР-1. ВАРИАНТ 1 (транскрипт заданий)
- Напишите уравнения реакций, характеризующие отношение лития к кислороду, сере, воде и соляной кислоте. Разберите уравнения с окислительно-восстановительной точки зрения.
- Сравните кислотно-основные свойства гидроксида натрия и гидроксида железа (II). Приведите необходимые уравнения реакций в молекулярном и ионном виде.
- Осуществите превращения:
Аl → Al2S3 → Аl(ОН)3 → Na[Al(OH)4] → Аl(ОН)3 → Аl2O3 → АlСl3.
Укажите условия протекания реакций. - Предложите способ распознавания растворов хлорида натрия, хлорида бария и хлорида алюминия. Приведите необходимые уравнения реакций, укажите их признаки.
- Определите массу железа, которая может быть получена из 8 кг оксида железа (III), если выход реакции составляет 85% от теоретически возможного.
Кр-1. Вариант 1. ОТВЕТЫ :

КР-1. ВАРИАНТ 2 (транскрипт заданий)
- Напишите уравнения реакций, характеризующие отношение кальция к кислороду, азоту, воде и разбавленной серной кислоте. Разберите уравнения с окислительно-восстановительной точки зрения.
- Сравните кислотно-основные свойства гидроксида алюминия и гидроксида магния. Приведите необходимые уравнения реакций в молекулярном и ионном виде.
- Осуществите превращения:
Na → NaH → NaOH → Na2SO4 → NaOH → NaCl → Na.
Укажите условия протекания реакций. - Предложите способ распознавания растворов нитрата железа (II), нитрата магния и нитрата калия. Приведите необходимые уравнения реакций, укажите их признаки.
- Определите массу меди, которая может быть получена из 16 кг оксида меди (II), если выход реакции составляет 70% от теоретически возможного.
Кр-1. Вариант 2. ОТВЕТЫ :

КР-1. ВАРИАНТ 3 (транскрипт заданий)
- Напишите уравнения реакций, характеризующие отношение алюминия к хлору, воде, гидроксиду натрия и разбавленной серной кислоте. Разберите уравнения с окислительно-восстановительной точки зрения.
- Сравните кислотно-основные свойства гидроксида калия и гидроксида железа (III). Приведите необходимые уравнения реакций в молекулярном и ионном виде.
- Осуществите превращения:
Са → СаО → Са(ОН)2 → СаСl2 → СаСO3 → Ca(NO3)2.
Укажите условия протекания реакций. - Предложите способ распознавания растворов сульфата алюминия, сульфата железа (II) и сульфата магния. Приведите необходимые уравнения реакций, укажите их признаки.
- Определите массу железа, которую можно получить из 1 кг руды, содержащей 92,8% оксида железа (II, III), если выход реакции составляет 90% от теоретически возможного.
Кр-1. Вариант 3. ОТВЕТЫ :

Вы смотрели: Контрольная работа Металлы — задания и ответы на контрольную работу № 1 по химии в 9 классе (в 3-х вариантах) из пособия для учащихся Контрольные и самостоятельные работы по химии: 9 класс: к учебнику О. С. Габриеляна / Н. С. Павлова. — М. : Издательство «Экзамен». Цитаты из учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях.
Ответы на итоговую контрольную работу за курс основной школы(Габриелян)
- Post category: Контрольные работы по химии 9 класс
- Reading time: 5 минут чтения
1. Схема распределения электронов по энергетическим уровням в атоме химического элемента, образующего соединения, соответствующие общим формулам Н2Э и Э03:
В. 2е, 8е, 6е.
2 . Электронное строение иона [+х )]+
соответствует элементу, символ которого:
Б. Н.
3. Ряд элементов, расположенных в порядке увеличения атомных радиусов:
A. S—Р—Si.
4. Термин «молекула» нельзя использовать при характеристике соединения, формула которого:
Б. К20.
5. Оксид углерода (IV) является:
Б. Кислотным.
6. Ряд формул веществ, реагирующих с разбавленной серной кислотой:
Г. Mg, СuО, ВаСl2.
7. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
В. СuСl2 и КОН.
8. Степень окисления +3 у атома хрома в соединении с формулой:
Б. Сr203.
9. Уравнению реакции 2NO + 02 = 2N02 соответствует схема превращения:
Г. N +2→ N +4.
10. Формула предельного одноатомного спирта:
В. СН40.
11. Составьте уравнения химических реакций между веществами, формулы которых:
А. Са и S.
В. СаО и Н20.
Б. Са(ОН)2 и H2S04.
Г. Са и 02.
Ca + S → CaS
Ca(OH)2+ H2SO4 => CaSO4 + 2H2O
СаО + Н2О = Са(ОН)2
2Са+ О2= 2СаО
12. Составьте генетический ряд кальция.
Ca→CaO→Ca(OH)2→CaCl2 →Ca3(PO4)
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+2HCl=CaCl2+2H2O
3CaCl2+2H3PO4=Ca3(PO4)2+6HCl
13. Составьте молекулярное уравнение реакции, соответствующее схеме
N2 → 2N -3
Разберите его с точки зрения ОВР.
3H20 + N20 = 2N−IIIH3+I
N20 +2*3е→2N-3 окислитель
H20 -2*1е→2H+1 восстановитель
14. По краткому ионному уравнению
Cu2+ + 20Н- = Cu(OH)2 ↓
составьте молекулярное уравнение.
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
15. Какой объем оксида углерода (IV) образуется при сгорании 11,2 л пропана?
С3Н8 + 5О2 = 4Н2О +3СО2
n(CO2) = 3n(C3H8)
n(C3H8) = 11,2/22,4= 0,5 моль
n(CO2) = 0,5*3= 1,5 моль
V(CO2) = 1,5*22,4 =33,6 л
1. Схема распределения электронов по энергетическим уровням в атоме химического элемента, образующего соединения, соответствующие общим формулам ЭН2 и ЭО:
В. 2е, 8е, 2е.
2. Электронное строение иона [+х )2)8)8]-
соответствует элементу, символ которого:
Б. Сl.
3. Ряд элементов, расположенных в порядке увеличения атомных радиусов:
Г. Be—Mg—Са.
4. Термин «молекула» нельзя использовать при характеристике соединения, формула которого:
Б. КСl.
5. Оксид кальция является:
Г. Основным.
6. Ряд формул веществ, реагирующих с раствором гидроксида натрия:
Г. HCl, Zn(OH)2, C02.
7. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
Г. КОН и СuСl2.
8. Наивысшая степень окисления у атома хлора в соединении, формула которого:
Г. КСl04.
9. Уравнению реакции
2S02 + 02 = 2S03
соответствует схема превращения:
A. S +4 → S +6.
10. Формула непредельного углеводорода:
Г. С3Нб.
11. Составьте уравнения химических реакций между веществами, формулы которых:
A. S03 и Н20.
Б. НСl и Na2S.
В. Na20 и H2S04.
Г. H2S и 02.
SO3+H2O=H2SO4
Na2S + 2HCl = 2NaCl + H2S
Na2O+H2SO4=Na2SO4+H2O
2Н2S + 3O2 = 2SO2 + 2H2O
12. Составьте генетический ряд серы.
S—>SO₂—>H₂SO₃—>Na₂SO₃
S+O₂=SO₂
SO₂+H₂O=H₂SO₃
H₂SO₃+2NaOH=Na₂SO₃+2H₂O
13. Составьте молекулярное уравнение реакции, соответствующее схеме
Сu +2→ Сu.
Разберите его с точки зрения ОВР.
CuO + H2 = Cu + H2O
Cu2+ + 2е = Сu0 окислитель
Н02 — 2е = 2Н+ восстановитель
14. По краткому ионному уравнению
СО3 2- + 2Н+ = С02↑ + Н20
составьте молекулярное уравнение.
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
15. Какой объем кислорода потребуется для сгорания 10 л этена?
C2H4 + 3O2 → 2CO2 + 2H2O
1 моль этена = 3 моль кислорода
V1/V2 = n1/n2
10 л этена =30 л кислорода
1. Схема распределения электронов по энергетическим уровням в атоме химического элемента, образующего соединения, соответствующие общим формулам НЭ, Э207:
Б. 2е, 8е, 7е.
2. Электронное строение иона [+х)2)8]2+ соответствует элементу, символ которого:
Б. Mg.
3. Ряд элементов, расположенных в порядке увеличения атомных радиусов:
Б. F—Сl—Вг.
4. Термин «молекула» нельзя использовать при характеристике соединения, формула которого:
Г. NaBr.
5. Оксид алюминия является:
А. Амфотерным.
6. Ряд формул веществ, реагирующих с соляной кислотой:
В. Mg, ZnO, NaOH.
7. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
В. СаСl2 и Na2C03.
8. Степень окисления -3 у атома азота в соединении, формула которого:
Г. NH3.
9. Уравнению реакции
4NH3 + 502 = 4N0 + 6Н20
соответствует схема превращения:
Г. N -3 → N +2.
10. Формула предельной одноосновной карбоновой кислоты:
В. С2Н402.
11. Составьте уравнения химических реакций между веществами, формулы которых:
A. Fe и НСl.
Б. Fe(OH)3 и НСl.
В. FeCl3 и NaOH.
Г. Fe и Сl2.
Fe+2HCl= FeCl2+H2
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
FeCl3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl
2Fe+3Cl2= 2FeCL3
12. Составьте генетический ряд углерода.
С→СО2→ Н2СО3→ Na2СО3 или СаСО3
C+O2 → CO2
CO2+ H2O→H2CO3
H2CO3+2NaOH→Na2СО3+H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
13. Составьте молекулярное уравнение реакции, соответствующее схеме Р 0 →Р+5.
Разберите его с точки зрения ОВР.
4P + 5O2 = 2P2O5
P0 — 5e=P+5 восстановитель
O20+4e=2O-2 окислитель
14. По краткому ионному уравнению
Аl3+ + ЗОН- = Аl(ОН)3↓
составьте молекулярное уравнение.
AlCl3 + 3NaOH = Al(OH)3 ↓ + 3NaCl
15. Какой объем оксида углерода (IV) образуется при сгорании 16 г метилового спирта?
2CH3OH +3O2 ->2CO2 +4H2O
2 моль метанола = 2 моль CO2
n (CH3OH) = 16/32 = 0,5 моль
n (CO2) = 0,5 моль
V(CO2) = 0,5*22,4 = 11,2 л
1. Схема распределения электронов по энергетическим уровням в атоме химического элемента, образующего соединения, соответствующие общим формулам ЭН, Э20:
А. 2е, 8е, 1е.
2. Электронное строение иона [+х)2)8)8]2- соответствует элементу, символ которого:
В. S.
3. Ряд элементов, расположенных в порядке увеличения атомных радиусов:
Б. N—Р—As.
4. Термин «молекула» нельзя использовать при характеристике соединения, формула которого:
Г. КСl.
5. Оксид углерода (II) является:
В. Несолеобразующим.
6. Ряд формул веществ, реагирующих с раствором гидроксида кальция:
A. H2S04, С02, Na2C03.
7. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
A. FeS04 и NaOH.
8. Высшая степень окисления серы в соединении, формула которого:
В. Na2S04.
9. Уравнению реакции
N2 + 3Н2 = 2NH3 соответствует схема превращения:
В. N → N +2.
10. Формула органического соединения, изменяющего окраску лакмуса с фиолетовой на красную:
Б. СН3—СООН.
11. Составьте уравнения химических реакций между веществами, формулы которых:
А. Р и 02.
Б. Р205 и Н20.
В. Н3Р04 и Са(ОН)2.
Г. Р и Сl2.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
2Н3РО4 + 3Са(ОН) 2 = Са3(РО4)2 + 6Н2О
2P + 3CI2 = 2PCI3
12. Составьте генетический ряд фосфора.
P—Ca3P2—PH3—P2O5—H3PO4—Na3PO4
1)2P+3Ca=Ca3P2
2)Ca3P2+6HCl=2PH3+3CaCl2
3) 2PH3+4O2=P2O5+3H2O
4) P2O5+3H2O=2H3PO4
5) 2H3PO4+6Na=2Na3PO4+3H2
13. Составьте молекулярное уравнение реакции, соответствующее схеме
2Н +1 → Н2.
Разберите его с точки зрения ОВР.
2Н+ + 2е = Н20 окислитель
2O-2 -4e O20 восстановитель
14. По краткому ионному уравнению
Fe3+ + 3ОН- = Fe(OH)3↓
составьте молекулярное уравнение.
FeCl3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl
15. Какой объем воздуха потребуется для полного сгорания 20 л метана?
CH4 + 2О2 = СО2 + 2Н2О
V1/V2 = n1/n2
n(O2) = 40 л.
40 л кислорода= 21%
Х л воздуха = 100%
V возд. = 40*100/21 = 190,47 л
Ответы на контрольную работу по теме «Металлы» (Габриелян)
- Post category: Контрольные работы по химии 9 класс
- Reading time: 4 минут чтения
1. Распределение электронов по энергетическим уровням в атоме магния:
Г. 2е, 8е, 2е.
2. Число электронов на внешнем электронном слое у атомов щелочных металлов:
А.1.
3. Тип химической связи в простом веществе литии:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г. Стронций.
5. Радиус атомов элементов 3-го периода с увеличением заряда ядра от щелочного металла к галогену:
Г. Уменьшается.
6. Атом алюминия отличается от иона алюминия:
Б. Радиусом частицы.
7. Наиболее энергично реагирует с водой:
А. Калий.
8 . С разбавленной серной кислотой не взаимодействует:
В. Платина.
9. Гидроксид бериллия взаимодействует с веществом, формула которого:
А. КОН (р-р).
10. Ряд, в котором все вещества реагируют с цинком:
А. НСl, NaOH, H2SО4.
11.Предложите три способа получения гидроксида калия. Ответ подтвердите уравнениями реакций.
2К + 2Н2О = 2КОН + Н2
К2О + Н2О = 2КОН
К2СО3 + Са(ОН)2 = СаСО3↓ + 2КОН
12. Определите вещества X, Y, Z, запишите их химические формулы.
Х CuO
Y CuSO4
Z Cu(OH)2
13. Как, используя любые реактивы (вещества) и барий, получить оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
13. 2Ba + O2 = 2BaO
Ba + 2H2O = Ba(OH)2 + H2↑
Ba + Cl2 = BaCl2
14. Расположите металлы: железо, олово, вольфрам, свинец в порядке увеличения относительной твердости (рис. 1).
свинец – олово – железо – вольфрам
15. Рассчитайте массу металла, который можно получить из 144 г оксида железа (II).
n (FeO)= 144г/ 72г/моль = 2 моль
n (Fe) = 2 моль
m (Fe) = 2моль*56г/моль = 112г
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме лития:
Б. 2e, 1е.
2. Число электронов на внешнем электронном слое у атомов щелочных металлов:
А. 1.
3. Вид химической связи в простом веществе натрии:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г. Индий.
5. Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
В. Увеличивается.
6. Атом кальция отличается от иона кальция:
Б. Числом электронов на внешнем энергетическом уровне.
7. Наиболее энергично реагирует с водой:
А. Барий.
8. С соляной кислотой не взаимодействует:
В. Серебро.
9. Гидроксид алюминия взаимодействует с веществом, формула которого:
Б. NaOH(p-p).
10. Ряд, в котором все вещества реагируют с железом:
Б. Cl2, CuC12, НС1.
11. Предложите три способа получения гидроксида кальция. Ответ подтвердите уравнениями реакций.
Са + 2Н2О = Са(ОН)2 + Н2↑
СаО + Н2О = Са(ОН)2
СаCl2 + 2KOH = Ca(OH)2 + 2KCl
12. Определите вещества X, Y, Z, запишите их химические формулы.
X ZnO
Y ZnCl2
Z Zn(OH)2
13. Как, используя любые реактивы (вещества) и литий, получить оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
4Li + O2 = 2Li2O
2Li + 2H2O = 2LiOH + H2↑
2Li + Cl2 = 2LiCl
14. Расположите металлы: алюминий, свинец, золото, медь в порядке увеличения относительной электропроводности (рис. 2).
Свинец, алюминий, золото, медь.
15. Рассчитайте массу металла, который можно получить из 80 г оксида железа (III).
n(Fe2O3) = 80г/160г/моль = 0.5моль
n (Fe) = 2n (Fe2O3) = 1моль
m (Fe) = 1моль*56г/моль = 56г
1. Распределение электронов по энергетическим уровням в атоме натрия:
В. 2е, 8е, 1е.
2. Номер периода в Периодической системе Д. И. Менделеева, в котором нет химических элементов-металлов:
А. 1.
3. Вид химической связи в простом веществе кальции:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г.Натрий.
5. Радиус атомов элементов 2-го периода с увеличением заряда ядра от щелочного металла к галогену:
Г. Уменьшается.
6. Атом магния отличается от иона магния:
Б. Зарядом частицы.
7. Наиболее энергично реагирует с водой:
Г. Рубидий.
8. С разбавленной серной кислотой не взаимодействует:
Г. Ртуть.
9. Гидроксид бериллия не взаимодействует с веществом, формула которого:
Б. NaCl (р-р)
10. Ряд, в котором все вещества реагируют с кальцием:
Б. С12, Н2О, H2SО4.
11. Предложите три способа получения сульфата железа (III). Ответ подтвердите уравнениями реакций.
Fe + H2SO4 = FeSO4 + H2↑
FeO + H2SO4 = FeSO4 + H2O
Fe + CuSO4 = FeSO4 + Cu
12. Определите вещества X, Y, Z, запишите их химические формулы.
X Fe2O3
Y FeCl3
Z Fe(OH)3
13. Как, используя любые реактивы (вещества) и алюминий, получить оксид, амфотерный гидроксид? Составьте уравнения реакций в молекулярном виде.
4Al + 3O2 = 2Al2O3
2Al + 6H2O = 2Al(OH)3 + 3H2
14. Расположите металлы: медь, золото, алюминий, свинец в порядке увеличения плотности (рис. 3).
алюминий, медь, свинец, золото
15. Рассчитайте массу металла, полученного из 160 г оксида меди (II).
n(CuO) = 160г/80г/моль = 2моль
n (Cu) = n (CuO) = 2моль
m (Cu) = 2моль*64г/моль = 128г
1. Распределение электронов по энергетическим уровням в атоме алюминия:
Б. 2е, 8е, 3е.
2. Номер группы в Периодической системе Д. И. Менделеева, состоящей только из химических элементов-металлов:
Б. II.
3. Вид химической связи в простом веществе магнии:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г. Рубидий.
6. Атом и ион натрия отличаются:
Б. Радиусом частицы.
7. Наиболее энергично реагирует с водой:
Б. Калий.
8. С соляной кислотой не взаимодействует:
В. Медь.
9. Гидроксид алюминия не взаимодействует с веществом, формула которого:
В. KNО3(p-p).
10. Ряд, в котором все вещества реагируют с магнием:
Б. С12, О2, НС1.
11. Предложите три способа получения оксида алюминия. Ответ подтвердите уравнениями реакций.
2Al(OH)3 = Al2O3 + 3H2O
4Al + 3O2 = 2Al2O3
2Al + Cr2О3 = Al2О3 + 2Cr
12. Определите вещества X, Y, Z, запишите их химические формулы.
X CaO
Y Ca(OH)2
Z CaCO3
13. Как, используя любые реактивы (вещества), получить из цинка оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
2Zn + O2 = 2ZnO
Zn + 2H2O = Zn(OH)2 + H2
Zn + Cl2 = ZnCl2
14. Расположите металлы: алюминий, вольфрам, олово, ртуть в порядке уменьшения температуры плавления (рис. 4).
вольфрам, алюминий, олово, ртуть
15. Рассчитайте массу металла, который можно получить алюминотермией из 34 г оксида хрома (II).
n(CrO) = 34г/68г/моль = 0,5моль
n (Cr) = n (CrO) = 0,5моль
m (Cr) = 0,5моль*52г/моль = 26г
ГДЗ контрольные и по химии 9 класс Габриелян проверочные работы | Ответы на 5 баллов

Проверочная работа №1. Характеристика химического элемента на основании его положения в Периодической системе:
Проверочная работа №2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений:
Для большинства девятиклассников химия – наука непонятная и сложная. Так что подготовка к каждой последующей проверочной работе становиться настоящим испытанием не только для самих учащихся, но и для их родителей, и даже учителей. Чтобы облегчить это процесс, автор гдз по химии контрольные и проверочные работы за 9 класс Габриелян добавил в свое учебно-практическое издание максимально полный объем информации по предмету и всем возможным заданиям. Периодический закон, металлы и их свойства, кислород, углерод, а также основы химических реакций – это лишь малая часть тем, разобранных в сборнике. Потому, занимаясь с ним, школьники могут более качественно организовать самоподготовку, без привлечения репетиторов и посещения дополнительных занятий.
Для кого решебник является хорошим подспорьем в процессе обучения?
Как показывает практика, решебники являются надежными помощниками не только для учеников, которым хочется просто поскорее списать ответ. Предлагаемый сборник решений к контрольным и проверочным работам по химии для 9 класса авторы Габриелян, Краснова будет хорошим подспорьем в учебном процессе и обязательно пригодится:
- школьникам, для которых химия не является приоритетным предметом. К примеру, любовь к математике, или чтению, не должна быть причиной плохим оценкам по другим предметам. Пользуясь ответами грамотно, для сравнения и анализа ошибок, можно достичь хороших результатов в учебе и запомнить достаточный объем фундаментальных химических законов и формул;
- участникам конкурсов и олимпиад по химии, для которых ежедневное повторение и заучивание различных заданий – привычное дело. Представленные авторами примеры решения заданий соответствуют всем стандартам по оформлению и содержанию, так что запомнить порядок правильности написания ответа к каждому конкретному заданию будет в разы проще;
- учителям, занимающимся с учениками удаленно. Решебник станет отличным помощником в подготовительном процессе. Достаточно использовать его в качестве методического пособия для работы на уроках и подготовки к предстоящим контрольным, чтобы ученики по аналогии сделали потом задания на «отлично»;
- девятиклассникам, у которых попросту не хватает времени на уроки. Не важно, по каким причинам, главное, что с ответами под рукой выучить проблемные темы будет проще. Даже родители при необходимости могут помочь разобраться, немного освежив свои знания благодаря поданной авторами информации.
Доводы в защиту сборников с готовыми ответами
Если подготовка к уроку занимает много времени, а материала учебника не хватает для объяснения сложной темы, обратите внимание на онлайн ответы по химии к контрольным и проверочным работам за 9 класс Габриеляна, Красновой, предложенные на сайте. Все сборники на портале еуроки ГДЗ объединяет одно:
- бесплатные и актуальные, база сайта постоянно обновляется;
- понятные как ученикам, так и родителям;
- ответы можно смотреть через любой браузер, с телефона, компьютера, и даже смарт-тв;
- есть четкие разъяснения процессов с картинками и пометками авторов.
Добавьте к этому удобный поиск и интуитивно понятный интерфейс, и вы получите удобный решебник, который всегда можно носить собой и пользоваться по мере необходимости.
Читайте также:
