Коррозия металлов с кислородной деполяризацией
Обновлено: 04.10.2024
Растворенный в коррозионной среде кислород является основным окислителем во всех наиболее распространенных на практике видах коррозии (атмосферной, подводной, грунтовой). Именно с коррозией с кислородной деполяризацией в практике приходится сталкиваться наиболее часто.
Катодный процесс при коррозии с кислородной деполяризацией описывается следующими реакциями:
O2 + 4Н + + 4е → 2H2O кислая среда,
О2 + 2H2O + 4е → 40Н – нейтральная и щелочная среда.
Равновесный потенциал этих реакций описывается уравнением
Таким образом, равновесный потенциал кислородного электрода всегда на 1,23 В больше равновесного потенциала водородного электрода. В связи с этим термодинамическое условие коррозии с кислородной деполяризацией
выполняется для всех металлов, за исключением золота.
Реакция восстановления кислорода включает в себя следующие стадии:
- растворение кислорода в коррозионной среде;
- диффузия растворенного кислорода к поверхности корродирующего металла;
- отвод образовавшихся продуктов.
Так как растворимость кислорода в электролитах невелика, то очень часто скорость коррозии определяется диффузией кислорода к корродирующему металлу. Стадия разряда также может быть замедлена, но только в достаточно редких случаях: при интенсивно перемешиваемых коррозионных средах или в тонких пленках электролита. Отвод продуктов не может быть замедленным, так как ионы ОН – обладают аномальной подвижностью.
При замедленности стадии диффузии скорость ее, а следовательно, и скорость коррозионного процесса определяются, исходя из закона Фика:
где СО – концентрация кислорода в коррозионной среде;
СS – концентрация кислорода на поверхности корродирующего металла;
D – коэффициент диффузии кислорода;
d – толщина диффузионного слоя.
При СS = 0 наблюдается максимальный коррозионный ток, определяемый предельным током диффузии кислорода:
Толщина диффузионного слоя определяется уравнением
δ=31 1/2 D 1/3 v –1/2 υ 1/6 , (4.14)
где υ – вязкость коррозионной среды,
v – скорость перемешивания коррозионной среды.
Таким образом, скорость коррозии с кислородной деполяризацией зависит прежде всего от концентрации растворенного кислорода в коррозионной среде, которая, в свою очередь, определяется давлением, температурой и концентрацией ионов в коррозионной среде. Кроме того, скорость коррозии существенно зависит от интенсивности движения коррозионной среды.
Коррозионная диаграмма, описывающая коррозию при замедленной стадии растворенного кислорода, представлена на рис.4.2.
Рис.4.2. Коррозионная диаграмма, описывающая коррозию с кислородной деполяризацией при замедленной диффузии растворенного кислорода
При коррозии в реальных условиях диффузия кислорода к отдельным участкам поверхности корродирующего металла может быть неодинаковой (неравномерная аэрация). В связи с этим коррозия с кислородной деполяризацией часто происходит локально, возникают так называемые аэрационные пары, при работе которых металл разрушается в местах, где диффузия затруднена, а катодный процесс коррозии осуществляется на участках с хорошей аэрацией.
Работой аэрационной пары объясняется, например, щелевая коррозия (рис. 4.3) и неравномерная коррозия подземных трубопроводов на различных участках.
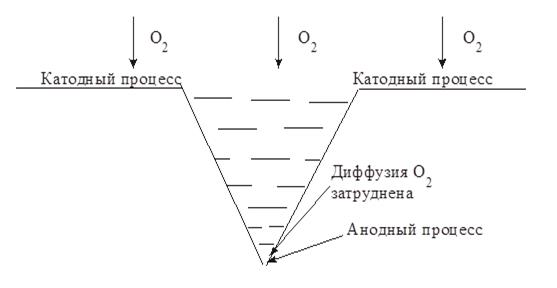
Рис. 4.3. Возникновение аэрационной пары при наличии щелей и
трещин в корродирующем металле
Диффузия кислорода к острию щели затруднена, т.к. путь движения молекул кислорода к острию трещины длиннее, чем к ее основанию. Поэтому на ее вершине локализуется анодный процесс, катодный процесс коррозии будет протекать на поверхности металла вблизи трещины и на стенках трещины. Таким образом, при наличии щели коррозионное поражение интенсивно распространяется вглубь металла (щелевая коррозия).
Ход выполнения работы
В реальных условиях, если возможна коррозия с водородной деполяризацией, то ей обязательно сопутствует в той или иной мере и коррозия с кислородной деполяризацией. В настоящей лабораторной работе коррозию с водородной и кислородной изучают, используя одновременно весовой и объемный методы исследования коррозии.
Весовой метод позволяет рассчитать по разнице между массой металла до коррозии и после нее массовый показатель коррозии под воздействием обоих окислителей (ионов водорода и растворенного кислорода):
где m1 – масса металла до коррозии, г;
m2 – масса металла после коррозии, г (определяется после удаления продуктов коррозии);
S – площадь поверхности корродирующего металла, см 2 ;
τ – время коррозии, ч.

Рис. 4.4. Установка для определения скорости коррозии с водородной
деполяризацией объемным методом (водородный коррозиметр)
1-измерительная бюретка; 2-сосуд с коррозионной средой;
3- исследуемый металл; 4- резиновая подставка; 5- кран
Объемный метод исследования коррозии с помощью водородного кор–розиметра (рис. 4.4) позволяет определить количество выделившегося водорода, а следовательно, и количество металла, прокорродировавшего за счет коррозии с водородной деполяризацией, и массовый показатель коррозии .
Определение осуществляется в следующей последовательности:
– фиксируется количество водорода , выделившееся за определенное время τ при коррозии металла с площадью поверхности S;
– объем выделившегося водорода приводится к нормальным условиям:
где – измеренный объем водорода, см 3 ;
Р – давление, мм (определяется по барометру);
Т – температура опыта в градусах Кельвина.
Исходя из условия стационарности коррозии, количество металла, прокорродировавшего по коррозии с водородной деполяризацией, пропорционально количеству выделившегося водорода и может быть определено по формуле
где А – атомный вес металла;
z – заряд металла;
22400 мл – объем занимаемый 1 г/моль H2 при нормальных условиях.
Далее рассчитывается массовый показатель коррозии под действием ионов водорода:
При известных и можно определить массовый показатель
коррозии с кислородной деполяризацией и долю коррозии (С) с водородной и кислородной деполяризацией:
Лабораторная работа проводится в следующей последовательности.
1. Подготовить образцы к работе: измерить поверхность, зачистить, протереть спиртом, высушить, взвесить.
2. Подготовить установку к измерениям (рис. 4.4), для чего в сосуд 2 залить коррозионную среду, с помощью груши заполнить ею бюретку 1, закрыть кран 5.
3. Вставить образец в резиновую пробку.
4. С помощью щипцов подвести резиновую пробку с образцом металла под бюретку, зафиксировать время и начать измерение объема выделившегося водорода.
5. По окончании опыта достать образец, промыть его, описать внешний вид, наличие продуктов коррозии.
6. Снять продукты коррозии ластиком, если они есть, промыть образец, протереть спиртом, высушить, взвесить.
7. Экспериментальные данные записать в табл. 4.1.
Таблица экспериментальных данных
| Материал обр-ца | Коррозионная среда | Масса образцов, г | ∆ m, г | Объем выделившегося Н2, мл | |||
| до опыта | после опыта | 10 мин | 20 мин | 30 мин | 40 мин. | 50 мин | 1 час |
8. Провести необходимые расчеты по определению показателей коррозии , , и доли коррозии с кислородной и водородной деполяризациями.
9. Рассчитать глубинный показатель общей коррозии (П мм/год):
, где g – плотность металла.
10. По величине глубинного показателя с помощью шкалы коррозионной стойкости (см. табл.1 приложения) определить группу и балл стойкости исследуемого металла.
11. Построить полученные зависимости V = f(t) и по их виду сделать выводы об изменении скорости коррозии с водородной деполяризацией во времени.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.


Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
II – коррозия с кислородной деполяризацией
Все металлы с потенциалами, более отрицательными, чем потенциал водородного электрода, термодинамически должны подвергаться коррозии. Часто этого не наблюдается из-за образования оксидных или солевых пленок на поверхности металла.
По этой причине, коррозия не всегда имеет деструктивный характер. Например, зеленый налет, наблюдаемый на бронзовых скульптурах, является малахитом, образующимся по реакции
Cu + O2 + CO2 + H2O = (CuOH)2CO3] и который защищает металл от атмосферной коррозии. Этим объясняется прекрасное состояние многих старинных бронзовых и медных скульптур и монет.
Из рис. 3 следует, что потенциалы кислородного электрода в зависимости от рН равны:
О2 + 4Н + + 4е = 2Н2О ( рН=0) Е°= +1,23 В
О2 + 2Н2О + 4е = 4ОН - (рН=7) Е°= +0,81 В
О2 + 2Н2О + 4е = 4ОН - (рН=14) Е°= +0,41 В
Очевидно, в насыщенной кислородом кислой среде подвергаться коррозии с кислородной деполяризацией могут те металлы, стандартный электродный потенциал которых лежит
отрицательнее +1,23 В, в нейтральной - +0,81 В, а в щелочной - отрицательнее + 0,4 В.
Коррозии с водородной деполяризацией в кислой среде будут подвергаться металлы, стандартный электродный потенциал которых лежат отрицательнее +0,00 В (Fe, Ni, Zn, Cd, Al), в нейтральной - – 0,41 В, а в щелочной – отрицательнее - - 0,82 В.
Таким образом, все металлы, у которых равновесные потенциалы отрицательнее соответствующего для этих условий потенциала водородного или кислородного электродов, могут растворяться, а металлы, у которых равновесный потенциал положительнее этих потенциалов, не подвергаются коррозии.
Из приведенных данных видно, что более активными в коррозионном отношении являются среды, содержащие кислород, так как потенциал кислородного электрода больше потенциала водородного электрода на 1,23 В при любых значениях рН.
В нейтральной среде коррозия всегда протекает с кислородной деполяризацией. Этот вид коррозии наиболее широко распространен
в природе: он наблюдается при коррозии металлов в воде, почве и в атмосфере. С кислородной деполяризацией ржавеет большинство оборудования, мосты, путепроводы, вышки ЛЭП; металлоконструкции и корпуса судов, соприкасающиеся с речной или морской водой, растворами солей и влажным воздухом.
Коррозия с водородной деполяризацией имеет место:
1) при большой концентрации [H + ] в растворе (коррозия Fe, Zn, Cd, Ni в растворах кислот);
2) в отсутствие в растворе кислорода при отрицательных значениях электродных потенциалов металлов, когда они не покрыты оксидными пленками и способны вытеснять водород из воды.
Рассмотрим наиболее распространенный коррозионный процесс, связанный с коррозией железа в атмосферных условиях, в которых Fe под действием воздуха и воды быстро покрывается ржавчиной.
Коррозионный процесс при этом можно записать следующим образом:
2 Fe + O2 + 2H2O = 2 Fe 2+ + 4OH -
Вторичным коррозионным процессом является стадия осаждения железа в виде гидроксида железа (II), а затем под действием кислорода воздуха и в виде гидроксида железа (III)
Эти продукты коррозии могут претерпевать дальнейшие превращения с образование сложных гидратированных оксидов FeO· Fe2О3 · nH2O – так называемой ржавчины.
Факторы, влияющие на коррозию металлов. Наиболее простой моделью коррозионного процесса, идущего по электрохимическому механизму, является модель коррозионного гальванического элемента. Возникновение катодных и анодных участков на поверхности металла связано с химической и геометрической неоднородностью поверхности, механическими напряжениями,
неоднородностью коррозионной среды, температурным градиентом поверхности, контактом с другими металлами и т.п. Рассмотрим наиболее распространенные случаи.
Химическая неоднородность поверхности.Часто в роли катодов в коррозионных микрогальванических элементах выступают включения: неметаллов, оксидов, нитридов, карбидов и др. В частности, в чугуне – это микровключения графита, в стали – кристаллиты цементита (Fe3C).
На рис. 4 приведена схема разрушения углеродистой стали с кислородной и водородной деполяризациями. Коррозионный микрогальванический элемент образуется из зерен железа и его соединения – карбида железа (Fe3C),отличающихся по значениям электрохимической активности (потенциалов).
(-) А (α-Fe): Fe – 2e → Fe 2+ PH

(-) А (α-Fe): Fe – 2e → Fe 2+ 2 PH≥7

Рис. 4. Схема коррозионного разрушения стали с водородной (а) и кислородной (б) деполяризациями
Геометрическая неоднородность связана с наличием шероховатости поверхности, наличия острых углов, граней, которые приводят к разным значениям энергии Гиббса на отдельных участках поверхности и, следовательно, к разным потенциалам Е1 иЕ2. На
выступах количество оборванных связей металла больше, чем во
впадинах, соответственно и энергия Гиббса выпуклого участка больше, а потенциал поверхности на нем более отрицательный (выступ является анодом).
G 1 = - zFЕ1
Контактная коррозия металлов. Электрохимическая коррозия может развиваться в результате контакта двух различных металлов. В результате будет возникать не микро-, а макрогальванопара.
Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, скрутки проводов алюминий – медь, соединение железа алюминиевыми или медными клепками и т.д.).
На рис.5 показана коррозия железа, находящегося в контакте с медью. Возникает коррозионный гальванический элемент, в котором железо является анодом (Е°= -0,44 В), а медь – катодом (Е°= 0,34 В). Анодный процесс будет представлять собой растворение железа, катодный же будет определяться видом и составом коррозионной среды.

Зона коррозии
Рис. 5. Коррозия при контакте двух металлов
Влияние неоднородности состава коррозионной среды может приводить к образованию микрогальванопар даже на поверхности одного и того же металла. Примером может служить коррозия
металла под каплей воды (рис.6). Так как поверхностные слои воды содержат больше растворенного кислорода, чем внутренние, поверхность металла в центре под каплей оказывается более активной (анодный участок), а на периферии капли будет наблюдаться восстановление кислорода (катодный участок). После высыхания капли в ее центре появляется довольно глубокое пятно ржавчины.

Рис. 6. Схема коррозии железа под каплей воды
Подобные гальванопары возникают очень часто при коррозии бытового и промышленного оборудования и в подземных сооружениях, из-за неравномерной аэрации кислородом отдельных участков поверхности металла. В качестве примера может служить коррозия стальной сваи, закопанной в речное дно (рис 7).

Рис. 7. Коррозия в результате неравномерного доступа кислорода. Б – свая; А – анодный участок; К – катодный участок
Часть сваи, находящаяся в воде, омывается растворенным в ней кислородом и, будет играть роль катода. Почва практически не
содержит растворенного кислорода и та часть сваи, которая
находится в ней, будет анодом и подвергается разрушению.
Механические напряжения. Микрогальванопары могут возникать при действии внешних и внутренних механических напряжений (например, изгиб и провисание балки, напряженные сварные швы). Коррозия в этом случае приводит к межкристаллитному растрескиванию или так называемой "ножевой" коррозии. Такой вид коррозии возникает из-за того, что на растянутой стороне балки межатомные связи растянуты и более слабы, чем на верхней стороне. Энергия Гиббса на этой стороне балки равна ∆G1. На сжатой стороне балки энергия Гиббса имеет более отрицательные значения ∆G2. Так как ∆G связано с потенциалом ∆G = -nFЕ, то на сжатой стороне имеем более положительный потенциал Е2 (катод), а на растянутой – более отрицательный потенциал Е1 (анод).
Таким образом, механические напряжения всегда приводят к возникновению гальванопар с ЭДС = Е2 – Е1. При этом в области растяжений наблюдается растворение металла, а в области сжатий (катодные участки) восстанавливается окислитель (Н + или О2).
Кинетика коррозионных процессов.Имеется много примеров того, как более активные металлы растворяются значительно медленнее, чем менее активные. Например, скорость коррозии алюминия в атмосферных условиях значительно меньше скорости коррозии железа (-0,44 В), хотя стандартный электродный потенциал алюминия более отрицателен (-1,66 В). Это говорит о том, что помимо влияния термодинамических факторов на процессы коррозии необходимо учитывать также и кинетические факторы, из которых наиболее важным является способность металлов переходить в пассивное состояние.
Процесс пассивации металлов связан с образованием на их поверхности тонких пленок малорастворимых соединений - оксидов, гидроксидов, солей или их смесей. Эти пленки блокируют поверхность и препятствуют переносу электронов и окислителя к поверхности металла.
Известно, что коррозия металла с водородной деполяризацией
протекает тем быстрее, чем меньше перенапряжение реакции
выделения водорода (hН2,В) на нем (см. табл. 3).
Например, Е°Pb 2+ /Pb = - 0,126 В, т.е. свинец термодинамически неустойчив в кислых средах, однако с разбавленными серной и соляной кислотами металл не взаимодействует, так как на свинце hН2 = -1,56 В.
По этой же причине цинк (Е° (Zn 2+ /Zn) = -0,76 В) тоже неустойчив в кислых средах. Однако, из-за большого перенапряжения водорода, он очень медленно вытесняет водород из кислот.
В контакте цинка с медью (Zn | H + | Cu), на Cu восстановление водорода протекает значительно быстрее (hН2 на меди на 0,4 В меньше, чем на Zn). По этой причине в контакте с медью цинк растворяется очень активно, что сопровождается интенсивным выделением водорода на меди.
Коррозия металлов
Ежегодно из-за коррозии теряются огромные количества металла. По ориентировочным данным от 5 до 30% получаемых чёрных металлов разрушается в результате коррозии. Однако во многих случаях косвенные убытки от коррозии могут значительно превышать прямые потери за счёт растворения металла.
Это и выход из строя металлических конструкций, сложных приборов и аппаратуры, простой оборудования, утечки нефти и газа из прокорродировавших трубопроводов, сопровождаемые при этом нанесением природе невосполнимого экологического ущерба. Поэтому изучение причин, вызывающих коррозию, установление влияния различных факторов на скорость коррозии имеют своей практической целью защиту металлов и сплавов от коррозионного разрушения при их обработке и эксплуатации.
Механизм коррозии.
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. В процессе химической коррозии происходит прямое гетерогенное взаимодействие металлов с окислителем окружающей среды, в результате которого между ними совершается обмен электронами, т.е. протекает обычная ОВР. Примером может служить окисление металлов кислородом воздуха при высоких температурах: Me + O2 ® MeO.
Электрохимическая коррозия возникает при контакте металлов с электролитами (во влажном воздухе, в почве, в растворах электролитов и т.п.) и является результатом протекания сопряжённых электродных процессов в образующихся короткозамкнутых гальванических элементах.
Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии двигаются внутри металла от анодных участков к катодным, т.е. образуются короткозамкнутые гальванические элементы, в которых анодные и катодные участки замкнуты накоротко через сам металл.
Отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходит анодный или катодный процессы, являются в зависимости от их размеров короткозамкнутыми макрогальваническими элементами (имеющими размеры, хорошо различимые невооружённым глазом) и микрогальваническими (обнаруживаемыми лишь при помощи микроскопа), т.е. явлются коррозионными элементами.
Обычно поверхность корродирующего металла представляет собой многоэлектродный коррозионный элемент (чередование катодных и анодных участков – рис. 10.6). В первом приближении эту поверхность можно считать как двухэлектродную систему, т.е. состоящую из участков двух видов: анодных и катодных. Коррозионный элемент (короткозамкнутый гальванический элемент) схематично можно изобразить:
(–) А | коррозионная среда | К (+)
При работе коррозионных элементов, т.е. при электрохимической коррозии имеют место три основных процесса (рис. 10.7):
1. Анодный процесс – окисление металла, образование гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции:
2. Процесс перетекания электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов и анионов в растворе.
3. Катодный процесс – приём электронов каким – либо окислителем окружающей коррозионной среды (какими – либо ионами или молекулами – деполяризаторами) на границе раздела фаз металл - коррозионная среда:
Ох + ne?® Red или Д + ne? ® [Дne?].
В коррозионных процессах окислитель часто называют деполяризатором 1 (Д); [Дne?] – восстановленная форма окислителя.
Таким образом, электрохимическая коррозия на неоднородной (гетерогенной) поверхности металла аналогична работе короткозамкнутого гальванического элемента.
Наиболее распространёнными окислителями, деполяризаторами в коррозионном процессе являются ионы водорода и молекулы кислорода. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией.
В наиболее простом виде электродные процессы для этого случая могут быть представлены уравнениями:
а) в кислых растворах (pH < 7)
б) в деаэрированных 2 (удален растворенный кислород) нейтральных и щелочных растворах (рН7)
Потенциал восстановления ионов водорода (потенциал водородного электрода) зависит от парциального давления водорода и рН. При (101кПа) данный потенциал рассчитывается по уравнению:
Например, при рН = 0 ;
Коррозия с водородной деполяризацией возможна, если потенциал восстановления ионов водорода больше потенциала окисляемого металла, т.е. когда ЭДС образующегося короткозамкнутого гальванического элемента больше нуля: Еэ = jк - jа = jок-ль - jв-ль > О.
Скорость коррозии с водородной деполяризацией зависит от рН и температуры среды, природы металла.
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Электродные процессы в этом случае могут быть представлены уравнениями:
Необходимо отметить, что в обычных условиях во всех растворах есть растворённый кислород – О2. Потенциал восстановления кислорода (потенциал кислородного электрода) зависит от парциального давления кислорода и рН среды. При (101 кПа) данный потенциал рассчитывается по уравнению
Коррозия с кислородной деполяризацией возможна, если потенциал восстановления кислорода больше потенциала окисляемого металла. Данный вид коррозии имеет место в нейтральных, щелочных растворах, во влажном воздухе (О2+Н2О). Скорость коррозии в этом случае определяется скоростью диффузии кислорода и возрастает при перемешивании раствора и увеличении концентрации растворённого кислорода. В кислых растворах в обычных условиях также есть растворённый кислород, но скорость его восстановления в кислых средах мала по сравнению со скоростью восстановления ионов водорода. Поэтому коррозией с кислородной деполяризацией в кислых средах пренебрегают.
На рис. 10.8 представлена диаграмма потенциал – рН, позволяющая определять возможность коррозии различных металлов с водородной и кислородной деполяризацией. Если ЭДС коррозионного элемента Еэ > О, то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя Еэ = jок-ль - jв-ль , то коррозия возможна при условии, что потенциал окислителя больше потенциала металла: . На данной диаграмме выделяются три области.
Область 3: если > , то коррозия металла невозможна, исключая случаи наличия других деполяризаторов. Потенциалы золота, платины, например, в отсутствие комплексообразователя во всей области рН больше потенциала кислородного электрода, поэтому золото и платина корродировать с поглощением О2 и выделением Н2 не могут.
Катодами в коррозионных элементах, как правило, являются:
1. Включения металлов, имеющих больший электродный потенциал.
2. Токопроводящие неметаллические примеси (углерод, нитриды карбиды, оксиды). Например, чугун легко ржавеет во влажном воздухе из-за примеси углерода.
3. Хорошо окисленные участки металла при неодинаковой аэрации.
Коррозия возможна при неодинаковом доступе воздуха (аэрации) к различным частям металла. Наиболее окисленный участок металла является электрохимически более пассивным (электродный потенциал такого участка больше электродного потенциала неокисленного металла). Возникновением короткозамкнутых гальванических элементов вследствие неодинакового доступа кислорода воздуха можно объяснить ржавление железа, сложенного в пачки, внутри пачек; по этой же причине наблюдается ржавление проволочных тросов изнутри, а не снаружи.
4. Недеформированные, необработанные механически участки металла.
При обточке, сверлении, штамповке и других видах механической обработки затраченная энергия частично превращается в тепловую, а частично идёт на увеличение поверхностной энергии обработанного участка (явление наклёпа). В результате обработанная часть детали по сравнению с необработанной обладает повышенным запасом энергии и большей химической активностью и поэтому служит анодом. В присутствии электролита деформированный участок разрушается, катодный процесс восстановления окислителя происходит на поверхности необработанной части детали.
Практическими примерами разрушения металла в результате неодинаковой механической обработки являются ржавление кровельного железа на крыше в местах стыка, где листы подвергались ударам и изгибу, коррозия металлических деталей в местах сверлений.
В реальных условиях в химической устойчивости механических конструкций большую роль играют свойства поверхностных оксидных слоёв, приводящих к пассивации металла.
Пассивность металлов.
Пассивностью металла называют состояние повышенной коррозионной устойчивости, вызываемое торможением анодного процесса в результате образования на поверхности металла защитных плёнок. Продукт окисления (коррозии) создает на поверхности металла плёнку, которая в дальнейшем влияет на процесс коррозии. Например, на поверхности алюминия образуется сплошная, хорошо сцепленная с металлом оксидная плёнка Al2O3, которая защищает его от дальнейшего окисления. Подобные защитные пленки имеются у хрома, цинка, титана и других металлов, что позволяет использовать их в качестве распространённых конструкционных материалов.
У других металлов, например у железа, в условиях контакта с воздухом и влагой образуется пористая, рыхлая, плохо сцепленная с металлом поверхностная плёнка ржавчины, не способная защитить металл от последующего окислительно-восстановительного взаимодействия с окружающей средой. Ржавчина образуется в ходе превращений:
Таким образом, ржавчина – сложные гидратированные оксиды железа. Однако железо можно запассивировать с помощью обработки его концентрированной азотной кислотой:
При этом образуется плотный, предотвращающий дальнейшее разрушение поверхностный оксидный слой. Защиту железа обеспечивает также тонкий плотный слой ортофосфата железа, не растворимый в воде. Фосфатирование сталей и чугуна осуществляется в специальных растворах.
Рассмотрим примеры возникновения и работы короткозамкнутых гальванических элементов в результате контакта двух металлов.
Пример 1. Железо с медью находятся в контакте. Какой металл будет корродировать в растворе хлорида натрия?
Решение. На любом металле, находящемся в электролите, за счёт процессов обмена возникает электродный потенциал, величина которого отражает физико – химическую природу этого элемента и электролита. Чем активнее металл, тем отрицательнее его электродный потенциал. В большинстве случаев состав электролита и внешние условия отличаются от стандартных, поэтому возникающие потенциалы не будут стандартными. В данном случае нас интересуют лишь их относительные величины: какой из двух контактирующих металлов электроотрицательнее, какой – положительнее. Для получения ответа на этот вопрос можно пользоваться таблицей стандартных электродных потенциалов, помня, что потенциалы в этих случаях отличаются от стандартных:
При контакте двух металлов, имеющих различные потенциалы, пойдёт локальный электрический ток – перемещение электронов от железа к меди (рис. 10.9). Несмотря на ушедшие к медному электроду электроны, потенциал железного электрода восстановит свою первоначальную величину за счёт процесса окисления, т.е. железо будет разрушаться с переходом ионов Fe 2+ из металлической решетки в электролит. Электроны, поступившие к меди, казалось бы должны изменить имеющийся у меди потенциал, но этот потенциал будет поддерживаться, т.к. поступившие к меди электроны израсходуются в ходе процесса, потребляющего электроны (процесса восстановления).
Какой именно процесс восстановления будет протекать на меди - зависит от состава электролита. В нейтральном водном растворе NaCl, контактирующем с воздухом, энергетически выгодным будет процесс восстановления кислорода, растворённого в воде. Рис. 10.8 подтверждает термодинамическую возможность коррозии железа с кислородной деполяризацией: .
Схема работы коррозионного элемента для данного случая имеет вид
(-) Fe | водный раствор NaCl | Cu (+)
A: Fe – 2e? = Fe 2+ 2
2Fe + O2 + 2H2O = 2 Fe 2+ + 4OH - = 2 Fe(OH)2$
Ответ: корродирует железо с кислородной деполяризацией; первичные продукты коррозии – Fe 2+ и OH; вторичный продукт коррозии – Fe(OH)2.
Образующийся гидроксид железа (II) подвергается дальнейшему окислению: 4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3 .
Аналогичные электродные процессы будут протекать при коррозии железа во влажном воздухе.
Пример 2. Цинк с медью находятся в контакте. Какой металл будет корродировать в деаэрированном растворе хлорида натрия?
(-) Zn | деаэрированный раствор NaCl | Cu (+).
В растворе отсутствует окислитель О2, поэтому здесь можно ожидать коррозию цинка с водородной деполяризацией. Термодинамически этот процесс возможен (см. рис. 10.8), т.к. < .
Ответ: корродирует цинк с водородной деполяризацией. Первичные продукты коррозии – Н2, Zn 2+ и OH; вторичный продукт коррозии – Zn(OH)2.
Пример 3. Марганец содержит примесь меди. Какой металл будет корродировать в растворе соляной кислоты (pH=2)?
(-) Mn раствор HCl Cu(+)
то термодинамически возможна коррозия марганца с водородной деполяризацией (см. рис. 10.8).
Mn + 2H + = Mn 2+ + H2
Ответ: происходит коррозия марганца с водородной деполяризацией, продукты коррозии – Mn 2+ и Н2.
Если в условии задачи неизвестна концентрация кислоты, водородный показатель рН, то решение выполняется для рН = 0.
Коррозия с кислородной деполяризацией

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Читайте также:
