Кристаллы металлической меди имеют гранецентрированную кубическую элементарную ячейку
Обновлено: 13.05.2024
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка. Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Э – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определенными.
углы между осями (,,).
координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
базис решетки - количество атомов, приходящихся на одну элементарную ячейку решетки.
плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74)
Различают 7 форм кристаллических решеток. По типу расположения частиц - 14 типов (решетки Браве).
Три типа наиболее распространенных кристаллических решеток.
О атомы располагаются в вершинах куба и в его центре (V, W, Ti, Fe, щелочные, щелочноземельные металлы)
,,=90 0 . На эл. ячейку - 2 частицы, координационное число К8, коэф. компактности - 0,68
Гранецентрированная кубическая (ГЦК) атомы рассполагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au, Fe)
На эл. ячейку - 4 частицы, коорд. число К12, коэф. компактности - 0,74.
Гексагональная, в основании которой лежит шестиугольник. (Ti,Zn, Be, Mn)
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) (если с/а=1,633) – имеется 3 дополнительных атома в средней плоскости (цинк).
коорд. число - К12, коэф. компактности - 0,74.
3. Несовершенства кристаллической решетки реальных металлов.
Из жидкого расплава можно вырастить монокристалл. Их обычно используют в лабораториях для изучения свойств того или иного вещества.
Металлы и сплавы, полученные в обычных условиях, состоят из большого количества кристаллов, то есть, имеют поликристаллическое строение. Эти кристаллы называются зернами. Они имеют неправильную форму и различно ориентированы в пространстве. Каждое зерно имеет свою ориентировку кристаллической решетки, отличную от ориентировки соседних зерен, вследствие чего свойства реальных металлов усредняются, и явления анизотропии не наблюдается
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие структурные несовершенства:
точечные – малые во всех трех измерениях;
линейные – малые в двух измерениях и сколь угодно протяженные в третьем;
поверхностные – малые в одном измерении.
Точеные дефекты
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей.
Вакансия – отсутствие атомов в узлах кристаллической решетки, «дырки», которые образовались в результате различных причин. Концентрация вакансий в значительной степени определяется температурой тела. Перемещаясь по кристаллу, одиночные вакансии могут встречаться. И объединяться в дивакансии. Скопление многих вакансий может привести к образованию пор и пустот.
Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие. Концентрация дислоцированных атомов значительно меньше, чем вакансий, так как для их образования требуются существенные затраты энергии. При этом на месте переместившегося атома образуется вакансия.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Вокруг точечных дефектов решетка искажена. Напряжения и деформации вокруг них убывают. Они обратнопропорциональны кубу расстояния от точечного дефекта. Они сильно влияют на некоторые физические свойства тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать. На механические характеристики значительного влияния не оказывают.

Линейные дефекты:
Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей.
Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости
Неполная плоскость называется экстраплоскостью.
Причина введения теории краевых дислокаций - большая разница между теоретической и реальной прочностью кристалла: теор/р 10 3 .
Большинство дислокаций образуются путем сдвигового механизма. Ее образование можно описать при помощи следующей операции. Надрезать кристалл по плоскости АВСD, сдвинуть нижнюю часть относительно верхней на один период решетки в направлении, перпендикулярном АВ, а затем вновь сблизить атомы на краях разреза внизу.
Н
Если экстраплоскость находится в верхней части кристалла, то краевая дислокация – положительная, если в нижней, то – отрицательная. Дислокации одного знака отталкиваются, а противоположные притягиваются.
Винтовая дислокация получена при помощи частичного сдвига по плоскости Q вокруг линии EF. На поверхности кристалла образуется ступенька, проходящая от точки Е до края кристалла. Такой частичный сдвиг нарушает параллельность атомных слоев, кристалл превращается в одну атомную плоскость, закрученную по винту в виде полого геликоида вокруг линии EF, которая представляет границу, отделяющую часть плоскости скольжения, где сдвиг уже произошел, от части, где сдвиг не начинался. Вдоль линии EF наблюдается макроскопический характер области несовершенства, в других направлениях ее размеры составляют несколько периодов.
Если переход от верхних горизонтов к нижним осуществляется поворотом по часовой стрелке, то дислокация правая, а если поворотом против часовой стрелки – левая.
Винтовая дислокация не связана с какой-либо плоскостью скольжения, она может перемещаться по любой плоскости, проходящей через линию дислокации. Вакансии и дислоцированные атомы к винтовой дислокации не стекают.
В процессе кристаллизации атомы вещества, выпадающие из пара или раствора, легко присоединяются к ступеньке, что приводит к спиральному механизму роста кристалла.
Линии дислокаций не могут обрываться внутри кристалла, они должны либо быть замкнутыми, образуя петлю, либо разветвляться на несколько дислокаций, либо выходить на поверхность кристалла.
Дислокационная структура материала характеризуется плотностью дислокаций.
П в кристалле определяется как среднее число линий дислокаций, пересекающих внутри тела площадку площадью 1 м 2 , или как суммарная длина линий дислокаций в объеме 1 м 3
Плотность дислокаций изменяется в широких пределах и зависит от состояния материала. После тщательного отжига плотность дислокаций составляет 10 5 …10 7 м -2 , в кристаллах с сильно деформированной кристаллической решеткой плотность дислокаций достигает 10 15 …10 16 м –2 .

Плотность дислокации в значительной мере определяет пластичность и прочность материала.
Минимальная прочность определяется критической плотностью дислокаций
Если плотность меньше значения а, то сопротивление деформированию резко возрастает, а прочность приближается к теоретической. Повышение прочности достигается созданием металла с бездефектной структурой, а также повышением плотности дислокаций, затрудняющим их движение. В настоящее время созданы кристаллы без дефектов – нитевидные кристаллы длиной до 2 мм, толщиной 0,5…20 мкм - “усы“ с прочностью, близкой к теоретической: для железа =30000 МПа. При упрочнении металлов увеличением плотности дислокаций, она не должна превышать значений 10 15 …10 16 м –2 . В противном случае образуются трещины.
Дислокации образуются при образовании кристаллов из расплава или газообразной фазы, при срастании блоков с малыми углами разориентировки. При перемещении вакансий внутри кристалла, они концентрируются, образуя полости в виде дисков. Если такие диски велики, то энергетически выгодно “захлопывание” их с образованием по краю диска краевой дислокации. Образуются дислокации при деформации, в процессе кристаллизации, при термической обработке.
Поверхностные дефекты:
Высоко- и малоугловые границы.

Граница между зернами - поверхностный деффект, в котором угол разориентировки между соседними кристалическими решетками составляет 5-10 градусов (высокоугловая граница)
Угол разориентировки между отдельными блоками менее 5 градусов(малоугловая граница). Пространство между блоками - совокупность линейных дислокаций.
Поверхностные деффекты оказывают сильное влияние на механические свойства.
т=0+kd -1/2 - предел текучести (d - размер зерна).
Представляют собой часть атомной плоскости, в пределах которой нарушен нормальный порядок чередования атомных слоев. Например в сплавах с ГЦК решеткой чередуются плотноупакованные слои ABC ABCAB . , а при пересечении дефекта упаковки слои чередуются в последовательности ABCBCABC. . Чередование слоев BCBC. типично для кристаллов с ГПУ решеткой, и таким образом дефект упаковки представляет собой как бы тонкую пластину с ГПУ решеткой в ГЦК решетке. Дефекты упаковки тесно связанны с дислокациями и ограниченны малоподвижными частичными дислокациями. Чем меньше поверхностная энергия дефекта упаковки, тем он шире и тем сильнее его влияние на свойства. Дефекты упаковки влияют на электросопротивление, упрочнении при деформировании, рекристаллизацию, кристаллографию фазовых превращений.
Примеры решения задач
Пример 1. Определить число узлов, приходящееся на одну элементарную ячейку в базоцентрированной ромбической решетке.
Решение. Выделим элементарную ячейку в кубической решетке (рис. 3.1) и определим, скольким соседним элементарным ячейкам принадлежит той или иной узел выделенной ячейки. Узлы в углах принадлежат одновременно восьми элементарным ячейкам, узлы на гранях принадлежат только двум ячейкам. Поэтому общее число узлов, приходящееся на одну базоцентрированную ячейку,
n = 1/8 × 8 + 1/2 × 2 = 2 узла.
`Рис. 3.1. Элементарная ячейка
Пример 2. Определить число элементарных ячеек кристалла меди объемом V = 1 см 3 .
Решение. Число элементарных ячеек кристалла определяется из выражения (3.4)
Поскольку ячейка состоит из одинаковых атомов, то k = 1. Плотность меди считаем известной (ρ = 8,93 × 10 3 кг/м 3 ). Малярная масса вещества определяется с помощью периодической таблицы Менделеева (М = 63,55 × 10 -3 кг/моль). Медь относится к кристаллам гранецентрированной кубической решетки, следовательно ее ячейка содержит 4 атома (n=4).
Подставив данные в расчетную формулу, получим z = 8,93 × 10 3 × 1 × 6,02 × 10 23 × 1 × 10 -6 /(4 × 63,55 × 10 -3 ) = 2,11 × 10 22 .
Пример 3. Определить параметры решетки а и расстояние d между ближайшими соседними атомами кристалла кальция.
Решение. Поскольку кальций имеет ГЦК-решетку, то объем элементарной ячейки V=a 3 . С другой стороны, объем элементарной ячейки может быть найден из соотношения (3.2)
В результате можно записать с учетом (3.4)
Подставляя значения величин n, М и Na в формулу и проводя вычисления, получим а = 556 пм.
Расстояние между ближайшими соседними атомами находится из простых геометрических соображений
Пример 4. Написать индексы направления прямой, проходящие через узлы [[110]] и [[011]] кубической примитивной решетки.
Решение. Рассмотрим аналитический метод решения. Напишем в общем виде уравнение прямой, проходящей через две точки в пространстве, с индексами узлов [[m1 n1 p1]] и [[m2 n2 p2]
Величины, стоящие в знаменателях, пропорциональны направляющим косинусам прямой. Но так как эти величины целочисленны (по определению), то они и будут являться индексами направления. Подставляя в знаменатели данного выражения значения индексов узлов, получим:
Таким образом искомые индексы направления [101].
Возможен также графический способ решения.
Пример 5. Найти индексы Миллера для плоскости, содержащей узлы с индексами [[2 0 0]], [[0 1 0]] и [[0 0 2]].
Решение. Анализ условий задачи показывает, что известны отрезки, отсекаемые плоскостью на осях координат. Отрезки выражаются в единицах постоянной решетки соответственно 2,1,2. В соответствии с общим правилом нахождения индексов Миллера запишем обратные значения данных чисел ½; 1/1; ½ и приведем их к наименьшему целому кратному этих чисел (умножив их на 2). Полученная совокупность значений и есть искомые индексы Миллера – (1 2 1).
Можно воспользоваться аналитическим методом, решая задачу об отыскании уравнения плоскости, проходящей через три точки с заданными индексами Миллера. Особенно удобен этот способ в том случае, когда точки не лежат на осях координат.
Задачи
1.1. Сколько атомов приходится на одну элементарную ячейку примитивной решетки кубической сингонии? Нарисовать ячейку.
1.2. Назвать и нарисовать элементарную ячейку кристаллической решетки кубической сингонии, содержащую 2 атома.
1.3. Сколько атомов приходится на одну элементарную ячейку гранецентрированной решетки кубической сингонии? Нарисовать ячейку.
1.4. Определить и нарисовать элементарную ячейку кристаллической решетки гексагональной сингонии, если она содержит 2 частицы.
1.5. Сколько атомов приходится на две смежных элементарных ячейки триклинной сингонии? Нарисовать ячейки.
1.6. Определить и нарисовать элементарную ячейку кристаллической решетки моноклинной сингонии, если она содержит 1 частицу.
1.7. Сколько атомов приходится на две элементарных ячейки базоцентрированной решетки ромбической сингонии. Нарисовать ячейки.
1.8. Определить и нарисовать элементарную ячейку кристаллической решетки ромбической сингонии, если она имеет 2 частицы.
1.9 Сколько атомов приходится на четыре элементарных ячейки гранецентрированной решетки ромбической сингонии? Нарисовать ячейки.
1.10. Определить и нарисовать элементарную ячейку кристаллической решетки тетрагональной сингонии, если она содержит 2 атома.
1.11. Определить число элементарных ячеек кристалла объемом V=1 м 3 (ГЦК решетка).
1.12. Определить число частиц в кристалле CsCl объемом 1 м 3 (ГЦК).
1.13. Найти число элементарных ячеек в кристалле меди объемом V=1 см 3 (ГЦК).
1.14 Определить число частиц в кристалле меди объемом 10 см 3 (ГЦК).
1.15. Вычислить число элементарных ячеек в кристалле кобальта объемом 1 м 3 (структура гексагональная).
1.16. Определить число частиц в 1 см 3 кристалла кобальта (структура гексагональная).
1.17. Найти число элементарных ячеек в 10 см 3 кристалла магния (структура гексагональная).
1.18. Определить число частиц в 5 см 3 кристалла магния (структура гексагональная).
1.19. Найти число элементарных ячеек в 5 см 3 бериллия (структура гексагональная).
1.20. Определить число частиц в 1 м 3 кристалла бериллия (структура гексагональная).
1.21. Определить плотность кристалла гелия при температуре 2К. Структура гексагональная, а=0,357 нм.
1.22. Вычислить постоянную решетки кристалла бериллия, который имеет гексагональную структуру, параметр решетки равен 0,359 нм.
1.23. Определить постоянные а и с решетки магния, который представляет собой гексагональную структуру.
1.24. Вычислить постоянную решетки и расстояние d между ближайшими соседними атомами для алюминия (ГЦК).
1.25. Определить атомную массу кристалла, если известно, сто расстояние d равно 0,304 нм.
1.26. Вычислить постоянную решетки и расстояние d для вольфрама (ОЦК).
1.27. Найти плотность кристалла неона (Т=20К), если решетка ГЦК и а=0,452 нм.
1.28. Найти плотность кристалла стронция, если известно, что его решетка ГЦК и а=0,43 нм.
1.29. Найти постоянную решетки и расстояние d для кристалла стронция (ГЦК).
1.30. Вычислить постоянную решетки и расстояние d для кристалла меди (ГЦК).
1.31. Написать индексы направлений прямых, проходящих в кубической решетке через начало координат и узел с кристаллографическими индексами, в двух случаях 1) [[1 2 1]]; 2)[[1 1 2]]. Показать на рисунке.
1.32. Написать индексы направлений ,проходящих через два узла 1) [[1 2 1]] и [[1 3 1]]; 2) [[2 1 1]] и [[1 1 1]]. Показать на рисунке.
1.33. Найти индексы Миллера плоскости, отсекающей на осях координат отрезки ; ; . Показать на рисунке.
1.34. Найти индексы плоскости, отсекающей на осях отрезки ; ; . Показать на рисунке.
1.35. Найти индексы вертикальной плоскости, отсекающей на оси х отрезок 2а, на оси у – отрезок 3b. Проиллюстрировать плоскость.
1.36. Найти индексы плоскости, отсекающей на осях отрезки 1а; -3b; 2с. Дать иллюстрацию плоскости.
1.37. Система плоскостей примитивной кубической решетки задана индексами (1 1 1). Определить расстояние d между соседними плоскостями, если параметр решетки равен 0,3 нм.
1.38. Система плоскостей в примитивной кубической решетке задана индексами Миллера (2 2 1). Найти наименьшие отрезки, отсекаемые плоскостью на осях координат, и изобразить эту плоскость графически.
1.39. Определить параметр а примитивной кубической решетки, если межплоскостное расстояние d для системы плоскостей (-2 1 2) равно 0,12 нм.
Кристаллическая структура металлов
Изучение металлов в соответствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур:
А1 – кубическая гранецентрированная решетка (ГЦК)
Кубической гранецентрированной решеткой обладают следующие металлы: g - Fe, Al, Cu, Ni, a - Co, Pb, Ag, Au, Pt и др.
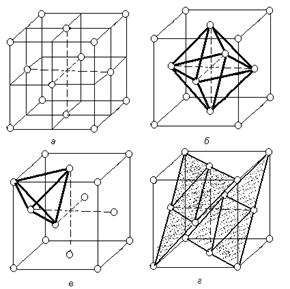
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис.1.5).
Каждый атом в этой решетке окружен 12-ю ближайшими соседями, располагающихся на одинаковых расстояниях, равных = 0,707×а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12-ти называется координационным числом кристаллической решетки. Кроме этих ближайших атомов, в кристаллической решетке имеется 6 атомов, удаленных на значительно большие расстояния, равные а.
Рассматриваемая кристаллическая решетка имеет два вида пустот, (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах) образующих твердые растворы внедрения.
Наибольшие междоузлия или пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК решетки, занимающими места в вершинах правильного октаэдра. В связи с этим, они называются октаэдрическими пустотами (рисунок 1.5, б). Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке g - Fe.
Кроме этих пустот в ГЦК решетке имеются более мелкие пустоты, называемые тетраэдрическими, в связи с тем, что их окружают 4 атома. Всего в ГЦК решетке 8 тетраэдрических пустот (рисунок 1.5, в).
Размеры тетраэдрических и октаэдрических пустот можно ощутить, если предположить, что решетка построена из жестких шаров, радиусом r, соприкасающихся друг с другом; в этом случае в имеющиеся промежутки можно было бы поместить сферы, радиусом 0,41 r и 0,225 r соответственно для октаэдрической и тетраэдрической пустот.
 |
| Рисунок 1.5. Гранецентрированная кубическая решетка (а), размещение в ней октаэдрических (б) и октаэдрических (в) пустот; г - расположение плотноупакованных плоскостей (111) |
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба являются плоскости изображенные на рисунке. Их условное обозначение (рисунок 1.5., г).
Объемно-центрированную кубическую решетку А2 (ОЦК) имеют металлы a - Fe, хром, вольфрам, молибден, ванадий, натрий, литий и другие. Структура А2 является менее плотноупакованной.
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рисунок 1.6).
Каждый атом в этой ячейке имеет 8 ближайших соседей, располагающихся на расстоянии где, а – длина ребра куба. Следовательно, координационное число решетки равно 8. Иногда его обозначают (8 + 6), т.к. следующие по удаленности атомы расположено на расстоянии а, число их равно 6.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рисунок 1.6, в). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рисунок 1.6, г). Если структуру ОЦК решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические - 0,154 r.
 |
| Рисунок 1.6. Объемноцентрированная кубическая решетка (а), размещение в ней наиболее плотной системы плоскостей (110) б; тетраэдрических (в) и октаэдрических (г) |
Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК.
Внедрение других атомов в октаэдрическую пору ОЦК решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки a - Fe.
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства (рисунок 1.6.б). В этих плоскостях имеются 2 направления, в которых жесткие шары могут соприкасаться.
Гексагональной плотноупакованной решеткой А3 (ГПУ) обладают такие металлы, как Zn, b - Co, Cd, Mg, a - Ti, a - Zr.
Гексагональная решета построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояиях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рисунок 1.7).
 |
| Рисунок 1.7. Гексагональная плотноупакованная решетка (ГПУ): а - расположение атомов; б - выделенные типы пустот в решетке: октаэдрическая (вверху) и тетраэдрическая (внизу) |
Расстояние между атомами в гексагональных слоях обозначается через а, высота ячейки через с. Шесть ближайших соседей, расположенных в смежных слоях будут также находиться на расстоянии, а от данного атома, если отношение осей с/а составит, то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае, также как и в ГЦК решетке, равно 12.
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 – 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси С. В гексагональной плотноупакованной решетке, также как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рисунок 1.7, б).
Диаметры жестких сфер, которые могут быть помещены в эти пустоты также как и для ГЦК равны 0,41 r и 0,225 r.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК решетки (рисунок 1.8, а), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК решетке: АВСАВС (рисунок 1.8, б), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна и, в связи с этим, последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, так называемых дефектов упаковки.
Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рисунок 1.8).
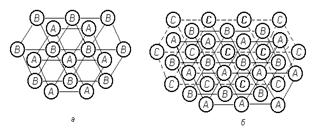 |
| Рисунок 1.8. Схема расположения плотноупакованных атомных слоев в решетках: а - ГПУ; б - ГЦК |
Углерод в виде алмаза, кремний, германий, a - олово (серое) имеют двойную кубическую решетку типа алмаза (рисунок 1.9). Она отличается от ГЦК решетки наличием в четырех из восьми тетраэдрических пустот дополнительно четырех атомов. В результате, структура оказывается более рыхлой.
Каждый атом алмаза окружен лишь четырьмя ближайшими соседями, располагающимися в углах правильного тетраэдра. Координационное число такой структуры равно 4.
Как было показано выше, одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела.
| Рисунок 1.9. Кристаллическая решетка алмаза |
В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a - Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g - Fe с гранецентрированной кубической решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С g - Fe в d - Fe с объемно-центрированной кубической решеткой, аналогичной a - Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a - Ti, a - Zr с гексагональной плотноупакованной решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются b - Ti и b - Zr, обладающие объемно-центрированной решеткой.
Как вы видели, аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающего аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла. Температура перехода называется критической точкой превращения. При температуре (Т0) наблюдается фазовое равновесие двух аллотропических разновидностей.
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит, так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии.
1. Кристаллическая структура меди
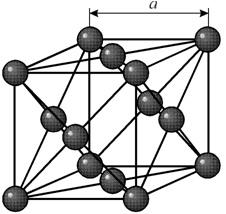
1. Из равенства осевых единицa=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов меди в элементарной ячейке 1/8*8+1/2*6=4. 1/8 – доля каждого атома меди, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1/2 – доля каждого атома находящегося в грани элементарной ячейки меди.
3. Атомы меди образуют сложную кубическую гранецентрированную ячейку Бравэ.
4. Поскольку ячейки атомов меди гранецентрированные, в базисе указываются координаты 4-х атомов. [[000;1/2 1/2 0; 1/2 0 1/2;0 1/2 1/2]]. Записывая базис, мы указываем координаты тех атомов, трансляцией которых можно получить всю пространственную решетку.
5. Основные трансляции для атомов меди – , мы получим все другие атомы меди в пространственной решетке, расположенные в вершинах ячеек.
6. В структуре меди любой атом, расположенный в вершине ячейки имеет двенадцать ближайших соседей, которыми является атомы, находящиеся в центрах граней. Поэтому КЧ=12.
2. Кристаллическая структура вольфрама.
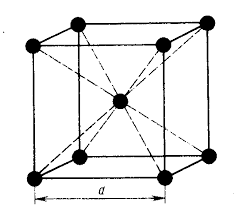
Рис. 2. Крист. структура вольфрама
1. Из равенства осевых единиц a=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов вольфрама в элементарной ячейке, ZW= 1/8 х 8 +1= 2, где 1/8 - доля каждого атома вольфрама, находящегося в вершине, в элементарной ячейке данной структуры; 8 — число такихатомов. 1 атом находится в центре ячейки.
3. Атомы вольфрама образуют сложную кубическую объемноцентрированную ячейку Бравэ.
4. Базисы для атомов вольфрама -[[1/2 1/2 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. Основные трансляции для атомов вольфрама – .
6. В структуре вольфрама каждый атом окружен восемью атомами, расположенными в вершинах ячейки. КЧ=8.
3. Кристаллическая структура , α-Ti
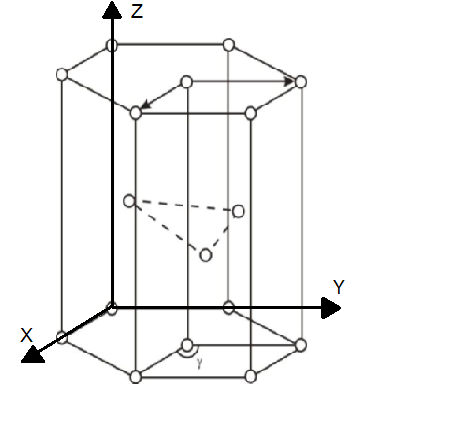
Рис. 3. Крист. структура α-Ti.
1. Из равенства осевых единиц a=b≠c и осевых углов α=β =90°,γ=120 следует, что сингония является гексагональной
2. Определим число атомов α-Ti в элементарной ячейке 1/8*8+1=2. 1/8 – доля каждого атома α-Ti, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1 –атома находящегося внутри элементарной ячейки.
3. Из рис. 4 очевидно, что атомы α-Ti образуют гексагональную компактную плотноупакованная решетку Браве.
4. Базисы для атомов α-Ti -[[2/3 1/3 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. – , мы получим все другие атомы в пространственной решетке, расположенные в вершинах ячеек. Также транслируя 2222222 мы получим атомы внутри решетки.
6. В структуре α-Ti каждый атом имеет 12 ближайших соседей атомов поэтому КЧ = 12.
4. Кристаллическая структура NaCl
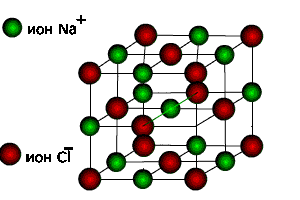
Рис. 4 Крист. структура NaCl.
2. Определим число ионов натрия ZNa и хлораZClв элементарной ячейке,ZNa= 1/8 х 4 = 1/2, где 1/8 - доля каждого иона натрия, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов.ZCl= 1/8 х 4 = 1/2, где 1/8 - доля каждого иона хлора, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов. Число ионов натрия равно числу ионов хлора.
3. Из рис. 4, очевидно, что ионы натрия образуют кубическую гранецентрированную ячейку Браве. Чтобы определить, какую ячейку образует ионы хлора, нужно рассмотреть и соседние ячейки. Выделив в них ионы хлора, нетрудно видеть, что они также образуют гранецентрированную ячейку Браве Р.
4. Запишем базис для ионов натрия и ионов хлора. Поскольку ячейки ионов натрия и хлора примитивные, в базисе указываются координаты двух ионов. Для иона хлора — [[1/2 1/2 1/2]], [[000]]. Для иона натрия - [[1/2 1/2 1/2]], [[000]].
5. Основные трансляции для ионов натрия –6. В структуре хлористого натрия каждый ион хлора окружен шестью ионами натрия. Число ближайших ионов хлора к каждому иону натрия также равно шести.. Поэтому КЧNaпо Cl = 6 и КЧСl поNa= 6.
Раздел 6. Металлы Атомно-кристаллическое строение металлов
Металлы – кристаллические вещества, характеризующие высокими электро- и теплопроводностью, ковкостью, способностью хорошо отражать электромагнитные волны и другими специфическими свойствами. Свойства металлов обусловлены их строением: в их кристаллической решётке есть не связанные с атомами электроны, которые могут свободно перемещаться.
Строение металлов представлено в виде мнимой пространственной решетки из пересекающихся стержней, в местах пересечения, которых располагаются атомы, потерявшие свои валентные электроны. Эти электроны становятся общими для всей совокупности атомов. Электроны образуют электронное облако, или электронный газ и хаотически движутся в пространстве между атомами. Атомы в узлах решетки совершают колебательное движение с частотой 10 13 колебаний в сек. Скорость хаотического движения электронов, и амплитуда колебаний атомов зависит от температуры (с повышением температуры скорость движения электронов и колебаний атомов увеличивается).
Строение всех металлов характеризуется закономерным и периодически повторяющимся расположением атомов в кристаллической решётке.
Любая решётка характеризуется размером, этот размер носит название период или параметр кристаллической решётки – это расстояние между ближайшими параллельными кристаллическими плоскостями (а). Если а- одинаков во всех направлениях, то решетка кубическая.

Минимальный объём носит название элементарная кристаллическая ячейка – это минимальный объём кристаллической решётки, перемещая которую, можно построить всю решётку.

Различают простую элементарную кристаллическую ячейку (1), когда атомы располагаются только в узлах сечения.
Сложная элементарная кристаллическая ячейка, когда атомы располагаются не только в узлах ячейки, но и в между узлиях (2), (3), (4).

Чаще всего это кубическая объемно-центрированная, кубическая гранецентрированная и гексагональная решетки
В объемно-центрированной кубической (ОЦК) решетке восемь атомов располагаются в вершинах куба и один в центре. ОЦК решетку имеют железо при комнатной температуре, ванадий, вольфрам, молибден, хром и др. металлы (рис. 3 а).
В гранецентрированной кубической (ГЦК) решетке атомы расположены в вершинах куба и в центрах шести граней. ГЦК решетку имеют алюминий, медь, никель, свинец, серебро и др. металлы (рис. 3 б).
Гексагональная плотноупакованная (ГПУ) решетка представляет собой шестигранную призму, в основании которой расположены правильные шестиугольники. Атомы расположены в вершинах и центрах этих шестиугольников. ГПУ решетку имеют магний, цинк, титан, цирконий и др. металлы (рис. 3 в).
Рисунок 3 - Типы кристаллических решеток металлов:
А) объемноцентрированная кубическая
б) гранецентрированная кубическая
в) гексагональная плотноупакованная
Некоторые металлы, в зависимости от температуры, могут иметь различный тип кристаллической решётки, т.е. могут существовать в различных кристаллических модификаций.
Полиморфизм (аллотропия) – когда металл имеет разную кристаллическую решётку в зависимости от условия образования. Переход одной решётки в другую называется полиморфное или аллотропическое состояние. Полиморфные превращения в металлах происходят при изменении температуры. Так, при температуре свыше 723°С железо переходит из α – модификации в γ – модификацию, при этом изменяются физико-механические свойства металла.
Чтобы отличить одну кристаллическую решётку железа Fe от другой ставят значок α или γ
До 910°С железо Fe существует в модификации α – Feα (ОЦК)
При температуре с 910°С до 1400°С – Feγ (ГЦК)
При температуре 1400°С – 1539°С – Feδ (ОЦК)
В монокристаллах свойства металла по различным направлениям различны – это явление носит название анизотропией.
В реальных поликристаллических металлах свойства по любому направлению одинаково – это явление называется изотропией.
Читайте также:
