Кривые охлаждения металлов и сплавов
Обновлено: 17.05.2024
Цель: изучить механизм и закономерности кристаллизации; рассмотреть строение металлического слитка, научиться строить кривые охлаждения.
Основные понятия:
· Фактическая температура кристаллизации
План лекции:
1. Кристаллизация металлов и сплавов.
2. Механизм и закономерности кристаллизации металлов.
3. Условия получения мелкозернистой структуры.
4. Строение металлического слитка.
5. Кривая охлаждения железа.
1. Кристаллизация металлов и сплавов.
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 1.

Рис.1. Изменение свободной энергии в зависимости от температуры
В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется реальная температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения:
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждении).
Рассмотрим переход металла из жидкого состояния в твердое.
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 2.

Рис.2. Кривая охлаждения чистого металла
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
2. Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.
Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.

Рис.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.4.

Рис.4. Модель процесса кристаллизации
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.5).

Рис.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы, уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров.
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 6).

Рис. 6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых.
3. Условия получения мелкозернистой структуры.
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
По механизму воздействия различают:
1. Вещества, не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
2. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту.
4. Строение металлического слитка.
Схема стального слитка, данная Черновым Д.К., представлена на рис.7.

Рис. 7. Схема стального слитка
Слиток состоит из трех зон:
1. мелкокристаллическая корковая зона;
2. зона столбчатых кристаллов;
3. внутренняя зона крупных равноосных кристаллов.
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелко
Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 8). Растут дендриты с направлением, близким к направлению теплоотвода.

Рис.8. Схема дендрита по Чернову Д.К.
Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией.
Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией.
Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка.
В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15…20 % от длины слитка)
Методы исследования металлов: структурные и физические
Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа.
5. Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Fe: ;
;
; (высокотемпературноеПревращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
6. Кривая охлаждения железа.
Порядковый номер железа в таблице Менделеева – 26, атомная масса - A= 55,85 а.е.м. (атомные единицы массы). Радиус атома - R = 1,27А. Температура плавления - Тпл = 1539 0 С. Плотность – 7,68 г/см 3 .
Железо существует в двух аллотропических модификациях: объемноцентрированного куба ( Fe a ) и гранецентрированного куба ( Fe g ). Из кривой охлаждения чистого железа (рис.9) видно, что Fe a существует в двух интервалах температур : ниже 911 0 С и от 1392 до 1539 0 С. Достигнув при охлаждении температуры 1392 0 С, Fe a претерпевает аллотропическое превращение, в процессе которого кристаллическая решетка объемно-центрированного куба при постоянной температуре перестраивается в решетку гранецентрированного куба Fe g . Второе аллотропическое превращение в процессе охлаждения происходит при температуре 911 0 С, когда Fe g (решетка гранецентрированного куба) перестраивается в объемноцентрированную кубическую решетку Fe a .
При температуре 768 0 С, называемой точкой Кюри, железо испытывает магнитное превращение: ниже 768 0 С железо становится магнитным. Магнитное превращение есть особый вид превращения и имеет ряд особенностей, отличающих его от аллотропического превращения.
Построение кривых охлаждения сплавов
Рассмотрим в качестве примера построение кривой охлаждения для сплава эвтектического типа (рис.3.6).
На вертикальном разрезе I диаграммы состояний, проходящем через точку а, произвольно выбираем начальную точку в области L и затем последовательно нумеруем критические точки сплава, то есть точки 1, 2 пересечения разреза I с линиями диаграммы. Проводим оси координат: температура t - время τ, в которых будет построена кривая охлаждения; проецируем на них уровни температур в критических точках.
Начальный участок кривой охлаждения (выше т .1). Для любой точки этого участка фазовый сослав сплава: L, так как этот участок находится в однофазовой области диаграммы. Следовательно, число фаз в сплаве f = 1, и по правилу фаз, число степеней свободы сплава с = 2. Следовательно, при отводе тепла температура сплава монотонно понижается и этот участок кривой охлаждения изобразится плавной падающей линией: возле этого участка на кривой охлаждения указываем фазовый состав и число степеней свободы сплава: L, с = 2.
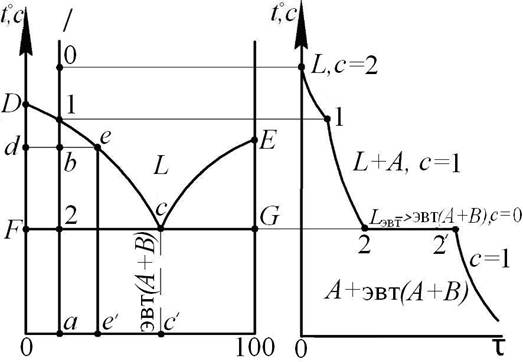
Рис. 3.6. Пример построения кривой охлаждения
Участок 1-2. Для любой точки b на этом участке по правилу отрезков устанавливаем фазовый состав сплава: L (т. e) + А (т. d), следовательно, f = 2 и по правилу фаз c = 1. Значит, этот участок кривой охлаждения, как и предыдущий, будет изображаться плавной линией, возле которого следует указать: L + А, c = 1. В точке 1 кривой охлаждения будет излом, так как здесь изменяется число степеней свободы сплава от c = 2 к c = 1.
Перемещая т. b от т.1 к т. 2 и, определяя весовую долю твердых кристаллов А – QA=(be/de) 100%, и химический состав жидкости в сплаве (е% В), можно легко установить, что на этом участке кривой охлаждения, начиная от т. 1, происходит выделение из жидкости твердых кристаллов А, а содержание компонента В в остающейся жидкости в сплаве постепенно увеличивается от а % В в т. 1 к значению с' % В для т. 2, то есть из жидкости выделяются кристаллы компонента, избыточного по отношению к эвтектическому составу. В конце участка 1-2 сплав будет состоять из кристаллов А и оставшейся жидкости эвтектического состава.
Участок 2 - 2¢. В точке 2 на диаграмме состояния по правилу отрезков легко установить, что в сплаве в равновесии находятся три фазы: А (т. F), L (т с) и B (т. G), причем L= Lэвт). Таким образом, по правилу фаз, f = 3 и c = 0. Следовательно, при температуре критической точки 2 на кривой охлаждения будет горизонтальный участок 2 - 2¢ с постоянной температурой сплава. Природу процесса, происходящего внутри сплава на этом участке, выясним следующим образом. Как видно из диаграммы состояний, ниже т. 2 (то есть, ниже уровня температуры линии FCG) невозможно существование в сплаве жидкой фазы L. Поэтому ясно, что на участке 2 - 2?¢, с одной стороны, должна "исчезать" фаза Lэвт с другой стороны, поскольку в конце процесса должно быть С = 1 (чтобы сплав смог далее снижать свою температуру), то эта фаза должна превращаться в смесь двух других:
то есть на участке 2-2 ?? ¢ в сплаве идет эвтектическое превращение.
Конечный участок кривой охлаждения (после т. 2). После окончания эвтектического превращения в сплаве останутся две фазы: А и В, что легко проверяется правилом отрезков для любой точки диаграммы на участке 2-а. Таким образом, f = 2 и c = 1, так что сплав монотонно снижает свою температуру до комнатной.
На этом участке необходимо указать конечную структуру сплава. В данном простом случае это можно сделать по правилу отрезков (для структурных составляющих) на участке 2 - а диаграммы.
В более общем случае конечную структуру устанавливают по совокупности твердых кристаллов, выделившихся на разных участках кривой охлаждения, и не подвергавшихся после этого внутренним изменением. В нашем случае структуру сплава образуют кристаллы А, выделившиеся на участке 1 - 2, и кристаллы эвтектики, образовавшиеся на участке 2 - 2?: А+эвт(А+В).
Основные теоритические положения построения диаграммы состояния по кривым охлаждения
Диаграмма состояния сплавов какой-либо системы графически изображает изменения, происходящие в сплавах этой системы при изменении концентрации и температуры, и позволяет правильно назначать режимы их обработки: горячей обработки давлением, термической обработки, литья.
Диаграммы состояния строят на основании данных термического анализа, с помощью которого определяют температуры фазовых превра-щений, происходящих в сплавах, т.е. так называемые критические точки.
Критические точки металлов и сплавов определяют путем непрерывного наблюдения за изменением температуры сплава, охлаждаемого от состояния полного расплавления до комнатной температуры. График изменения температуры сплава во времени называют кривой охлаждения.
Фазовые превращения, происходящие в сплавах при охлаждении, сопровождаются выделением скрытой теплоты, кристаллизации, компенсирующей отвод тепла во внешнюю среду и замедляющей снижение температуры сплава. Превращения, происходящие при постоянной температуре, отмечаются на кривой охлаждения площадкой, а протекающие в интервале температур - точками перегибов в начале и в конце превращения.
По найденным критическим точкам для большого числа сплавов различного состава строится диаграмма состояния. При ее построении по горизонтальной оси откладывается состав сплава в процентах, а по вертикальной - температуры. Все критические точки переносятся на ординаты соответствующих сплавов. Одноименные критические точки соединяют плавными линиями и таким путем получают диаграмму состояния.
Тип диаграммы состояния определяется характером взаимодействия веществ (компонентов), образующих систему сплавов.
Настоящая работа состоит в построении диаграммы состояния системы Pb-Sn методом термического анализа. Оба компонента (свинец и олово) в жидком состоянии полностью взаимно растворимы в любых соотношениях. В твердом состоянии они отличаются ограниченной взаимной растворимостью, уменьшающейся при снижении температуры, и не образуют химических соединений.
Линии DF и EG (рис. 5.1) представляют собой линии предельной растворимости соответственно олова в свинце и свинца в олове. Максимальная растворимость олова в свинце соответствует точке D (19,5% Sn, остальное свинец), а свинца в олове в точке E (97,4% Sn, остальное свинец). Линия АСВ называется линией ликвидус: выше этой линии все сплавы находятся в жидком состоянии. Линия ADCEB - линия солидус, ниже нее все сплавы находятся в твердом состоянии.
Рис. 5.1. Диаграмма состояния системы свинец-олово. Схемы кривых охлаждения
и мезоструктур сплавов
Проследим за процессом кристаллизации сплавов, отличающихся по характеру протекающих в них превращений и структуре.
Кристаллизация сплава II начинается в точке 1 выделением из однородного жидкого раствора кристаллов α-твердого раствора замещения олова в свинце. В точке 2 последние капли жидкости переходят в твердое состояние, т.е. кристаллизация сплава заканчивается образованием
α-твердого раствора во всем объеме сплава. В интервале температур между точками 2 и 3 сплав охлаждается, не претерпевая никаких превращений. В точке 3 твердый α-раствор становится насыщенным относительно олова. При дальнейшем медленном охлаждении сплава растворимость олова в свинце уменьшается (линия DF) и сплав становится пересыщенным оловом. Поэтому избыток олова выделяется с образованием кристаллов
βп-твердого раствора свинца в олове. При этом химический состав
α-твердого раствора изменяется по линии DF и при 20 °С в нем содержится около 1% Sn (точка F).
Аналогичные превращения происходят в сплавах содержащих от 97,4 до 99% олова, но с той разницей, что в результате первичной кристаллизации выпадают кристаллы β-твердого раствора, а вторичная кристаллизация сопровождается образованием вторичных кристаллов αп.
Таким образом, сплавы, содержащие от 1 до 19,5% Sn (остальное свинец) и более 97,4% (до 99%) Sn (остальное свинец), имеют три критические точки, выражающиеся на кривой охлаждения тремя перегибами (рис. 4.1).
Сплав IV состава точки С (61,9% Sn и 38,1% Рb) называется эвтектическим. Он затвердевает при постоянной эвтектической температуре tэ = 183 °С с образованием тонкой механической смеси (эвтектики), состоящей из мелких кристалликов твердых растворов на основе свинца и олова состава точек D и Е.
Чистые металлы - свинец и олово (сплавы I и VI на рис. 4.1), как и эвтектический сплав, начинают и заканчивают кристаллизацию при одной и той же температуре, и имеют на кривых охлаждения только горизонтальную площадку, т.е. одну критическую точку.
Все сплавы с концентрацией от 19,5 до 61,9% Sn (доэвтектические) и от 61,9 до 97,4% Sn (заэвтектические) заканчивают кристаллизацию при эвтектической температуре.
В доэвтектическом сплаве III кристаллизация начинается в точке I выделением из жидкости кристаллов a-твердого раствора, а в заэвтектическом (сплав V) - β-твердого раствора. В процессе охлаждения от точки 1 до точки 2 количество твердой фазы в сплаве увеличивается, а жидкой - уменьшается. Состав твердой части сплава изменяется по линии солидус, а жидкой части – по линии ликвидус. По достижении эвтектической линии оставшаяся жидкость приобретает эвтектический состав и при постоянной температуре tэ = 183 °С протекает эвтектическое превращение: из жидкости состава точки С одновременно выпадают кристаллы двух твердых растворов - α и β, т.е. образуется эвтектика.
Таким образом, доэвтектические и заэвтектические сплавы имеют две критические точки: верхнюю, соответствующую началу кристаллизации (перегиб на кривой охлаждения), и нижнюю, соответствующую окончанию кристаллизации с образованием эвтектической смеси (площадка на кривой охлаждения).
Для определения критических точек на кривой охлаждения находят перегибы и (или) площадки и, учитывая масштаб записи, определяют значения соответствующих температур.
Порядок выполнения работы
Для проведения работы студенты разбиваются на бригады
по 2–3 человека. Две бригады получают чистые металлы (свинец и олово), остальные бригады – сплавы свинца и олова различной концентрации.
Каждой бригаде предоставляется тигельная печь, высокотемпера-турная термопара, тигель со сплавом, секундомер и специальная подставка.
Для выполнения работы необходимо:
1. Опустить тигель со сплавом в тигельную печь, расплавить металл, немного перегрев его выше температуры плавления;
2. Вынуть тигель с расплавленным сплавом из печи и установить на специальной подставке;
3. Через каждые 30 с в п. 4 бланка отчета записывать значения температуры. Запись прекратить, когда температура сплавов и чистого олова снизится до 140–150 °С, а чистого свинца - до 250 °С;
4. На основании полученных данных в п. 5 бланка отчета построить кривую охлаждения сплава;
5. По кривым охлаждения определить критические точки начала и конца кристаллизации сплавов и записать их в таблицу на доске;
6. По результатам работы всех бригад заполнить п. 6 бланка отчета;
7. В п. 7 бланка отчета на оси абсцисс отметить точки, соответст-вующие составам исследованных сплавов, и из каждой точки восстановить перпендикуляр, т.е. провести линии сплавов. На каждой линии сплава отметить температуры критических точек. Соединить между собой плавными линиями точки, отвечающие одноименным фазовым превращениям. В каждой области построенной диаграммы указать фазовый и структурный состав;
8. В п. 3 бланка отчета дать схему установки, включающую вертикальный разрез тигельной печи с тиглем, сплавом и термопарой.
1. Какой принцип построения диаграммы Fe-C?
2. Какие фазовые превращения происходят в сплавах при охлаждении и нагреве?
3. Для чего необходима диаграмма состояния сплавов?
4. Что такое критические точки превращения в сплавах?
5. Что определяет тип диаграммы состояния?
6. Что такое ликвидус и солидус?
7. Какие кривые охлаждения имеют чистые металлы?
8. Что такое эвтектика, перитектика и эвтектоида. Их отличие?
9. Что такое Fe3C, его кристаллическая решетка и свойства?
10. Что называется сталью и чугуном? Показать на диаграмме Fe-C.
1. Арзамасов Б.Н. и др. Материаловедение. – М.: Машиностроение, 2002. – 648 с.
2. Лахтин Ю.М. Леонтьева Б.Н. Материаловедение. – М.: Машиностроение, 1990. – 528 с.
3. Ржевская С.В. Материаловедение: Учебник для вузов. – 4-е изд. – М.: Логос, 2004. – 424 с.
Кривая охлаждения для сплава
Кривая охлаждения – это линейный график, который представляет собой изменение фазы вещества, в большинстве случаев от газа к твердому веществу или от жидкости к твердому веществу.
Пример кривой охлаждения изображен на рисунке ниже.
Рисунок 1. Кривая охлаждения. Автор24 — интернет-биржа студенческих работ
Здесь ось X – время, является независимой переменной, а ось У - температура - зависимая переменная. Начальной точкой графика является начальная температура исследуемого вещества. Во время фазового превращения имеет место быть тепловая остановка, то есть температура становится постоянной. Это объясняется следующим образом: веществ имеет больше внутренней энергии в жидком или газообразном состоянии, чем в состоянии до которого оно охлаждается - твердое состояние. Количество энергии, которое необходимо для осуществления фазового превращения называется скрытым теплом. Скорость овладения представляет собой наклон кривой охлаждения в любой точке графика.
Построение кривой охлаждения для сплава
Рассмотрим построение кривой охлаждения для эвтектического сплава, которая изображена на рисунке ниже.
Рисунок 2. Кривая охлаждения для эвтектического сплава Автор24 — интернет-биржа студенческих работ
На разрезе I диаграммы состояния сплава, который проходит через точку а, сначала произвольно выбирается начальная точка, которая должна находиться в пределах области L, а затем последовательно нумеруются критические точки сплава - 1 и 2 пересечения с линиями разреза. После итого проводятся t - температура и т - время, в пределах которых будет строится кривая охлаждения, на них проецируются уровни температур в критических точках.
Начальный участок кривой охлаждения для рассматриваемого сплава находится выше точки 1. Для любой точки этой области фазовый состав сплава - L, потому что участок располагается однофазной области диаграммы состояния. Таким образом, количество фаз в сплаве f = 1, а согласно правилу фаз, количество степеней свободы с = 2. Отсюда, при отводе тепла температура сплава снижается монотонно, и рассматриваемый участок можно изобразить в виде плавно падающей линии: воле данного участка на кривой охлаждения необходимо указать состав и количество степеней свободы, то есть L и c = 2.
Готовые работы на аналогичную тему
Рассмотрим участок 1-2. Для любой точки b на рассматриваемом участке, согласно правилу отрезков, устанавливается следующий фазовый состав: L в точке е + А в точке d. Отсюда следует, что количество фаз равняется f = 2, а число степеней свободы с = 3. Таким образом данный участок кривой охлаждения сплава будет изображаться плавной линией, после которой необходимо указать следующие данные: L + A, c = 1. В точке 1 на кривой охлаждения будет излом, потому изменяется количество степеней свободы от 2 до 1. Если переместить точку b от точки 1 к точке 2, то можно определить весовую долю кристаллов твердого вещества А - QA = be / de * 100 %. На этом участке также можно определить химический состав жидкости в сплаве - от точки 1 начинается выделение из жидкости твердых кристаллов А, а содержание составляющих В в оставшейся в сплаве жидкости постепенно увеличивается. В конце рассматриваемого участка 1-2 сплав будет состоять из оставшейся жидкости эвтектического сплава и твердых кристаллов А.
Рассмотрим участок 2-2с^. В точке 2 согласно правилу отрезков можно установить, что в равновесном состоянии в есть три фазы:
- A - точка F.
- L - точка С.
- B - точка G.
Стоит заметить, что L = Lэвт. Получается, что количество фаз равняется f=3, а число степеней свободы с=0 - согласно правилу фаз. Следовательно, при критической температуре в точке 2 на кривой охлаждения эвтектического сплава имеет место быть горизонтальная линия 2-2^ с постоянной температурой. Природу процесса, который происходит внутри сплава на данном участке, можно определить следующим образом. Ниже уровня температуры FCG, то есть ниже точки 2 невозможно существование в сплаве фазы L. Таким образом на участке 2-2^ с одной стороны должна исчезать Lэвт, потому что в конце процесса С должно быть равно 1, а сама фаза превращается в смесь других - Lэвт => эвтектика (А + В) - на участке происходит эвтектическое превращение.
Рассмотри последний участок диаграммы - после точки 2. После завершения эвтектического превращения в сплаве остаются фазы А и В, ито легко проверить при помощи правила отрезков для любой точки рассматриваемой диаграммы состояния на участке 2-а. Получается следующее количество фаз f = 2, а число степеней свободы с=1, поэтому температура сплава монотонно снижается до комнатной температуры. На данном участке указывается конечная структура эвтектического сплава, руководствуясь правилом отрезков на участке 2-а. Конечная структура устанавливается по совокупности твердых кристаллов, которые выделились на различных участках кривой охлаждения и в дальнейшем не подвергавшиеся внутренним изменениям. В рассматриваемом случае структура сплава образована кристаллами твердого компонента А, которые выделились на участке 1-2, и кристаллов эвтектики, образовавшиеся на участке 2-2^.
Лекция №2. Теория сплавов
Рассмотрим ряд основополагающих определений и понятий.
Сплав – вещество, полученное сплавлением двух и более элементов (компонентов). Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называются металлическим сплавом.
По количеству компонентов сплавы соответственно называются двойными, тройными и многокомпонентными.
Структурные составляющие – обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями.
Система – совокупность тел (твердых, жидких) в определенном объеме при определенных внешних условиях, взятых для исследования.
Компонент – простейшая часть (вещество) из образующих систему. В металлических сплавах компонентами являются элементы (металлы и неметаллы) и химические соединения (не диссоциирующие при нагревании)
Фаза – однородная часть системы, имеющая физическую границу раздела (поверхность), при переходе через которую химические состав или структура изменяются скачком.
2.1. Строение сплавов
Чистые металлы находят довольно ограниченное применение. Основными конструкционными материалами являются металлические сплавы. В основном сплавы получают путём кристаллизации жидкого расплава нескольких металлов, но могут быть и другие пути – спеканием, диффузией, осаждением и другие.
Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях и образуют однородный жидкий раствор с равномерным распределением атомов одного металла среди атомов другого металла.
При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов. По характеру взаимодействия компонентов все сплавы подразделяются на три основных типа: механические смеси, твердые растворы и химические соединения.
Механическая смесь двух компонентов образуется, если они не способны к взаимодействию или взаимному растворению.
Каждый компонент при этом кристаллизуется в свою кристаллическую решетку. Структура механических смесей неоднородная, состоящая из отдельных зерен компонента А и компонента В. Свойства механических смесей зависят от количественного соотношения компонентов.
Если механическая смесь образуется при первичной кристаллизации, она называется эвтектической, если в результате вторичной – эвтектоидной.
Твердые растворы образуются, когда один компонент растворяется в другом. Тогда в твердом состоянии атомы одного компонента входят в кристаллическую решетку другого. Если атомы кристаллической решетки одного компонента А частичного замещаются атомами другого В, образуются твердые растворы замещения, рис. 2.1а. Твердые растворы замещения образуются элементами, атомные радиусы которых отличаются не более чем на 8 – 15%, но и в этом случае кристаллическая решетка растворителя искажается, не утрачивая своего строения.
Если атомы растворимого компонента В внедряются в пустоты решетки растворителя А, то образуются твердые растворы внедрения (рис. 2.1б). Следовательно, атомы растворимого элемента должны быть соизмеримы с пустотами кристаллической решетки растворителя. Концентрация твердых растворов внедрения не может быть высокой – не более 1…2%.

Рис. 2.1. Схемы твердых растворов замещения (а) внедрения (б)
Твердый раствор имеет однородную структуру и одну кристаллическую решетку. Обозначают твердые растворы буквами греческого алфавита α, β, γ, δ и т.д.
Химическое соединение образуется, если компоненты сплава А и В вступают в химическое взаимодействие. Химическое соединение имеет свою кристаллическую решетку, которая отличается от кристаллических решеток компонентов. При этом сохраняется кратное соотношение компонентов, что позволяет выразить состав химического соединения формулой А n В m .
Свойства химического соединения резко отличаются от свойств образующих его компонентов при этом они, как правило, обладают большой твердостью и хрупкостью (карбиды, нитриды и др.). Химическое соединение имеет однородную структуру, состоящую из одинаковых по составу и свойствам зерен, и может играть роль компонента в сплавах.
2.2. Диаграммы состояния двойных сплавов
Диаграмма состояния – графическое изображение состояния сплава изучаемой системы в зависимости от концентрации в нем компонентов и температуры. Диаграмма состояния показывает равновесные, устойчивые состояния сплава, т.е. такие, которые при данных условиях обладают минимальной свободной энергией.
Построение диаграмм состояния осуществляют различными экспериментальными методами. Наиболее часто используется метод термического анализа. Он заключается в том, что составляют несколько сплавов с различной концентрацией компонентов, расплавляют их и медленно охлаждают, фиксируя время охлаждения и температуру.
По полученным данным строят серию кривых охлаждения в координатах: время (τ, сек) – температура (t,°С), на которых наблюдают точки перегибов и температурные остановки – критические точки фазовых переходов (рис. 2.2).
Рис. 2.2. Кривая охлаждения сплава
В отличие от чистых металлов сплавы кристаллизуются не при постоянной температуре, а в интервале температур, поэтому на кривых охлаждения сплавов есть две критические точки. В верхней критической точке, называемой точкой ликвидус (tл), начинается кристаллизация. В нижней критической точке - солидус (tс) кристаллизация завершается.
Диаграмму строят в координатах температура – концентрация. Линии диаграммы разграничивают области одинаковых фазовых состояний. Для построения диаграммы состояния используют большое количество кривых охлаждения для сплавов различных концентраций. При построении диаграммы критические точки переносятся с кривых охлаждения на диаграмму (оси температура – концентрация) и соединяются линией. В получившихся на диаграмме областях записывают фазы или структурные составляющие. Линия начала кристаллизации сплавов на диаграмме называется линией ликвидус, а линия окончания кристаллизации – солидус.
Вид диаграммы зависит от того, как взаимодействуют между собой компоненты.
Диаграмма состояния сплавов,
образующих механические смеси чистых компонентов (1 тип)
Рассмотрим кривые охлаждения нескольких сплавов системы А – В, имеющих различный состав (рис. 2.3). Кристаллизация чистого компонента А (100%) начинается в т.1 и заканчивается в т.1*, протекая при постоянной температуре. Выше этой температуры компонент А находится в жидком состоянии, ниже – в твердом. Аналогично происходит кристаллизация чистого компонента В.
Кривая охлаждения сплава (60% А + 40%В) аналогична кривым охлаждения чистых компонентов. На ней имеется также только одна температурная остановка 2-2*, т.е. кристаллизация происходит при постоянной температуре. Особенность кристаллизации этого сплава заключается в том, что происходит одновременная кристаллизация обоих компонентов – появляются и растут кристаллы, образуя мелкокристаллическую механическую смесь обоих компонентов (А+В).
Механическая смесь двух или более разнородных кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой (от эвтэо (греч.) – легкоплавкий). Сплав, отвечающий составу эвтектики, называют эвтектическим сплавом. Он имеет постоянную и минимальную температуру плавления (кристаллизации) для сплавов данной системы и постоянный химический состав.

Рис. 2.3. Диаграмма состояния сплавов, образующих механические смеси
чистых компонентов, состав сплавов: 1 – 100%А, 2 – 80%А+20%В,
3 – 60%А+40%В, 4 – 20%А+80%В, 5 – 100%В
Кристаллизация сплава (80%А + 20%В) происходит иначе. На кривой имеются две кристаллические точки: точка перегиба 1 и температурная остановка 2-2*. Выше т.1 сплав находится в жидком состоянии, в т.1 появляются первые зародыши кристаллов компонента А – начало кристаллизации. Выделение и рост зерен А продолжается до т.2. При этой температуре жидкий сплав, вследствие удаления из расплава компонента А в виде твердых кристаллов, приобретет эвтектический состав (60%А + 40%В) и при постоянной температуре, равной эвтектической, произойдет одновременная кристаллизация обоих компонентов (А+В), т.е. произойдет эвтектическое превращение.
Сказанное в равной степени относится и к сплаву (20%А + 80%В), отличие состоит лишь в том, что на участке 1–2 происходит образование и рост зерен компонента В. Для этих сплавов характерной особенностью является то, что кристаллизация на участке 1–2 происходит в интервале температур.
Полученные критические точки перенесем на диаграмму, где координатами будут концентрация и температура. Если затем соединить линией все точки начала кристаллизации (линия АСВ) и точки окончания кристаллизации линия (ДСF), то получим диаграмму состояния системы А – В. Линия АСВ – геометрическое место точек ликвидус, называется линией ликвидус. Линия ДСF – линией солидус. Выше линии ликвидус находится жидкость (расплав), ниже линии солидус – сплавы находятся в твердом состоянии. Сплав, отвечающий составу эвтектики (точка С), как уже указывалось, называется эвтектическим. Сплавы, находящиеся левее точки С, называют доэвтектическими. Их структура – избыточные кристаллы А и эвтектика (А+В). Сплавы, расположенные правее точки С, – заэвтектические, их структура кристаллы – В и эвтектика (А+В). Из этого следует что А, В и эвтектика (А+В) являются структурными составляющими сплавов.
Диаграмма состояния сплавов с неограниченной растворимостью
компонентов в твердом состоянии (2 тип)
Для таких сплавов возможно образование двух фаз: жидкого сплава Ж и твердого раствора α. На диаграмме две линии, верхняя – ликвидус и нижняя – солидус (рис. 2.4).

Рис. 2.4. Диаграмма состояния сплавов с неограниченной растворимостью
Диаграмма состояния сплавов с ограниченной растворимостью
в твердом состоянии (3 тип)
В таких сплавах могут существовать три фазы: жидкий раствор (Ж), твердый раствор компонента В в компоненте А – (α) и твердый раствор компонента А в компоненте В – (β). Эта диаграмма содержит в себе элементы двух предыдущих (рис. 2.5).

Рис. 2.5. Диаграмма состояния сплавов с ограниченной растворимостью
компонентов в твердом состоянии
Линия АСВ – линия ликвидус, линия АЕСFВ – линия солидус. Линия ЕСF – линия эвтектики. Таким образом, здесь также образуется эвтектика, доэвтектические и заэвтектические сплавы. Линия РЕ – линия ограниченной растворимости компонента В в компоненте А, по этой линии происходит выделение вторичных кристаллов β II (вследствие уменьшения растворимости компонента В в компоненте А с понижением температуры). Процесс выделения вторичных кристаллов называется вторичной кристаллизацией.
Диаграмма состояния сплавов, образующих устойчивые химические соединения (4 тип)

Рис. 2.6. Диаграмма 4 типа
Такая диаграмма характеризуется наличием вертикальной линии, соответствующей соотношению компонентов в химическом соединении АnВ m (рис. 2.6). Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых устойчивым химическим соединением и одним из компонентов. На рисунке представлена диаграмма для случая, когда каждый из компонентов образует с химическим соединением механическую смесь.
2.3. Пластическая деформация, наклеп и рекристаллизация
Пластическая деформация – это необратимая деформация, т.е. ее влияние на форму, структуру и свойства тела сохраняются после снятия нагрузки. При пластической деформации зерна деформируются, вытягиваются в направлении деформации, образуется волокнистая структура, увеличивается число дислокаций. При этом прочность и твердость металла повышается, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклепом, или нагартовкой.
Волокнистое строение и наклеп можно устранить при нагреве металла. Частичное снятие наклепа происходит уже при небольшом нагреве. Снимается искажение кристаллической решетки. Этот процесс называется возвратом (рис. 2.7). Но волокнистая структура при этом сохраняется.
При нагреве до более высоких температур в металле происходит образование новых равноосных зерен. Такой процесс называют рекристаллизацией. Наклеп при этом снимается полностью. Различают рекристаллизацию первичную и собирательную.
Рекристаллизация первичная (участок 1–2 на рис. 2.7) заключается в образовании зародышей и росте новых равновесных зерен с неискаженной кристаллической решеткой.
Собирательная рекристаллизация – вторая стадия процесса, заключающаяся в росте образовавшихся новых зерен. Рост зерен обусловлен стремлением системы к более равновесному состоянию за счет уменьшения внутренней поверхности зерен. Особенность собирательной рекристаллизации – вторичная рекристаллизация – рост отдельных зерен за счет других. Основными факторами, определяющими величину зерен, являются температура, продолжительность выдержки при нагреве и степень деформации.

Рис. 2.7. Схема изменения структуры и свойств наклепанного металла
при возврате (отдыхе) и рекристаллизации
Температура, при которой идет процесс рекристаллизации, называется температурой рекристаллизации. Абсолютная температура рекристаллизации
где а – коэффициент, зависящий от структуры и состава металла. Для особо чистых металлов а = 0,2, для металлов технической чистоты а = 0,3 – 0,4, для сплавов а = 0,5 – 0,6.
На практике наклеп устраняют рекристаллизационным отжигом.
Если деформирование происходит при температуре выше температуры рекристаллизации, то наклепа не происходит. Такая деформация называется горячей. Деформация, которая происходит при температуре ниже температуры рекристаллизации, называется холодной.
Читайте также:
