Лабораторная работа по химии определение эквивалентной массы металла
Обновлено: 04.10.2024
Понятие о молярной массе эквивалента. Технология определения его количественного значения в лабораторных условиях методом вытеснения водорода из раствора кислоты. Определение метала по результатам опыта. Расчет относительной погрешности эксперимента.
| Рубрика | Химия |
| Вид | лабораторная работа |
| Язык | русский |
| Дата добавления | 13.10.2013 |
| Размер файла | 75,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Национальный минерально-сырьевой университет "Горный"
Отчет по лабораторной работе
По дисциплине : " Химия "Тема: "Определение эквивалентной массы металла"
Выполнил: студент гр. ПГС-13-2 Павличенко Т.Г.
Проверил: доцент Жадовский И.Т.Цель работы: усвоить одно из основных химических понятий - понятие об эквиваленте - и научиться определять его количественное значение.
Ход эксперимента:
1. Наполнить водой кристаллизатор и бюретку (стеклянную трубку с делениями и краном для выпуска жидкости внизу). Проверить, плотно ли закрыт кран бюретки.
2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом вода из бюретки не вытечет.
3. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы.
4. В колбу Вюрца (круглодонная колба с боковым отводом) при помощи мерного цилиндра отобрать 15-20 мл соляной кислоты.
5. Вытереть насухо горло колбы фильтром.
6. Расположив колбу горизонтально, поместить в ее горло навеску металла и плотно закрыть колбу пробкой.
7. Стеклянную трубку бокового отвода колбы Вюрца соединить с расположенной под водой частью бюретки.
8. Отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки - объем в миллилитрах (мл), при снятии показаний необходимо учитывать, что бюретка со шкалой перевернута.
9. Перевести колбу в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. Во время протекания реакции не следует держать колбу в руках во избежание ее нагрева и искажения результатов за счет теплового расширения газа.
10. Когда выделение пузырьков водорода прекратится, отметить конечный уровень воды в бюретке.
11. При помощи полоски миллиметровой бумаги измерить высоту столба воды в бюретке от нижнего края мениска до уровня воды в кристаллизаторе.
12. По показаниям барометра и термометра определить атмосферное давление и температуру в лаборатории.
Экспериментальные и расчетные данные опыта по определению эквивалентной массы металла
Определите среднюю относительную молекулярную массу и относительную плотность по водороду газовой смеси, состоящей из 20 % N2,
38 % NH3 и 42 % СН4 (по объему).
| Дано: φ(N2) = 20 % φ(NH3) = 38 % φ(СН4) = 42 % | Решение 1. Относительную плотность смеси по водороду можно вычислить из выражения: Мсм. Dсм. = ¾¾¾¾¾; m(Н2) молярную массу смеси – по формуле Мсм = mсм / νсм.; |
| Dсм. ? |
2. Объемная доля вещества рассчитывается по формуле: VВ.
Поскольку вся смесь составляет 100 % или, предположим, 100 л, то объемы газов составят: V(N2) = 20 л, V(NН3) = 38 л, V(СН4) = 42 л.
Тогда количество вещества каждого из газов будет равно:
ν(N2) = 20 /22,4 = 0,89 (моль); ν(NН3) = 38 /22,4 = 1,70 (моль);
ν (СН4) = 42 / 22,4 = 1,88 (моль);
а всей смеси: ν СМ. = 0,89 + 1,70 + 1,88 = 4,47 (моль)
3. Находим массу смеси mсм. и ее молярную массу Мсм.:
mсм. = 0,89 •28 + 1,7 • 17 + 1,88 • 16 = 83,9 (г),
Мсм. = 83,9 / 4,47 = 18,8 (г/моль)
4. Вычисляем относительную плотность смеси по водороду
Ответ: Dсм. = 9,4.
Пример 2
Объемные доли газов, составляющих воздух, равны: 78% N2, 21% О2, 0,97% Аr и 0,03% СО2. Определите парциальные давления газов (н.у.).
| Дано: φ(N2) = 78,00 % φ(О2) = 21,00 % φ(Аr) = 0,97 % φ(СО2) = 0,03 % н.у. | Решение Из выражения Рn = Р0 • φ , где Р0 = 101,3 кПа, находим парциальные давления газов Рn (N2) = 101,3 • 0,78 = 79,03 (кПа), Рn (О2) = 101,3 • 0,21 = 21,3 (кПа), Рn (Аr) = 101,3 • 0,0097 = 0,98 (кПа), |
| Рn(N2, О2, Аr, СО2) ? | Рn (СО2) = 101,3 • 0,0003 = 0,03 (кПа) |
Рn (Аr) = 0,98 кПа, Рn (СО2) = 0,03 кПа.
Масса 13,07 г двухвалентного металла вытесняет из кислоты объем водорода 4,48 л, измеренный при н.у. Вычислите молярную массу металла. Назовите металл.
| Дано: m (Ме) = 13,07 г W(Ме) = 2 V(Н2) = 4,48 л (н.у.) | Решение 1 способ М(Ме) = А(Ме) Мрлярную массу металла можно определить |
| М(Ме) = ? | из выражения: М(Ме) = МЭ • W (1) |
Эквивалентную массу металла найдем по закону эквивалентов:
2. Используя молярный объем Vm, определим количество вещества водорода и его массу:
ν(Н2) = 4,48 / 22,4 = 0,2 (моль), m (Н2) = ν • М = 0,2 • 2 = 0,4 (г).
Из выражений (2) и (1) вычислим эквивалентную и молярную массы металла:
МЭ(Ме) = 13,07 • 1 / 0,4 = 32,68 (г/моль), М(Ме) = 32,68 • 2 = 65,4 (г/моль).
По периодической системе Д.И. Менделеева находим, что искомый металл – Zn (цинк)
Способ
Из выражения: m (Ме) V(Н2)
Тогда молярная масса металла М(Ме) = МЭ• W=32,68 • 2 = 65,36 (г/моль).
Этот металл– Zn (цинк).
Ответ: МЭ(Ме) = 32,68 г/моль, М(Ме) = 65,36 г/моль. Металл – цинк.
Пример 4
Оксид трехвалентного металла содержит 47,1 % кислорода. Определите, что это за металл.
| Дано: w(О2) = 47,1 % | Решение 1. Пусть масса оксида металла составляет 100 г. |
| М(Ме) = ? | Тогда масса кислорода в оксиде составит 47,1 г, |
а масса металла в оксиде будет равна m (Ме) = 100 – 47,1 = 52,9 (г).
2. По закону эквивалентов находим эквивалентную массу металла:
то эквивалентная масса металла равна МЭ(Ме) = 52,9 • 8/47,1 ≈ 9 (г/моль),
а молярная масса металла – М(Ме) = 9 • 3 = 27 (г/моль).
По периодической системе находим, что этот металл – А1 (алюминий).
Ответ: А1 (алюминий)
Пример 5
При некоторой температуре плотность по кислороду паров фосфора равна 3,88. Из скольких атомов состоит молекула фосфора?
| Дано: D(О2) = 3,88 | Решение М(Рх) D(О2) = ¾¾¾ (1) М(О2) |
| РХ = ? |
Из выражения (1) находим молярную массу паров фосфора:
По периодической системе Д.И. Менделеева определяем молярную массу атомарного фосфора: М(Р) = 31 (г/моль).
Из выражения Х = ¾¾¾ = ¾¾¾ = 4.
Следовательно, молекула фосфора состоит из четырех атомов – Р4.
Контрольные задания по теме «Основные законы химии»
Вариант 1
1. При некоторой температуре плотность паров серы по воздуху равна 4,41.
Из скольких атомов состоит молекула серы?
2. Песок массой 3 кг сплавили с избытком гидроксида натрия, получив в результате 5 кг силиката натрия. Определите выход продукта реакции, если массовая доля оксида кремния (1V) в песке равна 85 %.
3. Какое количество вещества эквивалента содержится в 50 г СаСО3?
Вариант 2
1. Газ занимает объем 9,6 м 3 при 0 °С и давлении, в три раза превышающем нормальное. Какое число молекул газа находится в данном объеме?
2. Плотность некоторого газообразного органического вещества по кислороду равна 1,375. Чему равна плотность этого вещества по водороду?
3. Массовая доля металла в его гидриде составляет 87,5 %. Вычислите эквивалентную массу металла? Какой это металл?
Вариант 3
1. Найдите количество вещества, массу и число молекул НС1, взятых в объеме 39,2•10 -3 м3 .
2. Взято 10 г некоторого основания. Масса вступивших в реакцию ионов ОН - равна 0,7 г. Вычислите эквивалентную массу основания.
3. Какой объем займет воздух при 0 °С и давлении 93,3 кПа, если при н.у. он занимает объем 773 см 3 ?
Вариант 4
1. Определите эквивалентную массу серы, если 160 г ее окисляются 112 л
(н. у.) кислорода? Какова формула полученного оксида серы?
2. Вычислите относительную молекулярную массу бензола, если 1,1•10 -3 м3 его паров при 91 0 С и 81313 Па имеет массу 2,31•10 -3 кг.
3. Вычислите молярную массу газообразного неорганического вещества, 11 г которого при 22 °С и давлении 104 кПа занимают объем 5,9 л. Какой это газ?
Вариант 5
1. Массовая доля элемента в его оксиде (Э2О3) составляет 68,42 %. Установите элемент. Рассчитайте эквивалентную массу элемента и его оксида.
2. Масса газа объемом 515 см 3 при 48 °С и давлении 103400 Па равна 0,865 г. Вычислите молярную массу газа.
3. Какой объем займут 4,5 г фторида водорода при 27 °С и давлении 1,2 кПа?
Вариант 6
1. Массовая доля неизвестного элемента в его оксиде (Э2О5) составляет 56,04%. Определите этот элемент, молярную и эквивалентную массы его оксида.
2. Какой объем (н. у.) займут 3,6 г фосфина РН3? Сколько молекул содержится в этой массе фосфина?
3. Смесь газов состоит из 9 % гелия и 91 % аргона (доли объемные). Какова средняя относительная молекулярная масса этой газовой смеси?
Вариант 7
1. Какова средняя относительная молекулярная масса газовой смеси, состоящей из оксида углерода (II) и водорода, если объемные доли этих газов соответственно равны 47,2 % и 52,8 %?
2. Эквивалентная масса металла составляет 20 г/моль. Определите объем водорода, выделившегося в результате реакции 50 г данного металла с избытком кислоты. Условия нормальные.
Вариант 8
1. Какой объем займут 3,01•10 25 молекул газа при нормальных условиях?
2. У каких из перечисленных пар газов плотность каждого из них по водороду одинакова и равна 22? а) N2 и C2H4; б) CO2 и N2O; в) O2 и SiH4.
3. Рассчитайте массу 2 л газовой смеси, содержащей (по объему) 30% азота и 70% водорода (н. у.).
Вариант 9
1. Какой объем (н.у.) займет углекислый газ, полученный при термическом разложении 2NaНСО3 = Na2СО3 + CO2+ Н2О, если разложению подверглось 50 г гидрокарбоната натрия?
2. Вычислите эквивалентную молярную массу элемента, 0,5 г которого вытеснили при 21 0 С и 101,3 кПа 189 мл водорода.
3. Газообразный оксид азота имеет плотность по кислороду, равную 1,375. Какова формула оксида азота?
Вариант 10
1. Газообразный хлор при нормальных условиях занимает объем 4,4 м 3 . Определите количество вещества хлора.
2. Масса газа объемом 3,36 л (н. у.) равна 6,6•10 -3 кг. Рассчитайте молярную массу газа?
3. Один грамм некоторого металла соединяется с 1,78 г серы или с 8,89 г брома. Вычислите эквивалентные молярные массы брома и металла, зная, что эквивалентная молярная масса серы равна 16.
Вариант 11
1. Какой объем займет при температуре 15 °С и давлении 125 кПа газообразный аммиак массой 102 г?
2. Вычислите эквивалентную массу металла, если его соединение с йодом содержит 94,8 % (по массе) йода.
3. Плотность галогеноводорода по азоту равна 1,3. Какова формула этого галогеноводорода?
Вариант 12
1. Какой объем (н. у.) займет углекислый газ, полученный при разложении
200 г СаСО3?
2. Двухвалентный металл массой 1,37 г вытеснил из кислоты 0,5 л водорода при 18 0 С и 101,3 кПа. Вычислите молярную массу металла. Назовите этот металл.
3. Чему равна плотность некоторого газообразного вещества по кислороду, если плотность этого вещества по воздуху равна 1,317?
Вариант 13
1. Какова масса порции воды, содержащей 6,02•10 22 атомов водорода?
2. Какой объем (н. у.) займут 14,2 г газообразного хлора? Сколько атомов хлора содержится в этой массе газа?
3. На нейтрализацию кислоты массой 2,18 г израсходовано 2,49 г гидроксида калия. Какова эквивалентная масса кислоты?
3. При некоторой температуре плотность паров серы по воздуху равна 6,62.
Из скольких атомов состоит молекула серы?
Вариант 14
1. Какой объем будет занимать газообразный оксид азота (IV), взятый количеством 0,25 моль, при температуре 0 °С и давлении 202,6 кПа?
2. Определите объем водорода, выделившегося в результате реакции 11,2 г металла, эквивалентная масса которого составляет 28 г/моль, с избытком кислоты (н. у.).
3. Какой объем (н. у.) оксида азота (II) образуется при взаимодействии
0,5•10 21 молекул газообразного азота с кислородом?
Вариант 15
1. Вычислите эквивалентную массу кислоты, если известно, что 2 г этой кислоты содержат 0,1 г водорода, способного замещаться на металл.
2. Какой объем (н. у.) займут 16 г оксида серы (IV)?
3. Масса 15 л газа при 18 о С и при давлении 122 кПа равна 30,3 г. Определите молярную массу этого газа.
Определение эквивалентной массы металла
Закон эквивалентов открыт в конце 18 века: вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам. Для решения задач удобно пользоваться другой формулировкой: массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам)
- количество эквивалентов - количество эквивалентов
Химическим эквивалентом элемента (молярной массой эквивалента) называется такое его количество (моль), которое соответствует 1 моль атомов водорода (соединятся с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях). Химический эквивалент не является постоянной величиной, он зависит от валентности (степени окисления) элемента.
Молярная масса эквивалента (м э ) – это масса одного эквивалента (грамм/моль*экв, килограмм/моль*экв). Молярная масса эквивалента равна частному от деления молярной массы его атомов (А) на валентность (степень окисления) элемента (В) в данном соединении:
Например, молярная масса эквивалента серы в SO2 и SO3 соответственно равны 32/4 = 8 г/моль и 32/6 = 5.33 г/моль.
Эквивалентным объемом (л/моль, м 3 /моль) называется объем, занимаемый при данных условиях (Р, Т) 1 эквивалентов вещества. Значения эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в молярном объеме любого газа, состоящего из одноатомных молекул, содержится 2 моля атомов и т.д. Так в 22.4 л Н2 содержится при нормальных условиях (Р0=760 мм рт.ст.=101325 Па; Т0 = 273 К) 2 моля атомов водорода. Поскольку эквивалент водорода равен 1 моль, то в 22.4 л Н2 содержится 2 эквивалента водорода; значит, эквивалентный объем водорода равен
22.4/2 = 11.2 л/моль = 11.2 * 10 -3 м 3 /моль.
Пример № 1.Определить эквивалента и эквивалентные массы элементов в соединениях HF, H2O, NH3, CH4.
Решение. В указанных соединениях с 1 моль атомов водорода соединяется 1 моль атомов фтора, 1/2 моль атомов кислорода, 1/3 моль атомов азота, 1/4 моль атомов углерода.
Следовательно, фактор эквивалентности фтора, кислорода, азота и углерода соответственно равны 1 моль, 1/2 моль, 1/3 моль, 1/4 моль. Исходя из молярных масс атомов этих элементов, определяем, молярную масса эквивалента фтора равна 19 г/моль, кислорода – 16 * 1/2 = 8 г/моль, азота – 14 * 1/3=4.67 г/моль, углерода – 12 * 1/4=3 г/моль.
Для определения молярной массы эквивалента не обязательно исходить из его соединения с водородом. Молярную массу эквивалента можно вычислить по составу соединения данного элемента с любым другим, молярная масса эквивалента которого известна.
Пример № 2.Вычислить молярную массу эквивалента металла, зная, что его хлорид содержит 79.78% хлора. Молярная масса эквивалента хлора равна 35.45 г/моль•экв.
Решение. Содержание металла в этом соединении составляет: 100 – 79.78=20.22%. Согласно закону эквивалентов: количество эквивалентов металла равно количеству эквивалентов хлора mме/ М э ме = mСl/ М э Сl, т.е.
20.22/ М э ме = 79,78/35.45 => М э ме=20.22•35.45/79.78=8.98 г/моль. Молярная масса эквивалента металла равена 8.99 г/моль.
Молярные массы эквивалентов химических соединений так же как молярные массы эквивалентов элементов могут иметь переменные значения. Это определяется характером превращения веществ.
Молярные массы эквивалентов оксидов в реакциях обмена:
где Моксида – молярная масса оксида; n – число атомов элемента;
В – валентность (степень окисления) элемента.
Пример № 3.Определить эквивалентные массы оксидов железа.
Решение. Железо образует три оксида FeO, Fe2O3, FeO3.
Молярные массы эквивалентов кислот в реакциях обмена:
где Мкислоты – молярная масса кислоты; nн – число атомов водорода, содержащихся в молекуле кислоты, способных замещаться на металл.
Пример№4.Определить молярную массу эквивалента и фактор эквивалентности H3PO4 в следующих реакциях:
Решение. Молярная масса H3PO4 равна 98 г/моль.
В реакции (1) количество nн атомов водорода, заместившихся на металл, равно 3, следовательно эквивалент Н3Р04 равен 1/3 моль, а эквивалентная масса ЭН3Р04 = 98/3 = 32.7 (г/моль).
В реакции (2) пн-2, следовательно, эквивалент Н3Р04 равен 1/2 моль, а эквивалентная масса Э = 98/2 = 49 (г/моль).
В реакции (3) пн= 1, следовательно, эквивалент Н3Р04 равен 1 моль, а эквивалентная масса Э = 98/1 = 98 (г/моль).
Молярные массы эквивалентов оснований в реакциях обмена:
где Mоснования – молярная масса основания; nон – валентность металла ли число гидроксильных групп в молекуле основания, способных заместиться на кислотный остаток.
Пример № 5.Определить молярную массу эквивалента и фактор эквивалентности Сu(ОН)2 в следующих реакциях:
Решение. Молярная масса Сu(ОН)2 равна 97.5 г/моль. В реакции (1) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 2, следовательно фактор эквивалентности Сu(ОН)2 равен 1/2 моль, а молярная масса эквивалента М э Сu(ОН)2 = 97.5/2 = 48.75 (г/моль).
В реакции (2) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 1, следовательно эквивалент Сu(ОН)2 равен 1 моль, а эквивалентная масса ЭСu(ОН)2 = 97.5/1 = 97.5(г/моль).
Эквиваленты солей в реакциях обмена:
где Мсоли – молярная масса соли; –число атомов металла; –валентность (степень окисления) металла.
Пример № 6.Определить молярную массу эквивалента сульфата алюминия.
Решение. Молярная масса сульфата алюминия Al(SO4)3 равна 342 г/моль. Следовательно, М э Al2(SO4)3 = 342/(2•3) = 57 г/моль.
Окислительно-восстановительные эквиваленты определяются путём деления молярной массы на число электронов, идущих на восстановление или окисление
где Мо(в) – молярная масса окислителя (восстановителя); nе – число электронов, идущих на окисление (восстановление).
Пример № 7.Чему равна молярная масса эквивалентна перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается: 1) до сульфата марганца; 2) до диоксида марганца; 3) манганата калия?
Выполнение работы
Определение эквивалентной массы металла
Задание: Определить экспериментально эквивалентную массу металла (магния, цинка – по заданию преподавателя) по количеству выделившегося водорода в реакции взаимодействия металла с соляной кислотой
Вычислить ее теоретическое значение и относительную ошибку эксперимента.
Приборы и реактивы.Прибор для определения эквивалента металла (рис.1.1.). Аналитические весы. Термометр. Барометр. Мерный цилиндр на 25-50 мл. Стаканчик химический. Фильтровальная бумага. Навеска металла (химически чистого) около 0.04 – 0.05 г. Соляная кислота (10мас.% раствор).
Ход определения.
1. Налить через воронку в бюретку воду до нулевого деления. Плотно закрыть отверстие бюретки пробкой со стеклянной трубкой. В одну часть сосуда Ландольта поместить навеску цинка. Другую часть сосуда через воронку наполнить на две трети объема разбавленной (10мас.%) соляной кислотой. Присоединить сосуд к свободному концу трубки, соединенной с бюреткой.
2. Проверить герметичность прибора. Для этого опустить или поднять воронку вместе с кольцом на 10-15 см. Если уровень воды в бюретке не меняется, то прибор герметичен и можно приступать к опыту. Если уровень воды в бюретке меняется, то необходимо плотнее закрыть пробками бюретку и сосуд, снова проверить и т.д. Уровень воды V1 в бюретке до начала опыта записать с точностью до 0.1 мл.
3. Привести в контакт кислоту и металл, осторожно наклоняя сосуд Ландольта. После полного растворения металла выждать 5-7мин., чтобы содержимое сосуда охладилось. Затем установить на одной высоте уровень воды в бюретке и воронке. При этом внутри прибора создается давление, равное давлению наружного воздуха. Записать уровень воды V2 в бюретке после опыта.
4. Результаты эксперимента внести в журнал по форме:
Уровень воды в бюретке:
Объем водорода при нормальных условиях (н.у.) V0, мл………………
Температура опыта T = 273+t, K…………………………………………
Барометрическое давление P, мм рт.ст…………………………………..
Давление насыщенного водяного пара h, мм рт.ст. при температуре опыта……………………………………………………
Экспериментальная эквивалентная масса металла М э эксп, г/моль……….
Теоретическая эквивалентная масса металла М э теор, г/моль……………..
Относительная ошибка e, %.
Рис. 1.1.Прибор для определения эквивалента металла:
1) Бюретка для измерения объёма выделившегося водорода;
2) Сосуд Ландольта для проведения реакции;
3) Каучуковая трубка;
1. Подсчитать VН2, вытесненного водорода по разности уровней в бюретке:
2. Привести это объем к нормальным условиям:
Величину h посмотреть в справочнике. Поправку h вводят вследствие того, что общее давление на воду является суммой пропорциональных давлений водорода и воды.
3. Вычислить экспериментальную массу металла:
где - эквивалентный объем водорода, равный 11200 мл/моль.
4. Сравнить найденную экспериментальную эквивалентную массу металла с теоретически посчитанным Этеор = А/В, вычислив в процентах ошибку опыта:
3. Контрольные вопросы и задачи
1. Вычислить молярные массы эквивалентов следующих элементов:
а) магния, если известно, что при нагревании одного моль его в токе кислорода, масса увеличилась на 66.7%. Ответ: 11.9 г/моль;
б) олова, если при нагревании 0.9185 г его в токе кислорода образуется 1.166 г оксида олова. Ответ: 29.68 г/моль.
2. Определить молярную массу эквивалента элемента, если при восстановлении 1.3 г оксида этого элемента алюминием получилось 1.02г оксида алюминия, содержащего 47% кислорода. Ответ: 13.66г/моль.
3. Написать формулу соединения сурьмы с серой, если известно, что молярная масса атомов сурьмы равна 121.8 г/моль, эквивалентная масса ее - 40.6 г/моль, молярная масса атомов серы равна 32 г/моль, эквивалентная масса - 16 г/моль.
4. Определить молярные массы эквивалентов и факторы эквивалентности кислот и оснований в следующих реакциях:
5. Вычислить молярную массу эквивалента и фактор эквивалентности хромата калия К2СrO4 как окислителя, если К2СrO4 восстанавливается до КСrO2.
6. Определить молярную массу эквивалента металла, если 0.34*10 -3 кг его вытесняют из кислоты 56.94*10 -6 м 3 водорода при температуре 0°С и давлении 94643 Па. Ответ: 67.8 г/моль.
7. Определить молярную массу эквивалента металла в следующих соединениях:
Лаба №1Определение эквивалентной массы металла
Цель работы: определение эквивалентной массы металла, которая находится методом вытеснения водорода из раствора кислоты.
Основные теоретические положения: эквивалентом вещества называется такое его количество, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой называется масса одного эквивалента вещества.
Формулы для вычисления, перечень символов: Согласно закону эквивалентов массы, вступающие в реакцию веществ, пропорциональны эквивалентам этих веществ:

, где М1 и М2 – массы реагирующих веществ, кг; Э1 и Э2 – их эквиваленты.
Эквивалентная масса элемента:
Э = А/n , где А – масса одного моля атомов элемента;
n – его валентность.
Методика эксперимента
Получили навеску опилок металла у преподавателя.
Перед началом опыта проверили сосуд на герметичность.
Подготовили эвдиометр для собирания водорода. Заполнили его до краев водой (с помощью стакана), зажали открытый конец пальцем и, перевернув, погрузили в чашку с водой.
С помощью мерного цилиндра отмерили 5 мл раствора соляной кислоты HCl (в объемном соотношении I:I), влили ее через воронку в пробирку так, чтобы не замочить стенки изнутри. Держа пробирку в слегка наклонном положении, поместили внутрь на сухую стенку навеску опилок металла в папирусной бумаге, закрыли пробирку пробкой и конец газоотводной трубки подвели под водой внутрь эвдиометра.
Атмосферное давление записали по показаниям барометра:
1 мм рт. ст. = 1, 333 · 10 2 Па
763 мм рт. ст. = 1001707,9 Па
Комнатную температуру зафиксировали ртутным термометром:
22 ºС + 273 = 295 К
Значение парциального давления водяных паров h при температуре комнаты нашли по таблице:
Объем полученного водорода Vt = 31 · 10 -6 привели к нормальным условиям:
;
V0 – объем выделившегося водорода при нормальных условиях (Т0 = 273 К, Р0 = 101325 Па), м 3
РН2 – парциальное давление водорода, Па;
Т – температура опыта.
Используя закон эквивалентов, рассчитали эквивалентную массу металла:
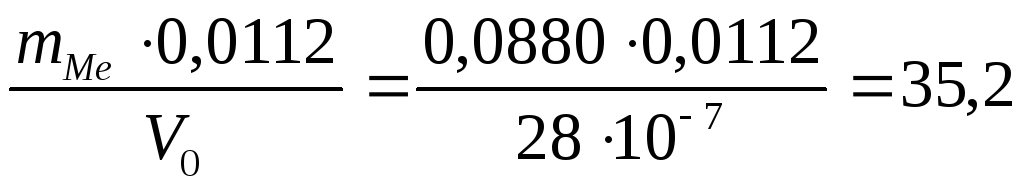
ЭМе = м 3 /моль
ЭМе – эквивалентная масса металла, кг/моль;
mMe – навеска металла, кг;
0,0112 – эквивалентный объем водорода при нормальных условиях, м 3 /моль.
11. Вычислим по соотношению Э = А/n теоретическую эквивалентную массу металла Эт
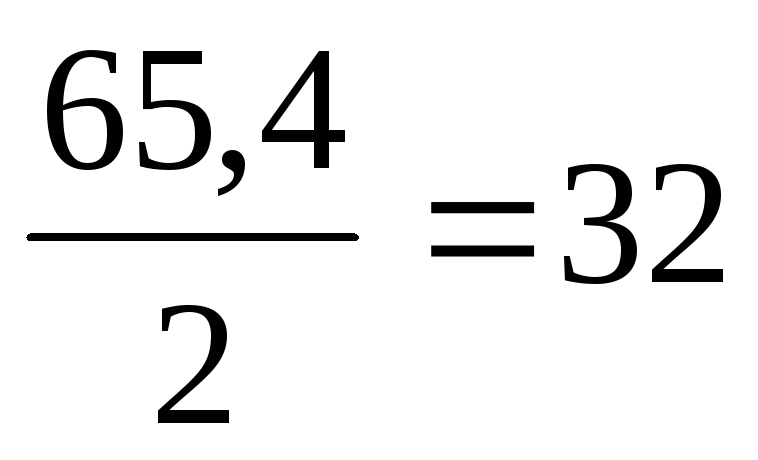
Эт (Zn) = м 3 /моль
12. Вычислим абсолютную и относительную погрешности в определении эквивалентной массы металла в процентах:
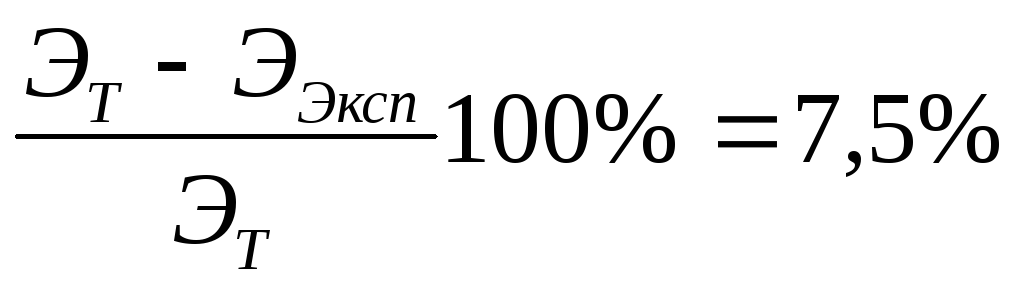
Уравнение химической реакции в молекулярном и ионном виде:
2 2 + H2
2Схема установки:
Рис 1. Схема установки: 1 – штатив; 2 – чашка с водой; 3 – эвдиометр; 4 – пробирка с газоотводной трубкой; 5 – деревянный штатив.
Читайте также:
