Легкий серебристый металл с желтым отливом
Обновлено: 06.07.2024
СКАНДИЙ (Scandium) Sc, хим. элемент III гр. периодич. системы, ат. н. 21, ат. м. 44,9559; относится к редкоземельным элементам. Известен один прир. стабильный изотоп 45 Sc. Поперечное сечение захвата тепловых нейтронов 1,66·10 -21 м 2 . Конфигурация внеш. электронных оболочек атома 3d 1 4s 2 ; устойчивая степень окисления + 3, редко + 1, + 2; энергии ионизации при последоват. переходе от Sc 0 к Sc 3+ равны соотв. 6,5616, 12,80 и 24,76 эВ; сродство к электрону — 0,73 эВ; электроотрицательность по Полингу 1,3; атомный радиус 0,164 нм, ионный радиус Sc 3+ 0,089 нм (координац. число 6), 0,101 нм (8).
Скандий-рассеянный литофильный элемент, геохимически близок РЗЭ иттриевой группы, Mg, Аl, М h , Zr и Ti. Среднее содержание скандия в земной коре 1 · 10 -3 % по массе, концентрация скандия в речных водах 4·10 -8 г/л. подземных (2,2-5) x x 10 -8 г/л, в воде океанов -8·10 -10 г/л. Известно более 120 минералов-носителей скандия. Собств. минералы скандия (очень редки): тортвейтит (Sc,Y) 2 Si 2 O 7 , баццит Sc 2 Be 3 Si 6 O l8 , джервисит NaScSi 2 О 6 , каскандит CaScSi 3 O 8 (ОН), кольбекит (эггонит) ScPO 4 · 2Н 2 О.
Свойства. Скандий-легкий серебристый металл с характерным желтым отливом, существует в двух кристаллич. модификациях: до 1336°С устойчива a -форма с гексагон. решеткой типа Mg, а = 0,33085 нм, с = 0;52680 нм, z=2, пространств группа Р6 3 /ттс, рентгеновская плота. 2,989 г/см 3 ; выше 1336°С существует b -форма с кубич. объемноцентрир. решеткой; D H перехода 4,01 кДж/моль; т. пл. 1541 °С, т. кип. 2837 °С; давление пара 10,24 Па (1541 °C; 14,1 кДж/моль, : 314,2 кДж/моль;
По хим. св-вам скандий имеет как сходство с элементами III гр. (Al, Ga, In, РЗЭ), так и существ. различия. Скандий химически высокоактивен. На воздухе покрывается защитной пленкой Sc 2 O 3 толщиной до 15-60 нм, заметное окисление на воздухе начинается при 250 °С, в атмосфере О 2 -при 200 °C С Н 2 реагирует выше 450 °С с образованием гидрида ScH x , где x
Оксид (сесквиоксид) Sc 2 O 3 при обычном давлении существует в кубич. модификации (С-тип, см. табл.) или аморфном состоянии; при 1000°С и давлении 13 ГПа образуется моноклинная модификация (а = 1,3173 нм, b = 0,3194 нм, с = 0,7976 нм, b =100,67°, z = 6, плотн. 4,16 г/см 3 ); устойчив к гидролизу, взаимод. с р-рами минер. к-т, с р-рами щелочей не реагирует; получают разложением гидрокси-да, нитрата, оксалата и др. соединений скандия при 400-500 °С (аморфный) или 800-1000 °С (кристаллич. Sc 2 O 3 ). Образует скандиаты (M I ScO 2 , M II Sc 2 O 4 ), смешанные оксиды (напр., 2Sc 2 O 3 -3ZrO 2 ).
Гидроксиды скандия бесцветны, по составу и строению аналогичны гидроксидам Al, Fe и Ga; из р-ров солей скандия осаждается NH 3 и щелочами при рН 3,9-8,5 аморфный Sc (ОН) 3 · n H 2 О с высокой степенью гидратации, на воздухе постепенно обезвоживается до Sc 2 О (ОН) 4 и Sc 2 О 2 (ОН) 2 x x 2H 2 О; подвержен старению с образованием мелких кристаллов. Кристаллич. Sc(OH) 3 получен в гидротермальных условиях; решетка кубич. (а = 0,7888 нм, z = 8; плотн. 2,68 г/см 3 ). Известен кристаллич. ScO(OH); при атм. давлении при 370 °С получена a -модификация с ромбич. решеткой типа a -АlO(ОН); не раств. в воде (7·10 -5 г/л Sc 2 O 3 при 25 °С), незначительно раств. в р-рах NH 3 и щелочей.
Трифторид ScF 3 : устойчивая тритон. модификация образуется при получении ScF 3 термич. разложением (NH 4 ) 3 ScF 6 при 340-450 °С с послед. плавлением и охлаждением в атмосфере HF; претерпевает полиморфное превращ. при 1350°С; при обезвоживании ScF 3 ·0,16H 2 O (осажденного из водных р-ров) в интервале 450-500 °С и перегонке в вакууме ScF 3 (полученного р-цией Sc с HF под давлением) образуется устойчивая кубич. модификация (а = 0,40137 нм, пространств. группа Pm3m); метастабильная ромбич. модификация получена при нагр. ScF 3 при 430 °С и давлении 1000 Па; не раств. в воде (~ 10 -5 г в 100 г воды при 20°С), раств. в жидком HF (0,011 г в 100 г HF при О °С); при нагр. во влажном воздухе выше 300 °С последовательно превращ. в ScOF и Sc 2 O 3 .
Трихлорид ScCl 3 хорошо раств. в воде (43,2% по массе при 25 °С), спиртах, ацетоне, глицерине; образует кристаллогидраты ScCl 3 · n Н 2 О, где n = 6,5, аддукты с азот- и кислородсодержащими орг. лигандами и др. Получают ScCl 3 хлорированием Sc 2 O 3 хлором в присут. угля при 1000°С, с добавкой серы при 1200°С, смесью Сl 2 и S 2 Cl 2 при 800 °С или CCl 4 при 750-800 °C. Известны также гидроксо- и оксо-хлориды Sc(OH)Cl·nН 2 0, где n = 4, 3, 1, SсОСl·Н 2 O.
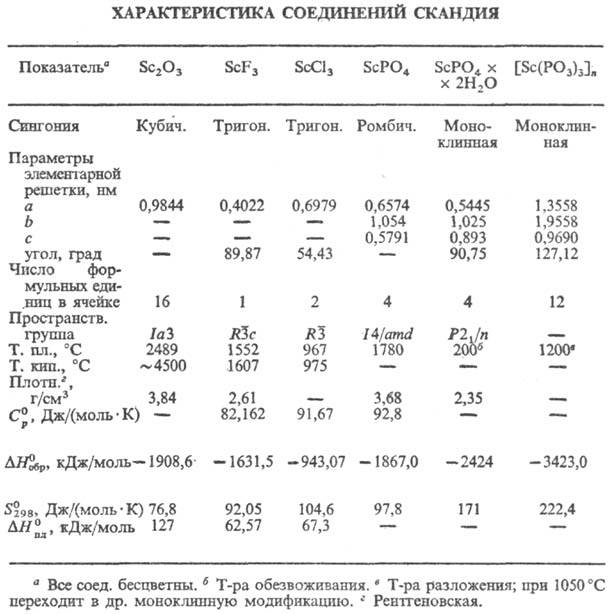
Ортофосфат ScPO 4 не раств. в воде (3,4·10 6 моль/л при 25°С), раств. в соляной к-те (1,0·10 -3 -4,0·10 -4 моль/л при 25°С) и разб. H 2 SO 4 (0,5·10 -2 -1,2·10 -3 моль/л при 25 °С); получают взаимод. Sc 2 O 3 с конц. Н 3 РО 4 при 400 °С или с (МН 4 ) 2 НРО 4 при 950-1200 °С, разложением Sс 2 (НРО 3 ) 3 . Полифосфат скандия [Sc(PO 3 ) 3 ] n не раств. в воде (0,2·10 -5 моль/л при 25 °С), незначит.'раств. в соляной и бромистоводородной к-тах.
Р-римые в воде соединения скандия-хлорид, нитрат, перхлорат, сульфат, ацетат и др.; гидролизуются водой, выделяются в виде гидратов.
Получение. Осн. источники получения скандия-отходы произ-в W, Sn, Al, Ti, V, а также чугуна, При гидро- и пирометаллургич. переработке руд скандия концентрируется в отвалах или шлаках (содержание Sc 2 O 3 0,01-0,5%). Отходы и шлаки обычно вскрывают кислотным методом. Наиб. эффективный метод концентрирования и очистки скандия - экстракция. Компактный металл (99,5% Sc и выше) получают каль-циетермич. восстановлением SсСl 3 или ScF 3 с послед, перегонкой металла в высоком вакууме (~1,3·10 -4 Па) при 1600-1700 °C.
Скандий-компонент легких сплавов с высокой прочностью и коррозионной устойчивостью на основе Mg, Al, Ti, легирующая добавка к сплавам на основе Ni, Со, Сr, Mo, W, Zr и др., геттер. Оксид скандия применяют в произ-ве ферритов для запоминающих устройств в ЭВМ, искусств. гранатов, эмиттеров (на основе 3ВаО · 2Sc 2 O 3 ) для электровакуумных приборов, твердых электролитов (вместе с ZrO 2 ), как компонент керамич. материалов и огнеупорных покрытий и др. Ортофосфат скандия-основа флуоресцирующих составов, активированных Сu, Мn и др.
Существование скандия предсказано Д. И. Менделеевым в 1870; он открыт Л.Нильсоном в 1879.
Лит.: Мельников П. П., Комиссарова Л. Н., "Координац. химия", 1988, т. 14, № 7, с. 875-99; Минерально-сырьевые ресурсы скандия и технология извлечения. Сборник обзорной информации Министерства геологии СССР, М., 1989; Scandium, L.-[a.o.], 1975. Л. Н. Комиссарова.
Скандий
Sc, химический элемент III группы периодической системы Менделеева: атомный номер 21, атомная масса 44,9559; лёгкий металл с характерным жёлтым отливом, который появляется при контакте металла с воздухом. Известен один природный стабильный изотоп 45 Sc. Из 10 искусственных радиоактивных изотопов важнейший 46 Sc с периодом полураспада 84 сут. С. был предсказан Д. И. Менделеевым в 1870 и выделен в 1879 Л. Ф. Нильсоном из минералов гадолинита и эвксенита, найденных в Скандинавии (лат. Scandia), отсюда и название элемента.
Распространение в природе. Среднее содержание С. в земной коре (кларк) 2,2․10 -3 % по массе. В горных породах содержание С. различно: в ультраосновных 5․10 -4 , в основных 2,4․10 -3 , в средних 2,5․10 -4 , в гранитах и сиенитах 3 . 10 -4 ; в осадочных породах (1—1,3) . 10 -4 . С. концентрируется в земной коре в результате магматических, гидротермальных и гипергенных (поверхностных) процессов. Известно два собственных минерала С. — тортвейтит и стерреттит; они встречаются чрезвычайно редко. В целом С. — типичный рассеянный элемент (См. Рассеянные элементы), слабый мигрант (см. также Рассеянных элементов руды). Содержание С. в морской воде 4․10 -5 г/л.
Физические и химические свойства. С. существует в двух кристаллических модификациях: α и β; при обычной температуре устойчива α-модификация с гексагональной решёткой (а = 3,3080 Å и с = 5,2653 Å), выше 1350 °С — β-модификация с кубической объёмноцентрированной решёткой. Плотность С. в а-форме при 25 °С 3,020 г/см 3 , атомной радиус 1,64 Å, ионный радиус 0,75 Å, tпл 1539 ± 5 °С, tkип 2700 °C, выше 1600 °С летуч. При 25 °С удельная теплоёмкость 25,158 кдж/(кг . К) [6,01 ккал/ (г․°С)], удельное электрическое сопротивление (54—70,7) . 10 -6 ом․см, С. слабый парамагнетик, его атомная магнитная восприимчивость 236-10 -6 (20 °С). Sc — первый переходный элемент с одним 3d электроном; конфигурация внешних электронов атома 3d 1 4s 2 .
По хим. поведению сходен с др. переходными элементами в степени окисления +3 (например, Ti 3+ , Fe 3+ , Мп 3+ ), элементами подгруппы Al, Be, а также элементами иттриевой подгруппы, вместе с которыми его иногда относят к редкоземельным элементам (См. Редкоземельные элементы). На воздухе покрывается защитной окисной плёнкой толщиной до 600Ǻ, заметное окисление начинается при 250 °С. При взаимодействии с водородом (450 °С) образуется гидрид ScH2, с азотом (600—800 °С) — нитрид ScN, с галогенами (400—600 °С) — соединения типа ScCI3; С. реагирует также с бором и кремнием при температуре выше 1000 °С. Металл легко растворяется в соляной, азотной и серной кислотах (с понижением концентрации кислоты скорость растворения С. резко падает и с 0,001 н. растворами он не реагирует). Соли соляной, серной, азотной, роданистоводородной и уксусной кислот хорошо растворяются в воде, а соли фосфорной, щавелевой и плавиковой кислот мало растворимы; некоторой летучестью обладают ацетилацетонат и его фторпроизводные. На С. практически не действуют разбавленные растворы NaOH (10%) и смесь концентрированных HNO3 и HF (1: 1). В воде соединения С. заметно гидролизуются с образованием основных солей. Ионы Sc 3+ склонны к полимеризации, образованию комплексных ионов различного типа, состав которых зависит от природы аниона и pH среды, например Sc (CO3) - 2, Sc (SO4) 3- 3. Основные соли в растворе легко переходят в аморфную гидроокись.
Получение и применение. С. преимущественно в виде окислов извлекают попутно при гидро- и пирометаллургической переработке вольфрамовых, оловянных, титановых, урановых руд и бокситов. Окислы хлорируют или фторируют при повышенной температуре, а затем компактный металлический С. (выход Скандий 99,5°о) получают термическим восстановлением его хлорида или фторида металлическим кальцием с последующей дистилляцией (возгонкой) Sc в высоком вакууме 133,3․10 -6 н/м 2 (10 -6 мм рт. cm.) при 1600—1700 °С.
Масштабы применения С. весьма ограничены. Окись С. идёт на изготовление ферритов для элементов памяти быстродействующих вычислительных машин. Радиоактивный 46 Sc используется в нейтронно-активационном анализе и в медицине. Сплавы С., обладающие небольшой плотностью и высокой температурой плавления, перспективны как конструкционные материалы в ракето- и самолётостроении, а ряд соединений С. может найти применение при изготовлении люминофоров, оксидных катодов, в стекольном и керамических производствах, в химической промышленности (в качестве катализаторов) и в других областях.
Лит.: Борисенко Л. Ф., Скандий, М, 1961; Фаворская Л. В., Химическая технология скандия, А.-А., 1969; Коган Б. И., Названова В. А., Скандий, М., 1961; Справочник но редким металлам, пер. с англ., М., 1965; Vickery R. С., The chemistry of yttrium and scandium, Oxf., 1960.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .

Умеренно мягкий, лёгкий редкоземельный металл серебристого цвета с жёлтым отливом
Скандий / Scandium (Sc), 21
1,36 (шкала Полинга)
a=3,309 c=5,268 (α-Sc) Å
Ска́ндий (лат. Scandium ; обозначается символом Sc) — элемент побочной подгруппы третьей группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 21. Простое вещество скандий (CAS-номер: 7440-20-2) — лёгкий металл серебристого цвета с характерным жёлтым отливом. Существует в двух кристаллических модификациях: α-Sc с гексагональной решёткой типа магния, β-Sc с кубической объёмноцентрированной решёткой, температура перехода α↔β 1336 °C [1] .
Содержание
Нахождения в природе
Месторождения
Самые значительные месторождения тортвейтита (минерала, наиболее богатого скандием) расположены на Мадагаскаре и в Норвегии [2] .
История
Элемент был предсказан Д. И. Менделеевым (как эка-бор) и открыт в 1879 году шведским химиком Ларсом Нильсоном. Нильсон назвал элемент в честь Скандинавии.
Физические свойства
Скандий — лёгкий металл серебристого цвета с характерным жёлтым отливом. Существует в двух кристаллических модификациях: α-Sc с гексагональной решёткой типа магния (a=3,3085 Å; с=5,2680 Å; z=2; пространственная группа P63/mmc), β-Sc с кубической объёмноцентрированной решёткой, температура перехода α↔β 1336 °C, ΔH перехода 4,01 кДж/моль. Температура плавления 1541 °C, температура кипения 2837 °C. Скандий — мягкий металл, с чистотой 99,5 % и выше (в отсутствие O2) легко поддается механической обработке [1] .
Химические свойства
Геохимия и минералогия
Среднее содержание скандия в земной коре 10 г/т. Близки по химическим и физическим свойствам к скандию иттрий, лантан и лантаноиды. Во всех природных соединениях скандий, так же как и его аналоги алюминий, иттрий, лантан, проявляет положительную валентность, равную трём, поэтому в окислительно-восстановительных процессах он участия не принимает. Скандий является рассеянным элементом и входит в состав многих минералов. Собственно скандиевых минералов известно 2: тортвейтит (Sc, Y)2 Si2O7 (Sc2O3 до 53,5 %) и стерреттит Sc[PO4] • 2H2O (Sc2O3 до 39,2 %). Относительно небольшие концентрации обнаружены примерно в 100 минералах. В связи с тем, что по свойствам скандий близок к Mg, Al, Ca, Mn 2+ , Fe 2+ , TR (редкоземельным элементам), Hf, Th, U, Zr, главная масса его рассеивается в минералах, содержащих эти элементы. Имеет место изовалентное замещение скандием элементов группы TR, особенно в существенно иттриевых минералах (ксенотим, ассоциация Sc — Y в тортвейтите и замещение Al в берилле). Гетеровалентное замещение скандием Fe 2+ и магния в пироксенах, амфиболах, оливине, биотите широко развито в основных и ультраосновных породах, а замещение циркония — в поздние стадии магматического процесса и в пегматитах.
Основные минералы-носители скандия: флюорит (до 1 % Sc2O3), касситерит (0,005-0,2 %), вольфрамит (0-0,4 %), ильменорутил (0,0015-0,3 %), торианит (0,46 % Sc2O3), самарскит (0,45 %), виикит (1,17 %), ксенотим (0,0015-1,5 %), берилл (0,2 %), баццит (скандиевый берилл, 3-14,44 %). В процессе формирования магматических пород и их жильных производных скандий в главной своей массе рассеивается преимущественно в тёмноцветных минералах магматических пород и в незначительной степени концентрируется в отдельных минералах постмагматических образований. Наиболее высокие (30 г/т Sc2O3) концентрации скандия приурочены к ультраосновным и основным породам, в составе которых ведущую роль играют железо-магнезиальные минералы (пироксен, амфибол и биотит). В породах среднего состава среднее содержание Sc2O3 10 г/т, в кислых — 2 г/т. Здесь скандий рассеивается также в тёмноцветных минералах (роговой обманке, биотите) и устанавливается в мусковите, цирконе, сфене. Концентрация в морской воде 0,00004 мг/л [3] .
Получение
Следует отметить значительные ресурсы скандия в золе каменных углей и проблему разработки технологии извлечения скандия при переработке углей на искусственное жидкое топливо.
Мировые ресурсы скандия
Скандий является рассеянным литофильным элементом (элемент горных пород), поэтому для технологии добычи этого элемента важно полное извлечение его из перерабатываемых руд и по мере развития металлургии руд-носителей скандия, его ежегодный объём добычи будет возрастать. Ниже приведены основные руды-носители и масса выделяемого из них попутного скандия:
- — 71 млн тонн переработки в год, содержат попутный скандий в объёме 710—1420 тонн; руды — 50 млн тонн в год, попутный скандий 50—500 тонн в год; — 2 млн тонн в год, попутный скандий 20—40 тонн в год; — попутный скандий около 30—70 тонн в год; — 200 тысяч тонн в год, попутный скандий 20—25 тонн в год; — 100 тысяч тонн в год, попутный скандий 5—12 тонн в год.
Всего известно более сотни скандий-содержащих минералов, собственные его минералы (тортвейтит, джервисит) очень редки [4] .
Скандий присутствует в каменном угле и для его добычи можно вести переработку доменных чугунолитейных шлаков, которая была начата в последние годы в ряде развитых стран.
Производство и потребление скандия
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 12 мая 2011.
В 1988 году производство оксида скандия в мире составило:
| Страна | Объём добычи, не менее, кг/год |
|---|---|
| Китай | 50 |
| Франция | 100 |
| Норвегия | 120 |
| США | 500 |
| Япония | 30 |
| Казахстан | 700 |
| Украина | 610 |
| Россия | 958 |
Следует учесть колоссальные ресурсы скандия в России и бывшем Советском Союзе (данные по добыче весьма разрозненны, но объёмы добычи, по оценкам независимых специалистов, равны или превышают официальную мировую добычу). В целом, по оценкам независимых специалистов, в настоящее время основными продуцентами скандия (оксида скандия) являются Россия, Китай, Украина и Казахстан. Публикуемые в печати объёмы скандия/оксида скандия в США, Японии, Франции — это в большей степени вторичный металл и металл, закупленный на мировом рынке. В определённой степени в ближайшие годы ожидается значительный объём поступлений скандиевого сырья из Австралии, Канады, Бразилии.
Следует также отметить, что запасы редкоземельного сырья в Монголии, содержащего скандий, это также перспективный источник скандия для скандиевой промышленности и развития металлургии скандия.
Скандий смело можно назвать металлом XXI века и прогнозировать резкий рост его добычи, рост цен и спрос в связи с переработкой огромного количества каменных углей (особенно переработка каменных углей России) на жидкое топливо. Последние пять лет цены на металлический скандий на мировом рынке колеблются от 12 до 20 тыс. долл за один кг (время от времени наблюдаются резкие скачки цен на скандий и его оксид, мало объяснимые с точки зрения специалистов). [источник не указан 476 дней]
Применение
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 11 мая 2011.
Скандий — моноизотопный элемент, в природе встречается только один стабильный изотоп скандий-45.
Металлургия
Применение скандия в виде микролегирующей примеси оказывает значительное влияние на ряд практически важных сплавов, так например прибавление 0,4 % скандия к сплавам алюминий-магний повышает временное сопротивление разрыву на 35 %, а предел текучести на 65—84 %, и при этом относительное удлинение остаётся на уровне 20—27 %. Добавка 0,3—0,67 % к хрому, повышает его устойчивость к окислению вплоть до температуры 1290 °C, и аналогичное но ещё более ярко выраженное действие оказывает на жаростойкие сплавы типа «нихром» и в этой области применение скандия куда как эффективнее иттрия. Оксид скандия обладает рядом преимуществ для производства высокотемпературной керамики перед другими оксидами, так прочность оксида скандия при нагревании возрастает и достигает максимума при 1030 °C, в то же время оксид скандия обладает минимальной теплопроводностью и высочайшей стойкостью к термоудару. Скандат иттрия это один из лучших материалов для конструкций, работающих при высоких температурах. Определённое количество оксида скандия постоянно расходуется для производства германатных стёкол для оптоэлектроники.
Сплавы скандия
Главным по объёму применением скандия является его применение в алюминиево-скандиевых сплавах, применяемых в спортивной экипировке (мотоциклы, бейсбольные биты и т. п.) — везде, где требуются высокопрочные материалы. В сплаве с алюминием скандий обеспечивает дополнительную прочность и ковкость. Предел прочности на разрыв у чистого скандия около 400 Мпа (40 кг/мм), у титана например 250—350 МПа, а у нелегированного иттрия 300 Мпа. Применение скандиевых сплавов в авиации и ракетостроении позволит значительно снизить стоимость перевозок и резко повысить надёжность эксплуатируемых систем, в то же время при снижении цен на скандий и его применение для производства автомобильных двигателей так же значительно увеличит их ресурс и частично КПД. Очень важно и то обстоятельство что скандий упрочняет алюминиевые сплавы легированные гафнием. Важной и практически не изученной областью применения скандия является то обстоятельство что подобно легированию иттрием алюминия, легирование чистого алюминия скандием также повышает электропроводность проводов, и эффект резкого упрочнения имеет большие перспективы для применения такого сплава для транспортировки электроэнергии (ЛЭП). Сплавы скандия наиболее перспективные материалы в производстве управляемых снарядов. Ряд специальных сплавов скандия, композитов на скандиевой связке весьма перспективен в области конструирования скелета киборгов. В последние годы важная роль скандия (и отчасти иттрия и лютеция) выявилась в производстве некоторых по составу суперпрочных мартенситностареющих сталей, некоторые образцы которых показали прочность свыше 700 кг/мм 2 (свыше 7000 МПа).
Сверхтвёрдые материалы
Скандий используется для получения сверхтвёрдых материалов. Так, например, легирование карбида титана карбидом скандия весьма резко поднимает микротвёрдость (в 2 раза), что делает этот новый материал четвёртым по твёрдости после алмаза (около 98,7 — 120 ГПа), нитрида бора (боразона), (около 77—87 ГПа), сплава бор-углерод-кремний (около 68—77 ГПа), и существенно больше чем у карбида бора(43,2 — 52 ГПа), карбида кремния (37 ГПа), микротвёрдость сплава карбида скандия и карбида титана около 53,4 ГПа (у карбида титана например 29,5 ГПа). Особенно интересны сплавы скандия с бериллием, обладающие уникальными характеристиками по прочности и жаростойкости.
Так, например, бериллид скандия (1 атом скандия и 13 атомов бериллия) обладает наивысшим благоприятным сочетанием плотности, прочности и высокой температуры плавления, и может явится лучшим материалом для строительства аэрокосмической техники, превосходя в этом отношении лучшие сплавы из известных человечеству на основе титана, и ряд композиционных материалов (в том числе ряд материалов на основе нитей углерода и бора).
Микроэлектроника
Оксид скандия (температура плавления 2450 °C) имел важнейшую роль в производстве супер-ЭВМ: ферриты с малой индукцией при использовании в устройствах хранения информации позволяют увеличить скорость обмена данными в несколько раз из-за снижения остаточной индукции с 2 — 3 КГаусс до 0,8 — 1 КГаусс.)
Источники света
Порядка 80 кг скандия (в составе Sc2O3) в год используется для производства осветительных элементов высокой интенсивности. Иодид скандия добавляется в ртутно-газовые лампы, производящие очень правдоподобные источники искусственного света, близкого к солнечному, которые обеспечивают хорошую цветопередачу при съёмке на телекамеру.
Изотопы скандия
Радиоактивный изотоп скандий-47 (период полураспада 3,35 сут) является одним из лучших источников позитронов.
Ядерная энергетика
В атомной промышленности с успехом применяется гидрид и дейтерид скандия — прекрасный замедлитель нейтронов, и мишень (бустер) в мощных и компактных нейтронных генераторах.
Диборид скандия (температура плавления 2250 °C) применяется в качестве компонента жаропрочных сплавов, а также как материал катодов электронных приборов. В атомной промышленности находит применение бериллид скандия в качестве отражателя нейтронов, и в частности этот материал, равно как и бериллид иттрия предложен в качестве отражателя нейтронов в конструкции атомной бомбы.
Медицина
Важную роль оксид скандия может сыграть в медицине (высококачественные зубные протезы).
Лазерные материалы
Высокотемпературной сверхпроводимости, производстве лазерных материалов (ГСГГ). Галлий-скандий-гадолиниевый гранат при легировании его ионами хрома и неодима позволил получить 4,5 % КПД и рекордные параметры в частотном режиме генерации сверхкоротких импульсов, что даёт весьма оптимистичные предпосылки для создания сверхмощных лазерных систем для получения термоядерных микровзрывов уже на основе чистого дейтерия (инерциальный синтез) уже в самом ближайшем будущем. Так например ожидается [кем?] что в ближайшие 10—13 лет лазерные материалы на основе ГСГГ и боратов скандия займут ведущую роль в разработке и оснащении лазерными системами активной обороны для самолётов и вертолётов в развитых странах, и параллельно с этим развитие крупной термоядерной энергетики с привлечением гелия-3 (добываемого на Луне [источник не указан 917 дней] ), в смесях с гелием-3 лазерный термоядерный микровзрыв уже получен.
Производство солнечных батарей
Оксид скандия в сплаве с оксидом гольмия используется в производстве фотопреобразователей на основе кремния в качестве покрытия. Это покрытие имеет широкую область прозрачности (400—930 нм), и снижает спектральный коэффициент отражения света от кремния до 1—4 %, и при его применении у такого модифицированного фотоэлемента увеличивается ток короткого замыкания на 35—70 %, что в свою очередь позволяет увеличить выходную мощность фотопреобразователей в 1,4 раза.
МГД-генераторы
Хромит скандия используется как один из лучших и наиболее долговечных материалов для изготовления электродов МГД-генераторов, к основной керамической массе добавляют предварительно окисленный хром и спекают, что придаёт материалу повышенную прочность и электропроводность. Наряду с диоксидом циркония как электродным материалом для МГД-генераторов, хромит скандия обладает более высокой стойкостью к эрозии соединениями цезия (используемого в качестве плазмообразующей добавки).
Рентгеновские зеркала
Скандий широко применяется для производства многослойных рентгеновских зеркал (композиции: скандий-вольфрам, скандий-хром, скандий-молибден). Теллурид скандия очень перспективный материал для производства термоэлементов (высокая термо-э.д.с, 255 мкВ/К и малая плотность и высокая прочность).
В последние годы значительный интерес для авиакосмической и атомной техники приобрели тугоплавкие сплавы (интерметаллические соединения) скандия с рением (температура плавления до 2575 °C), рутением (температура плавления до 1840 °C), железом (температура плавления до 1600 °C), (жаропрочность, умеренная плотность и др).
Огнеупорные материалы
Важную роль в качестве огнеупорного материала специального назначения оксид скандия (температура плавления 2450 °C) играет в производстве сталеразливочных стаканов для разливки высоколегированных сталей, по стойкости в потоке жидкого металла оксид скандия превосходит все известные и применяемые материалы (так например наиболее устойчивая окись иттрия уступает в 8,5 раза оксиду скандия) и в этой области можно сказать незаменим. Его широкому применению препятствует лишь весьма высокая цена, и в известной степени альтернативным решением в этой области является применение скандатов иттрия армированных нитевидными кристаллами оксида алюминия для увеличения прочности), а также применение танталата скандия.
Производство фианитов
Важную роль играет оксид скандия для производства фианитов, где он является самым лучшим стабилизатором.
Некоторое количество скандия расходуется для легирования жаростойких сплавов никеля с хромом и железом (нихромы и фехрали) для резкого увеличения срока службы при использовании в качестве нагревательной обмотки для печей сопротивления.
Люминофоры
Борат скандия, равно как и борат иттрия применяется в радиоэлектронной промышленности в качестве матрицы для люминофоров.
Скандий – полезные свойства и особенности металла
Глобальная добыча этого металла измеряется килограммами, стоимость – тысячами долларов за кг. Скандий называют металлом третьего тысячелетия.

Что представляет собой
Скандий – это элемент № 21 периодической системы Д. И. Менделеева:
- Чистый скандий – почти невесомое вещество серебристого цвета с желтоватым отливом, по которому его можно отличить от других легких металлов.
- Относится к группе редкоземельных металлов. Первый по атомному номеру не лантаноид из «редкоземельной триады» скандий-иттрий-лантан.
- Структура кристаллической решетки представлена двумя видами в зависимости от температуры (рубеж – 1336°C).
- По составу это моноизотоп – скандий-45.
Международное обозначение-символ – Sc (Scandium).
Биологического значения не имеет.
Как был открыт
Первым в истории науки существование элемента предсказал Дмитрий Менделеев. Он назвал вещество эка-бором, «вычислил» его атомную массу, свойства.
Через девять лет (в 1879 году) гипотезу Менделеева подтвердил шведский ученый Ларс Нильсен.
Он дал элементу имя в честь Скандинавского полуострова, на котором располагается Швеция.
Крупицы металла получили к 1914 году.
Физико-химические характеристики
Редкоземельный металл легок, мягок, но хрупок. Химические свойства скандия типичны для «редких земель»: хорошее взаимодействие с кислотами, проблемная окисляемость на воздухе, парамагнетизм.

При отсутствии примесей (особенно O2) металл легко обрабатывается.
| Свойства атома | |
|---|---|
| Название, символ, номер | Скандий / Scandium (Sc), 21 |
| Атомная масса (молярная масса) | 44,955912(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d1 4s2 |
| Радиус атома | 162 пм |
| Химические свойства | |
| Ковалентный радиус | 144 пм |
| Радиус иона | (+3e) 72,3 пм |
| Электроотрицательность | 1,36 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 3 |
| Энергия ионизации (первый электрон) | 630,8 (6,54) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 2,99 г/см³ |
| Температура плавления | 1 814 K |
| Температура кипения | 3 110 K |
| Уд. теплота плавления | 15,8 кДж/моль |
| Уд. теплота испарения | 332,7 кДж/моль |
| Молярная теплоёмкость | 25,51 Дж/(K·моль) |
| Молярный объём | 15,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная (α-Sc) |
| Параметры решётки | a=3,309 c=5,268 (α-Sc) |
| Отношение c/a | 1,592 |
| Прочие характеристики | |
| Теплопроводность | (300 K) 15,8 Вт/(м·К) |
| Номер CAS | 7440-20-2 |
Как представлен на планете
Чистый скандий на Земле не обнаружен.
Он представлен другими формами:
- Собственные минералы – джервисит и тортвейтит. В составе последнего – химическая формула Sc, Y2Si2O7 – скандия почти половина. Редкость.
- Чаще это компонент сотни других минералов, железных, урановых руд, углей.
Тонна земной коры содержит 10 граммов скандия.
Это сопоставимо с концентрацией свинца, но извлечение материала усложняет распыленность по литосфере.
Спектральный анализ установил насыщенность скандием некоторых типов звезд.
Месторождения сосредоточены на территории бывшего СССР и Монголии. В России это Якутия, Алтай, Красноярский край, Мурманская область.
Квартет поставщиков сырья на мировой рынок – Китай (91%), Россия, Казахстан, Украина. Как потенциальные игроки рассматриваются Австралия, Бразилия, Канада.
90% скандиевого сырья на мировой рынок поставляет Китай.
Технология получения
Извлечение скандия – многоступенчатый затратный процесс:
- Первым получают гидрооксид. Для этого отходы вольфрамовых руд обжигают, обрабатывают смесью воды, аммиака и серной кислоты.
- Гидроокись обезвоживают (620-730°С).
- Полученную окись избавляют от примесей, разделяют по фракциям.
- Повышенно чистый материал (оксид металла) получают рафинированием плюс прокаливание.
Второй способ получения предусматривает превращение окиси во фторид:
- Сырье дважды обрабатывают фтористым водородом.
- Фтористый скандий восстанавливают металлическим кальцием.
- Смесь металлического скандия и шлака плавят, разделяют в вакууме.
Для получения продукта чистоты 95%+ задействуют вакуумную дистилляцию.
Рентабелен способ получения скандия из каменноугольной золы и отходов переработки углей в синтетическое жидкое топливо.
Где используется
На практике скандий как металл используется редко. Чаще это сплавы, соединения. Особенно популярен оксид.

Умеренно мягкий, лёгкий редкоземельный металл серебристого цвета с жёлтым отливом – Скандий
Металлургия
Скандий востребован как лигатура, улучшающая характеристики продукции:
- У алюминиево-магниевых сплавов повышается порог сопротивляемости, текучести. , нихромовые становятся устойчивее к окислению. В данном сегменте скандий действует эффективнее иттрия.
- Компонент сверхтвердых материалов: с карбидом титана, кремния, нитридом бора, бериллием. Твердость повышается кратно.
Оксид скандия входит в состав огнеупора, из которого сделаны емкости для разливки сталей специальных марок. По жаростойкости оставляет позади всех «конкурентов».
Другие отрасли промышленности
Прочностные характеристики скандиевых сплавов, соединений оценены оборонным и гражданским сектором:
- Оксид металла – основа начинки суперкомпьютеров. Скорость обмена данными увеличивается в разы.
- Производство стекол для оптоэлектроники и жаростойкой керамики. Здесь используются достоинства оксида металла: минимальная теплопроводность плюс неразрушимость структуры термоударом.
- Соединение с иттрием – материал номер один для конструкций, функционирующих в экстремальных условиях.
- Атомщики применяют гидрид и дейтерид как замедлитель нейтронов. Бериллид отражает поток нейтронов (в том числе в ядерных боеголовках).
Это также материал рентгеновских зеркал, автомобилей, воздушных лайнеров, ракет, спутников, солнечных батарей, лазерных компонентов, элементов повышенной светимости.
Радиоактивный изотоп-46 – маркер в нефтепереработке, контролер хода выплавки металлов. Скандий-47 оптимален как источник позитронов.
Непромышленный сегмент
Скандий-46 используют онкологи.
Оксид металла – лучший стабилизатор при производстве фианитов.
Из сплавов с алюминием изготавливают байки, щитки, биты, другое снаряжение для физкультуры, фитнеса, спорта.
Перспективы
Направления использования алюминиево-скандиевых сплавов в будущем:
- Передача электроэнергии. Такое соединение повышает прочность и пропускную способность электропроводов.
- Производство самонаводящихся снарядов.
- Сплавы тестируются как материал остова боевых роботов.
Единственный недостаток, сдерживающий применение металла, – цена.
Стоимость
Диапазон стоимости скандия на мировом рынке – $13-22 тыс./кг.
На цену влияет конъюнктура рынка и вид продукции. Например, материал чистоты «пять девяток» – 99,999% оценили в $10 тыс./ кг. Мелкодисперсный порошок (249 мкм) шел по $296 тыс./кг, оксид металла – по $3,5 тыс./кг.
Скандий как химический элемент таблицы Менделеева
С Скандий является химическим элементом таблицы Менделеева с атомным номером 21 и обозначением Sc. Скандий представляет собой легкий металл серебристого цвета с характерным желтым отливом.
Как был открыт Скандий

Скандий является довольно молодым элементом. Дмитрий Иванович Менделеев, который является русским химиком и основополагателем периодической таблицы химических элементов, еще в 1869 году предполагал существование нового химического элемента с атомной массой от 40 до 48 и назвал его «эка-бор». Сам новый химический элемент был получен шведским ученым Ларсом Фредриком Нильсоном и его командой в 1879 году. Они получили 2 грамма оксида скандия высокой чистоты. Название этому элементу Ларс дал в честь своей Родины — латинское Scandia означает «Скандинавия». Нильсон, вероятно, не знал о предположении Менделеева, но Дмитрия Ивановича об открытии оповестил соотечественник Нильсона Пер Теодор Клив. Название Скандий закрепилось за этим химическим элементом и по сей день.
Проблема заключалась в том, что этот химический элемент долгое время не могли выделить из оксида. Чистый металл впервые извлекли из оксида только в 1937 году. Метод извлечения заключался в электролизе калия, лития и хлорида скандия при температуре 700 – 800°C. Первый фунт металлического скандия чистотой 99% был получен только в 1960 году. Для справки 1 фунт приблизительно равняется 0.45 килограмма. Производство алюминиево-скандиевых сплавов было начато только в 1970-х годах по патентам США.
Где и как добывают Скандий

Ежегодная мировая добыча скандия варьируется в пределах 10 – 15 тысяч тонн. Скандий в промышленных масштабах добывается исключительно в виде оксида. По состоянию на 2003 год во всем мире было всего 3 шахты по добыче скандийсодержащих минералов. Этими странами являлись Россия, Украина и Китай. В большинстве случаев скандий получают в виде побочного продукта при добыче других ископаемых. В пример можно поставить железные и урановые рудники в Днепропетровской области. Так же апатитовые рудники на Кольском полуострове современной РФ. Сейчас многие страны строят перерабатывающие заводы, которые выделяют скандий из минералов. Примером можно поставить заводы на Филлипинах и в Индии. Так же США готовится выделить 1 млрд американских долларов для ввода завода по добыче скандия и его добыче в ниобиевом руднике в Элк-Крик на юго-востоке Небраски.
Принцип работы перерабатывающего завода заключается в получении фторида скандия из минералов. Самым ценным скандийсодержащим минералом является тортвеитит. Учеными предполагается, что наибольшими залежами тортвеитита обладают Мадагаскар и Норвегия, но эти места еще не освоены. Еще одним высококонцентрированным скандийсодержащим минералом является колбекит, но его крупных месторождений пока не обнаружено.
Распространенность Скандия
Скандий из-за своей высокой реакционной способности практически никогда не встречается в виде свободного элемента. Этот химический элемент имеет единственный естественный изотоп встречающийся в природе с атомной массой в 45 а.е.м. Так же он имеет 12 искуственно созданных изотопов. Из-за его редкости и довольно узкого круга применения его добывают не в столь больших количествах. В природе он встречается в виде минералов. Самыми известными скандийсодержащими минералами являются Претулит, Тортвейтит, Колбекит, Аллендейт и Хефтетьернит. До недавнего времени только эти 5 скандийсодержащих минерала были известны науке. Сегодня некоторые источники сообщают, что их уже более сотни. Другие же сообщают, что таких минералов, в каоторых ионы скандия содержатся в виде примесей с долей менее 1% известно уже более 800.
Если разобраться, то скандий является довольно новым химическим элементом и мало изученным. О его распространенности во Вселенной, так же много не скажешь. Так как пока известно только то, что он содержится в звездах. В пример можно поставить наше Солнце, где скандий занимает 23 место по массе. На нашей планете скандий занимает 50 место по массе. Следовательно, скандий не является очень распространенным элементом и так же редким его назвать довольно трудно, потому что он содержится в разнообразных веществах по всему миру, но в очень небольших количествах.
Применение Скандия

Из-за своей редкости, трудности его получения и цены применение скандия довольно ограничено. Стоит заметить, что цена 1 килограмма чистого скандия может варьироваться от 4 до 20 тысяч долларов США. В тоже время скандий применяется в своем большинстве в виде соединений. В пример можно привести сплав алюминия и скандия в военном деле. Некоторые части российских военных самолетов таких как Миг-21 состоят именно из этого сплава. Так же йодид скандия используется в высокоэффективных ртутных лампах высокого давления. Такие лампы можно увидеть, например, на футбольных стадионах. Они способны обеспечивать освещенность светом, похожим на дневной, большие площади покрытия. Сплавы скандия используются при производстве велосипедных составных частей так и частей легковых автомобилей. Еще одним применением скандия является химическая промышленность, где скандий применяется для изготовления лазерных кристаллов. Оксид скандия добавляется в устройства магнитного хранения данных, для увеличения скорости магнитного обращения.
Интересные факты
Интересных фактов связанных со скандием не так уж и много. Стоит начать с того, что порошок скандия является легковоспламеняющимся веществом. Есть предположения, что скандий будет основой нового ракетного топлива, которое сможет обеспечить передвижение кораблей между планетами. Элементарный скандий является нетоксичным, но эксперименты на людях не проводились. Такие эксперименты проводились над крысами. Из опыта стало понятно, что смертельная доза при внутримышечном введении составляет 4 мг/кг чистого веса. При пероральном введении смертельная доза составила 755 мг/кг чистого веса. Вопрос о его токсичности доволььно спорный и изучается учеными по сей день.
Читайте также:
