Металлические свойства у лития выражены слабее чем у
Обновлено: 07.05.2024
Литий ― это элемент 2 периода главной подгруппы I группы периодической системы Д. И. Менделеева, элемент IA или подгруппы щелочных металлов.
Строение атома лития можно отразить так: 3Li ― 2ē, 1ē. Атомы лития будут проявлять сильные восстановительные свойства: легко отдадут свой единственный внешний электрон и получат в результате степень окисления (с. о. ) +1. Эти свойства атомов лития будут слабее выражены, чем у атомов натрия, что связано с увеличением радиусов атомов: Rат (Li) < Rат (Na). Восстановительные свойства атомов лития выражены сильнее, чем у бериллия, что связано и с числом внешних электронов, и с расстоянием от ядра до внешнего уровня.
Литий ― простое вещество, представляет собой металл, а, следовательно, имеет металлическую кристаллическую решетку и металлическую химическую связь. Заряд иона лития: не Li+1 (так указывают с. о.) , а Li+. Общие физические свойства металлов, вытекающие из их кристаллического строения: электро- и теплопроводность, ковкость, пластичность, металлический блеск и т. д.
Литий образует оксид с формулой Li2O ― это солеобразующий, основной оксид. Это соединение образовано за счет ионной химической связи Li2+O2-, взаимодействуют с водой, образуя щелочь.
Гидроксид лития имеет формулу LiOH. Это основание ― щелочь. Химические свойства: взаимодействие с кислотами, кислотными оксидами и солями.
В подгруппе щелочных металлов отсутствует общая формула "Летучие водородные соединения". Эти металлы не образуют летучих водородных соединений. Соединения металлов с водородом ― бинарные соединения ионного типа с формулой M+H-.
План характеристики химического элемента по его положению в периодической системе
1. Положение элемента в периодической системе. Период, группа, подгруппа.
2, Порядковый номер, заряд ядра, количество протонов, количество электронов, количество нейтронов.
3. Электронное строение атома.
4. Возможные валентные состояния атома.
5. Металл, неметалл, амфотерный металл.
6. Высший оксид элемента, его характер.
7.Гидроксид элемента, его характер.
8. Пример формул солей.
химия, 9 класс. дайте характеристику лития по плану.
3. Сравнение свойств простого вещ-ва со свойствами простых вещ-тв, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещ-ва со свойствами простых вещ-тв, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер (основный, кислотный, амфотерный).
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид).
7. Состав летучего водородного соединения (для неметаллов)
Помогите сделать характеристику элемента (Лития)
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Графическим изображением Периодического закона является Периодическая система (таблица). Горизонтальные ряды системы называют периодами, а вертикальные столбцы – группами.
Всего в системе (таблице) 7 периодов, причем номер периода равен числу электронных слоев в атоме элемента, номеру внешнего (валентного) энергетического уровня, значению главного квантового числа для высшего энергетического уровня. Каждый период (кроме первого) начинается s-элементом — активным щелочным металлом и заканчивается инертным газом, перед которым стоит p-элемент — активный неметалл (галоген). Если продвигаться по периоду слева направо, то с ростом заряда ядер атомов химических элементов малых периодов будет возрастать число электронов на внешнем энергетическом уровне, вследствие чего свойства элементов изменяются – от типично металлических (т.к. в начале периода стоит активный щелочной металл), через амфотерные (элемент проявляет свойства и металлов и неметаллов) до неметаллических (активный неметалл – галоген в конце периода), т.е. металлические свойства постепенно ослабевают и усиливаются неметаллические.
В больших периодах с ростом заряда ядер заполнение электронов происходит сложнее, что объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда ядра число электронов на внешнем энергетическом уровне остается постоянным и равным 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в четных рядах изменяются медленно. При переходе к нечетным рядам, с ростом величины заряда ядра увеличивается число электронов на внешнем энергетическом уровне (от 1 до 8), свойства элементов изменяются также, как в малых периодах.
Вертикальные столбцы в Периодической системе – группы элементов со сходным электронным строением и являющимися химическими аналогами. Группы обозначают римскими цифрами от I до VIII. Выделяют главные (А) и побочные (B) подгруппы, первые из которых содержат s- и p-элементы, вторые – d – элементы.
Номер А подгруппы показывает число электронов на внешнем энергетическом уровне (число валентных электронов). Для элементов В-подгрупп нет прямой связи между номером группы и числом электронов на внешнем энергетическом уровне. В А-подгруппах металлические свойства элементов усиливаются, а неметаллические – уменьшаются с возрастанием заряда ядра атома элемента.
Между положением элементов в Периодической системе и строением их атомов существует взаимосвязь:
— атомы всех элементов одного периода имеют равное число энергетических уровней, частично или полностью заполненных электронами;
— атомы всех элементов А подгрупп имею равное число электронов на внешнем энергетическом уровне.
План характеристики химического элемента на основании его положения в Периодической системе
Обычно характеристику химического элемента на основании его положения в Периодической системе дают по следующему плану:
— указывают символ химического элемента, а также его название;
— указывают порядковый номер, номер периода и группы (тип подгруппы), в которых находится элемент;
— указывают заряд ядра, массовое число, число электронов, протонов и нейтронов в атоме;
— записывают электронную конфигурацию и указывают валентные электроны;
— зарисовывают электронно-графические формулы для валентных электронов в основном и возбужденном (если оно возможно) состояниях;
— указывают семейство элемента, а также его тип (металл или неметалл);
— сравнивают свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами;
— сравнивают свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами;
— указывают формулы высших оксидов и гидроксидов с кратким описанием их свойств;
— указывают значения минимальной и максимальной степеней окисления химического элемента.
Характеристика химического элемента на примере магния (Mg)
Рассмотрим характеристику химического элемента на примере магния (Mg) согласно плану, описанному выше:
2. Порядковый номер – 12. Элемент находится в 3 периоде, в II группе, А (главной) подгруппе.
3. Z=12 (заряд ядра), M=24 (массовое число), e=12 (число электронов), p=12 (число протонов), n=24-12=12 (число нейтронов).
4.12Mg 1s 2 2s 2 2p 6 3s 2 – электронная конфигурация, валентные электроны 3s 2 .
5. Основное состояние


6. s-элемент, металл.
7. Высший оксид – MgO — проявляет основные свойства:
В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все типичные свойства оснований:
8. Степень окисления «+2».
9. Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция.
10. Металлические свойства у магния выражены слабее, чем у натрия, но сильнее, чем у алюминия (соседние элементы 3-го периода).
Примеры решения задач
| Задание | Охарактеризуйте химический элемент серу на основании её положения в Периодической системе Д.И. Менделеева |
| Решение | 1. S – сера. |
2. Порядковый номер – 16. Элемент находится в 3 периоде, в VI группе, А (главной) подгруппе.
3. Z=16 (заряд ядра), M=32 (массовое число), e=16 (число электронов), p=16 (число протонов), n=32-16=16 (число нейтронов).
4.16S 1s 2 2s 2 2p 6 3s 2 3p 4 – электронная конфигурация, валентные электроны 3s 2 3p 4 .


6. p-элемент, неметалл.
7. Высший оксид – SO3 — проявляет кислотные свойства:
8. Гидроксид, соответствующий высшему оксиду – H2SO4, проявляет кислотные свойства:
9. Минимальная степень окисления «-2», максимальная – «+6»
10. Неметаллические свойства у серы выражены слабее, чем у кислорода, но сильнее, чем у селена.
11. Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее, чем у хлора (соседние элементы в 3-м периоде).
| Задание | Охарактеризуйте химический элемент натрий на основании её положения в Периодической системе Д.И. Менделеева |
| Решение | 1. Na – натрий. |
2. Порядковый номер – 11. Элемент находится в 3 периоде, в I группе, А (главной) подгруппе.
3. Z=11 (заряд ядра), M=23 (массовое число), e=11 (число электронов), p=11 (число протонов), n=23-11=12 (число нейтронов).
4.11 Na 1s 2 2s 2 2p 6 3s 1 – электронная конфигурация, валентные электроны 3s 1 .

7. Высший оксид – Na2O — проявляет основные свойства:
В качестве гидроксида натрию соответствует основание NaOH, которое проявляет все типичные свойства оснований:
8. Степень окисления «+1».
9. Металлические свойства у натрия выражены сильнее, чем у лития, но слабее, чем у калия.
10. Металлические свойства у натрия выражены сильнее, чем у магния (соседний элемент 3-го периода).
Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева

Видеоурок начинается воспоминанием ученика Васи, который должен сделать домашнее задание по химии, а для этого ему нужно охарактеризовать два химических элемента: натрий и фосфор по плану, который они изучали в 8 классе. В видеофрагменте подробно расписан план характеристики химического элемента на основании положения его в Периодической системе, приведены конкретные примеры и подробное описание элементов натрия и фосфора.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева"
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические элементы в Периодической системе – это герои, и им, как и любым героям, нужно давать определенные характеристики. За основу их характеристики нужно брать Периодическую систему химических элементов Д.И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
5. определить состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7. для неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп.
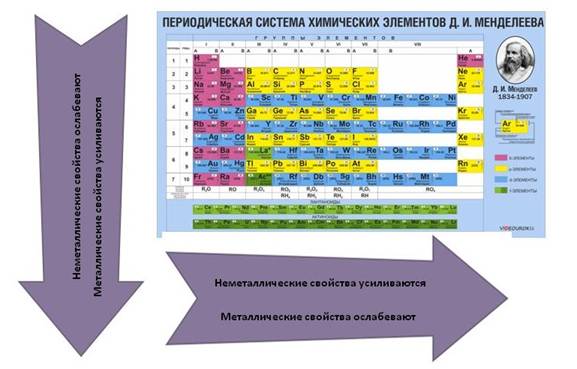
Для атомов химических элементов в группах сверху вниз
· увеличивается заряд ядра атомов, который численно равен порядковому номеру элемента
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и восстановительные свойства усиливаются
· окислительные – ослабевают.
· высшая степень окисления остается неизменной и равна номеру группы
· низшая степень окисления тоже не изменяется и равна № группы – 8.
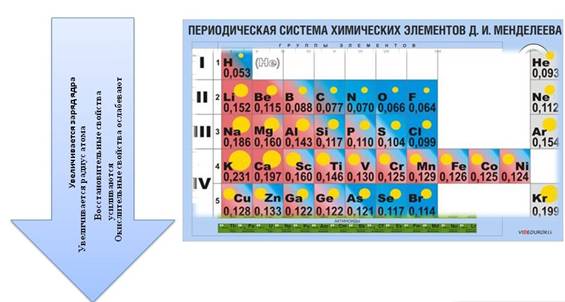
В периодах слева направо:
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
· Высшая степень окисления изменяется от +1 до +8: в первой группе ‒ +1, во второй ‒ +2, в третьей ‒ +3, в четвертой ‒ +4, в пятой ‒ +5
· низшая степень окисления изменяется от -4 до -1: в четвертой группе она равна -4, в пятой -3, в шестой -2, а в седьмой -1.
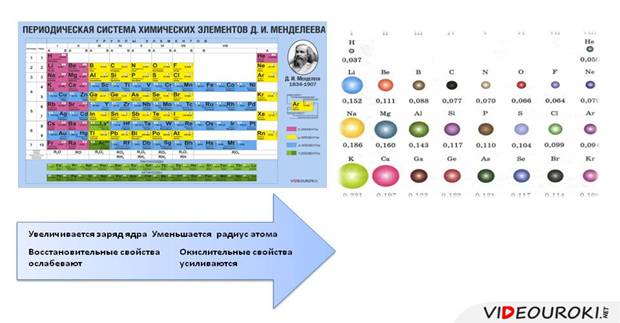

Что касается простых веществ, то металлические свойства в группах сверху вниз усиливаются, а в периодах слева направо ослабевают. Неметаллические свойства, наоборот, в группах сверху вниз ослабевают, а в периодах слева направо усиливаются.
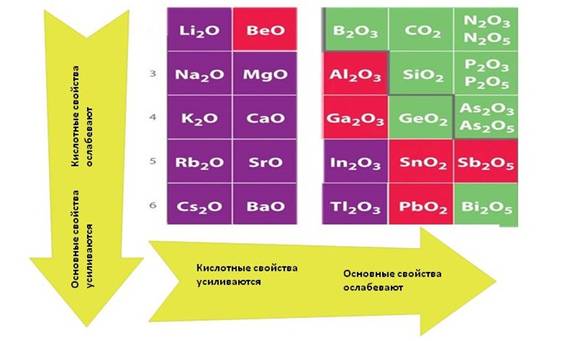
Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у оксида свинца (IV) (PbO2). В периодах слева направо усиливаются кислотные свойства, а ослабевают основные. Например, у оксида магния (MgO) основные свойства выражены сильнее, чем у оксида алюминия (Al2O3), у оксида углерода (IV) (CO2) – кислотные свойства выражены сильнее, чем у оксида бора (B2O3).
Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
· Порядковый номер натрия (Na), т.е. клетка, в которой он стоит – 11
· Массовое число – 23

· Значит, заряд его ядра равен +11, Z = +11 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 11 электронов (11 ē), а число нейтронов определяется по формуле N = A – Z, т.е. 23 – 11 = 12, значит в атоме 12 нейтронов (12n).
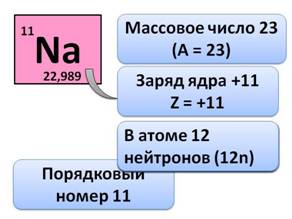
· Натрий находится в 3-ем периоде, у него 3 энергетических уровня, на которых располагаются все его электроны. На первом уровне 2 электрона (это максимально), на втором – 8, на третьем – 1 электрон.
Т.к. у натрия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
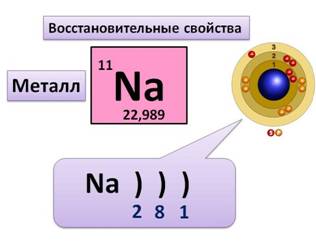
Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.

Сравним свойства натрия со свойствами его соседей по группе: металлические свойства натрия выражены сильнее, чем у лития, но слабее, чем у калия, т.к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра и их становится легче оторвать.
Сравним свойства натрия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у магния, т.к. в периодах, слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее оторвать, чем присоединить.
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи.

Гидроксид натрия – это NaOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями.

Натрий – металл, но он не образует летучих водородных соединений.
Охарактеризуем фосфор.
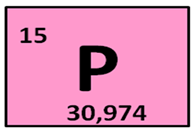
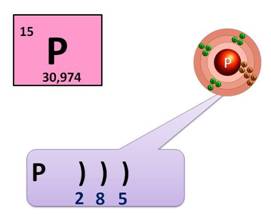
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15: (р = 15, ē = 15). Массовое число фосфора – 31, поэтому число нейтронов будет равно 16, т.к. если мы от массового числа отнимем число протонов, то будет 16 (31 – 15 = 16).

Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
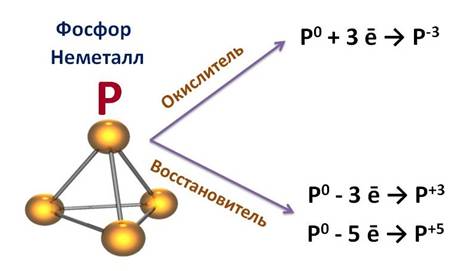
Фосфор – это неметалл, он может быть как окислителем, так и восстановителем. Как окислитель, он может присоединить 3 электрона до завершения внешнего уровня, получая при этом степень окисления -3 (Р 0 + 3 ē → Р -3 ), а как восстановитель, он может отдать 3 или 5 электронов и получить степень окисления +3 или +5 (Р 0 - 3 ē → Р +3 , Р 0 - 5 ē → Р +5 ).
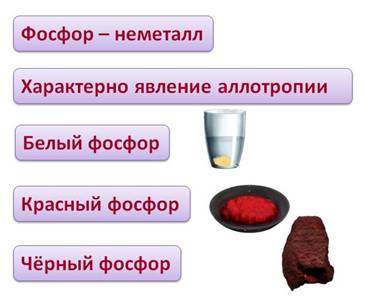
Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить свойства фосфора и его соседей. Неметаллические свойства фосфора выражены сильнее, чем у мышьяка, но слабее, чем у азота, т.к. радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду, свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Составим формулу оксида и гидроксида фосфора.
Высший оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты.

Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.

Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
Читайте также:
