Литий имеет наименьшую плотность среди металлов
Обновлено: 03.05.2024
Видео: Седалит. Лития карбонат
Содержание
В ключевое отличие между бериллием и литием заключается в том, что бериллий - это бело-серый металл, который является диамагнитным, тогда как литий - серебристо-серый металл, который является парамагнитным..
И бериллий, и литий находятся в одном периоде, периоде 2. Однако они находятся в двух разных группах в периодической таблице. Следовательно, они имеют разные свойства. Оба этих химических элемента являются элементами s-блока, потому что их валентные электроны находятся на s-орбиталях.
1. Обзор и основные отличия
2. Что такое бериллий
3. Что такое литий
4. Сравнение бок о бок - бериллий и литий в табличной форме
5. Резюме
Что такое бериллий?
Бериллий - щелочноземельный металл, имеющий атомный номер 4 и химический символ Be. Относительно, это редкий химический элемент во Вселенной. Этот металл имеет бело-серый цвет. Это элемент s-блока, потому что он имеет валентные электроны на s-орбитали. Электронная конфигурация этого элемента [He] 2s 2 . В соответствии со своей электронной конфигурацией бериллий образует двухвалентные катионы, удаляя два электрона с 2s-орбитали.
Бериллий - твердый и хрупкий металл. Он имеет гексагональную кристаллическую систему с плотной упаковкой. Говорят, что жесткость бериллия исключительна. Температура плавления этого металла очень высока. Причем эластичность бериллия больше, чем у стали. Этот металл является диамагнитным, потому что в основном состоянии у него нет неспаренных электронов.
При рассмотрении наличия бериллия было обнаружено, что на Солнце содержится около 0,1 частей на миллиард бериллия, в то время как концентрация бериллия на Земле составляет около 2-4 частей на миллион. В основном мы можем наблюдать, что этот металл - песок. Он присутствует в воде, но в очень незначительных количествах. Есть две основные руды бериллия: берилл и бертрандит.
Что такое литий?
Литий - это щелочной металл с атомным номером 3 и химическим символом Li. Согласно теории большого взрыва о создании Земли, литий, водород и гелий являются основными химическими элементами, образующимися на самых ранних этапах создания мира. Атомный вес этого элемента 6,941, а электронная конфигурация [He] 2s 1 . Более того, он принадлежит к блоку s, поскольку он находится в группе 1 периодической таблицы, а точки плавления и кипения этого элемента составляют 180,50 ° C и 1330 ° C соответственно. Он имеет серебристо-белый цвет, и если мы сожжем этот металл, он даст малиновое пламя.
К тому же этот металл очень легкий и мягкий. Следовательно, мы можем легко разрезать его ножом. Кроме того, он может плавать в воде, что приводит к взрывной химической реакции. Более того, этот металл обладает некоторыми уникальными свойствами, которых нет у других щелочных металлов. Например, это единственный щелочной металл, который может реагировать с газообразным азотом, и при этой реакции он образует нитрид лития. Это самый маленький элемент среди других членов этой группы. Кроме того, он имеет наименьшую плотность среди твердых металлов.
В чем разница между бериллием и литием?
И бериллий, и литий находятся в одном периоде, периоде 2. Но они находятся в двух разных группах периодической таблицы. Следовательно, они имеют разные свойства. Ключевое различие между бериллием и литием состоит в том, что бериллий - это бело-серый металл, который является диамагнитным, тогда как литий - серебристо-серый металл, который является парамагнитным. Бериллий образует двухвалентные катионы, а литий - одновалентные катионы.
Инфографика ниже суммирует различия между бериллием и литием.
Резюме - Бериллий против лития
И бериллий, и литий находятся в одном периоде, периоде 2. Но они находятся в двух разных группах в периодической таблице. Следовательно, они имеют разные свойства. Ключевое различие между бериллием и литием состоит в том, что бериллий - это бело-серый металл, который является диамагнитным, тогда как литий - серебристо-серый металл, который является парамагнитным.
Плотность металлов и сплавов

В таблице представлена плотность металлов и сплавов, а также коэффициент К отношения их плотности к плотности стали. Плотность металлов и сплавов в таблице указана в размерности г/см 3 для интервала температуры от 0 до 50°С.
Дана плотность металлов, таких как: бериллий Be, ванадий V, висмут Bi, вольфрам W, галлий Ga, гафний Hf, германий Ge, золото Au, индий In, кадмий Cd, кобальт Co, литий Li, марганец Mn, магний Mg, медь Cu, молибден Mo, натрий Na, никель Ni, олово Sn, палладий Pd, платина Pt, рений Re, родий Rh, ртуть Hg, рубидий Rb, рутений Ru, свинец Pb, серебро Ag, стронций Sr, сурьма Sb, таллий Tl, тантал Ta, теллур Te, титан Ti, хром Cr, цинк Zn, цирконий Zr.
Плотность алюминиевых сплавов и металлической стружки: алюминиевые сплавы: АЛ1, АЛ2, АЛ3, АЛ4, АЛ5, АЛ7, АЛ8, АЛ9, АЛ11, АЛ13, АЛ21, АЛ22, АЛ24, АЛ25. Насыпная плотность стружки: стружка алюминиевая мелкая дробленая, стальная мелкая, стальная крупная, чугунная. Примечание: плотность стружки в таблице дана в размерности т/м 3 .
Плотность бронзы различных марок: бронзы безоловянные, обрабатываемые давлением: БрА5, 7, БрАМц9-2, БрАЖ9-4, БрАЖМц10-3-1,5, БрАЖН10-4-4, БрКМц3,1, БрКН1-3, БрМц5; бронзы бериллиевые: БрБ2, БрБНТ1,9, БрБНТ1,7; бронзы оловянные деформируемые: Бр0Ф8,0-0,3, Бр0Ф7-0,2, Бр0Ф6,5-0,4, Бр0Ф6,5-0,15, Бр0Ф4-0,25, Бр0Ц4-3, Бр0ЦС4-4-2,5, Бр0ЦС4-4-4; бронзы оловянные литейные: Бр03Ц12С5, Бр03Ц7С5Н1, Бр05Ц5С5; бронзы безоловянные литейные: БрА9Мц2Л, БрА9Ж3Л, БрА10Ж4Н4Л, БрС30.
Плотность сплавов никеля и цинка: никелевые и медно-никелевые сплавы, обрабатываемые давлением: НК0,2, НМц2,5, НМц5, НМцАК2-2-1, НХ9,5, МНМц43-0,5, НМЦ-40-1,5, МНЖМц30-1-1, МНЖ5-1, МН19, 16, МНЦ15-20, МНА 13-3, МНА6-1,5, МНМц3-12; цинковые сплавы антифрикционные: ЦАМ9-1,5Л, ЦАМ9-1,5, ЦАМ10-5Л, ЦАМ10-5.
Плотность стали, чугуна и баббитов: сталь конструкционная, стальное литье, сталь быстрорежущая с содержанием вольфрама 5…18%; чугун антифрикционный, ковкий и высокопрочный, чугун серый; баббиты оловянные и свинцовые: Б88, 83, 83С, Б16, БН, БС6.
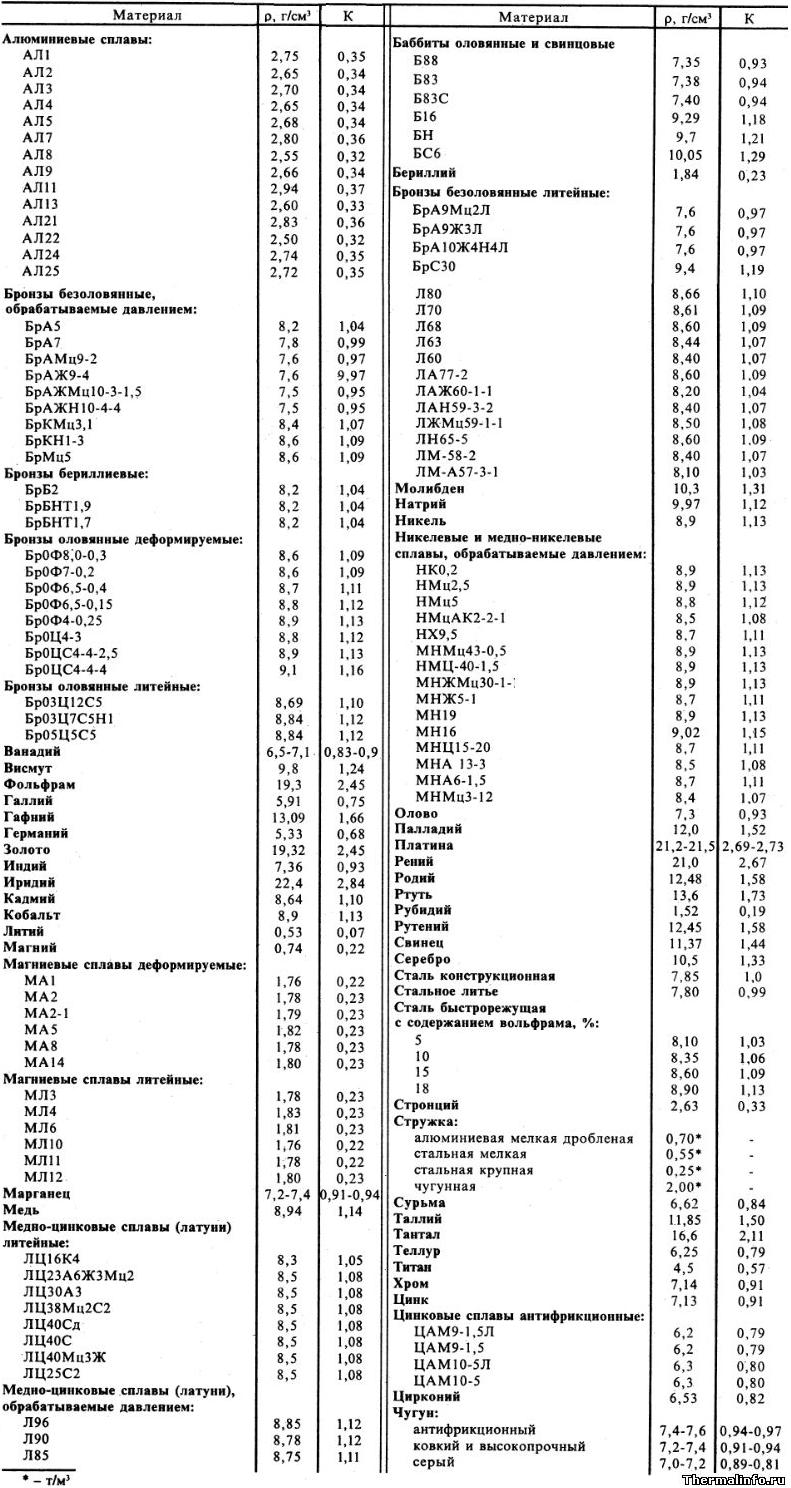
Приведем показательные примеры плотности различных металлов и сплавов. По данным таблицы видно, что наименьшую плотность имеет металл литий, он считается самым легким металлом, плотность которого даже меньше плотности воды — плотность этого металла равна 0,53 г/см 3 или 530 кг/м 3 . А у какого металла наибольшая плотность? Металл, обладающий наибольшей плотностью — это осмий. Плотность этого редкого металла равна 22,59 г/см 3 или 22590 кг/м 3 .
Следует также отметить достаточно высокую плотность драгоценных металлов. Например, плотность таких тяжелых металлов, как платина и золото, соответственно равна 21,5 и 19,3 г/см 3 . Дополнительная информация по плотности и температуре плавления металлов представлена в этой таблице.
Сплавы также обладают широким диапазоном значений плотности. К легким сплавам относятся магниевые сплавы и сплавы алюминия. Плотность алюминиевых сплавов выше. К сплавам с высокой плотностью можно отнести медные сплавы такие, как латуни и бронзы, а также баббиты.
Источник:
Цветные металлы и сплавы. Справочник. Издательство «Вента-2». НН., 2001 — 279 с.
Литий имеет наименьшую плотность среди металлов
Видео: Химия 9 класс (Урок№23 - Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды.)
Основное отличие - литий от других щелочных металлов
Термин щелочной металл используется для обозначения элементов группы 1 периодической таблицы, исключая водород. Следовательно, щелочные металлы включают литий, натрий, калий, рубидий, цезий и франций. У них есть общие химические и физические свойства, но у них есть и другие свойства. Эти элементы включены в группу 1 периодической таблицы, потому что самый внешний электрон их атомов находится на орбитали в ns 1 форма. Они известны как щелочные металлы, так как соединения, которые они образуют, очень щелочные (основные соединения). Литий является самым маленьким щелочным металлом среди других щелочных металлов. Основное различие между литием и другими щелочными металлами заключается в том, что литий является единственным щелочным металлом, который реагирует с азотом.
Ключевые области покрыты
1. Что такое литий
- определение, химические факты, уникальные свойства
2. Что такое щелочные металлы
- Определение, Члены группы, Общие свойства
3. В чем разница между литием и другими щелочными металлами
- Сравнение основных различий
Основные термины: щелочные металлы, щелочной, анионный, основной, цезий, катион, франций, литий, калий, радиоактивный, рубидий, натрий

Что такое литий
Литий является щелочным металлом, имеющим химический символ «Li». Считается, что литий является одним из трех элементов, которые были произведены в больших количествах в результате Большого взрыва, два других элемента - водород и гелий. Ниже приведены некоторые химические факты о литии.
- Атомный номер - 3
- Атомный вес - 6,941
- Электронная конфигурация - [He] 2s 1
- Блок - блок
- Группа 1
- Период - 2
- Температура плавления - 180.50 ° C
- Точка кипения - 1330 ° C
- Внешний вид - серебристо-белый, металлик
- Цвет пламени - Малиновый цвет
- Общие изотопы - 6 Li, 7 Li
Рисунок 1: Цвет Литиевого Пламени - Малиновый.
Литий очень легкий и мягкий, то есть его можно разрезать просто ножом. Литий может плавать на воде и обладает высокой реакционной способностью. Реакция часто взрывная и приводит к образованию гидроксида лития. Однако литий является единственным щелочным металлом, который не может образовывать анион. Но литий легко образует катион Li + , удалив один из трех его электронов.
Хотя литий обладает некоторыми свойствами, подобными свойствам других щелочных металлов, существуют также некоторые другие и уникальные свойства. Соединения лития требуют больше кислот для нейтрализации его щелочных растворов, чем другие щелочные металлы. Другими словами, литий образует самые сильные щелочные растворы. Литий является единственным щелочным металлом, который может реагировать с азотом. Это дает соль нитрида лития. При комнатной температуре и давлении металлический литий реагирует с газообразным азотом следующим образом.
Литий имеет наименьшую плотность среди щелочных металлов. Это не происходит свободно в природе из-за его высокой реакционной способности. Когда металлический литий остается на воздухе, он быстро окисляется, образуя оксидное покрытие черного цвета.
Какие щелочные металлы
Щелочные металлы относятся к группе 1, за исключением водорода. Поэтому в эту категорию входят литий, натрий, калий, рубидий, цезий и франций. Они известны как щелочные металлы, так как соединения, которые они образуют, являются щелочными (основные соединения).
У щелочных металлов самый удаленный электрон находится на орбитали. Следовательно, они находятся в блоке s периодической таблицы элементов. У них есть самый внешний электрон в нс 1 форма. Поэтому они находятся в группе 1 периодической таблицы. Все они образуют одновалентный катион как наиболее стабильное состояние окисления.
При переходе вниз по группе щелочных металлов существуют некоторые периодические изменения, перечисленные ниже.
- Атомный размер увеличивается.
- Температура плавления и температура кипения уменьшаются из-за способности образовывать сильные связи в уменьшенной группе (когда атом становится большим, образовавшаяся связь становится слабой).
- Плотность увеличивается.
- Первая энергия ионизации уменьшается. Потому что в больших атомах внешний электрон слабо связан, и его можно легко удалить.
- Электроотрицательность уменьшается.
- Реактивность уменьшается.
- Щелочные металлы имеют низкое сродство к электрону, чем другие элементы.
Рисунок 2: Щелочные металлы имеют более низкое сродство к электрону, чем другие элементы.
Это только некоторые из свойств. Теперь давайте кратко рассмотрим некоторые факты о членах этой группы.
литий
Литий - самый маленький элемент среди щелочных металлов. Больше фактов о литии обсуждено выше.
натрий
Натрий - это химический элемент, имеющий атомный номер 11 и химический символ «Na». Атомный вес натрия составляет около 22,98 а.е.м. Температура плавления составляет 97,79 ° С, а температура кипения составляет 882,8 ° С. При комнатной температуре и давлении натрий находится в твердой фазе. Хотя он имеет блестящий металлический вид, это мягкий металл, который легко режется ножом.
Натрий обладает высокой реактивностью. Он легко реагирует с кислородом и водой. Следовательно, металлическая форма натрия имеет меньше применений. Его нельзя использовать в качестве строительного материала, потому что он слишком мягкий и очень реактивный. При сгорании натрий дает желто-оранжевое пламя. Когда крошечный кусочек натрия добавляется в воду, это показывает очень взрывную реакцию.
калий
Калий является третьим щелочным металлом, найденным в группе 1 периодической таблицы. Калий является элементом, который абсолютно необходим как для растений, так и для животных. Сэр Хэмфри Дэви выделил калиевый элемент электролизом расплавленного гидроксида калия (KOH). Калий металлический имеет мягкий и серебристо-белый цвет. У него очень низкая температура плавления. Так как это металл, это хороший электрический проводник. Калий является седьмым наиболее распространенным элементом на земле. Большинство коммерчески доступных соединений получают электролизом некоторых соединений, таких как карналлит, потому что элементарный калий присутствует в нерастворимых в воде отложениях и породах, что затрудняет его извлечение.
Рубидий
Рубидий является химическим элементом с символом Rb и является щелочным металлом. Это мягкий металл серебристо-белого цвета. Это очень реактивный. У этого есть некоторые изотопы, которые немного радиоактивны. Металлический рубидий легко испаряется. Температура плавления составляет 39,30 ° С, а температура кипения составляет 688 ° С. Но при комнатной температуре он находится в твердом состоянии.
цезий
Цезий является химическим элементом, имеющим химический символ Cs. Атомный номер цезия составляет 55. Он имеет вид бледно-золотой. Стандартный атомный вес этого металла составляет 132,9 а.е.м. Он находится в твердой фазе при комнатной температуре. Температура плавления составляет 28,5 ° С, а температура кипения составляет 671 ° С. Он имеет только один стабильный изотоп, а другие изотопы радиоактивны.
Франций
Франций - это химический элемент, имеющий символ Fr и атомный номер 87. Это второй наименее электроотрицательный химический элемент. Это один из самых редких химических элементов, которые встречаются в природе. Франций очень радиоактивен.
Разница между литием и другими щелочными металлами
Определение
литий: Литий является щелочным металлом, имеющим химический символ «Li».
Другие щелочные металлы: Щелочные металлы относятся к группе 1, за исключением водорода.
Реакция с азотом
литий: Литий является единственным щелочным металлом, который может реагировать с газообразным азотом, и он образует нитрид лития.
Другие щелочные металлы: За исключением лития, другие щелочные металлы не могут реагировать с газообразным азотом.
Атомный размер
литий: Литий является самым маленьким среди щелочных металлов.
Другие щелочные металлы: Атомные размеры щелочных металлов увеличиваются по группе.
Атомный номер
литий: Атомный номер лития составляет 3, наименьшее значение среди щелочных металлов.
Другие щелочные металлы: Щелочные металлы имеют разные атомные номера, самые маленькие из которых 3 (литий) и самые высокие 87 (франций).
плотность
литий: Литий имеет наименьшую плотность среди твердых металлов.
Другие щелочные металлы: Плотность щелочных металлов увеличивается вниз по группе.
Анион Формирование
литий: Литий является единственным щелочным металлом, который не может образовывать анион.
Другие щелочные металлы: Другие щелочные металлы могут образовывать анионы либо в твердой фазе, либо в жидкой фазе.
основность
литий: Литий является самым сильным щелочным металлом, которому требуется больше кислот для нейтрализации литийсодержащих растворов.
Другие щелочные металлы: Щелочные металлы имеют разные основы.
Заключение
Щелочные металлы - это химические элементы, которые образуют соединения с основными свойствами. Члены этой группы включают литий, натрий, калий, рубидий, цезий и франций. Основное различие между литием и другими щелочными металлами заключается в том, что литий является единственным щелочным металлом, который реагирует с азотом.
Ссылка:
1. Паппас, Стефани. «Факты о литии». LiveScience, Закупка, 23 сентября 2015 г.,
Литий
Ли́тий — химический элемент главной подгруппы первой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 3. Обозначается символом Li ( Lithium ). Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия

Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Хамфри Дэви в 1825 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» ( λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), которая при холодной обработке переходит в кубическую плотноупакованную решётку, где каждый атом, имеющий двойную кубооктаэдрическую координацию, окружён 12 другими. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380° С и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.

Химические свойства
Щелочной металл, неустойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует.
Во влажном воздухе медленно окисляется, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °С до 300 °С литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °С. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с аммиаком и с галогенами (с иодом — только при нагревании).
Литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на кожу, слизистые оболочки и в глаза.
Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6 Li (7,5 %) и 7 Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов. Это следует иметь ввиду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов и два ядерных изомера ( 4 Li − 12 Li и 10m1 Li − 10m2 Li соответственно). Наиболее устойчивый из них, 8 Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3 Li (трипротон), по-видимому, не существует как связанная система.
7 Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть вскоре после Большого Взрыва). Образование элемента лития в звездах возможно по ядерной реакции «скалывания» более тяжелых элементов.
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т.
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Применение
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Химические источники тока
Литий используют в анодах химических источников тока (аккумуляторов, например литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидрооксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Ракетное топливо
| Окислитель | Удельная тяга (Р1, сек) | Температура сгорания °С | Плотность топлива г/см 3 | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 378,3 сек | 5350 °C | 0,999 | 4642 м/сек | 28 % |
| Тетрафторгидразин | 348,9 сек | 5021 °C | 0,920 | 4082 м/сек | 21,07 % |
| ClF3 | 320,1 сек | 4792 °C | 1,163 | 4275 м/сек | 24 % |
| ClF5 | 334 сек | 4946 °C | 1,128 | 4388 м/сек | 24,2 % |
| Перхлорилфторид | 262,9 сек | 3594 °C | 0,895 | 3028 м/сек | 41 % |
| Окись фтора | 339,8 сек | 4595 °C | 1,097 | 4396 м/сек | 21 % |
| Кислород | 247,1 сек | 3029 °C | 0,688 | 2422 м/сек | 58 % |
| Перекись водорода | 270,5 сек | 2995 °C | 0,966 | 3257 м/сек | 28,98 % |
| N2O4 | 239,7 сек | 3006 °C | 0,795 | 2602 м/сек | 48 % |
| Азотная кислота | 240,2 сек | 3298 °C | 0,853 | 2688 м/сек | 42 % |
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания.
Окислители
Перхлорат лития используют в качестве окислителя.
Дефектоскопия
Лития сульфат используют в дефектоскопии.
Пиротехника
Нитрат лития используют в пиротехнике.
Сплавы
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Электроника
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
Металлургия
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия и его потребление растет с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5-3,5 кг на тонну выплавляемого алюминия).
Легирование алюминия
Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию. Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин. Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.
Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления емкостей для сжиженных газов).
Ядерная энергетика
Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний
Литий-6 (термояд)
Применяется в термоядерной энергетике.
При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный тритий 3 1H (Т):
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития-6 6 LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7 (теплоноситель)
Применяется в ядерных реакторах, использующих реакции с участием тяжёлых элементов, таких как уран, торий или плутоний.
Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов, жидкий литий-7 (часто в виде сплава с натрием или цезием-133) служит эффективным теплоносителем. Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Соли лития обладают психотропным действием и используются в медицине при профилактике и лечении ряда психических заболеваний. Наиболее распространен в этом качестве карбонат лития. применяется в психиатрии для стабилизации настроения людей, страдающих биполярным расстройством и частыми перепадами настроения. Он эффективен в предотвращении мании депрессии и уменьшает риск суицида.Медики не раз наблюдали, что некоторые соединения лития (в соответствующих дозах, разумеется) оказывают положительное влияние на больных, страдающих маниакальной депрессией. Объясняют этот эффект двояко. С одной стороны, установлено, что литий способен регулировать активность некоторых ферментов, участвующих в переносе из межклеточной жидкости в клетки мозга ионов натрия и калия. С другой стороны, замечено, что ионы лития непосредственно воздействуют на ионный баланс клетки. А от баланса натрия и калия зависит в значительной мере состояние больного: избыток натрия в клетках характерен для депрессивных пациентов, недостаток – для страдающих маниями. Выравнивая натрий калиевый баланс, соли лития оказывают положительное влияние и на тех, и на других.
Смазочные материалы
Стеарат лития — литиевое мыло используется в качестве высокотемпературной смазки.
Регенерация кислорода в автономных аппаратах
Гидроксид лития LiOH, пероксид Li2O2 и супероксид LiO2 применяются для очистки воздуха от углекислого газа; при этом последние два соединения реагируют с выделением кислорода (например, 4LiO2 + 2CO2 → 2Li2CO3 + 3O2), благодаря чему они используются в изолирующих противогазах, в патронах для очистки воздуха на подлодках , на пилотируемых космических аппаратах и т. д.
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление различной косметики).
Дополнительные данные
Литий, Lithium, Li (3)
Когда Дави производил свои знаменитые опыты по электролизу щелочных земель, о существовании лития никто и не подозревал. Литиевая щелочная земля была открыта лишь в 1817 г. талантливым химиком-аналитиком, одним из учеников Берцелиуса Арфведсоном. В 1800 г. бразильский минералог де Андрада е Сильва, совершая научное путешествие по Европе, нашел в Швеции два новых минерала, названных им петалитом и сподуменом, причем первый из них через несколько лет был вновь открыт на острове Уте. Арфведсон заинтересовался петалитом, произвел полный его анализ и обнаружил необъяснимую вначале потерю около 4% вещества. Повторяя анализы более тщательно, он установил, что в петалите содержится «огнепостоянная щелочь до сих пор неизвестной природы». Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь в отличие от кали и натра впервые была найдена в «царстве минералов» (камней); название зто произведено от греч.- камень.
Позднее Арфведсон обнаружил литиевую землю,или литину, и в некоторых других минералах, однако его попытки выделить свободный металл не увенчались успехом. Очень небольшое количество металлического лития было получено Дэви и Бранде путем злектролиза щелочи. В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития. В русской химической литературе начала XIX в. встречаются названия: литион, литин (Двигубский, 1826) и литий (Гесс); литиевую землю (щелочь) называли иногда литина.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Читайте также:
