Магний металл средней активности
Обновлено: 05.07.2024

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
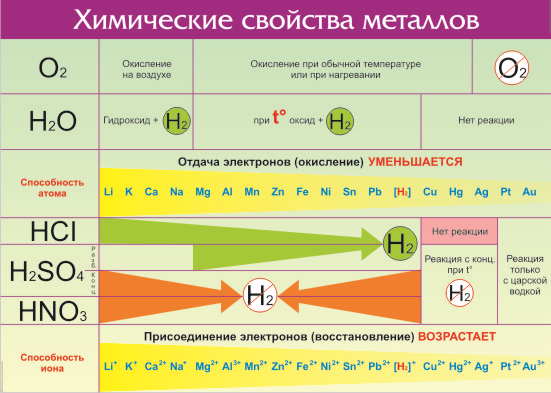
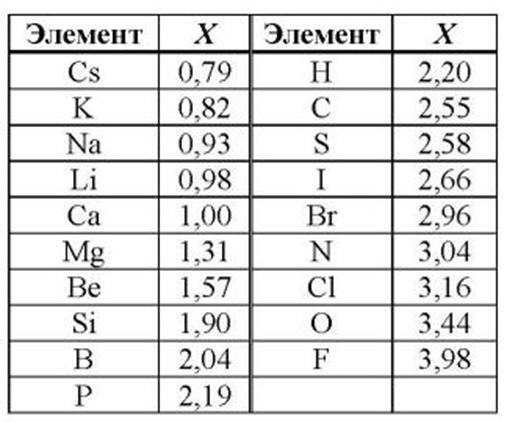
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
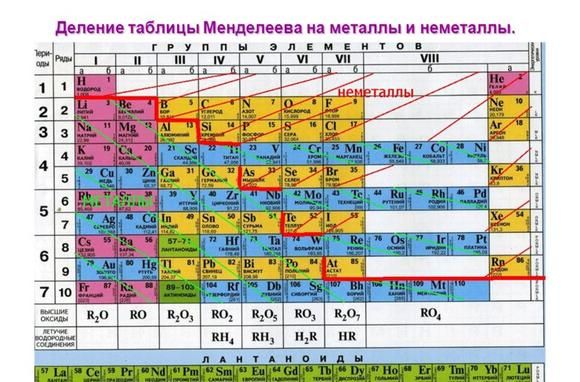
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
МАГНИЙ — огненный металл
Тем, что название «магний» существует в мире химии, мы обязаны учебнику «Основания чистой химии» русского химика Гесса. Много русских химиков зубрили науку по этой книге — она была переиздана семь раз.
Пейте минералку
История открытия нашего героя начинается на английском курорте. Там скучающие химики решили исследовать, чем же их лечат. Из минеральной воды (горькой, но регулирующей пищеварение) выделили соль — горькую или английскую. Опыты продолжили, в результате почти одновременно Фарадей и Бюсси получили магний.

Этот металл серебристо-белого цвета можно добыть из почти любого булыжника под ногами, хотя для промышленного применения этот метод навряд ли пригоден.
Каков он, «вспыльчивый металл»

Наш герой — элемент второй группы периодической системы Менделеева. Латинское название Magnesium, атомный номер 12.
Магний теперь относится к щелочноземельным металлам. Однако раньше он таким не считался — его гидроксид не является щелочью, хотя раствор в присутствии фенолфталеина (индикатор) окрашивается в слабо-розовый цвет. Полноценные щелочи с фенолфталеином окрашиваются в густой малиновый цвет.
У чистого магния плотноупакованная гексагональная кристаллическая структура.
Строение атома указывает на принадлежность к металлам. Электронная формула элемента — 1s 2 2s 2 2p 6 3s 2. То есть, на внешнем энергетическом уровне у магния болтается пара электронов, в любой момент готовая «свалить налево» — вступить в реакцию с другим элементом. Кое-кто еще помнит, что свойство металлов на внешнем уровне иметь от 1 до 3 электронов.
И чем же наш герой не металл?
Некоторые характеристики магния:
| Свойство металла | Данные |
| Атомная масса | 24,304 г/моль |
| Степени окисления | 0; +2 |
| Плотность | 1,74 г/см3 |
| Температура плавления | 650оС |
| Теплопроводность | (300 K) 156 Вт/(м·К) |
| Температура кипения | 1090 оС |
| Ковалентный радиус | 136 пм |
|---|---|
| Радиус иона | 66 (+2e) пм |
| Электроотрицательность | 1,31 (шкала Полинга) |
| Электродный потенциал | −2,37 В |
| Степени окисления | 0; +2 |
| Энергия ионизации (первый электрон) | 737,3 (7,64) кДж/моль (эВ) |
Химия магниевых реакций
Вспомним школьные годы. Немного химии во время карантина не повредит.
Итак, химические свойства нашего героя:
- К щелочам огненный металл равнодушен (сами такие, к щелочноземельным металлам относимся). В реакции со щелочами не вступает.
- Зато во взаимодействие с кислотами вступает охотно, даже бурно, с выделением водорода.
- На воздухе магний реагирует с кислородом воздуха, покрывается оксидной пленкой. Эта «одежка» защищает металл от дальнейшего окисления. Но влажная атмосфера разрушает нашего «горячего» героя. Потому его и не хранят во влажных помещениях.
Как он горит!
Немного найдется металлов, горящих на воздухе, и наш герой — один из них. Подожгите магниевую стружку, и вспыхнет яркий, жгучий огонь. Еще бы не жгучий, его температура более 3000 градусов. Только не зажигайте магний на песке. Металл прореагирует с диоксидом кремния в песке, и будет гореть веселее. Потому затушить «магниевый» пожар песочком не получится.

Горящий магний можно использовать как факел в темноте. Пара грамм магния — и даже в самую черную ночь все будет видно в радиусе 5-7 метров.
Подожгите металл в луже, и увидите мощную вспышку. Здесь образуется гидроксид магния (Mg(OH)2) и водород, который многократно усилит мощность огня.
Печально: в 1937 году дирижабль «Гинденбург», наполненный водородом, загорелся. Погибла треть пассажиров. Эта трагедия поставила крест на дирижаблях, как виде воздушного транспорта.
Кстати, головная боль пожарных — магний нельзя тушить водой. От этого огонь разгорится еще больше. Углекислотный огнетушитель тоже не вариант, ведь наш необыкновенный герой в присутствии углекислого газа хорошо горит, образуя уголь и оксид магния:
2Мg + CO2 = C + 2MgO
Минералы, месторождения
Наш герой настолько активен в химическом отношении (просто-таки «неразборчив в связях»), что его нахождение в природе в чистом виде практически невозможно.
Природные источники магния — минералы:
- брусит;
- кизерит;
- доломит;
- магнезит;
- бишофит;
- эпсомит;
- карналлит.
Даже из морской воды можно добывать огненный металл. Самосадочные озера (вода в них называется рапой), содержат большое количество минеральных солей, в том числе магния.
Познавательно: таких озер много в Астраханской области. Это Белинские, Зинзилинские, Мочаговские самосадочные озера (список можно продолжить).
Крупнейшая российская группа месторождений — Саткинское — (разведано 14 штук) находится в Челябинской области, рядом с городом Сатка. Тут сосредоточены магнезиальные руды высокой чистоты.
Получение чистого металла
Промышленное получение металла возможно двумя способами:
В первом способе необходимы обезвоженные хлориды магния, натрия, калия. Их смешивают в электролитической ванне, в расплаве происходит восстановления магния.
Чистый металл сливают, добавляя в ванну сырье. В черновом металле содержится до 2% примесей. При необходимости еще не остывший магний рафинируют, доводя чистоту почти до идеальной — 99,999%.
Во втором способе в качестве сырья предпочтительно использовать доломит с добавлением кокса. Возможно использование морской воды. Смесь разогревают до 2100 градусов, пары магния отгоняются и конденсируются.
Польза и вред добавок
Чистый магний ковкий, легкий металл. Только есть у металла свойство — подверженность коррозии. Потому чистый металл используют редко, в отличие от его сплавов. Для сплавов магния очень важны добавки алюминия, циркония, цинка.
Алюминий делает сплав прочнее и удобнее для литейных работ.
Количество лигатуры важно для качеств сплава:
- 3% алюминия придадут наибольшую пластичность;
- 6% лигатуры — даст лучшие прочность и пластичность;
- 9% алюминия подарит сплаву максимальную прочность.
Свойства цинка в сплавах подобны алюминиевым:
- 3% добавка максимально увеличивает пластичность;
- 5% цинка даст гармоничное сочетание пластичности и прочности сплава;
Если в сплаве есть вредные примеси (никель, железо), то лигатура цинка повысит коррозионную стойкость.
Кремний повысит способность к литью, но в присутствии железа уменьшит устойчивость к ржавчине.
Никель и железо примеси вредные, они делают сплав подверженным ржавчине.
Сплавы магния делят на деформируемые (МА) и литейные (МЛ); последние применяются значительно чаще. В сплав МЦИ добавляют медь, железо, цинк, никель. Эта смесь металлов хороша при вибронагрузках.
Магний в нашей жизни
Металл и его сплавы нашли широкое применение в разных сферах жизни.
- Способность металла давать яркий огонь использовали на заре фотографии.
- Легкость металла открыла ему путь в авиацию. Наши ноутбуки, многие фотокамеры содержат магниевые детали — не таскать же тяжелый прибор, если можно сделать легкий.
- В химических источниках тока энергия химических реакций напрямую превращается в электрическую. Чистый металл и его соединения в электрических батареях сообщают им высокие ЭДС и отменные энергетические характеристики.

Анодом в таких батареях служит магний. В качестве катода применяют:
- ; ;
- серу;
- хлористое серебро;
- хлористый свинец в смеси с графитом;
- диоксид марганца с графитом.
Огнеупорные материалы необходимы для футеровки металлургических печей, тиглей.
Дешевым и качественным сырьем для этого могут быть минералы магния:
В военном деле магний «освещает темные места». А проще, из него делают светозвуковые и светошумовые боеприпасы (патроны, гранаты, снаряды). До конца не убьет, но оглушит и дезориентирует.
Применяют в антитеррористических операциях, при освобождении заложников, разгоне противозаконных сборищ (при массовых беспорядках).
Зажигательные бомбы, трассирующие пули, ракеты сигнальные и осветительные — везде используется яркое горение металла.
Препараты магния необходимы в медицине. Недостаток макроэлемента губителен для сердечно-сосудистой системы. Ишемическая болезнь, артериальная гипертония, аритмии — каждая из этих болезней усугубляется дефицитом магния.
Недостаток нескольких граммов металла плохо отражается на наших нервах (депрессии, мигрени, головокружения, тревога, раздражительность).
Важно: у каждого потребность в магнии возрастает при стрессах, физических нагрузках; у спортсменов — при изнурительных тренировках и на соревнованиях.
Специалисты фирмы Тойота разработали аккумуляторную батарею (на основе серно-магниевых элементов). Показатели у аккумулятора завидные. Загвоздка в том, что в батарее происходит саморазряд (катод электрохимически восстанавливается, образуются полисульфидные анионы, переходящие в раствор). Пока эта проблема не будет решена, серно-магниевые аккумуляторы специалистам только снятся.
Магний металлический обладает сильными восстановительными свойствами. Его используют для получения бериллия, ванадия, хрома. Металл используют как лигатуру в сталях и чугуне.
Все шире применяют магнийорганические соединения в химическом синтезе галогенопроизводных, спиртов, углеводородов.
Где еще применяют соединения магния
Бесцветные кристаллы фторида магния используют в специальной оптике (вещество прозрачно в диапазонах от ультрафиолетового до инфракрасного.
Стеарат магния — пищевая добавка Е470. Используют в косметической, пищевой промышленности, в фармации.
Магниевые сплавы применяют в изготовлении отбойных молотков, в атомной и нефтяной промышленности.
Стоимость огненного металла
Цена первичного магния (МГ90):
Лом металла и магнийсодержащих элементов будет стоить от 35 до 50 рублей за килограмм.

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Магний. Характеристика металла магния – его применения, свойства и цена

Сегодня даже не каждый взрослый вспомнит почему мы можем однозначно ответить на вопрос: магний металл или неметалл? Магний – относят к щелочноземельным металлам! Вспомнить это поможет беглый взгляд на электронную конфигурацию 1s22s22p63s2 нейтрального атома этого вещества. Учитывая специфику металлов иметь от 1 до 3 свободных электронов на внешнем энергетическом уровне, смотрят на этот параметр и для Mg. Не трудно увидеть, что конфигурация содержит 2 свободных электрона.
Общие металлические свойства магния характерны тем же, что проявляют другие вещества, относящие к данному типу. Обычно они тверды, но пластичны (в отличие от хрупких неметаллов). Имеют специфический блеск. Mg имеет склонность тускнеть на воздухе из-за того, что покрывается защитной кислородной пленкой. Порошок магния легко воспламеняется, достаточно поднести зажженную спичку. Цвет магния, горящего – ярко-белый. Одна из причин, почему этот металл первоначально использовался при фотографировании. Mg наносили на специальную ленту и поджигали ее. При горении образуется MgO, также при протекании процесса на воздухе выделяется нитрид магния с выделением большого количества теплоты.

Так выглядит металлический магний
Особенности Mg, как элемента периодической системы
Химические свойства магния во многом лежат где-то между бериллием и кальцием. Прежде всего, это проявляется во взаимодействии с водой. Первый не реагирует с ней вообще, второй же в ней растворяется. Mg слабо взаимодействует с нагретой водой. Но при взаимодействии с водяным паром (от 400 градусов по Цельсию) происходит реакция Mg+ H2O = MgO + H2, в которой металл растворяется при активном выделении водорода.
Видео – химические свойства магния:
Несколько иная реакция происходит с водяным паром: Mg+ 2H2O = Mg(OH)2 +H2. Причем свободный водород в итоге поглощается магнием MgH3. В результате, если плавление металла происходило во влажной среде, по мере его застывания водород практически полностью исчезает.
Свойства магния: взаимодействовать с водой при высоких температурах становится и гореть при присутствии в атмосфере углекислого газа, – затрудняют тушение пожаров с участием Mg. Их нельзя тушить водой. По инструкции используют порошковые огнетушители и песок. Также можно применять оксиды Si, с которыми магний вступает в реакцию, но количество выделяемой теплоты значительно ниже.

На фото: горение магния
Также необходимо отметить, что несмотря на фактическую нерастворимость Mg(OH)2 в воде, раствор фенолфталеина в его присутствии окрашивается в розовый цвет.

Магний в таблице Менделеева
Магний металл устойчив к едким щелочам, соде, керосину, бензину, минеральным маслам. Способность этого элемента отнимать кислород и хлор, используют для восстановления чистых веществ. Например, брома или титана.
Для синтезов разных классов органических соединений используется свойство магния взаимодействовать с галогенами. Обычно это Cl, Br, I, с фтором Mg образует защитную пленку, из-за чего их соединение редко используется для синтеза реактивов Гриньяра. Последние наиболее часто формируются на основе формулы RMgHal, где R – это органический радикал, а Hal – один из перечисленных галогенов.
Какие физические свойства имеет металл магний
Видео: Магний – металл, который горит
Легкость элемента отображает плотность, которая составляет 1,74 г/см3. Меньшую имеют только кальций и щелочные металлы. Физические свойства магния можно коротко описать стандартными энциклопедическими параметрами:
- Т плавления – 651°С;
- Т кипения – 1107°С;
- Теплопроводность – 0,376 кал/(см·с·град) достаточно высока, сравнима с тем, что демонстрируют бериллий и вольфрам;
- Теплоемкость при Т плавления – 0,3 кал/град;
- Удельная теплоемкость увеличивается до Т плавления и уменьшается по ее достижении;
- Усадка при смене состояний (жидкость – твердое тело) – 3,97-4,2%;
- Удельное электросопротивление при комнатной температуре – 0,047 ом·мм2/м.
Этот элемент периодической таблицы Менделеева относят к щелочноземельным металлам. Однако это утверждение не всегда верно, поскольку химические свойства приближают этот элемент к алюминий подобным веществам.

Так выглядит оксид магния
Оксиды MgO относят к белым тугоплавким веществам, их называют жженой магнезией и применяют при изготовлении строительных материалов. Соли магния металла образуются при взаимодействии вещества с кислотами. Наиболее известная из них MgCO3. Используется металлургам для освобождения сплавов от шлаков, называют карбонат магния. Еще одна соль MgSO4 – известна как горькая или английская. Химики ее именуют сульфат магния. Mg и Ca влияют на жесткость воды. Высокая концентрация этих веществ в Н2О не позволяет моющим средствам пениться.

Магниевый сплав МЦр1Н3
Чтобы более детально ответить на то, какие физические свойства имеет магний, необходимо рассматривать изменения его состояний и качеств по мере применения к нему различных тепловых эффектов: нагревание и охлаждение. Так, например, плотность снижается на 6% при Т – 600 0 С, расплавившись и вовсе падает до значения 1.58 г/см3.
Характеристики металла магния сильно отличаются при низких и высоких температурах. Некоторые результаты экспериментов требуют объяснения, часть из них дают вполне предвиденные реакции.
Гексагональная решетка элемента имеет следующие параметры:
При нагревании до 6270С эти расстояния увеличиваются, дойдя до температуры плавления связи решетки разрушаются вовсе.
Если говорить о том, какого цвета магний придется отметить, что в целом серебристо-белый металл, может выглядеть как черный обуглившийся с присущим блеском. В последнем случае речь идет о стружке магния. Поэтому определяя «на глаз» тип материала, все-таки лучше обратиться к химическим экспериментам, если под рукой не имеется спектрального анализатора.
Классическая задача для школьников рассматривает ряд натрий – магний –алюминий, металлические свойства которого ослабевает от первого к последнему элементу.
Взаимодействие с различными кислотами
Для краткости, проще рассмотреть несколько экспериментов. Для них берутся такие виды кислот:
- Соляная.
- Азотная.
- Серная (разбавленная и нет).

В первом случае наблюдается практически мгновенное растворение, сопровождающееся пузырьками белых газов и резким запахом хлора. Емкость, в которой происходила реакция нагревается.
В азотной кислоте кусочек магния не тонет. Бурый газ скапливается над поверхностью жидкости, выделяется тепло. Иногда говорят, что кислота «кипела», окружая кусочки магния.
Третий случай необходимо рассматривать, как два частных. В неразбавленной серной кислоте реакция идет медленно. Если же использовать раствор с небольшим количеством воды, магний также, как с азотной кислотой плавает на поверхности. При этом происходит едва заметная реакция с выделением белых пузырьков газа.
Получение магния и история открытия
Высокая химическая активность препятствует тому, чтобы магний металлический встречался в чистом виде. Источниками материалов для его добычи становятся магниевые руды или соединения солей, содержащихся в водах морей, океанов, а также подземных. Именно асбест, оливин, серпентин, магнезит, доломит, другие минералы известны миру с давних пор. Название вещества имеет те же корни, что и название города в Малой Азии – Магнезия. Только в 1808 году английский химик Г. Дэви методом электролиза получил металлический осадок, который назвал магнием.
Однако это не был чистый металл. Еще 20 лет понадобилось миру ученых, чтобы получить именно Mg в том виде, который представил его в таблице Менделеева. Сделал открытие чистого металла магния французский химик А. Бюсси в 1828 году.

Что такое электролиз
Сам же метод электролиза лег в основу классических способов получения этого элемента в чистом виде. Для производства в основном используют месторождения магний содержащих руд. Наиболее известное гражданам России находится на Урале – Саткинское. Но в Сибири имеется еще ряд месторождений, как и в Индии, Китае, Корее, некоторых странах Европы и Южной Америке.
На производстве для получения металлического магния используют расплав обезвоженных хлоридов: магния, натрия и калия. При применении непрерывного электролиза происходит восстановление по следующей формуле:
MgCl2 (электролиз) = Mg + Cl2.
Возможность реализации процессов, описанных далее, магний металл с ценой за кг остается востребованным. Очищенный металл выбирают из электролизной ванны, вливая на замещение сырье с содержанием магния. Таким способом получают металл практически свободный от примесей. Доля последних составляет не более 0,1%. Если есть необходимость уменьшить этот показатель, еще не застывший металл рафинируют, получая чистоту 99,999% и больше.
Существует еще один способ получения магния – это восстановление оксида MgO с добавлением кокса при высокой температуре. Альтернативно используют доломит, этот метод не требует предварительного отделения кальция. Получаемые в результате реакции оксиды CaO и MgO смешивают с кремнием. На выходе имеют чистейший магний и Ca2SiO4. Для этого метода допустимо использования минералов или морской воды.
Применение магния
Имеет широкий спектр от медицины до самолетостроения. Физические свойства металла магния, а именно его легкость (плотность) делает незаменим этот элемент в сплавах. Чаще это соединения с цинком, цирконием или алюминием. При очевидной легкости таких сплавов наблюдается их прочность.
Еще раз стоит отметить, что активные химические свойства металла магния позволяют использовать в процессах восстановления Ti, U, V, Zr, прочих. Обычно используется способность отбирать кислород или реагирование с фтором. На выходе получают чистые металлы плюс оксиды или фториды Mg.

Использование магния в медицине
У магния металлические свойства выражены по-особенному: он хорошо режется, благодаря чему легко получают стружку этого элемента. Но в чистом виде элемент практически не используют, как конструкционный металл, однако его сплавы – да.
О свойствах последних уже немного сказано. Но надо отметить, что соединения магния с незначительным количеством Al, Zn, Mn, Be, Ti и редкоземельными элементами имеют лучшие механические качества, чем чистый металл Mg. Они более устойчивы к коррозии, прочнее, устойчивее.

Магний используется для производства некоторых деталей самолета
Основные области применения магния в сплавах: это конструкционные материалы в строении самолетов, машин, ЖД транспорта. Еще одно направление – синтез органических веществ, рассмотрен ранее.
Магний неметалл больше известен, как фторид Mg и активно применяется в оптике для производства линз. Последние обладают прозрачностью, пластичностью, прочностью. Материалы более известны, как синтетические монокристаллы. В промышленности иногда используют кремний, а также золотое, серебряное напыление.
В сталелитейном производстве лом магния используют за его свойство притягивать кислород. Он выполняет роль раскислителя. Благодаря чему сплавы легированной стали обладают большей коррозийной устойчивостью. Поэтому магний часто участвует и в цветном литье. Из него изготавливают аноды.

Особым спросом пользуются и другие «неметаллические» соединения магния, например, его сульфат. Известны растворы для инъекций или суспензий, последние пациент может готовить дома самостоятельно. Прием магния снижает риск заболевания гипертонией у курильщиков.
Используют магний и в земледелии, практически все виды почвы, где имеется растительность содержат этот элемент. Также следует отметить участие Mg в фотосинтезе растений.
Магний металлический цена за килограмм
Не все пункты приема принимают магний. У тех, кто принимает существует лишь одна категория этого металла – кусковой лом магния (точнее это даже не магний в чистом виде, а сплавы, в которых он содержится, но в пунктах обозначается, как лом магния), его стоимость (средняя) составляет:
Лом магния кусковой – 38 рублей за килограмм .
В домашнем обиходе лом магния – это различные вешалки, дверные ручки. Лом магния можно встретить в виде старых блоков цилиндров от двигателей, карсасов авто сидений, панелей приборов, картеров сцепления и коробки передач, педалей, а также поддона картера двигателя, крышки головки блока цилиндров, впускного коллектора.

Так выглядит лом магния
Не стоит путать лом магния с ломом ЦАМа.
Широкий спектр применения этого элемента в металлургии, медицине, агропромышленном комплексе делает его интересным, в качестве вторичного сырья.
Однако увидеть объявления с желанием купить магний с ценой за кг лома, приходится довольно редко. Чаще востребованы сплавы и сернокислый порошок Mg. Но это не мешает бирже оценивать магний металл, цена которого зависит от выпуска чистого продукта. Периодически выпуск снижается, тогда таблоиды показывают возрастание стоимости продукта.
В пунктах приема лом магния и цена на него может зависеть от условий, на которых происходит факт купли/продажи – цена может варьироваться незначительно и от его объема.
Интерес к материалу подогревается его высокой огнеупорностью. Благодаря этому свойству Mg участвует в производстве футеровок и тиглей для металлургических печей. Видимо поэтому, объявления: куплю лом магния, не теряют актуальности – см. также лом огнеупоров.
Магний: свойства и возможности самого активного конструкционного металла

Описаны основные физические и химические свойства магния. Рассмотрены способы получения магния из различных минералов и его применения в технике, металлургии и медицине.
Ключевые слова : магний, применения магния, свойства магния, оксид магния, гидроксид магния.
Физические и химические свойства
Магний (Mg) — 12-й элемент периодический системы Д. И. Менделеева. Лёгкий, ковкий щелочноземельный металл серебристо-белого цвета. Шестой элемент по содержанию в земной коре после кислорода, кремния, алюминия железа и кальция. В природе встречается в виде трёх стабильных изотопов:
Длина стороны основания шестиугольной призмы, нм
Высота шестиугольной призмы, нм
Плотность при 20°C, кг/м 3
Плотность при 700°C, кг/м 3
Температурный коэффициент линейного расширения,
Удельное электрическое сопротивление при 20°C,
Температура плавления, °C
Температура кипения, °C
Конфигурация невозбуждённого атома:
. Валентными являются электроны на внешнем электронном уровне (
), которые можно легко оторвать, в результате чего во всех стабильных соединениях Mg имеет валентность Ⅱ.
Магний — сильный восстановитель, при нагревании он способен вытеснять ряд элементов из их оксидов. В ряду активности металлов он стоит левее алюминия, а его потенциал
. Однако потенциал зависит как от значения pH (в щелочной среде потенциал равен
), так и от состава раствора, в котором находится металл: при одном и том же pH в растворе сульфата потенциал менее положителен, чем в растворе хлорида.
При комнатной температуре магний стабилен из-за образования на его поверхности оксидной плёнки
. Но при увеличении температуры его активность возрастает, и при 600–650°C магний, окружённый воздухом, воспламеняется, выделяя большое количества тепла, а также мощное ультрафиолетовое излучение.
Магний образует один основный оксид
— белый порошок, почти нерастворимый в воде. Является тугоплавким соединением (
), а на его активность влияет степень прокалки.
Оксид магния редко встречается в природе в виде минерала периклаз. В основном его получают двумя способами:
- Обжиг карбоната магния(магнезит) в специальных печах (“сухой” способ производства) позволяет в зависимости от условий получать различные виды оксида магния:
- Сначала получение осадка гидроксида магния, взаимодействием сильной щёлочи и раствора бишофита (
легко растворяется в кислотах:
Также реагирует с кислотными оксидами и амфотерными оксидами, образуя двойные соли:
Являясь основным оксидом,
реагирует с водой, образуя гидроксид магния. С холодной водой реакция будет идти очень медленно, но с подогретой или с водяным паром она ускорится:
— практически нерастворимое в воде аморфное вещество белого цвета. Поглощает углекислый газ и воду из воздуха. Является слабым основанием, поэтому термически неустойчив и при температуре выше 350°C разлагается на
и воду. Эта реакция показана в “мокром” способе получения оксида.
встречается в виде минерала брусит или его волокнистой разновидности минерала немалит. Искусственно его чаще всего получают взаимодействием сильной щёлочи и бишофита.
Гидроксид магния проявляет амфотерный характер, то есть взаимодействует как с кислотами, образуя соль и воду, так и со щелочами (но только при нагревании и с сильно концентрированной щёлочью), образуя комплексные соединения:
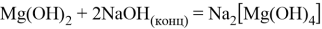
Также реагирует с кислотными оксидами, образуя соль и воду:
При длительном контакте с воздухом
подвергается “старению”, которое вызывает уменьшение дисперсности, то есть укрупнение частиц, что приводит к уменьшению удельной поверхности осадков.
— одно из важнейших соединений магния. Имеет белую окраску. Встречается в природе в виде минерала бишофит, из которого в основном получают магний.
Соединения магния образуют кристаллогидраты с переменным количеством молекул воды:
Магний, как очень активные металл, неустойчив к влаге. При наличии аэрации на его поверхности будет образовываться слой гидроксида:
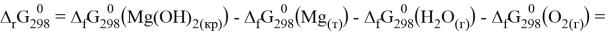
Как видно из термодинамических расчётов данная реакция протекает при стандартных условиях. Если аэрация отсутствует, то в ходе реакции также образуется гидроксид магния, но ещё выделяется водород:
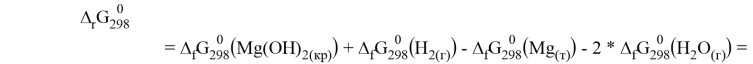
Без аэрации реакция может протекать при стандартных условиях, но медленно, поэтому для увеличения скорости температуру, при которой протекает реакция, надо повысить.
При нахождении магния во влажном воздухе имеет место электрохимическая коррозия. Это происходит из-за того, что на поверхности металла образуется тонкая плёнка воды, в которой растворены присутствующие в воздухе газы и другие вещества. Поэтому атмосферная коррозия магния усиливается по мере увеличения влажности и загрязнённости воздуха, особенно если в воздухе присутствуют хлориды, так как Cl является сильным катализатором коррозии.
Магний реагирует с кислотами неокислителями и кислотами окислителями:
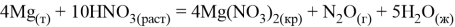
Эти реакции обусловлены его химической активностью: в кислых средах потенциал равен
, из-за чего он вытесняет ион водорода.
Магний не реагирует со щелочами при стандартных условиях, что объясняется образованием пассивирующего слоя на поверхности металла, но при увеличении температуры выше 70°C реакция возможна.
Добыча и получение магния
Магний — один из самых распространённых элементов в земной коре. Он содержится в составе многих минералов: из известных науке 1500 минералов он содержится в 200. Некоторые из них находятся рядом с залежами каменной соли под слоями различных пород, другие же образуют огромные массивы и даже горные хребты. Кроме минералов и горных пород хлорид магния содержится в водах океана, солёных озёрах и минеральных источниках (запасы неисчерпаемы —
Минералы, использующиеся в качестве сырья для добычи магния
% содержания магния или оксида
Ежегодная добыча магния составляет около миллиона тонн. Основные месторождения находятся в Китае, России и США. В то время как на Китай приходится 80 % от мировой добычи магния, на Россию 15 %, на США 5 %, а остальные страны добывают незначительное количество.
Впервые магний был получен восстановлением расплавленного хлорида магния калием:
Хлориды растворяются в воде и поэтому удаётся выделить чистый металл. Сейчас химический способ получения не используется, так как требует использования дорогостоящих восстановителей (калий и натрий), а создать непрерывный технологический процесс не удалось.
В 1830 г. Майкл Фарадей получил магний, пропуская электрический ток через расплав его хлорида. В 1852 г. этот метод был детально исследован и усовершенствован Р. Бунзеном. С помощью электролизера ему удавалось всего за короткое время получать несколько граммов металла.
Технология электролитического получения магния значительно усовершенствована в наши дни, но основные её принципы не претерпели сильных изменений.
Второй способ промышленного получения магния сейчас — термический. Он основан на восстановлении оксида магния углеродистыми и металлическими восстановителями. Впервые этот способ начали использовать в промышленности в 30-х годах XX века. Термических способов несколько:
а. Pidgeon-процесс: разработан в 40-х годах Ллойдом Пидженом в Канадском исследовательском центре. Суть процесса в восстановлении обожжённого доломита ферросилицием:
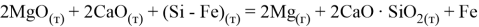
В 60-х годах интерес к данному способу у западных производителей значительно упал из-за высокой трудоёмкости и малой производительности, но получил второе рождение в Китае в конце 70-х годов прошлого века.
б. Процесс Magnetherm: был создан в 1960-х годах в французской фирме Pechiney Electrometallurgie и позволил существенно улучшить технологию силикотермического производства магния. Основное отличие новой технологии заключается в том, что восстановление оксида магния происходит в шлаковом расплаве. В процессе плавления периодически удаляется шлак без нарушения вакуума, что сильно повышает производительность термической установки.
Преимущество термического способа заключается в том, что он позволяет получать более чистый металл.
Применение магния
в конструкционных материалах
Главное преимущество магния — его лёгкость. В чистом виде он обладает невысокой прочностью, но введение в него небольшого числа других элементов сильно улучшает его свойства, как конструкционного металла, при этом не сильно увеличивая вес.
На основе этих свойств в Германии в 1909 году был создан сплав “электрон” (Al — 6 %, Zn — 1 %, Mn — 0,5 %, остальное Mg). Он, как и другие сплавы на основе магния, использовался в авиастроении в середине прошлого века. Но в ходе эксплуатации был выявлен недостаток таких сплавов: при повышении температуры сильно менялись их механические свойства, поэтому они были признаны непригодными. После множества проведённых исследований были открыты новые сплавы, лучше отвечающие поставленным требованиям.
Ещё один недостаток использования магния в качестве конструкционного материала — его высокая химическая активность, увеличивающейся с увеличением температуры, из-за которой он подвержен коррозии. С этим можно бороться, добавляя некоторые примеси. Не все элементы подойдут на эту роль. Так Fe, Ni, Cu, Pb будут только усиливать коррозию, но Mn, Zr, Zn, Ti улучшат коррозионную стойкость. Например, при добавлении менее процента титана к магниевому сплаву коррозионная стойкость увеличивается в 3 раза.
Одним из важнейших созданных сплавов стал “мангалий” (Mg — 5–30 %, остальное Al). Он сплав твёрже и прочнее алюминия, но легче обрабатывается и полируется.
Удельная вибрационная прочность магниевых деталей почти в 100 раз больше, чем у алюминиевых сплавов, и в 20 раз больше, чем у легированной стали. Также магниевые сплавы обладают лучшей удельной жёсткостью и поэтому применяются для изготовления деталей, подвергающимся изгибающим нагрузкам.
Современные сплавы, в которых содержится магний как основной или добавочный компонент, используются в автомобилестроении, корпусах телефонов, фотоаппаратов и видеокамер, ноутбуков, в деталях электроприборов и многих других областях техники.
В металлургии магний используют в процессах металлотермического получения трудновосстанавливаемых и редких металлов (Ті, Be, Zr, Hf, U). Процессы протекают при высокой температуре, когда взаимодействующие компоненты находятся в жидком состоянии. Магниетермия является основным способом получения титановой губки:
Технология получения металлических циркония и гафния во многом схожа с металлургией титана и основана на магниетермическом восстановлении хлоридов.
В черной металлургии магний нашел широкое применение при раскислении и десульфуризации чугуна и стали, что связано с большой химической активностью расплавленного магния по отношению к кислороду и сере.
В России около 80 % от всего используемого магния идёт на получение трудновосстанавливаемых и редких металлов.
В протекторной защите
Электрохимическая защита металлов от коррозии при помощи протекторов основана на значительной разности потенциалов металлов. Так как основная масса металлических конструкций в мире делается из чугуна и стали, в качестве протектора должны использоваться металлы с более отрицательным, чем у железа, электродным потенциалом. Один из них — магний. Его разница потенциалов с железом максимальная, что позволяет использовать этот металл в меньших количествах, чем другие: средний расход магниевых протекторов при защите от коррозии стальных конструкций и сооружений составляет
Широко применяется протекторная защита магнием паровых котлов, конденсаторов и трубчатых холодильников, резервуаров питьевой воды и ряда бытовых приборов, подземных трубопроводов, внутренней поверхности балластных танков наливных судов, морских буев и наружной облицовки. Также возможна катодная или протекторная защита железа магнием в среде расплавленных хлоридов.
Магний необходим для работы сердца, нервной системы, мышц и жизнедеятельности клеток. Если человек потребляет мало свежих овощей, зелени, фруктов или имеет вредные привычки, может развиться дефицит этого вещества. Тогда врачом назначается препарат с содержанием оксида магния, чтобы повысить содержание магния в организме.
Также в медицине применяется и гидроксид магния. В основном он используется в двух целях:
а. Лекарство для нейтрализации кислоты в желудке. Если человек болеет гастритом, в его желудке образуется избыток соляной кислоты. При принятии человека лекарства, содержащего гидроксид магния, он вступает в реакцию нейтрализации с кислотой, тем самым уменьшая её количество:
б. После реакции с кислотой хлорид магния, переходя в кишечник, оказывает послабляющий эффект, действуя как солевое слабительное.
В качестве альтернативного источника энергии
При сжигании магния в воздухе выделяется большое количество энергии —
, что в 4–5 раз больше, чем количество теплоты, которую нужно сообщить магнию для нагревания до температуры горения. Из-за этого магний используют во взрывчатых веществах и твердом ракетном топливе.
Также благодаря этому свойству некоторые учёные видят в магнии альтернативный источник энергии, так как кроме выделения тепла горение магния даёт в качестве отходов оксид, который можно перерабатывать обратно в магний в условиях чрезвычайно высокой температуры и в вакууме или отчищать и использовать в медицине.
Данное применение не распространено из-за высокой стоимости на магний, затрат энергии на нагрев, а также разницы в цене между чистым магнием и его оксидом (в России магний стоит 200 тыс., а оксид 100 тыс.). Всё это приводит к тому, что использовать магний в качестве промышленного источника энергии пока невыгодно.
- Металлургия магния: учебное пособие /В. А. Лебедев, В. И. Седых. Екатеринбург: УГТУ-УПИ, 2010. 174 с.
- Магний /М. А. Эйдезон. М.: «Металлургия», 1969. 352 с.
- Магниды / Г. В. Самсонов, В. П. Перминов. Киев: “Наукова думка”, 1971. — 313 с.
- Гидрокиси металлов / В. П. Чалый. Киев: “Наукова думка”, 1972. — 163 с.
- Перспективы использование магния в качестве возобновляемого источника энергии / Р. К. Костанян, Г. Г. Карамян, П. И. Ивашкин, М. М. Калугин, Г. А. Мартоян. М.: Российская академия наук, 2017. — 28 с.
Основные термины (генерируются автоматически): магний, гидроксид магния, Россия, вид минерала, Китай, минерал, оксид, реакция, сплав, увеличение температуры.
Читайте также:
