Масса металла выделившегося на катоде
Обновлено: 19.09.2024
Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч. При силе тока 4А?
Решение.Согласно законам Фарадея m = ЭIt/96500, (1)
где т — масса вещества, окисленного или восстановленного на электроде; Э – молярная масса эквивалента вещества; I – сила тока, A; t – продолжительность электролиза, с.
Молярная масса эквивалентов меди в CuSO4 равна 63,54 : 2 = =31,77 г/моль. Подставив в формулу (1) значения Э = 31,77, I = 4 А, t= 60 ∙ 60 = 3600 с, получим
Пример 2.Определение молярной массы эквивалента металла по количеству электричества, прошедшего через электролит
Вычислите молярную массу эквивалента металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение.Подставляя в формулу (1) числовые значения, получаем
Э = 11,742 ∙ 96500/3880 = 29,35 г/моль,
где m = 11,742 г; It = Q = 3880 Кл.
Пример 3.Определение силы тока по объему выделившегося при электролизе водорода
Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение.Из формулы (1) I = m 96500/Эt
Так как дан объем водорода, то отношение т/Э заменяем отношением VH; /VЭ(Н , где VH — объем водорода, л.; VЭ(Н объем эквивалентной массы водорода, л. Тогда I = VH 96500/ VЭ(Н .
Объем эквивалентной массы водорода при н.у. равен половине молярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения VН = 1,4л, VЭ(Н ) = 11,2 л, t = 6025 (1 ч 40 мин 25 с=6025с), находим
I = 1,4∙96,500/(11.2∙6025) = 2А
Пример 4.Определение массы веществ, образовавшихся у электродов при электролизе солей щелочных металлов и кислородосодержащих кислот
Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение.Объем эквивалентной массы кислорода (н.у.) 22,4/4 = = 5,6 л. Следовательно, 11,2 л содержат две молярные массы эквивалента кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11 ∙ 2 = 112,22 г (56,11 г/моль — молярная и эквивалентная масса КОН).
9.3.Коррозия металлов
Коррозия — это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металлаодновременно протекают два процесса: анодный — окисление металла
Ме°-пе=Ме п+ и катодный — восстановление ионов водорода
или молекул кислорода, растворенного в воде,
Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород.
Пример 1.Определение продуктов коррозии и составление электродных процессов
Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение.Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом.
Анодный процесс: Zn°-2e - =Zn 2+
в кислой среде 2Н + + 2е - = Н2
в нейтральной среде ½ О2 + Н2О + 2е - = 2ОН -
Так как ионы Zn 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Электронные уравнения процессов, происходящих на электродах при электролизе растворов солей
Задание 274.
Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВг. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А? Ответ: 0,886 г; 70,79 г.
Решение:
Стандартный электродный потенциал системы К + + = К 0 (-2,92 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы К + , приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
На аноде будет происходить электрохимическое окисление ионов Br-, приводящее к выделению брома:
поскольку отвечающий этой системе стандартный электродный потенциал (+1,07 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
Массу веществ, выделившихся на электродах находим из уравнения Фарадея, имея в виду, что 1 ч 35 мин = 5700 с и МЭ(Н2) = 1 г/моль, МЭ(Br2) = 79,916 г/моль получим:
m(B) = МЭ(B) . I . t/F
m(H2) = МЭ(H2) . I . t/F = 1 . 15 . 5700/96500 = 0,886 г;
m(Br2) = МЭ(Br2) . I . t/F = 79,916 . 15 . 5700/96500 = 70,81 г.
m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Ответ: m(H2) = 0,886 г; m(Br2) = 70,81 г.
Задание 275.
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
Решение:
а) Электролиз соли хлорида меди на угольных электродах:
Стандартный электродный потенциал системы Cu 2+ + 2 = Cu 0 (+0,34 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае при электролизе соли на угольных электродах, на катоде будет происходить электрохимическое восстановление меди Cu 2+ :
На аноде будет происходить электрохимическое окисление ионов Cl - , приводящее к выделению хлора:
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно выше, чем стандартный потенциал (+1,23 В), характеризующий систему
Чтобы вычислить массу меди, выделившейся на катоде при электролизе CuCl2, рассчитаем количество эквивалентов хлора, выделившегося на аноде, зная его объём и эквивалентный объём, получим:
Эквивалентный объём хлора равен 11,2 л/моль. Тогда количество эквивалентов выделившегося хлора равно:
Так как (Cl2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе CuCl2, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,05 . 31,77 = 1,588 г.
Ответ: m(Cu) = 1,588 г.
Задание 275.
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
Решение:
а) Электролиз соли медного купороса на угольных электродах:
Стандартный электродный потенциал системы Cu 2+ + 2 = Cu 0 (+0,34 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае при электролизе соли на угольных электродах, на катоде будет происходить электрохимическое восстановление меди Cu 2+ :
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему
Задание 276.
При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Ответ: 114,835.
Решение:
Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно массы вещества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F;
МЭ(Ме) = m(В) . F/(I . t) = (1,071 . 96500)/(1,5 . 60 . 30) = 38,278 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Учитывая, что металл трёхвалентный рассчитаем его атомную массу:
Аr(Ме) = МЭ(Ме) . В = 38,278 . 3 = 114,835, где В – валентность металла.
Вычисление массы и объема веществ, образующихся при электролизе
Задание 261.
Электролиз раствора К2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 5,03 г; 6,267 л; 3,133 л.
Решение:
Стандартный электродный потенциал системы К + + 1 = К 0 (-2,92 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы К + , приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- - 2 = 2S2O8 2- . Ионы SO4 2- , движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Массу разложившейся воды находим из уравнения Фарадея, имея в виду, что 3 ч = 10800 с и МЭ(Н2О) = 9 г/моль, получим:
m(H2O) = МЭ(В) . I . t/F = 9 . 5 . 10800/96500 = 5,036 г.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I . t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея , 96500.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль, получим:
V(H2) = (11,2 . 5 . 10800)/96500 = 6,267 л;
V(О2) = (5,6 . 5 . 10800)/96500 = 3,133 л;
Ответ: m(H 2 O) 5,03 г; V(H2) = 6,267 л; V(О2) =3,133 л.
Задание 262.
При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17.37 г/моль.
Решение:
Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно эквивалентной массы вещества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F;
МЭ(Ме) = m(В) . F/(I . t) = (1,75 . 96500)/(1,8 . 60 . 60 . 1,5) = 17,37 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: 17.37 г/моль.
Задание 263.
При электролизе раствора СuSO4 на аноде выделилось 168 см 3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. Ответ:0,953г.
Решение:
Стандартный электродный потенциал системы Cu 2+ + 2 = Cu 0 (+0,34 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае на катоде будет происходить электрохимическое восстановление меди Cu 2+ :
Эквивалентный объём кислорода равен 5,6 л/моль. Тогда количество эквивалентов выделившегося кислорода равно:
Так как (О2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе сульфата меди, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,03 . 31,77 = 0,953 г.
Ответ: m(Cu) = 0,953 г.
Задание 264.
Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14,62 л; 7,31 л.
Решение:
Стандартный электродный потенциал системы Na + +1 = Na 0 (-2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
Массу разложившейся воды находим из уравнения Фарадея, имея в виду, что 5 ч = 18000 с и МЭ(Н2О) = 9 г/моль, получим:
m(H2O) = МЭ(В) . I . t/F = 9 . 7 . 18000/96500 = 11,75 г.
V = VЭ . I . t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выде m(H 2 O) = 11,75 г; V(H2) = 14,62 л;V(О2) = 7,31 л.лившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль, получим:
V(H2) = (11,2 . 7 . 10800)/96500 = 14,62 л;
V(О2) = (5,6 . 7 . 10800)/96500 = 7,31 л
Ответ: V(H2) = 14,62 л; V(О2) = 7,31 л.
Как рассчитать массу металла, выделившегося на электроде при электролизе его соли
Задача 696.
Никель в ряду напряжений стоит до водорода. Объяснить, почему возможно электролитическое выделение никеля из водных растворов его солей.
Решение:
Никель имеет стандартный электродный потенциал равный -0,250 В, что больше, чем электродный потенциал водородного электрода в нейтральной среде (-0,41 В), но меньше, чем для водородного электрода в кислой среде, то в зависимости от рН раствора, плотно-сти тока, концентрации ионов металла, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. На-пример, если рН раствора соли будет близка нейтральной, то разряжаться будет никель, так как его потенциал значительно положительнее потенциала водородного электрода (-0,41 В), а если раствор соли имеет кислую среду, то разряжаться будет водород, так как его потенциал (0,00 В) значительно положительнее потенциала металла (-0,250 В).
Задача 697.
Неочищенная медь содержит примеси серебра и цинка. Что произойдет с этими примесями при электролитическом рафиниронии меди?
Решение:
При электролитическом рафинировании меди применяют сульфат меди – наиболее дешёвая и распространённая соль меди. Неочищенные примеси в металлической меди, состоящие из цинка и серебра можно разделить на две группы: Zn – металл, имеющий значительно более отрицательный электродный потенциал (-0,763 В), чем медь (+0,337 В). Поэтому он анодно растворяется вместе с медью, но не осаждается на катоде, а накапливается в электролите у катодного пространства. В связи с этим электролит нужно периодически очищать от цинка.
Ag – благородный металл, не претерпевает анодного растворения, и в ходе процесса электролиза оседает у анода, образуя вместе с другими примесями анодный шлам, который можно извлечь.
Задача 698.
При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
Решение:
Для расчета количества электричества используем формулу:
Теперь рассчитаем массу меди, выделившейся на катоде по формуле:
Здесь Э – эквивалентная масса меди равная 31,773г/моль; F – постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; VЭ – эквивалентный объём газа, для хлора он равен 11200 мл/моль; V – объём выделившегося газа, m – масса выделившегося вещества.
Ответ: 1,59г.
Задача 699.
Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
Решение:
Схема электрохимического процесса: Ag+ - 1 = Ag+, поэтому эквивалентная масса Ag+ равна М/1 = 107,868/1 = 107,868г/моль. Массу выделившегося серебра находим по формуле, имея в виду, что 30 мин = 1800с:
Здесь Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Электролиз раствора соли
Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде и объем газа, выделившегося на аноде, при электролизе раствора соли нитрата серебра (AgNO3), если время электролиза 20 минут, а сила тока I=2А, если выход по току Вт=100%. Какие вещества будут выделяться на электродах при замене инертного анода на металлический (Ag)?
Решение задачи
Электролиз раствора соли нитрата серебра (AgNO3):
Катионы металла (Ag + ), имеющие большое значение ϕ0 при электролизе полностью восстанавливаются. Следовательно:
(-) К: Ag + + e — = Ag 0 ;
Анион NO3 — неокисляем. Суммарное уравнение электролиза раствора соли нитрата серебра (AgNO3):
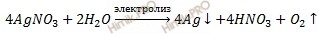
Итак, в ходе электролиза раствора соли нитрата серебра на инертных электродах будут выделяться серебро (на катоде) и кислород (на аноде).
Найдем массу серебра, полученного на катоде согласно закону Фарадея. Закон Фарадея выражается следующей формулой:
m — масса образовавшегося на электродах или подвергшегося превращению вещества, г;
Мэ — его эквивалентная масса, г/ моль;
I — сила тока, А (ампер);
F — число Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Учитывая, что эквивалентная масса серебра (Ag + ) равна 108 г/моль (смотри таблицу Менделеева), следовательно, его эквивалентная масса равна 108 г/моль, получаем:
m (Ag) = 108 ⋅ 2 ⋅ 1200 /96500 = 2,69 (г).
II закон Фарадея. При прохождении одинакового количества электричества через растворы (расплавы) различных электролитов массы (объемы) выделяющихся веществ пропорциональны их эквивалентным массам (объемам).
Так как масса серебра равна 2,69 г; Vэ(O2) = 5,6 л/моль; Э (Ag) = M (Ag) / n = 108 /1 = 108 г/моль (n -количество электронов, принимающих участие в анодном процессе).
V (O2) = 2,69 ⋅ 5,6 /108 = 0,14 (л)
Ответ:
масса серебра 2,69 грамма,
объем кислорода 0,14 литра.
При замене инертного анода на серебряный, на аноде становится возможным протекание еще одного окислительного процесса — растворение серебра, из которого сделан анод:
(+) А: Ag 0 — e — = Ag +
Этот процесс характеризуется более низким значение потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе раствора соли нитрата серебра (AgNO3) с серебряным анодом на аноде происходит реакция окисления серебра (Ag), а в анодном пространстве будет накапливаться AgNO3.
Суммарная электродная реакция выразится уравнением в ионном виде:
Ag 0 + Ag + = Ag + + Ag 0
Так как ионы сокращаются, то составить молекулярное уравнение электролиза раствора соли нитрата серебра (AgNO3) невозможно. Это означает, что электролиз раствора соли нитрата серебра (AgNO3) с анодом из серебра (Ag) сводится к переносу серебра с анода на катод.
Читайте также:
