Медь легкий или тяжелый металл
Обновлено: 30.06.2024

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
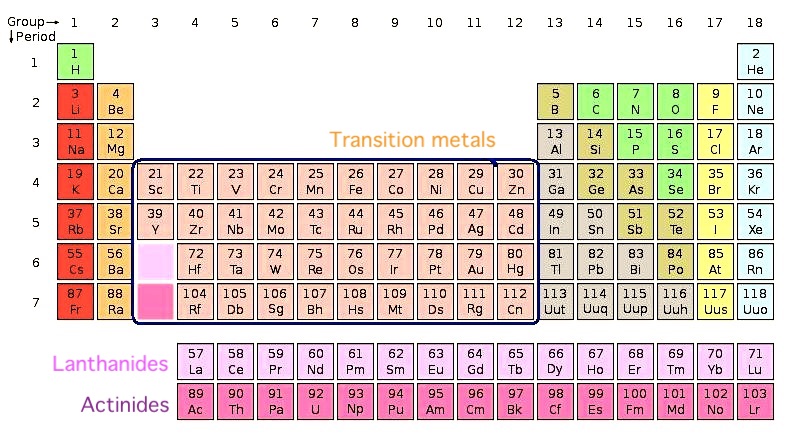
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Медь легкий или тяжелый металл

Медь (лат. cuprum) — химический элемент с символом Cu и атомным номером 29. Это металл 4-го периода в 11-й группе периодической таблицы химических элементов. Латинское название cuprum происходит от «aes cyprium» (руда с острова Кипр), где медь добывалась в древности.
Как относительно мягкий металл, медь относительна легка по весу и прочна по форме, обладает прекрасной гибкостью и пластичностью. Является отличным проводником тепла и электричества.
Историческая справка
Медь является одним из самых важных элементов древности. Медь, золото, серебро и олово были первыми металлами, которые человечество узнало в своем историческом развитии. Поскольку медь легко обрабатывается, она использовалась древнейшими культурами более 10 000 лет назад. Время широкого использования меди пришлось с 5 тысячелетия до н.э. до 3-го тысячелетия до н.э.
Однако, в чистом виде медь оказалась относительно мягкой для производства оружия и инструментов. Поэтому древние люди путем экспериментов, добавляя в расплавленную медь кусочки свинца и олова, получили бронзу. Это гораздо более твердый материал, чем нелегированная медь. Бронза используется человечеством уже более 5000 лет. Этот сплав дал название целой исторической эпохе.
В алхимии медь ассоциировалась с Венерой (женственностью). Безусловно не в последнюю очередь потому, что первые зеркала, которыми пользовались женщины, были сделаны из этого металла.
Физические свойства
При плотности 8920 кг/куб.м медь является одним из тяжелых металлов с температурой плавления 1083,4 С. Она кристаллизуется в гранецентрированную кубическую систему (ГЦК) и имеет твердость по Моосу от 2,5 до 3. Медь очень хорошо проводит электричество. Немного хуже, чем серебро, и значительно лучше золота. Кроме того, медь является очень хорошим проводником тепла.
Однако алюминий является лучшим электрическим проводником на грамм вещества, чем медь. Но он более объемный, так что медь на квадратный сантиметр сечения кабеля проводит электричество лучше, по сравнению с аналогичным сечением провода из алюминия.
Чистая металлическая медь имеет ярко-красный цвет с розовым отливом. На воздухе медь приобретает красновато-коричневый оттенок. Из-за дальнейшего окисления и коррозии очень медленно (часто в течение столетий) на поверхности меди образуется патина. Металлический блеск теряется, а цвет меняется с красновато-коричневого на голубовато-зеленый.
Месторождения меди
Медь иногда встречается в природе в чистом виде как твердый элемент. В основном в базальтовых лавах. Она находится там в виде самородка (затвердевшего расплава) или в разветвленных породных структурах, так называемых дендритах, очень редко в кристаллической форме. Доля чистой меди в природе очень низка.
Напротив, медные руды очень распространены. Медь добывается из следующих минералов: халькопирита (медный гравий — CuFeS2), халькоцита (медный глянец — Cu2S), реже из борнита (Cu5 FeS4), атакамита, малахита и других. Крупнейшие месторождения меди в мире находятся в Чили, США, России, Замбии, Канаде и Перу.
Основной страной-производителем меди является Чили, за ней следуют Индонезия и США. Основные страны-экспортеры объединены в содружество стран-производителей — CIPEC. К CIPEC принадлежат Чили, Перу, Австралия, Индонезия, Демократическая Республика Конго и Папуа-Новая Гвинея.
Производство меди
Для производства меди из медного гравия (CuFeS2) первоначально получают так называемый медный камень (Cu2S с различным содержанием FeS) с содержанием меди около 70%. Для этого исходный материал нагревают с добавлением кокса и содержащихся в нем оксидов железа, зашлакованных кремнистыми заполнителями. Полученный шлак из силиката железа плавает в расплаве на поверхности и может быть легко слит. Далее медный камень перерабатывается в сырую медь (черная медь) с содержанием меди около 98%.
Для этого расплав заливают в конвертер и вдувают воздух. На первой стадии (продувка шлаком) содержащийся в нем сульфид железа обжаривается до оксида железа, и происходит связывание хлопьевидного кварца со шлаком, который можно слить. На втором этапе две трети оставшегося Cu2S окисляются до Cu2O. Затем оксид реагирует с оставшимся сульфидом с образованием неочищенной меди. Сырая медь (цементная медь) затем очищается электролитическим способом.
Медь мигрирует в виде ионов через электролит к катоду и осаждается там. Итоговое содержание меди — 99,99% с очень маленькой примесью других веществ. Менее благородные металлы этих примесей остаются растворенными в электролите, более благородные металлы (включая серебро и золото) образуют «осадок электролита» и далее обрабатываются отдельно.
Применение меди
Современный рынок предлагает широкий спектр потребительских товаров с содержанием меди: от посуды до компьютеров. Медь используется для производства монет, электрических проводов, ювелирных изделий, столовых приборов, фитингов, чайников, прецизионных деталей, произведений искусства, музыкальных инструментов, трубопроводов и многого другого.
Для электрических токопроводящих кабелей и линий, печатных плат и интегральных схем, электрических компонентов (обмотки трансформаторов, дроссели индуктивности, анодные тела магнетронов) используется только чистая медь из-за ее очень хорошей электропроводности. Для воздушных линий используется бериллиевая медь.
Медь обладает высокой отражательной способностью в инфракрасном диапазоне и поэтому используется в качестве зеркал для лазерных установок на углекислом газе. Из-за ее хорошей теплопроводности, медь часто используется в качестве тепловых радиаторов.
Медь является частью многих сплавов, таких как золотисто-желтая латунь (с цинком), бронза (с оловом) и никелированное серебро (с цинком и никелем). Кованые сплавы (латунь и никелированное серебро) приводятся в желаемую форму с помощью пластического формования (горячая штамповка: прокатка, ковка или холодная штамповка: волочение проволоки, ковка, холодная прокатка, глубокая вытяжка), в то время как литые материалы (оружейная сталь, бронза) обычно трудно или невозможно формовать пластическим способом.
Объекты с серебристо-белым (похожим на нержавеющую сталь) внешним видом часто на самом деле представляют собой сплавы с высоким содержанием меди, так как цвет меди полностью исчезает при добавлении никеля. Современные монеты изготовлены из сплава меди, цинка, алюминия и олова. Соединения меди используются в цветных пигментах, в качестве тонеров, в медицинских препаратах и гальванических покрытиях. Благодаря благородному внешнему виду медь незаменима в мебельной промышленности и в области декора.
Биологический эффект
Медь является компонентом голубого гемоцианина, который используется многими моллюсками и членистоногими в качестве красителя крови для транспортировки кислорода. Медь также является жизненно важным микроэлементом высших организмах и входит в состав многих ферментов.
Суточная потребность меди для взрослого человека составляет около 2 миллиграммов.
Депо меди в организме человека находится в печени. Избыток меди выводится через пищеварительную систему вместе с желчью. По сравнению со многими другими тяжелыми металлами переизбыток меди не наносит существенного вреда организму. Человек может съедать 0,04 грамма меди в день, не причиняя вреда своему здоровью. Медь в основном содержится в шоколаде, печени, злаках, овощах и орехах.
Дефицит меди редко диагностируется у людей. В основном он наблюдается при хронической диарее, у недоношенных детях, при длительном голодании. Потребление высоких доз цинка, железа или молибдена может привести к снижению количества меди в организме. В свободной (не связанной с белком) форме медь обладает выраженными антибактериальными свойствами. Такими же качествами обладает и чистое серебро.
Сульфат меди (медный купорос) является сильным рвотным средством и поэтому используется для лечения многих интоксикационных заболеваний на стадии острого реагирования.
Медь и вода
Средняя концентрация меди в морской воде составляет около 0,2–3 частей на миллиард, хотя значения могут сильно варьироваться. Речная вода обычно составляет 2-5 частей на миллиард. Водоросли содержит около 2-68 частей на миллион (сухое вещество), в то время как устрицы содержат около 63 частей на миллион. В растворенном состоянии элемент находится в форме CuOH + или в виде неионного CuCO3. Кроме того, медь имеет сильную тенденцию к образованию хелатов с использованием доступных органических веществ.
Как и в каких соединениях медь реагирует с водой?
Металлическая медь при нормальных условиях является коррозионно-стойким материалом.
Растворимость меди и / или ее соединений в воде
Элементарная металлическая медь нерастворима в воде, как и оксид меди, сульфат меди. С другой стороны, хлорид меди (I) имеет растворимость в воде 200 мг / л, а медный купорос до 220 г / л.
Как медь может попасть в воду?
Медь содержится в различных минералах, таких как халькопирит, малахит, азурит или куприт. Несмотря на возможное выветривание, его можно найти лишь в небольших количествах в природных водах. Соединения меди также используются в сельском хозяйстве и, таким образом, выбрасываются в окружающую среду. Некоторая часть меди и ее соединений может быть переработана. Однако они часто попадают на мусоросжигательные заводы, откуда, в свою очередь, в определенной степени могут попадать в окружающую среду.
Не следует недооценивать количество меди, которая растворяется при взаимодействии дождевой воды с кровельными материалами. В результате также часто увеличивается содержание меди в осадке сточных вод.
Какие экологические проблемы может вызвать загрязнение воды медью?
Медь имеет важное значение для многих, если не для всех живых существ, в том числе потому, что она входит в состав многих ферментов.
Содержание меди в нормальных воздушно-сухих почвах в среднем составляет около 10-20 частей на миллион с диапазоном около 1-80 частей на миллион. Однако в загрязненных почвах может встречаться даже 3500 частей на миллион. Медь относительно неподвижна в почве, растворимость этого элемента самая низкая при pH 5-6. Она в основном накапливается в верхних слоях почвы, где связывается как с неорганическими, так и с органическими веществами.
Содержание азота в почве, вероятно, влияет на пассивный перенос меди. Симптомы дефицита у растений обычно возникают при концентрациях ниже 5 ppm. Травянистые растения и листья деревьев обычно содержат около 2-20 частей на миллион (в пересчете на сухое вещество), при этом можно предположить, что дефицит меди проявляется менее 3 частей на миллион. Кроме того, молодые растения содержат больше меди, чем более старые. В лишайниках содержится около 9-24 частей на миллион, а в грибах — около 7-160 частей на миллион.
Ионы Cu 2+ особенно токсичны для многих мелких организмов, таких как бактерии, грибы и водоросли. Таким образом, токсичность металлической меди для теплокровного организма очень ограничена, поскольку она почти не растворяется в нем. Отравление медью более вероятно при приеме уже растворенных соединений или ионов меди. Особенно чувствительны к этому жвачные животные.
Медь наносит косвенный ущерб окружающей среде, поскольку она катализирует образование диоксинов и фуранов во время сжигания отходов.

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
Смотрите так же:
СТРУКТУРА

Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура – кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками “медной зелени” (малахит), “медной сини” (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА

Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10 −3 % (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10 −7 % и 10 −7 % (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди – Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ

Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Медь – цветной металл планеты номер один
Медь не относится к благородным или редким элементам. Это самый распространенный цветной металл на Земле. Благодаря своим характеристикам в почете у промышленников и ювелиров. Предмет охоты сборщиков лома.

Что представляет собой
Медь – это розоватый металл с золотисто-металлическим блеском. Элемент №29 периодической системы Менделеева. Международное обозначение – Cu (Cuprum).
Чистый металл мягок, поэтому чаще используется с примесями. Пластичен: вытягивается до микронных диаметров.
На воздухе покрывается пленкой, обретая желтовато-красный оттенок. Тонкие пластинки на просвет зеленовато-голубые.
По официальной классификации причислен к тяжелым цветным металлам. В эту же группу входят свинец, цинк, олово, никель.
История
Медь – один из первых металлов, с которыми имело дело человечество. Этому способствовали преимущества: большая распространенность, доступность, относительно низкая температура плавления.
Достоинства меди люди оценили восемь тысячелетий назад.
Медный век начался сразу после каменного:
- Древнейшими признаны медные артефакты, откопанные на территории современной Турции. Это бусинки и декоративные накладки.
- Из металла делали режущий инструментарий и посуду.
- История открытия медных рудников на Руси начинается на Урале за две тысячи лет до новой эры. Затем были Кавказ, Алтай, Сибирь.
- Промышленная переработка с использованием бронзы началась в XIV веке. Из сплава отливали пушки и колокола.
Из бронзы отлиты Царь-колокол и Царь-пушка.
Предполагается, что металл назван по имени острова Кипр. Здесь еще в III веке до нашей эры обнаружились медные залежи, а население освоило выплавку меди.
Происхождение русскоязычного термина медь «Этимологический словарь русского языка» М.Фасмера увязывает с древненемецким корнем smid – кузнец, металл.
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.

Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн. тонн.
Физико-химические параметры
Медь – металл с типичными внешними признаками (блеск, гладкость) и структурой кристаллической решетки. Наделена высокой электро- и теплопроводностью. По этим физическим свойствам вторая после серебра.
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
|---|---|
| Атомная масса (молярная масса) | 63,546(3)а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1083,4 °С) |
| Температура кипения | 2567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Главное химическое свойство металла, оцененное человеком, – нулевая коррозийность. Медь химически малоактивна, при стандартных условиях не окисляется.
Медь в природе
В природе выявлено два проявления элемента – самородки и компонент соединений с другими элементами.

Самородок меди
Чаще это соединения: оксиды, сульфиды, гидрокарбонаты. Самое распространенное сырье – медный колчедан.
Медь придает глубокие синие, голубые, зеленоватые оттенки малахиту, бирюзе, хризоколле, другим минералам ювелирно-декоративного сегмента.
Способы получения
Содержание металла в рудах не превышает 2%. Поэтому перед плавкой их обогащают. Существует два способа получения меди: пиро- и гидрометаллургический.
Пирометаллургический
Многоуровневый процесс, включающий следующие этапы:
- Обогащение. Руды обогащают методом флотации. Взвешенные в воде медные частички «цепляются» к воздушным пузырькам, которые увлекают их на поверхность. На выходе получается порошок-концентрат с 12-36% меди.
- Обжиг. Процедура показана бедным (9-24% меди) медным рудам и концентратам, сильно «загрязненным» серой. При прокаливании с кислородом доля серы падает вдвое.
- Плавка. Кусками руды или порошком-концентратом загружают печи шахтного либо отражательного типа при 1452°С. Получают медный штейн.
- Продувка. В конвертерах на него воздействуют сжатым воздухом. Сульфиды и железо окисляются, образуется почти чистая (98,51 – 99,51%) черновая медь плюс железо, другие ценные компоненты в следовых количествах.
- Рафинирование. Черновой продукт отправляют на рафинирование – пламенем, затем электролитом. Примеси удаляются с газами. После первого этапа металл очищается до 99,51%, после заключительного – до 99,96%.
Способ применяется к 9/10 добытого сырья.
Гидрометаллургический
Состоит в обработке сырья растворенной серной кислотой малой концентрации и выделении металлического медного продукта.
Метод оптимален для руд с минимальным процентом меди. Извлечения других компонентов не предусматривается.
Сплавы
Номенклатура сплавов меди с другими компонентами насчитывает десятки позиций.

Сплавы меди и их применение
Они применяются чаще чистого металла, поскольку уменьшают недостатки, присущие чистому металлу. То есть делают продукт прочнее, устойчивее, дешевле.
Медные соединения подразделяются на две группы:
Помимо этих главных легирующих компонентов, в составе соединения алюминий, никель, висмут, титан, серебро, золото, неметаллические элементы.
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.

Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника. Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
- Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.

Медные трубы
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.

Кольцо из меди
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.

Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Значение для человека
Медь заложена в организм человека изначально:
- Участвует в образовании красных кровяных телец, коллагена, эластина.
- Активирует работу эндокринной системы, замедляет старение организма.
- Ее дефицит чреват замедлением белкового обмена. Это влечет патологии в развитии скелета и составе крови.
Она есть во многих продуктах питания. Медью богаты говяжья печень, устрицы, кунжут, какао-порошок, черный перец, гречневая крупа. А также орехи (лесной, грецкий, кешью, арахис, миндаль).
Предостережение
В составе металла есть изотопы: два стабильных плюс два десятка нестабильных. Хотя период полураспада «долгожителя» – менее 2,5 суток, материал токсичен.
Поэтому применение меди контролируется.
В России на федеральном уровне (национальный стандарт, федеральный Свод Правил) регламентируется:
- Производство и использование медных водо- паро- и газопроводных труб.
- Количество меди в питьевой воде.
В 1 литре питьевой воды не должно быть больше 1 мг меди.
Избыток медных компонентов вызывает отравление организма. Для приготовления пищи медная посуда непригодна.
Карьер, в котором медную руду извлекали открытым способом, становится источником токсичных соединений.
Мировая цена меди устанавливается на Лондонской бирже металлов. Она зависит от спроса, определяемого состоянием экономики.

И колеблется соответственно:
- К началу 2008 года преодолена психологическая отметка $8000 за тонну.
- Через полгода было уже $+940, что стало рекордом за всю историю биржи.
- На начало 2011 года взята планка $10 000.
Затем произошел спад. На 2021 год тонна меди торгуется по $8057. Сказалось торможение экономики из-за пандемии коронавируса.
Тяжелые металлы – перечень, свойства и риски элементов
Официально такой группы химических элементов не существует. Однако металлурги, аграрии, особенно экологи, оперируют понятием «тяжелые металлы». Этот сегмент привлекает повышенное внимание.

Что представляют собой
Термин «тяжелые металлы» еще двести лет назад пытался ввести в научный оборот немецкий химик Лео Гмелин.
Однако в номенклатуре Международного союза, курирующего вопросы теории и практики химии (IUPAC), такое подразделение отсутствует.
В академических и промышленных кругах циркулирует четыре десятка критериев, по которым металл признается тяжелым.
Самые популярные основания:
- Атомный номер выше 50.
- Плотность 5+ г/см3.
На практике чаще востребован второй критерий.
То есть к тяжелым металлам относятся элементы с плотностью, превышающей 5 г/см3.
В соответствии с ним таковыми считаются:
- Традиционные: железо, медь, хром, марганец, кобальт, олово, свинец, никель, цинк.
- Менее известные: кадмий, молибден, вольфрам, сурьма. Плюс экзотика – галлий, теллур.
- И самые коварные – ртуть, таллий, висмут.
На бытовом уровне они считаются токсичными элементами. Подобное отождествление некорректно.
Не каждый тяжелый металл токсичен, но таким способно стать при благоприятных условиях безобидное вещество.
Экология, медицина
У экологов и врачей свои подходы. Для них тяжелыми металлами являются особо значимые (полезные либо опасные) для биологических организмов элементы.
Суровее критерии Организации Объединенных наций (ООН). В соответствии с ее экологической доктриной, тяжелыми считаются стабильные металлы либо металлоиды, их соединения (особенно соли тяжелых металлов) с плотностью более 4,5 г/см3.
Критерий действует с 1998 года.
Классификация
Кроме плотности, маркером принадлежности к группе служат температура плавления, степень использования, другие свойства.
На основании этого выделяют следующие виды тяжелых металлов:
- – цинк, медь, олово, свинец, никель. – железо.
- Редкие – галлий, висмут, таллий, кадмий. – молибден, вольфрам, хром. – кадмий, кобальт, свинец, ртуть, олово, галлий, таллий, висмут.
Самый тяжелый металл планеты – иридий. Кубик с ребром в 1 см весит 22,6 грамма. Но вещество попадает на Землю только с метеоритами.

Иридий
В сегменте обычных земных «тяжеловесов» лидирует вольфрам – он на три грамма легче. Это восьмая позиция среди металлов.
Откуда берутся
Естественных поставщиков тяжелых металлов четыре:
- Горное сырье. Чаще это магматические либо осадочные породы.
- Породообразующие минералы. У меди, например, это малахит и другие минералы.
- Вулканы. Частицы вещества извергаются попутно с вулканическими продуктами (газами, гейзерами).
Еще один источник – Вселенная. Вещество заносится в стратосферу метеоритами либо облаками космической пыли.
Получение продукта
На большинстве металлургических комбинатах сырье плавят в доменных и мартеновских печах. Это оборудование из позапрошлого века делает процесс тяжелым, опасным для экологии и человека.
Внедрение « зеленых » технологий продвигается медленно, поскольку требует инвестиций.
Результат недостаточной очистки отходов производства – высокое содержание вредных компонентов. Следствие – загрязнение почвы, воды, воздуха.
Влияние на экологию
Особо опасные загрязнители биосферы – именно тяжелые металлы. Самая вредная форма соединений – соли.
Пути поступления
Загрязнение биосферы происходит следующими способами:
- Металлургия. Выбросы в процессе плавки, обжига. Вымывание тяжелых веществ из отвалов месторождений либо меткомбинатов водой, выветривание.
- Агросектор. Полив плантаций, удобрение полей илом бытовых стоков либо пестицидами.
- Быт. Использование как топлива торфа, угля, другого сырья.
- Автобаны. Свинцом, цинком, кадмием насыщены обочины автострад.
Свинец пропитывает почву минимум на 100 м по обе стороны дороги.

Свинец
Способы очищения
Почва очищается от такого груза десятилетиями, иногда столетиями.
Концентрация цинка уменьшается наполовину спустя столетие, кадмию требуется вдвое меньше.
Медь исчезает через три столетия, свинец – через десять:
- Токсичные соединения растворяются в воде.
- В почве процесс активируют влажность и растительность.
Флора вытягивает «свои» металлы. Так, лишайники «кушают» цинк, никель, медь.
Токсичность тяжелых металлов возрастает с увеличением атомного номера.
Воздействие на человека
Влияние большинства таких веществ двояко:
- Микродозы цинка, железа, меди задействованы в биологических процессах. Например, поддержании уровня гемоглобина в крови.
- Превышение микродоз опасно: тормозится работа нервной системы, сердца, почек, других органов. Разрушается скелет, идет разбалансировка жизненных процессов.
- Токсичны бесполезные свинец, ртуть.
Отравление организма внешне проявляется как тошнота, рвота, головная боль, нарушение координации движений. Плюс более тяжелые последствия, до летального исхода.
В зоне риска следующие категории:
- Работники меткомбинатов.
- Жители мегаполисов, окрестностей автострад.
- Потребители продуктов со стихийных рынков (не прошедших санитарный контроль).
Уровень загрязненности территории экологи определяют благодаря местным животным.
Чуткие «индикаторы» загрязненности на европейской части – лоси, мышь-полевка, кроты, бурый мишка.
Читайте также:
