Металл это твердое тело
Обновлено: 04.10.2024
В твердых кристаллических телах молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров. Молекулы в кристаллах привязаны к определенным центрам и не могут перемещаться по всему объему тела. Этим объясняется то, что твердые тела сохраняют свою форму и объем.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические тела.
Молекулы и атомы в аморфных телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц мала.
Их свойства (механические, тепловые, электрические, оптические) по всем направлениям одинаковы, т.е. аморфные тела изотропны. Изотропность -независимость всех физических свойств (механических, оптических и т. д.) от направления.
Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), воск, смола, пластики и т. д. Аморфные тела являются переохлажденными жидкостями (жидкости с большой вязкостью).
Характерной особенностью аморфных тел является отсутствие у них определенной точки плавления, т.е. нельзя указать температуру, выше которой будет жидкое состояние, а ниже – твердое. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур. Со временем в аморфных телах происходит кристаллизация, поэтому стекло с течением времени теряет прозрачность, мутнеет. В последнее время очень широкое практическое применение получили органические аморфные тела – полимеры. Молекулы полимеров состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими связями. К полимерам относятся крахмал, белок, каучук, пластмасса, резина, капрон и др. вещества. Полимеры обладают прочностью и эластичностью, некоторые из них могут выдерживать растяжение, превышающее их первоначальную длину в 5–10 раз.
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества.
Частицы в кристаллах образуют пространственные периодически повторяющиеся структуры, которые называют кристаллические решетки.
Точки в кристаллической решетке, соответствующие наиболее устойчивому положению равновесия частиц твердого тела, называются узлами решетки.
Правильное расположение частиц в узлах кристаллической решетки называют дальним порядком.
Пример ближнего порядка молекул аморфного тела и дальнего порядка молекул кристаллического вещества:
1 – аморфное тело; 2 – твердое тело.
Правильное расположение частиц в решетке является причиной анизотропиикристаллов.
Анизотропиякристаллов заключается в зависимости некоторых физических свойств кристаллов от направления (скорость распространения света, теплопроводность, модуль упругости).
Кристаллические тела могут быть монокристалламии поликристаллами.
Крупные одиночные кристаллы называют монокристаллами.
Поликристаллы состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами.
Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
Монокристаллы анизотропны. В отличие от монокристаллов, поликристаллические тела изотропны, то есть их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом.
Переход из одной модификации в другую называется полиморфным переходом.
Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К.
В зависимости от характера сил взаимодействия и природы частиц, находящихся в узлах кристаллической решетки, различают четыре типа кристаллических решеток.
1. Ионные кристаллы.В узлах кристаллической решетки находятся ионы (положительно и отрицательно заряженные) атомов, которые входят в состав молекулы данного вещества. Связь между ними обусловлена электрическими (кулоновскими) силами взаимодействия (притяжения) между разноименными ионами.
Примером ионной решетки служит кристалл каменной соли NaCl. Кристаллическая решетка поваренной соли содержит ионы Na + и Cl – , не объединенные попарно в молекулы NaCl. (следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц)
2. Атомные кристаллы.В узлах кристаллической решетки находятся нейтральные атомы. Между ними существует ковалентная связь (связь, при которой каждые два соседних атома удерживаются рядом силами притяжения, возникающими при взаимном обмене между этими атомами двумя валентными электронами).
Примером атомных кристаллов являются алмаз, графит, германий, кремний.
3. Молекулярные кристаллы.В узлах кристаллической решетки находятся молекулы, ориентированные определенным образом. Между молекулами действуют силы притяжения, характерные для взаимодействия молекул.
К молекулярным кристаллам относятся нафталин, парафин, сухой лед СО2, лед Н2О.
4. Металлические кристаллы.В узлах кристаллической решетки находятся положительные ионы металла, между которыми движутся свободные (валентные) электроны, образующие электронный газ. Связь в металлических кристаллах обеспечивается силами притяжения между положительными ионами, находящимися в узлах решетки, и отрицательным электронным газом.
Эти силы притяжения уравновешиваются силами отталкивания между одноименными ионами.
По геометрической конфигурации кристаллические решетки можно разделить на кубические и гексагональные.
Простые кристаллические решетки:
1 – простая кубическая решетка;
2 – гранецентрированная кубическая решетка;
3 – объемноцентрированная кубическая решетка;
4 – гексагональная решетка.
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 4 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na + и Cl – .
В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
В настоящее время большой интерес вызывает новый класс веществ – жидкие кристаллы.
Это почти прозрачные вещества, проявляющие одновременно свойства жидкости и кристалла. Жидкие кристаллы открыл в 1888 г. австрийский ботаник Ф. РЕЙНИТЦЕР. Он обратил внимание, что у кристаллов холестерилбензоата и холестерилацетата было две точки плавления и, соответственно, два разных жидких состояния — мутное (от 145 °С до 179 °С) и прозрачное (выше 179 °С).
Жидкие кристаллы находят широкое практическое применение. Многие вещества в жидкокристаллическом состоянии обладают весьма ценным качеством: некоторые их свойства резко изменяются при незначительном изменении внешних условий (температура, длина волны облучаемого света, электрическое и магнитное поля и т. д.). Оптическую ось в жидких кристаллах можно легко ориентировать электрическим полем. Этот эффект используется при построении жидкокристаллических индикаторов и экранов. На основе жидких кристаллов разработан преобразователь инфракрасного изображения в видимое, применяемый в медицине, военном деле и других отраслях. Некоторые жидкие кристаллы весьма чувствительны к присутствию паров различных химических веществ: при наличии в воздухе ничтожно малой концентрации этих веществ структура жидкого кристалла меняется, что сопровождается изменением его цвета.
Молекулы жидких кристаллов не образуют кристаллической решетки, но ввиду своей формы (плоские, нитевидные) могут выстраиваться при незначительном воздействии в определенном порядке. Структура при этом приобретает свойства слоистых или нитевидных кристаллов. Упорядоченное расположение молекул в жидких кристаллах наблюдается лишь по одному направлению. Структура, соответствующая жидким кристаллам, возникает в органических веществах, молекулы которых имеют нитевидную вытянутую форму или же форму плоских пластин. Например, растворенное в воде мыло образует жидкие кристаллы. Молекула мыла имеет форму палочки. Тот конец молекулы, который имеет отрицательный заряд, тяготеет к молекулам воды, это является причиной упорядоченной ориентации молекул мыла по отношению к воде. Мыльный раствор (в воде) состоит из большого числа двойных слоев молекул мыла, разделенных слоем воды. Двойные слои, образующие жидкий кристалл, обладают большой подвижностью, что определяет моющие свойства мыла. Частички грязи и очищаемая поверхность покрываются слоями жидких кристаллов, легко скользящих один относительно другого. При небольшом механическом воздействии частички грязи, обволакиваемые «шубой» жидких кристаллов легко переходят в раствор и уносятся вместе с водой.
Жидкие кристаллы обнаруживаются в важнейших функциональных участках клетки живых организмов. Распространенность жидкокристаллического состояния в живых тканях обусловлена его высокой чувствительностью к окружающей среде, гибкостью структуры и достаточной устойчивостью к внешним воздействиям. Для обмена веществ с окружающей средой (основная особенность живой клетки) жидкие кристаллы являются идеальными образованиями, так как они могут растворять многие вещества, не изменяя своей жидкокристаллической структуры, легко обмениваться молекулами. При соответствующих условиях жидкие кристаллы могут набухать, а затем опять сжиматься, не теряя жидкокристаллического строения, в мышечных волокнах они могут растягиваться и сжиматься, не разрушаясь. Значительная прочность жидкокристаллических волокон необходима для образования опорных тканей.
Механические свойства твердых тел.
В твердых телах – аморфных и кристаллических – частицы (молекулы, атомы, ионы) совершают тепловые колебания около положений равновесия, в которых энергия их взаимодействия минимальна. При увеличении расстояния между частицами возникают силы притяжения, а при уменьшении – силы отталкивания. Силы взаимодействия между частицами обусловливают механические свойства твердых тел.
Деформация твердого тела является результатом изменения под действием внешних сил взаимного расположения частиц, из которых состоит тело, и расстояний между ними.
Деформация –изменение формы или объема тела.
Существует четыре основных вида деформаций твердых тел: растяжение (сжатие), сдвиг, кручение, изгиб.
При любом виде деформации в твердом теле происходит смещение частиц, из которых оно состоит, относительно друг друга. Это вызывает возникновение в материале сил, препятствующих деформации – сил упругости.Они стремятся восстановить прежнюю форму и объем тела.
Свойство деформированных тел принимать свою первоначальную форму и свой объем после прекращения действия внешних сил называется упругостью.
Упругая деформация –деформация, которая полностью исчезает после снятия внешних нагрузок (деформирующих факторов).
Пластическая деформация – деформация тела, которая не исчезает после снятия внешних нагрузок на тело.
Простейшим видом деформации является деформация растяжения или сжатия.
1 – деформация растяжения; 2 – деформация сдвига
Ее можно характеризовать абсолютным удлинениемΔl, возникающим под действием внешней силы F . Связь между Δl и F зависит не только от механических свойств вещества, но и от геометрических размеров тела (его толщины и длины).
Отношение абсолютного удлинения Δl к первоначальной длине lобразца называется относительным удлинением или относительной деформацией ε:
При растяжении ε > 0, при сжатии ε < 0.
Если принять направление внешней силы, стремящейся удлинить образец, за положительное, то F > 0 при деформации растяжения и F < 0 – при сжатии.
Отношение модуля внешней силы F к площади S сечения тела называется механическим напряжением σ:
За единицу механического напряжения в СИ принят паскаль (Па). Механическое напряжение измеряется в единицах давления. Оно характеризует действие внутренних сил в деформированном твердом теле.
Связь между упругими деформациями и внутренними силами в материале впервые была установлена английским ученым Р. Гуком.
Закон Гука:механическое напряжение в упруго деформированном теле прямо пропорционально относительной деформации этого тела.
k –коэффициент упругости (модуль упругости), характеризующий упругие свойства материала – зависимость механического напряжения от рода материала и от внешних условий.
Другая форма записи закона Гука: ε = σ/Е
Коэффициент E в этом соотношении называется модулем Юнга –величина, обратная коэффициенту упругости. Е = 1/k
Зависимость между ε и σявляется одной из важнейших характеристик механических свойств твердых тел. Графическое изображение зависимости между ε и σназывается диаграммой растяжения.
По оси абсцисс откладывается относительное удлинение ε, а по оси ординат – механическое напряжение σ.
Типичный пример диаграммы растяжения для металлов (таких как медь или мягкое железо) представлен на рисунке:
Типичная диаграмма растяжения для пластичного материала.
Голубая полоса – область упругих деформаций.
Участок OA на диаграмме – упругая деформация.
При малых деформациях (обычно существенно меньших 1 %) связь между σ и ε линейная. Максимальное значение σ = σпр, при котором сохраняется линейная связь между σ и ε, называется пределом пропорциональности(точка A).
На линейном участке выполняется закон Гука: ε = σ/Е
Участок AB - еще упругая деформация.При дальнейшем увеличении напряжения связь между σ и ε становится нелинейной, однако при снятии напряжения деформация практически полностью исчезает, то есть восстанавливаются размеры тела. Максимальное напряжение на этом участке σупр называется пределом упругости.
Если σ > σупр, образец после снятия напряжения уже не восстанавливает свои первоначальные размеры и у тела сохраняется остаточная деформация εост.
Участки BC, CD и DE – пластическая деформация.
На участке BC деформация происходит почти без увеличения напряжения. Это явление называется текучестью материала.
В точке D достигается наибольшее напряжение σmax, которое способен выдержать материал без разрушения - предел прочности.
В точке E происходит разрушение материала.
Для расчета различных конструкция необходимо знать механические свойства твердых тел.
Прочность –способность материала выдерживать нагрузки без разрушения.
У многих материалов предел прочности значительно больше предела упругости. Такие материалы называют вязкими. К ним относятся медь, цинк, железо.
Материалы, у которых отсутствует область упругих деформаций, называют пластическими. К ним относят воск, глину, пластилин.
В технике материалы различают по твердости.Из двух материалов более твердым считается тот, который оставляет царапины на поверхности другого. Из природных материалов наибольшей твердостью отличается алмаз.
Материалы, у которых разрушение происходит при небольших деформациях (лишь незначительно превышающих область упругих деформаций) называются хрупкими (стекло, фарфор, чугун).
Может ли металл быть газом?

Да, металлы могут быть газами, в зависимости от того, насколько высока их температура кипения. Но действительно ли газообразные металлы считаются металлами?
Закройте на мгновение глаза и позвольте слову "металл" всплыть в вашей голове. А теперь ответьте: какой первый образ приходит вам на ум, когда вы думаете о "металле"?
Большинство из вас увидят твердый, блестящий твердый предмет - может быть, блестящий меч, гладкую машину или чистую посуду?
Слово "металл" ассоциируется у нас с твердыми объектами, потому что большинство металлов вокруг нас - это твердые тела. Но ограничиваются ли металлы только твердым телом? Могут ли они быть газом?
Да, конечно! Хотя металлы обычно находятся в твердом состоянии при комнатной температуре (вероятно, поэтому мы ассоциируем слово "металл" с твердыми объектами), металлы также могут быть газами.
Дело в том, что состояния вещества универсальны: металл может быть твердым, жидким или газообразным. Но это состояние определяется на основе правильных условий температуры и давления.
Например, металл, скажем, свинец, имеет температуру кипения 1740 градусов по Цельсию. Теперь вы знаете, что свинец в своем «естественном состоянии» представляет собой твердое вещество. Но когда вы начнете его нагревать, он сначала превратится в жидкость при 327 градусах Цельсия, а если вы продолжите подавать больше тепла, он превратится в газ при 1740 градусах Цельсия.

Свинец превращается в пар при 1740 градусах Цельсия.
Другой отличный пример - ртуть. Фактически, это металл с самой низкой температурой кипения (356,7 °C), что означает, что из всех металлов он превращается в газ при относительно более низкой температуре.
Но учтите, что пары ртути очень вредны. По данным Всемирной организации здравоохранения, "вдыхание паров ртути может оказывать вредное воздействие на нервную, пищеварительную и иммунную системы, легкие и почки и может быть фатальным. Неорганические соли ртути разъедают кожу, глаза и желудочно-кишечный тракт, а при попадании внутрь могут вызывать токсическое воздействие на почки".

Ртуть весьма примечательна - это металл, который существует в жидком виде при комнатной температуре, а затем закипает при небольшой температуре.
А теперь давайте обсудим еще один аспект этой саги о превращении металла в газ.
Остается ли металл металлом, когда он превращается в газ?
Мы установили, что металлы могут превращаться в газы, если их нагреть до точки кипения. Но если металл нагревается до точки кипения и становится газом, остается ли он металлом? Другими словами, может ли металл находиться в газообразном состоянии и при этом оставаться металлом?
Газообразные металлы не сохраняют свойств своих твердых аналогов, включая металлические связи, металлическую проводимость, пластичность, блеск или другие металлические свойства. Вот почему металлы больше не считаются металлами, когда они переходят в газообразное состояние - это просто газ с определенными характерными свойствами "родительского" элемента. (тогда чем же они считаются? - В ЭТОЙ ТОЧКЕ ОНИ ЯВЛЯЮТСЯ ПРОСТО ГАЗОМ. РТУТЬ ЯВЛЯЕТСЯ МЕТАЛЛОМ, НО КОГДА ОНА КИПИТСЯ, ЕЕ ПАР НАЗЫВАЕТСЯ РТУТНЫМ ГАЗОМ/ПАРАМИ)
Но почему металлы твердые? Что в них такого особенного, что делает их твердыми?
Почему металлы вообще твердые?
Металлы твердые при комнатной температуре из-за того, как их последовательные атомы упаковываются внутри.
Видите ли, вся материя состоит из атомов. Состояние вещества зависит от того, насколько близко или далеко друг от друга находятся эти атомы.
Если составляющие атомы вещества находятся далеко друг от друга, то это вещество будет существовать в виде газа при комнатной температуре. Атомы в жидком состоянии относительно ближе друг к другу, но в твердых телах атомы упакованы вместе в плотные кристаллы.
Из-за сильных сил, которые удерживают эти атомы близко друг к другу, твердые тела жесткие и имеют определенную форму и размер (в отличие от жидкости и газа).
Металлы твердые при комнатной температуре, потому что входящие в их состав атомы металлов упаковываются близко друг к другу, придавая им жесткий или "затвердевший" внешний вид. Это также является причиной того, что металлы имеют высокую температуру плавления и не существуют в жидком состоянии при комнатной температуре.
В целом, металлы могут превращаться в газ, но как только они превращаются в газ, они не сохраняют своих металлических свойств.
14 различных типов металлов

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
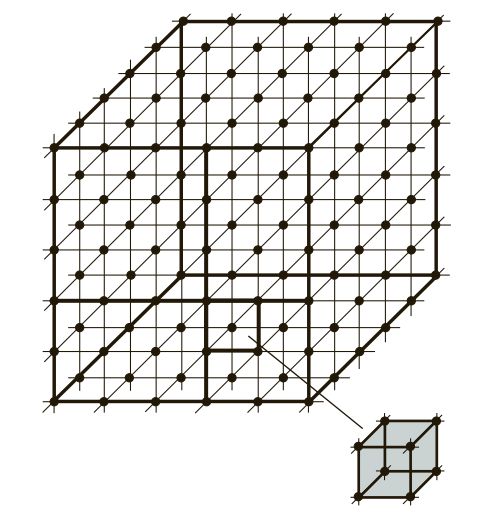
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
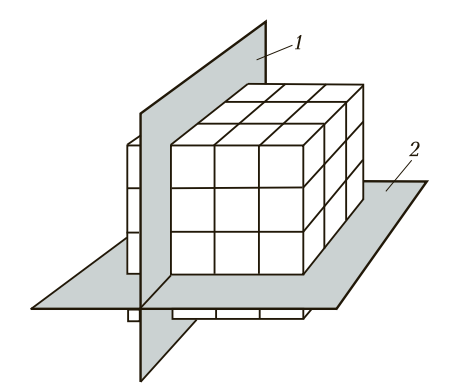
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
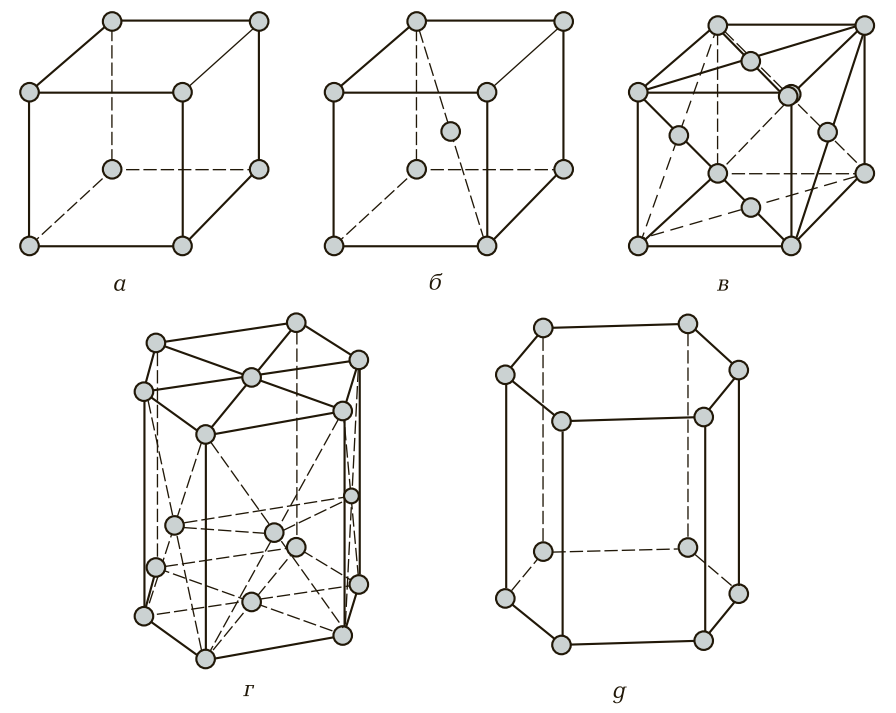
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
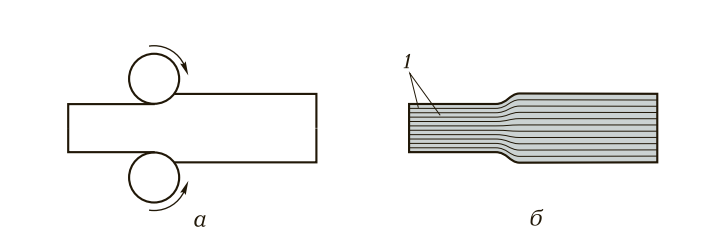
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
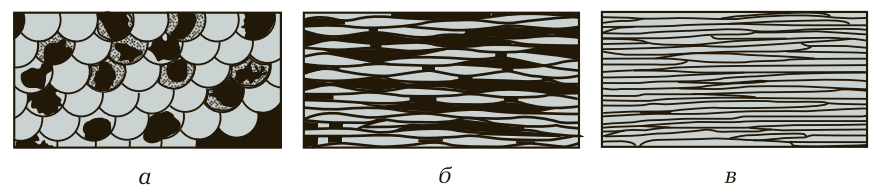
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
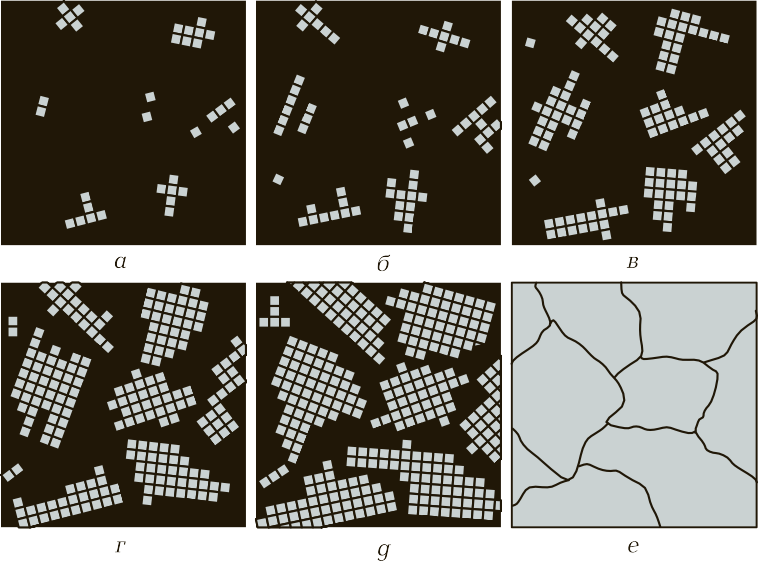
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
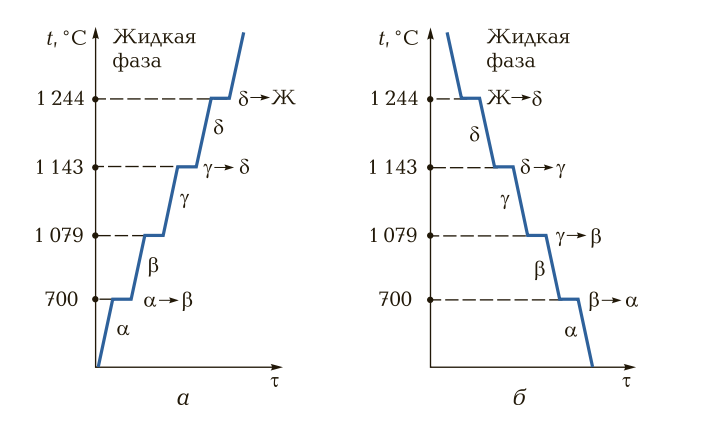
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Читайте также:
