Металл la в таблице менделеева
Обновлено: 04.10.2024
По древней традиции, корни которой тянутся к средним векам, все химические элементы получали свои названия на латинском языке; эта традиция не нарушается и в наше время. В начале XIX столетия для химических элементов были предложены сокращенные буквенные обозначения, которыми служили или одна начальная буква латинских названий элементов, или, значительно чаще, две буквы, начальная и одна из последующих. Так образовались современные знаки (символы) химических элементов, получившие впоследствии международное признание.
Русские названия химических элементов в большинстве представляют собой их латинские названия с измененными окончаниями в соответствии с особенностями нашего языка. Но вместе с тем можно назвать много элементов, которые имеют на русском языке особые названия, отличные от латинских. Этими названиями служат или коренные русские слова, например железо (Fe), медь (Сu), ртуть (Hg), или перевод латинского названия элемента на русский язык, например водород (Н), кислород (О). Для того, чтобы в этих случаях можно было понять происхождение символов, следует сопоставить их с латинскими названиями соответствующих элементов, указанными в табл. 2-16.
Попутно в примечаниях к таблице указываются те особые названия и обозначения химических элементов, которые применяются в научной литературе ряда зарубежных стран.
Латинское название элемента
Примечания к таблице:
1) Жансен и независимо от него Локьер в 1868 г. обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
2) Еще в конце XVIII в. было известно, что при действии серной кислоты на плавиковый шпат выделяется особая кислота, которая разъедает стекло. В 1810 г. Ампер показал, что эта кислота подобна соляной и является соединением с водородом некоторого неизвестного элемента, который он назвал фтором. В чистом виде фтор удалось получить Муассану только в 1886 г.
3) Окись магния была известна давно, ее исследовал Блэк еще в 1775 г. Деви в 1808 г. пытался получить металлический магний, но в чистом виде металл получить ему не удалось.
4) Двуокись титана была получена лабораторным путем еще в конце XVIII в., Берцелиус получал титан, но не вполне чистый. Более чистый металлический титан был получен Грегор, затем Муассаном.
5) Сернистые соединения мышьяка былп известны в древнее время.
6) В начале XIX в. была получена смесь ниобия и тантала, которая рассматривалась как новый элемент; ему было присвоено название колумбий. В Америке и Англии ниобий до сих пор носит название колумбий.
7) В виде окиси церий был получен в 1803 г.
8) Долгое время смесь празеодима и неодима считалась отдельным элементом, который назывался дидием (Di).
9) Как особый металл платина была описана в 1750 г.; до 1810 г. единственным местом добычи платины была Колумбия. Затем платина была найдена в других местах, в том числе на Урале, который до настоящего времени является наиболее богатым источником ее получения.
10) Двуокись урана, полученная впервые еще в 1789 г., была принята вначале за новый элемент. Металлический уран был получен впервые в 1842 г., его радиоактивные свойства были открыты только в 1896 г.
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, - М.: 1960.
ТАБЛИЦА МЕНДЕЛЕЕВА - периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) - это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 - 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец - это группа, определяющая основные физико-химические свойства, а строки - это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА

Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента - это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
2 элемента (1s 2 )
18 элементов (5s 2 4d 10 5p 6 )
8 элементов (2s 2 2p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
8 элементов (3s 2 3p 6 )
18 элементов (4s 2 3d 10 4p 6 )
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
внешний (n) s-подуровень
внешний (n) р-подуровень
предвнешний (n–1 ) d-подуровень
(n-2)f 1–14 (n-1)d 1–10 ns 1–2
третий снаружи (n–2) f-подуровень
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s 2 p 6 , для гелия s 2 .
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R - обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда "Основы химии", который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса". Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: "Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)."
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
Лантан

Лантан — химический элемент 3-й группы (по устаревшей классификации — побочной подгруппы третьей группы) шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 57, атомная масса — 138,9055. Обозначается символом La (лат. Lanthanum ). Простое вещество лантан — блестящий металл серебристо-белого цвета, относится к редкоземельным элементам.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства
- 6.1 Основные соединения
- 6.2 Минералы
История
Лантан как химический элемент не удавалось открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб Берцелиус исследовал минерал, известный теперь под названием церит. В этом минерале была обнаружена иттриевая земля и ещё одна редкая земля, очень похожая на иттриевую. Её назвали цериевой. В 1826 г. Карл Мозандер исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится ещё один новый элемент. Доказать сложность цериевой земли Мозандеру удалось лишь в 1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.
Происхождение названия
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Оно было дано в честь истории его открытия и происходит от др.-греч. λανθάνω — «скрываюсь», «таюсь».
Нахождение в природе
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Содержание лантана в земной коре порядка 2,9·10 −3 % по массе, в морской воде — около 2,9·10 −6 мг/л. Основные промышленные минералы лантана — монацит, бастнезит, апатит и лопарит. В состав этих минералов также входят другие редкоземельные элементы.
Получение
Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом и неодимом. Сначала из смеси отделяют церий, затем оставшиеся элементы разделяют экстракцией.
Физические свойства
Лантан — блестящий серебристо-белый металл, в чистом состоянии — ковкий и тягучий. Слабо парамагнитен. Кристаллическая структура плотноупакованная типа плотнейшей гексагональной упаковки.
Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой (а=0,3772 нм, с=1,2144 нм, z=4, пространственная группа Р63/ттс), β-La с кубической решёткой типа меди (а=0,5296 нм, z=4, пространственная группа Fm3m), γ-La с кубической объёмноцентрированной решёткой типа α-Fe (а=0,426 нм, z=2, пространственная группа Im3m, устойчив до 920 °C) температуры переходов α↔β 277 °C и β↔γ 861 °C. DH° полиморфных переходов: α:β — 0,36 кДж/моль, β:γ — 3,12 кДж/моль. При переходе из одной модификации в другую меняется плотность лантана: α-La имеет плотность 6,162-6,18 г/см 3 , β-La — 6,19 г/см 3 , γ-La — 5,97 г/см 3 .
Сплавляется с цинком, магнием, кальцием, таллием, оловом, свинцом, никелем, кобальтом, марганцем, ртутью, серебром, алюминием, медью и кадмием. С железом лантан образует пирофорный сплав.
Химические свойства
По своим химическим свойствам лантан больше всего похож на 14 следующих за ним элементов, поэтому их называют лантаноидами. Металлический лантан обладает высокой химической активностью.
- Во влажном воздухе быстро превращается в основный карбонат лантана:
- При 450 °С сгорает в кислороде с образованием оксида лантана(III):
- Медленно реагирует с холодной водой и быстро — с горячей, образуя гидроксид лантана (III):
- При нагревании лантан вступает в реакции со фтором, хлором, бромом и йодом, давая соответственно фторид, хлорид, бромид и йодид:
- Легко взаимодействует с минеральными кислотами с образованием ионов La 3+ и водорода. Вполне возможно, что в водном растворе ион La 3+ в значительной степени существует как комплексный ион [La(OH2)9] 3+ :
Основные соединения
- Ацетилацетонат лантана — органическое соединение, хелат, формула La(C5H7O2)3. Представляет собой бесцветное твёрдое вещество, хорошо растворимое в воде и органических растворителях. Получается реакцией солей лантана со спиртовым раствором ацетилацетона.
- Бензоилацетонат лантана — хелатное соединение лантана, формула La(C10H9O2)3. Образует жёлтые призматические кристаллы. Получается взаимодействием солей лантана со спиртовым раствором бензоилацетона.
- Бромид лантана (III) — бинарное соединение, формула LaBr3. Образует белые кристаллы, хорошо растворимые в воде. Получают действием бромоводорода на оксид или сульфид лантана.
- Гидрид лантана (III) — бинарное соединение, формула LaH3. Представляет собой тёмно-синее кристаллическое вещество; реагирует с водой с образованием гидроксида лантана. Получается действием водорода на лантан при 210—290 °С.
- Гидроксид лантана (III) — белое нерастворимое в воде вещество с формулой La(OH)3. Образуется при действии горячей воды на металлический лантан или на оксид. При температурах выше 300 °С — разлагается.
- Йодид лантана (III) — бинарное соединение, формула LaI3. Образует кристаллы жёлто-зелёного цвета, хорошо растворимые в воде и органических растворителях. Получают нагреванием лантана и йода в инертной атмосфере.
- Карбид лантана (III) — бинарное соединение лантана с углеродом, формула LaС2. Образует жёлтые кристаллы. Реагирует с водой с образованием гидроксида и с выделением этана и ацетилена.
- Карбонат лантана (III) — бесцветное кристаллическое вещество с формулой La2(CO3)2, образует кристаллогидрат состава La2(CO3)2·8H2O. Получается пропусканием углекислого газа через суспензию гидроксида лантана.
- Купферонат лантана — органическое вещество, хелат, формула [La6H5N(NO)O>3]. Образует жёлтые кристаллы. Получается реакцией хлорида лантана с раствором купферона в кислой среде.
- Нитрат лантана (III) — бесцветное кристаллическое вещество с формулой La(NO3)3; хорошо растворяется в воде и органических растворителях. Получается растворением лантана, его оксида или гидроксида в азотной кислоте.
- Оксалат лантана (III) — бесцветное вещество, формула La2(C2O4)3. Не растворяется в воде. Получается действием на растворимые соли лантана избытком щавелевой кислоты.
- Оксид лантана (III) — белые кристаллы, формула La2O3. Не растворяется в воде, но медленно реагирует с ней. Получается сгоранием лантана на воздухе или разложением его солей при высоких температурах. Растворяется в кислотах с образованием солей La(III). На воздухе поглощает углекислый газ, постепенно превращаясь в основной карбонат лантана.
- Оксисульфид лантана — желтовато-белые гексагональные кристаллы с формулой La2O2S.
- Оксифторид лантана (III) — бесцветные кристаллы кубической сингонии, формула LaOF. Получают взаимодействием фторида лантана с водяными парами при 800 °С или спеканием оксида лантана с фторидом лантана в вакууме.
- Силицид лантана (III) — бинарное неорганическое соединение, формула LaSi2. Образует серые кристаллы.
- Сульфат лантана (III) — бесцветные кристаллы, растворимые в воде, формула La2(SO4)3. Получается растворением металлического лантана, его оксида или гидроксида в серной кислоте. Разлагается при нагревании.
- Сульфиды лантана — бинарные неорганические соединения лантана и серы. Сульфид лантана (III) имеет формулу La2S3; образует жёлто-красные кристаллы, нерастворимые в воде. Получается действием паров серы на лантан при 600—800 °С. Моносульфид лантана LaS — образует золотистые кристаллы кубической сингонии. Дисульфид лантана LaS2 — коричневые кристаллы.
- Фосфат лантана (III) — бесцветные кристаллы, плохо растворимые в воде, формула LaPO4. Получается обменной реакцией между растворимой солью лантана и фосфатом щелочного металла.
- Фосфид лантана (III) — бинарное неорганическое соединение, чёрные кристаллы с формулой LaP. Получается реакцией лантана и фосфора при 400—500 °С.
- Фторид лантана (III) — бесцветное вещество с формулой LaF3. Не растворяется в воде. Получают взаимодействием лантана с плавиковой кислотой либо прямым сгоранием лантана во фторе.
- Хлорид лантана (III) — бесцветное вещество с формулой LaCl3, хорошо растворимое в воде. Получается реакцией лантана с хлором или взаимодействием его с соляной кислотой.
Минералы
- Бастнезит — минерал класса фторкарбонатов, формула (Ce, La, Y)CO3F. Образует прозрачные кристаллы жёлтого, оранжевого, красного и бурого цветов. Твёрдость по Моосу — 4—4,5; удельный вес — 4,93—5,18. Может содержать от 34,7 до 45,8 % оксида лантана (III).
- Гадолинит — чёрный (чёрно-бурый) минерал с жирным стекловатым блеском, формула (Ce, La, Nd, Y)2FeBe2Si2O10. Твёрдость по шкале Мооса — 6,5-7. Удельный вес — 4-4,3. Состав непостоянен.
- Монацит — минерал класса фосфатов, формула (Ce, La, Nd, Th)[PO4]. Может иметь жёлтую, красновато-бурую, гиацинтово-красную, оливиново-зеленую окраску; цвет черты — белый (зеленовато-белый). Твёрдость по Моосу — 5—5,5; удельный вес — 4,9—5,2. Из-за высокого содержания урана и тория — радиоактивен.
- Ортит — бурый или чёрный минерал, класса силикатов. Химическая формула — (Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH). Твёрдость по Моосу — 5,5-6. Удельный вес составляет 3,3—3,8.
Применение
![Лантан]()
- Впервые в истории лантан применяли в газокалильных сетках. Австрийский химик Карл Ауэр фон Вельсбах использовал смесь, состоящую из 60 % оксида магния, 20 % оксида иттрия и 20 % оксида лантана, которая получила название Actinophor и была запатентована в 1885 году. Новый осветительный прибор («ауэровский колпачок») давал светло-зелёный свет.
![Лантан]()
![Лантан]()
- Оксид и борид лантана используются в электронно-вакуумных лампах как материал т. н. «горячего катода», то есть катода с высокой интенсивностью потока электронов. Кристаллы LaB6 применяются в источниках катодных лучей для электронных микроскопов.
- Лантан применяется как компонент сплавов никеля, магния, кобальта и др.
- Соединение состава La(Ni3.55Mn0.4Al0.3Co0.4Fe0.35) используется для анодного материала никель-металл-гидридных аккумуляторов. Оно представляет собой интерметаллид AB5-типа.
- Чистый лантан практически не используется по причине своей высокой стоимости; вместо него применяется мишметалл: сплав с содержанием лантана 20—45 %. Мишметалл является компонентом жаропрочных и коррозионностойких сплавов.
- Для производства типичного гибридного автомобиля Toyota Prius требуется 10—15 кг лантана, где он входит в состав аккумулятора.
- Карбонат лантана используется как лекарство, имеющее собственное название Fosrenol, применяющееся при гиперфосфатемии для поглощения избытка фосфатов.
- Лантан имеет свойство поглощать водород. Один объём этого вещества способен поглотить до 400 объёмов водорода в процессе обратимой адсорбции. Это свойство применяется для создания емких аккумуляторов водорода (металлогидридное хранение водорода) и в системах сохранения энергии, так как при растворении водорода в лантане выделяется теплота.
- Соли лантана и других редкоземельных элементов применяются в угольных дуговых лампах для увеличения яркости дуги. Угольные дуговые лампы были популярны в кинопроекторах. На производство последних приходится около 25 % соединений лантана, которые изначально предполагались для дуговых ламп.
- Жидким лантаном извлекают плутоний из расплавленного урана.
- Небольшая добавка лантана к стали увеличивает её пластичность и деформируемость. Добавка лантана к молибдену уменьшает его твёрдость и чувствительность к перепадам температур.
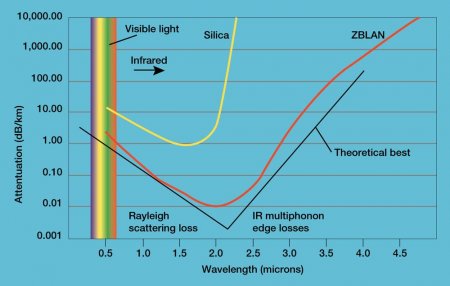
- Фторид лантана — важный компонент люминофоров. В смеси с фторидом европия он используется в кристаллической мембране ионоселективных электродов. Он также входит в состав стекла ZBLAN. Оно обладает улучшенным коэффициентом пропускания в инфракрасном диапазоне и поэтому применяется в волоконной оптике.
- Оксид лантана (III) — компонент специальных стёкол, высокотемпературной керамики, применяется также для производства других соединений лантана.
- Хлорид и бромид лантана применяются как сцинтилляторы с высоким световым выходом, лучшим энергетическим разрешением и временем высвечивания.
- Оксисульфид и алюминат лантана используются в люминофорах.
- Ионы лантана, как и пероксидаза хрена, используется в молекулярной биологии для усиления электрического сигнала до уровня, необходимого для детекции.
- Бентонитовая глина (т. н. Phoslock), в которой ионы натрия и кальция заменяются на ионы лантана, используется для очистки сточных вод от фосфатов.
- Небольшое количество соединений лантана связывает фосфаты в воде, в результате чего останавливается рост водорослей, которым необходимы соединения фосфора. Это свойство может применяться для очистки воды в бассейнах.
- Некоторые соединения лантана (и других редкоземельных элементов), например, хлориды и оксиды являются компонентами различных катализаторов, применяемых в частности, для крекинга нефти.
- Добавка оксида лантана (La2O3) к вольфраму используется при дуговой сварке вольфрамовым электродом ( англ. ) , как замена радиоактивному торию.
- Лантан-бариевый метод радиометрического датирования иногда используется для оценки возраста горных пород и месторождений полезных ископаемых.
Биологическая роль
В 1930-х годах советский учёный А. А. Дробков исследовал влияние редкоземельных металлов на культурные растения. Он проводил опыты с горохом, репой и другими растениями, вводя в грунт редкоземельные элементы (РЗЭ) вместе с бором, марганцем или без них. Результаты опытов показывали, что редкоземельные элементы, в том числе лантан, улучшают рост растений. Однако использование микроудобрений на основе лантана и других РЗЭ приводит к противоположным результатам для разных видов и даже сортов одного вида культурных растений. В Китае, являющемся ведущим мировым производителем РЗЭ, такие микроудобрения массово применяются в сельском хозяйстве.
Ионы лантана способны увеличивать амплитуду ГАМК-активированных сигналов на пирамидальных нейронах гена CA1 ( англ. ) , отмеченных в гиппокампе головного мозга. Получение этих данных позволило сравнить чувствительность рецепторов ГАМКA пирамидальных нейронов с аналогичными рецепторами других клеток по восприимчивости к ГАМК и ионам лантана.
Изотопы
В природе лантан встречается в виде смеси двух изотопов: стабильного 139 La и радиоактивного 138 La (период полураспада 1,02⋅10 11 лет). Доля более распространённого изотопа 139 La в природной смеси составляет 99,911 %. Искусственно получены 39 неустойчивых изотопов с массовыми числами 117—155 и 12 ядерных изомеров лантана. Наиболее долгоживущим из них является лантан-137 с периодом полураспада около 60 тыс. лет. Остальные изотопы имеют периоды полураспада от нескольких миллисекунд до нескольких часов.
Меры предосторожности
Лантан относится к умеренно-токсичным веществам. Металлическая пыль лантана, а также мелкие частицы его соединений могут раздражать верхние дыхательные пути при попадании их внутрь, а также вызвать пневмокониоз.
- Ацетат лантана (III) (La(CH3COO)3)
- Ацетилацетонат лантана (La(C5H7O2)3)
- Бензоилацетонат лантана (La(C10H9O2)3)
- Борид лантана (III) (LaB6)
- Бромид лантана (III) (LaBr3)
- Гидрид лантана (I) (LaH)
- Гидрид лантана (II) (LaH2)
- Гидрид лантана (III) (LaH3)
- Гидроксид лантана (III) (La(OH)3)
- Йодид лантана (III) (LaI3)
- Карбид лантана (III) (LaC2)
- Карбонат лантана (III) (La2(CO3)3)
- Купферонат лантана ([La6H5N(NO)O>3])
- Нитрат лантана (III) (La(NO3)3)
- Оксалат лантана (III) (La2(C2O4)3)
- Оксид лантана (III) (La2O3)
- Оксисульфид лантана (La2O2S)
- Оксифторид лантана (III) (LaOF)
- Силицид лантана (III) (LaSi2)
- Сульфат лантана(III) (La2(SO4)3)
- Сульфит лантана (III) (La2(SO3)3)
- Сульфид лантана (III) (La2S3)
- Сульфиды лантана
- Фосфат лантана (III) (LaPO4)
- Фосфид лантана (III) (LaP)
- Фторид лантана (III) (LaF3)
- Хлорид лантана (III) (LaCl3)
- Хромат лантана (III) (La2(CrO4)3)
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, AuЛатинские названия химических элементов (Таблица)
Таблица
МенделееваТаблица Менделеева, (или периодическая система химических элементов) - это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д.И. Менделеев. Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
![Таблица Менделеева]()
Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» - для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» - после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме - возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке - с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок - D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Читайте также: