Металл не образуется при термическом разложении
Обновлено: 17.05.2024
Тесты по химии 9 класс. Тема: "Азотная кислота"
Правильный вариант ответа отмечен знаком +
1. Из чего получают в промышленности HNO3?
+ из оксидов азота
- из солей азотной кислоты
- все ответы верные
2. NO2 - это ядовитый газ с характерным запахом … цвета.
3. HNO3 диссоциирует на ионы?
4. Чему равна степень окисления N в HNO3?
5. Под тепловым и световым воздействием HNO3 разлагается на:
6. Как называются соли HNO3?
7. В ходе химической реакции азотной кислоты с металлами не может образоваться:
8. Верно ли следующее утверждение: «Чистая HNO3 – дымящаяся жидкость без цвета и запаха»?
- без запаха, но очень быстро меняет цвет
- невозможно определить ни цвет, ни запах
9. Выберите формулу азотной кислоты:
тест 10. Какие соли называют селитрами?
11. С какими классами химических соединений взаимодействует азотная кислота?
- основными и амфотерными оксидами
- все ответы правильные
12. HNO3 является:
- электролитом средней силы
13. Выберите соль, в процессе термического разложения которой образуется N2O:
14. Имеет ли запах азотная кислота?
- только в определённых условиях
15. Окислением какого соединения в присутствии катализатора платины получают в промышленности азотную кислоту?
16. Какие вещества добавляют к образцу для обнаружения в нём нитратов?
+ медь и концентрированную серную кислоту
- медь и концентрированную азотную кислоту
- медь и разбавленную азотную кислоту
- медь и разбавленную серную кислоту
17. Верно ли утверждение: «концентрированная HNO3 обычно имеет жёлтую окраску»?
- быстро меняет окраску
18. Что получается в процессе химического взаимодействия между гидроксидом железа (III) и азотной кислотой?
19. Соль, при термическом разложении которой образуется свободный металл, называется:
тест-20. Чем является азотная кислота?
- и окислителем, и восстановителем одновременно
21. С какими металлами реагирует концентрированная HNO3?
22. Насколько справедливо следующее убеждение: «Au, Pt, Os реагируют с HNO3»?
- реагируют только Pt и Os
- все вещества реагируют
- реагируют только Au и Pt
+ ни одно вещество не реагирует
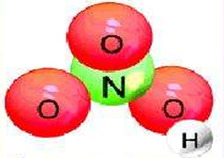
23. Строение какой кислоты изображено на рисунке?
24. Какое соединение образуется при разложении HNO3?
25. Выберите соль, при термическом разложении которой не выделяется бурый газ:
26. Раствор HNO3 не реагирует с:
27. Что происходит при взаимодействии HNO3 с металлами?
- нет верного ответа
28. HNO3 является кислотой:
29. Нитрат не образуется при взаимодействии HNO3 с:
- оксидом меди (II)
+ оксидом серы (IV)
- оксидом железа (III)
тест_30. Какого соединения не хватает в цепочке (см. рис.) поэтапной добычи азотной кислоты промышленным способом?
Готовимся к углубленному изучению химии
В отличие от других элементов азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4, N2O5. Все оксиды азота термодинамически неустойчивы к распаду на простые вещества, однако при 700 °С реакция разложения оксидов кинетически заторможена. Рассмотрим свойства оксидов.
Молекула N2O линейная, малополярная, её строение описывается при помощи двух резонансных структур. Связь между атомами азота равна 0,113 нм, она сравнима с длиной тройной связи.
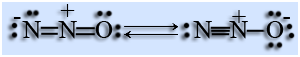
При комнатной температуре оксид азота (I) N2O – бесцветный газ, без запаха, сладковатый на вкус, растворим в воде, при 0 °С 1 объем газа растворяется в 1 объеме воды. Температура плавления -91 °С, температура кипения -89 °С. При вдыхании вызывает судорожный смех, поэтому имеет название «веселящий газ».
Оксид азота (I) не взаимодействует с водой. Несолеобразующий оксид. Проявляет окислительные свойства, в нем, как и в кислороде, вспыхивает тлеющая лучина и ярко горит сера.
нагревание нужно проводить очень осторожно, перегрев и использование больших количеств нитрата может привести к взрыву.
Молекула NO малополярная, линейная, длина связи составляет 0,115 нм, её строение описывается двумя резонансными структурами, обе формы имеют один неспаренный электрон, поэтому молекула является радикалом, но при обычных условиях не склонна к димеризации.

При комнатной температуре оксид азота (II) NO – бесцветный газ, без вкуса и запаха. Растворим в воде, при 0 °С 5 мл газа растворяется в 100 мл воды. Температура плавления -164,4 °С, температура кипения -152,2 °С.
Оксид азота (II) не взаимодействует с водой. Несолеобразующий оксид. Проявляет восстановительные свойства.
В промышленности получают каталитическим окислением аммиака на платино-родиевом катализаторе при 700 °С:
Молекула N2O3 плоская и состоит из фрагментов ON – NO2 c непрочной связью N – N. У атома азота имеется неподеленная пара электронов. Твердый оксид азота (III) – ионное соединение.
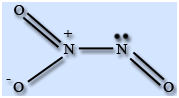
Оксид азота (III) N2O3 – крайне неустойчивое соединение и существует только при низких температурах, выше 0 °С оно разлагается. Температура плавления -100 °С, температура кипения -40 °С. В твердом и жидком состоянии окрашен в синий цвет.
Оксид азота (III) – типичный кислотный оксид, взаимодействует с водой с образованием азотистой кислоты:
Оксид азота (IV) в широком интервале температур существует в виде равновесной смеси мономера NO2 и димера N2O4.
Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp 2 -гибридизации, длина связи N – O равна 0,119 нм, что соответствует полуторной связи.
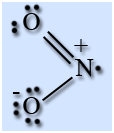
На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N2O4. Молекула N2O4 плоская и состоит из фрагментов2ON – NO2 c непрочной связью N – N.
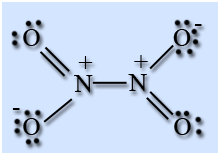
Оксид азота (IV) NO2 – бурый газ, с резким удушливым запахом, ядовит, N2O4 – бесцветен. Твердый оксид азота (IV) бесцветен и состоит только из молекул N2O4. При его нагревании до температуры плавления -12,8 °С появляется бурая окраска, которая усиливается при повышении температуры и увеличения доли мономера в смеси. Температура кипения 21,5 °С.
Оксид азота (V) – ангидрид азотной кислоты, построен из ионов NO2 + и NO3 - , в газовой фазе и растворе состоит из молекул N2O5.
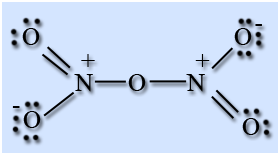
Азотный ангидрид – бесцветные гигроскопичные кристаллы, температура сублимации 32,3 °С. Неустойчив и в течение нескольких часов распадается, при нагревании – со взрывом.
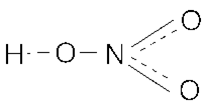
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV .
Азотная кислота HNO 3 в чистом виде - бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см 3 . В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением N О2 и за c чет этого приобретает светло-бурый цвет:
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Металл не образуется при термическом разложении
Реакции разложения

При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Разложение перманганата калия
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
Читайте также:
