Металл под номером 57
Обновлено: 16.05.2024
Редкоземе́льные элеме́нты — группа из 17 элементов, включающая лантан, скандий, иттрий и лантаноиды. Все эти элементы — металлы серебристо-белого цвета, при том все имеют сходные химические свойства (наиболее характерна степень окисления +3).
Содержание
Происхождение названия
Название «редкоземельные» (встречается сокращение TR, ср. лат. terrae rarae — «редкие земли») дано в связи с тем, что они, во-первых, сравнительно редко встречаются в земной коре (содержание (1,6-1,7)·10 −2 % по массе) и, во-вторых, образуют тугоплавкие, практически не растворимые в воде оксиды (такие оксиды в начале XIX века и ранее назывались «землями»).
Название «редкоземельные элементы» исторически сложилось в конце XVIII — начале XIX века, когда ошибочно считали, что минералы, содержащие элементы двух подсемейств, — цериевого (лёгкие — La, Се, Рг, Nd, Sm, Eu) и иттриевого (тяжёлые — Y, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu) — редко встречаются в земной коре. Однако по запасам сырья редкоземельные элементы не являются редкими, по суммарной распространенности они превосходят свинец в 10 раз, молибден — в 50 раз, вольфрам — в 165 раз.
История
В 1794 году финский химик Юхан Гадолин, исследуя рудные образцы вблизи шведского местечка Иттербю, обнаружил неизвестную до того «редкую землю», которую назвал по месту находки иттрий. Позже, немецкий химик Мартин Клапрот разделил эти образцы на две «земли», для одной из которых он оставил имя иттрий, а другую назвал церий (в честь недавно открытой малой планеты Церера и по имени древнеримской богини Цереры). Немного спустя шведский ученый К. Мосандер сумел выделить из того же образца еще несколько «земель». Все они оказались оксидами новых элементов, получивших название редкоземельные металлы. Совместно к 1907 году химики обнаружили и идентифицировали всего 14 таких элементов. На основе изучения рентгеновских свойств всем элементам были присвоены атомные номера от 57 (лантан) до 71 (лютеций), кроме 61. По возрастанию атомного веса они расположились следующим образом:
| Z | Имя | Этимология | |
|---|---|---|---|
| 57 | La | Лантан | от греч. «скрытный» |
| 58 | Ce | Церий | в честь Цереры |
| 59 | Pr | Празеодим | от греч. «зеленый близнец», из-за зеленой линии в спектре |
| 60 | Nd | Неодим | «новый близнец» |
| 61 | Pm | Прометий | от имени мифического героя Прометея, похитившего у Зевса огонь и передавшего его людям. |
| 62 | Sm | Самарий | по имени минерала самарскит, в котором был обнаружен |
| 63 | Eu | Европий | в честь Европы |
| 64 | Gd | Гадолиний | в честь Иохана Гадолина |
| 65 | Tb | Тербий | в честь Иттербийского месторождения |
| 66 | Dy | Диспрозий | от греч. «труднодоступный» |
| 67 | Ho | Гольмий | в честь Стокгольма |
| 68 | Er | Эрбий | в честь Шведского села Иттербю |
| 69 | Tm | Тулий | от старого названия Скандинавии |
| 70 | Yb | Иттербий | в честь Шведского города Иттерби |
| 71 | Lu | Лютеций | от древнеримского названия Парижа |
Вначале ячейка под номером 61 была незаполненной, в дальнейшем это место занял прометий, выделенный из продуктов деления урана и ставший 15-м членом этого семейства.
Свойства и получение


Оксиды редкоземельных элементов. По часовой стрелке от центрального первого: празеодим, церий, лантан, неодим, самарий, гадолиний
Редкоземельные элементы проявляют между собой большое сходство химических и некоторых физических свойств, что объясняется почти одинаковым строением наружных электронных уровней их атомов. Редкоземельные элементы — металлы, их получают восстановлением соответствующих оксидов, фторидов, электролизом безводных солей и другими методами.
Химические свойства
Скандий, иттрий и лантаноиды имеют высокую реакционную способность. Химическая активность этих элементов особенно заметна при повышенных температурах. При нагревании до 300—400 °C металлы реагируют даже с водородом, образуя RH3 и RH2 (символ R выражает атом редкоземельного элемента). Эти соединения достаточно прочные и имеют солевой характер. При нагревании в кислороде металлы легко реагируют с ним, образуя оксиды: R2O3, CeO2, Pr6O11, Tb4O7 (лишь только Sc и Y при помощи образования защитной оксидной плёнки являются стойкими на воздухе, даже при нагревании до 1000 °C). Во время горения данных металлов в атмосфере кислорода выделяется большое количество тепла. При сгорании 1 г лантана выделяется 224,2 ккал тепла. Для церия характерной особенностью является свойство пирофорности — способность искриться при разрезании металла на воздухе.

Лантан, церий и другие металлы уже при обычной температуре реагируют с водой и кислотами-неокислителями, выделяя водород. Из-за высокой активности к атмосферному кислороду и воде куски лантана, церия, иттрия и др. следует хранить в парафине.
Химическая активность редкоземельных металлов неодинакова. От скандия до лантана химическая активность возрастает, а в ряду лантан — лютеций — снижается. Отсюда следует, что наиболее активным металлом является лантан. Это обуславливается уменьшением радиусов атомов элементов от лантана до лютеция с одной стороны, и от лантана до скандия — с другого.
Эффект «лантаноидной контракции» (сжатия) приводит к тому, что следующие после лантаноидов элементы (гафний, тантал, вольфрам, рений, осмий, иридий, платина) имеют уменьшенные радиусы атомов на 0,2—0,3 Å отсюда и очень схожие их свойства со свойствами соответствующих элементов пятого периода.
В элементах — скандий, иттрий, лантан — d-оболочка предпоследнего электронного слоя только начинает образовываться, поэтому радиусы атомов и активность металлов в этой группе возрастают сверху вниз. Этим свойством группа отличается от других побочных подгрупп металлов, у которых порядок изменения активности противоположный.
Поскольку радиус атома иттрия (0,89 Å) близок к радиусу атома гольмия (0,894 Å), то по активности этот металл должен занимать одно из предпоследних мест. Скандий же из-за своей активности должен располагаться после лютеция. В этом ряду ослабляется действие металлов на воду.
Редкоземельные элементы чаще всего проявляют степень окисления +3. Из-за этого наиболее характерными являются оксиды R2O3 — твёрдые, крепкие и тугоплавкие соединения. Будучи основными оксидами, они для большинства элементов способны соединяться с водой и создавать основания — R(OH)3. Гидроксиды редкоземельных металлов малорастворимы в воде. Способность R2O3 соединяться с водой, основная функция, то есть и растворимость R(OH)3 уменьшаются в той же последовательности, что и активность металлов: Lu(OH)3, а особенно Sc(OH)3, проявляют некоторые свойства амфотерности. Так, кроме раствора Sc(OH)3 в концентрированном NaOH, получена соль: Na3Sc(OH)6·2H2O.
Поскольку металлы данной подгруппы активны, а их соли сильных кислот растворимы, они легко растворяются в кислотах-неокислителях и кислотах-окислителях.
Все редкоземельные металлы энергично реагируют с галогенами, создавая RHal3 (Hal — галоген). С серой и селеном они также реагируют, но при нагревании.
Нахождение в природе
Как правило, редкоземельные элементы встречаются в природе совместно. Они образуют весьма прочные окислы, галоидные соединения, сульфиды. Для лантаноидов наиболее характерны соединения трёхвалентных элементов. Исключение составляет церий, легко переходящий в четырёхвалентное состояние. Кроме церия четырёхвалентные соединения образуют празеодим и тербий. Двухвалентные соединения известны у самария, европия и иттербия. По физико-химическим свойствам лантаноиды весьма близки между собой. Это объясняется особенностью строения их электронных оболочек.
Суммарное содержание редкоземельных элементов составляет более 100 г/т. Известно более 250 минералов, содержащих редкоземельные элементы. Однако к собственно редкоземельным минералам могут быть отнесены только 60 — 65 минералов, в которых содержание Ме2О3 превышает 5 — 8 %. Главнейшие минералы редких земель — монацит (Ce, La)PO4, ксенотим YPO4, бастнезит Ce[CO3](OH, F), паризит Ca(Ce, La)2[CO3]3F2, гадолинит Y2FeBe2Si2O10, ортит (Ca, Ce)2(Al, Fe)3Si3O12(O, OH), лопарит (Na, Ca, Ce)(Ti, Nb)O3, эшинит (Ce, Ca, Th)(Ti, Nb)2O6. Наиболее распространён в земной коре церий, наименее — тулий и лютеций.
Несмотря на неограниченный изоморфизм, в группе редких земель в определённых геологических условиях возможна раздельная концентрация редких земель иттриевой и цериевой подгрупп. Например, с щелочными породами и связанными с ними постмагматическими продуктами преимущественное развитие получает цериевая подгруппа, а с постмагматическими продуктами гранитоидов с повышенной щёлочностью — иттриевая. Большинство фторкарбонатов обогащено элементами цериевой подгруппы. Многие тантало-ниобаты содержат иттриевую подгруппу, а титанаты и титано-тантало-ниобаты — цериевую. Некоторая дифференциация редких земель отмечается и в экзогенных условиях. Изоморфное замещение редких земель между собой, несмотря на разницу в их порядковых номерах, обусловлено явлениями «лантаноидного сжатия»: с увеличением порядкового номера происходит достройка внутренних, а не внешних электронных орбит, в результате чего объём ионов не увеличивается.
Селективное накопление редкоземельных элементов в минералах и горных породах может быть обусловлено различиями в их радиусах ионов. Дело в том, что радиусы ионов лантаноидов закономерно уменьшаются от лантана к лютецию. Вследствие этого возможно преимущественное изоморфное замещение в зависимости от степени различия в размерах замещённых ионов редкоземельных элементов. Так, в скандиевых, циркониевых и марганцевых минералах могут присутствовать только редкие земли ряда лютеций — диспрозий; в урановых минералах преимущественно накапливаются минералы средней части ряда (иттрий, диспрозий, гадолиний); в ториевых минералах должны концентрироваться элементы цериевой группы; в состав стронциевых и бариевых минералов могут входить только элементы ряда европий — лантан.
Производство
В 2007—2008 гг. в мире добывалось по 124 тыс. т редкоземельных элементов. Причем лидировали следующие страны Китай (120,00 тыс. т), Индия (2,70 тыс. т), Бразилия (0,65 тыс. т). Данные по СНГ, США и Австралии на 2008 год неизвестны. На конец 2008 года данные по запасам следующие: Китай (89 000 тыс. т), СНГ (21 000 тыс. т), США (14 000 тыс. т), Австралия (5 800 тыс. т), Индия (1 300 тыс. т), Бразилия (84 тыс. т). [1]
В июле 2011 года исследовательская группа из Японии обнаружила на дне Тихого океана обширные залежи редкоземельных материалов. Находка подтверждена образцами грунта, извлеченными со дна на глубинах от 3500 до 6000 м в 78 местах. Залежи располагаются в международных водах и тянутся к западу и востоку от Гавайев, а также к востоку от Таити и Французской Полинезии. По оценкам специалистов, найденные залежи содержат от 80 до 100 млрд метрических тонн редкоземельных материалов, что значительно больше текущих глобальных запасов на уровне 100 млн тонн [2] .
Применение
Редкоземельные элементы используют в различных отраслях техники: в радиоэлектронике, приборостроении, атомной технике, машиностроении, химической промышленности, в металлургии и др. Широко применяют La, Ce, Nd, Pr в стекольной промышленности в виде оксидов и других соединений. Эти элементы повышают светопрозрачность стекла. Редкоземельные элементы входят в состав стекол специального назначения, пропускающих инфракрасные лучи и поглощающих ультрафиолетовые лучи, кислотно- и жаростойких стекол. Большое значение получили редкоземельные элементы и их соединения в химической промышленности, например, в производстве пигментов, лаков и красок, в нефтяной промышленности как катализаторы. Редкоземельные элементы применяют в производстве некоторых взрывчатых веществ, специальных сталей и сплавов, как газопоглотители. Монокристаллические соединения редкоземельных элементов (а также стёкла) применяют для создания лазерных и других оптически активных и нелинейных элементов в оптоэлектронике. На основе Nd, Y, Sm, Er, Eu с Fe-B получают сплавы с рекордными магнитными свойствами (высокие намагничивающая и коэрцитивная силы) для создания постоянных магнитов огромной мощности, по сравнению с простыми ферросплавами.
Лантан

Мягкий, ковкий, вязкий металл серебристо-белого цвета
Лантан / Lanthanum (La), 57
1,10 (шкала Полинга)
Ланта́н — элемент побочной подгруппы третьей группы шестого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 57. Обозначается символом La (лат. Lanthanum ). Простое вещество лантан (CAS-номер: 7439-91-0) — металл серебристо-белого цвета. Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой, β-La с кубической решёткой типа меди, γ-La с кубической объёмноцентрированной решёткой типа α-Fe, температуры переходов α↔β 277 °C и β↔γ 861 °C [1] .
Лантан, как химический элемент, не удавалось открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб Берцелиус исследовал минерал, известный теперь под названием церита. В этом минерале была обнаружена иттриевая земля и ещё одна редкая земля, очень похожая на иттриевую. Её назвали цериевой. В 1826 г. Карл Мозандер исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится ещё один новый элемент. Доказать сложность цериевой земли Мозандеру удалось лишь в 1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Оно было дано в честь истории его открытия и происходит от др.-греч. λανθάνω — «скрываюсь», «таюсь».
Содержание в земной коре порядка 18 — 30 г/т, в воде океанов 0,012 мкг/л [2] .
Месторождения
Получение
Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом и неодимом. Сначала из смеси отделяют церий, затем оставшиеся элементы разделяют экстракцией.
Стоимость
Цены на металлический лантан чистотой 99-99,9 составляют около 2 — 4 долл за 1 г.
Производство стекла
Оксид лантана (от 5 до 40 %) применяется для варки оптического стекла (лантановое стекло), для изготовления линз и призм используемых в кино и фотоаппаратуре, а также для астрономических целей.
Производство керамических электронагревателей
Хромит лантана, легированный кальцием, стронцием, магнием, используется для производства высокотемпературных печных нагревателей (температура плавления ― 2453 °C, раб.темп. — около 1780 градусов в атмосфере кислорода). С ростом температуры электрическое сопротивление хромита лантана резко уменьшается. Коэффициент термического расширения хромита лантана очень низкий и это предопределяет долговечность электронагревателей.
Высокотемпературная сверхпроводимость
Оксид лантана применяется для синтеза высокотемпературных сверхпроводников на основе оксидов лантана, иттрия, бария, стронция, меди и др.
Металлотермия
Изредка лантан применяют в металлотермии для восстановления редких элементов.
Специальные покрытия стекла
На основе соединений лантана производятся покрытия для оконного стекла позволяющие понижать температуру в помещении на 5-7 градусов.
Термоэлектрические материалы
Монотеллурид лантана имеет очень высокую термо-э.д.с (834 мкВ/К) и применяется в термоэлектрогенераторах с высоким кпд.
Производство металлогидридных накопителей водорода
Лантан-никелевый гидрид широко употребляется как емкий аккумулятор водорода (металлогидридное хранение водорода) для автомобилей.
Ядерная энергетика
Важное значение металлический лантан высокой чистоты имеет в атомной промышленности, и конкретно, в технологии переработки ядерного топлива с целью извлечения плутония. В расплавленный металлический уран, имеющий в качестве примеси металлический плутоний, добавляют расплавленный лантан. Расплавленный лантан полностью извлекает изотопы плутония из урана и всплывает над ним, не смешиваясь с ураном. Полученный сплав сливают и перерабатывают методами химической технологии.
На текущий момент данный способ не используется. Последний плутониевый (промышленный) реактор был закрыт в Железногорске в 2010—2011 гг. Для извлечения плутония использовался экстракционный передел.
Электроника
В последние годы [когда?] в значительной степени возрос интерес к молибдату лантана, обладающему высокой проводимостью.
Электронная микроскопия
Применение катодов из LaB6 (Гексаборид лантана) в электронных микроскопах позволило повысить разрешающую способность за счёт увеличения плотности тока в 6 раз и одновременно увеличить ресурс катода в 5 раз (до 500 часов) по сравнению с вольфрамовыми катодами.
Химические источники тока
Весьма значительный интерес промышленности и электроники вызывают производство и исследования в области аккумуляторов с твёрдым электролитом. В этой области очень большое значение приобрёл фторид лантана в качестве электролита и с металлическим лантаном в качестве анода, катодом обычно является фторид висмута, свинца или меди. Привлекательная сторона таких источников тока — это очень высокая удельная энергоёмкость по объёму (3000 Вт·ч/дм³, практически достигнутая — 1500—2300 Вт·ч/дм³), длительный срок сохранности энергии, прочность, долговечность; в этой связи многие ведущие специалисты [кто?] видят в них альтернативу любым другим видам аккумуляторов.
Биологическая роль
В середине 30-х годов советский ученый А. А. Дробков исследовал влияние редкоземельных металлов на разные растения. Он экспериментировал с горохом, репой и другими культурами, вводил редкоземельные металлы вместе с бором, марганцем или без них. Результаты опытов говорили, что редкоземельные металлы нужны для нормального развития растений… Но прошла четверть века, прежде чем эти элементы стали относительно доступны. Окончательный ответ на вопрос о биологической роли лантана предстоит ещё дать. [источник не указан 307 дней]
В медицине карбонат лантана используется при гиперфосфатемии как препарат, препятствующий всасыванию фосфатов из пищи.
Изотопы
В природе лантан встречается в виде смеси двух изотопов: стабильного 139 La и радиоактивного 138 La (период полураспада 2·10 11 лет). Доля наиболее распространённого изотопа 139 La в смеси составляет 99,911 % [3] . Искусственно получены 39 неустойчивых изотопов с массовыми числами 117—155 и 12 ядерных изомеров лантана [4] [5] . Наиболее устойчивым из них является лантан-137 с периодом полураспада около 60 тыс. лет. Остальные изотопы имеют периоды полураспада от нескольких миллисекунд до нескольких часов.
См. также
- — сплав лантана с другими редкоземельными элементами.
Примечания
- ↑ 12 Химическая энциклопедия: в 5-ти тт. / Редкол.:Кнунянц И. Л. (гл. ред.). — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 577. — 671 с. — 100 000 экз.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- ↑Статья в Большой Химической Энциклопедии
- ↑ Данные приведены по G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ Данные приведены по G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
Ссылки
- Химические элементы
- Соединения лантана
- Лантаноиды
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Лантан" в других словарях:
ЛАНТАН — (лат., от греч. lanthano быть скрытым, спрятанным). Металл, открытый в 1840 г. Мозандером в церите. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЛАНТАН лат., от греч. lanthano, быть скрытым, спрятанным. Металл,… … Словарь иностранных слов русского языка
ЛАНТАН — (лат. Lanthanum) La, химический элемент III группы периодической системы, атомный номер 57, атомная масса 138,9055, относится к редкоземельным элементам. Назван от греческого lanthano скрываюсь, в связи с трудностями получения. Металл. Плотность… … Большой Энциклопедический словарь
ЛАНТАН — (символ La), серебристо белый металлический элемент группы ЛАНТАНИДЛОВ, впервые обнаружен в 1839 г. Основные руды, в которых он содержится, это монациты и бастнезиты. Мягкий, ковкий и вязкий, лантан применяется как КАТАЛИЗАТОР при КРЕКИНГЕ… … Научно-технический энциклопедический словарь
ЛАНТАН — (Lanthanum), La, химический элемент III группы периодической системы, атомный номер 57, атомная масса 138,9055; относится к редкоземельным элементам; металл. Открыт шведским химиком К. Мосандером в 1839 … Современная энциклопедия
Лантан — La (от греч. lanthano скрываюсь * a. lanthanum; н. Lanthan; ф. lanthane; и. lantano), хим. элемент III группы периодич. системы Менделеева, относится к редкоземельным элементам, ат. н. 57, ат. м. 138,9. Природный Л. состоит из двух… … Геологическая энциклопедия
ЛАНТАН — (Lanthanum), La, хим. элемент III группы периодич. системы элементов, ат. номер 57, ат. масса 138,9055, относится к редкоземельным элементам. Природный Л. состоит из смеси стабильного 139La (99,911%) и слаборадиоактивного 138La распад и К захват … Физическая энциклопедия
лантан — сущ., кол во синонимов: 2 • металл (86) • элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Лантан — (хим.) один из металлов церитовой группы , по способунахождения в природе; по химическим отношениям, по способностиобразовать La2H3 его должно отнести к более основной подгруппе 3 йгруппы периодической системы (La=138,2, Б. Браунер),… … Энциклопедия Брокгауза и Ефрона
лантанід — іменник чоловічого роду … Орфографічний словник української мови
ЛАНТАН — хим. элемент, символ La (лат. Lanthanum), ат. н. 57, ат. м. 138,90; ковкий и тягучий серебристо белый металл, плотность 6170 кг/м3, tпл = 920°С. Л. применяют в производстве оптических стёкол, как лазерные материалы, в керамических… … Большая политехническая энциклопедия
Список химических элементов по атомным номерам
Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в Периодической системе, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
Аббревиатуры
- GSI, Gesellschaft für Schwerionenforschung (Общество исследования тяжёлых ионов), Вихаузен, Дармштадт, Германия
- ОИЯИ, Объединённый институт ядерных исследований), Дубна, Московская область, Россия( == JINR, (Joint Institute for Nuclear Research,)
- LLNL, Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э.Лоуренса), Ливермор, Калифорния, США
- LBNL, Lawrence Berkeley National Laboratory, Беркли, Калифорния, США
- ↑ Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ Данный элемент не имеет стабильных изотопов, и значение в скобках, например [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source. (2005). . Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
Смотреть что такое "Список химических элементов по атомным номерам" в других словарях:
Список химических элементов по символам — См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
Алфавитный список химических элементов — См. также: Список химических элементов по атомным номерам и Список химических элементов по символам Алфавитный список химических элементов. Азот N Актиний Ac Алюминий Al Америций Am Аргон Ar Астат At … Википедия
Периодическая законность химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая таблица химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
ПСХЭ — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Переодичная система — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система — химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским… … Википедия
Периодическая система Менделеева — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая таблица — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия

Лантан — химический элемент 3-й группы (по устаревшей классификации — побочной подгруппы третьей группы) шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 57, атомная масса — 138,9055. Обозначается символом La (лат. Lanthanum ). Простое вещество лантан — блестящий металл серебристо-белого цвета, относится к редкоземельным элементам.
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства
- 6.1 Основные соединения
- 6.2 Минералы
Лантан как химический элемент не удавалось открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб Берцелиус исследовал минерал, известный теперь под названием церит. В этом минерале была обнаружена иттриевая земля и ещё одна редкая земля, очень похожая на иттриевую. Её назвали цериевой. В 1826 г. Карл Мозандер исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится ещё один новый элемент. Доказать сложность цериевой земли Мозандеру удалось лишь в 1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Содержание лантана в земной коре порядка 2,9·10 −3 % по массе, в морской воде — около 2,9·10 −6 мг/л. Основные промышленные минералы лантана — монацит, бастнезит, апатит и лопарит. В состав этих минералов также входят другие редкоземельные элементы.
Физические свойства
Лантан — блестящий серебристо-белый металл, в чистом состоянии — ковкий и тягучий. Слабо парамагнитен. Кристаллическая структура плотноупакованная типа плотнейшей гексагональной упаковки.
Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой (а=0,3772 нм, с=1,2144 нм, z=4, пространственная группа Р63/ттс), β-La с кубической решёткой типа меди (а=0,5296 нм, z=4, пространственная группа Fm3m), γ-La с кубической объёмноцентрированной решёткой типа α-Fe (а=0,426 нм, z=2, пространственная группа Im3m, устойчив до 920 °C) температуры переходов α↔β 277 °C и β↔γ 861 °C. DH° полиморфных переходов: α:β — 0,36 кДж/моль, β:γ — 3,12 кДж/моль. При переходе из одной модификации в другую меняется плотность лантана: α-La имеет плотность 6,162-6,18 г/см 3 , β-La — 6,19 г/см 3 , γ-La — 5,97 г/см 3 .
Сплавляется с цинком, магнием, кальцием, таллием, оловом, свинцом, никелем, кобальтом, марганцем, ртутью, серебром, алюминием, медью и кадмием. С железом лантан образует пирофорный сплав.
Химические свойства
По своим химическим свойствам лантан больше всего похож на 14 следующих за ним элементов, поэтому их называют лантаноидами. Металлический лантан обладает высокой химической активностью.
- Во влажном воздухе быстро превращается в основный карбонат лантана:
- При 450 °С сгорает в кислороде с образованием оксида лантана(III):
- Медленно реагирует с холодной водой и быстро — с горячей, образуя гидроксид лантана (III):
- При нагревании лантан вступает в реакции со фтором, хлором, бромом и йодом, давая соответственно фторид, хлорид, бромид и йодид:
- Легко взаимодействует с минеральными кислотами с образованием ионов La 3+ и водорода. Вполне возможно, что в водном растворе ион La 3+ в значительной степени существует как комплексный ион [La(OH2)9] 3+ :
Основные соединения
- Ацетилацетонат лантана — органическое соединение, хелат, формула La(C5H7O2)3. Представляет собой бесцветное твёрдое вещество, хорошо растворимое в воде и органических растворителях. Получается реакцией солей лантана со спиртовым раствором ацетилацетона.
- Бензоилацетонат лантана — хелатное соединение лантана, формула La(C10H9O2)3. Образует жёлтые призматические кристаллы. Получается взаимодействием солей лантана со спиртовым раствором бензоилацетона.
- Бромид лантана (III) — бинарное соединение, формула LaBr3. Образует белые кристаллы, хорошо растворимые в воде. Получают действием бромоводорода на оксид или сульфид лантана.
- Гидрид лантана (III) — бинарное соединение, формула LaH3. Представляет собой тёмно-синее кристаллическое вещество; реагирует с водой с образованием гидроксида лантана. Получается действием водорода на лантан при 210—290 °С.
- Гидроксид лантана (III) — белое нерастворимое в воде вещество с формулой La(OH)3. Образуется при действии горячей воды на металлический лантан или на оксид. При температурах выше 300 °С — разлагается.
- Йодид лантана (III) — бинарное соединение, формула LaI3. Образует кристаллы жёлто-зелёного цвета, хорошо растворимые в воде и органических растворителях. Получают нагреванием лантана и йода в инертной атмосфере.
- Карбид лантана (III) — бинарное соединение лантана с углеродом, формула LaС2. Образует жёлтые кристаллы. Реагирует с водой с образованием гидроксида и с выделением этана и ацетилена.
- Карбонат лантана (III) — бесцветное кристаллическое вещество с формулой La2(CO3)2, образует кристаллогидрат состава La2(CO3)2·8H2O. Получается пропусканием углекислого газа через суспензию гидроксида лантана.
- Купферонат лантана — органическое вещество, хелат, формула [La6H5N(NO)O>3]. Образует жёлтые кристаллы. Получается реакцией хлорида лантана с раствором купферона в кислой среде.
- Нитрат лантана (III) — бесцветное кристаллическое вещество с формулой La(NO3)3; хорошо растворяется в воде и органических растворителях. Получается растворением лантана, его оксида или гидроксида в азотной кислоте.
- Оксалат лантана (III) — бесцветное вещество, формула La2(C2O4)3. Не растворяется в воде. Получается действием на растворимые соли лантана избытком щавелевой кислоты.
- Оксид лантана (III) — белые кристаллы, формула La2O3. Не растворяется в воде, но медленно реагирует с ней. Получается сгоранием лантана на воздухе или разложением его солей при высоких температурах. Растворяется в кислотах с образованием солей La(III). На воздухе поглощает углекислый газ, постепенно превращаясь в основной карбонат лантана.
- Оксисульфид лантана — желтовато-белые гексагональные кристаллы с формулой La2O2S.
- Оксифторид лантана (III) — бесцветные кристаллы кубической сингонии, формула LaOF. Получают взаимодействием фторида лантана с водяными парами при 800 °С или спеканием оксида лантана с фторидом лантана в вакууме.
- Силицид лантана (III) — бинарное неорганическое соединение, формула LaSi2. Образует серые кристаллы.
- Сульфат лантана (III) — бесцветные кристаллы, растворимые в воде, формула La2(SO4)3. Получается растворением металлического лантана, его оксида или гидроксида в серной кислоте. Разлагается при нагревании.
- Сульфиды лантана — бинарные неорганические соединения лантана и серы. Сульфид лантана (III) имеет формулу La2S3; образует жёлто-красные кристаллы, нерастворимые в воде. Получается действием паров серы на лантан при 600—800 °С. Моносульфид лантана LaS — образует золотистые кристаллы кубической сингонии. Дисульфид лантана LaS2 — коричневые кристаллы.
- Фосфат лантана (III) — бесцветные кристаллы, плохо растворимые в воде, формула LaPO4. Получается обменной реакцией между растворимой солью лантана и фосфатом щелочного металла.
- Фосфид лантана (III) — бинарное неорганическое соединение, чёрные кристаллы с формулой LaP. Получается реакцией лантана и фосфора при 400—500 °С.
- Фторид лантана (III) — бесцветное вещество с формулой LaF3. Не растворяется в воде. Получают взаимодействием лантана с плавиковой кислотой либо прямым сгоранием лантана во фторе.
- Хлорид лантана (III) — бесцветное вещество с формулой LaCl3, хорошо растворимое в воде. Получается реакцией лантана с хлором или взаимодействием его с соляной кислотой.
Минералы
- Бастнезит — минерал класса фторкарбонатов, формула (Ce, La, Y)CO3F. Образует прозрачные кристаллы жёлтого, оранжевого, красного и бурого цветов. Твёрдость по Моосу — 4—4,5; удельный вес — 4,93—5,18. Может содержать от 34,7 до 45,8 % оксида лантана (III).
- Гадолинит — чёрный (чёрно-бурый) минерал с жирным стекловатым блеском, формула (Ce, La, Nd, Y)2FeBe2Si2O10. Твёрдость по шкале Мооса — 6,5-7. Удельный вес — 4-4,3. Состав непостоянен.
- Монацит — минерал класса фосфатов, формула (Ce, La, Nd, Th)[PO4]. Может иметь жёлтую, красновато-бурую, гиацинтово-красную, оливиново-зеленую окраску; цвет черты — белый (зеленовато-белый). Твёрдость по Моосу — 5—5,5; удельный вес — 4,9—5,2. Из-за высокого содержания урана и тория — радиоактивен.
- Ортит — бурый или чёрный минерал, класса силикатов. Химическая формула — (Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH). Твёрдость по Моосу — 5,5-6. Удельный вес составляет 3,3—3,8.
![Лантан]()
- Впервые в истории лантан применяли в газокалильных сетках. Австрийский химик Карл Ауэр фон Вельсбах использовал смесь, состоящую из 60 % оксида магния, 20 % оксида иттрия и 20 % оксида лантана, которая получила название Actinophor и была запатентована в 1885 году. Новый осветительный прибор («ауэровский колпачок») давал светло-зелёный свет.
![Лантан]()
![Лантан]()
- Оксид и борид лантана используются в электронно-вакуумных лампах как материал т. н. «горячего катода», то есть катода с высокой интенсивностью потока электронов. Кристаллы LaB6 применяются в источниках катодных лучей для электронных микроскопов.
- Лантан применяется как компонент сплавов никеля, магния, кобальта и др.
- Соединение состава La(Ni3.55Mn0.4Al0.3Co0.4Fe0.35) используется для анодного материала никель-металл-гидридных аккумуляторов. Оно представляет собой интерметаллид AB5-типа.
- Чистый лантан практически не используется по причине своей высокой стоимости; вместо него применяется мишметалл: сплав с содержанием лантана 20—45 %. Мишметалл является компонентом жаропрочных и коррозионностойких сплавов.
- Для производства типичного гибридного автомобиля Toyota Prius требуется 10—15 кг лантана, где он входит в состав аккумулятора.
- Карбонат лантана используется как лекарство, имеющее собственное название Fosrenol, применяющееся при гиперфосфатемии для поглощения избытка фосфатов.
- Лантан имеет свойство поглощать водород. Один объём этого вещества способен поглотить до 400 объёмов водорода в процессе обратимой адсорбции. Это свойство применяется для создания емких аккумуляторов водорода (металлогидридное хранение водорода) и в системах сохранения энергии, так как при растворении водорода в лантане выделяется теплота.
- Соли лантана и других редкоземельных элементов применяются в угольных дуговых лампах для увеличения яркости дуги. Угольные дуговые лампы были популярны в кинопроекторах. На производство последних приходится около 25 % соединений лантана, которые изначально предполагались для дуговых ламп.
- Жидким лантаном извлекают плутоний из расплавленного урана.
- Небольшая добавка лантана к стали увеличивает её пластичность и деформируемость. Добавка лантана к молибдену уменьшает его твёрдость и чувствительность к перепадам температур.
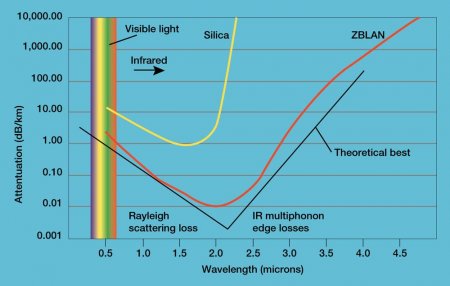
- Фторид лантана — важный компонент люминофоров. В смеси с фторидом европия он используется в кристаллической мембране ионоселективных электродов. Он также входит в состав стекла ZBLAN. Оно обладает улучшенным коэффициентом пропускания в инфракрасном диапазоне и поэтому применяется в волоконной оптике.
- Оксид лантана (III) — компонент специальных стёкол, высокотемпературной керамики, применяется также для производства других соединений лантана.
- Хлорид и бромид лантана применяются как сцинтилляторы с высоким световым выходом, лучшим энергетическим разрешением и временем высвечивания.
- Оксисульфид и алюминат лантана используются в люминофорах.
- Ионы лантана, как и пероксидаза хрена, используется в молекулярной биологии для усиления электрического сигнала до уровня, необходимого для детекции.
- Бентонитовая глина (т. н. Phoslock), в которой ионы натрия и кальция заменяются на ионы лантана, используется для очистки сточных вод от фосфатов.
- Небольшое количество соединений лантана связывает фосфаты в воде, в результате чего останавливается рост водорослей, которым необходимы соединения фосфора. Это свойство может применяться для очистки воды в бассейнах.
- Некоторые соединения лантана (и других редкоземельных элементов), например, хлориды и оксиды являются компонентами различных катализаторов, применяемых в частности, для крекинга нефти.
- Добавка оксида лантана (La2O3) к вольфраму используется при дуговой сварке вольфрамовым электродом ( англ. ) , как замена радиоактивному торию.
- Лантан-бариевый метод радиометрического датирования иногда используется для оценки возраста горных пород и месторождений полезных ископаемых.
В 1930-х годах советский учёный А. А. Дробков исследовал влияние редкоземельных металлов на культурные растения. Он проводил опыты с горохом, репой и другими растениями, вводя в грунт редкоземельные элементы (РЗЭ) вместе с бором, марганцем или без них. Результаты опытов показывали, что редкоземельные элементы, в том числе лантан, улучшают рост растений. Однако использование микроудобрений на основе лантана и других РЗЭ приводит к противоположным результатам для разных видов и даже сортов одного вида культурных растений. В Китае, являющемся ведущим мировым производителем РЗЭ, такие микроудобрения массово применяются в сельском хозяйстве.
Ионы лантана способны увеличивать амплитуду ГАМК-активированных сигналов на пирамидальных нейронах гена CA1 ( англ. ) , отмеченных в гиппокампе головного мозга. Получение этих данных позволило сравнить чувствительность рецепторов ГАМКA пирамидальных нейронов с аналогичными рецепторами других клеток по восприимчивости к ГАМК и ионам лантана.
В природе лантан встречается в виде смеси двух изотопов: стабильного 139 La и радиоактивного 138 La (период полураспада 1,02⋅10 11 лет). Доля более распространённого изотопа 139 La в природной смеси составляет 99,911 %. Искусственно получены 39 неустойчивых изотопов с массовыми числами 117—155 и 12 ядерных изомеров лантана. Наиболее долгоживущим из них является лантан-137 с периодом полураспада около 60 тыс. лет. Остальные изотопы имеют периоды полураспада от нескольких миллисекунд до нескольких часов.
Меры предосторожности
Лантан относится к умеренно-токсичным веществам. Металлическая пыль лантана, а также мелкие частицы его соединений могут раздражать верхние дыхательные пути при попадании их внутрь, а также вызвать пневмокониоз.
- Ацетат лантана (III) (La(CH3COO)3)
- Ацетилацетонат лантана (La(C5H7O2)3)
- Бензоилацетонат лантана (La(C10H9O2)3)
- Борид лантана (III) (LaB6)
- Бромид лантана (III) (LaBr3)
- Гидрид лантана (I) (LaH)
- Гидрид лантана (II) (LaH2)
- Гидрид лантана (III) (LaH3)
- Гидроксид лантана (III) (La(OH)3)
- Йодид лантана (III) (LaI3)
- Карбид лантана (III) (LaC2)
- Карбонат лантана (III) (La2(CO3)3)
- Купферонат лантана ([La6H5N(NO)O>3])
- Нитрат лантана (III) (La(NO3)3)
- Оксалат лантана (III) (La2(C2O4)3)
- Оксид лантана (III) (La2O3)
- Оксисульфид лантана (La2O2S)
- Оксифторид лантана (III) (LaOF)
- Силицид лантана (III) (LaSi2)
- Сульфат лантана(III) (La2(SO4)3)
- Сульфит лантана (III) (La2(SO3)3)
- Сульфид лантана (III) (La2S3)
- Сульфиды лантана
- Фосфат лантана (III) (LaPO4)
- Фосфид лантана (III) (LaP)
- Фторид лантана (III) (LaF3)
- Хлорид лантана (III) (LaCl3)
- Хромат лантана (III) (La2(CrO4)3)
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, AuЧитайте также: