Металлическая кристаллическая решетка это
Обновлено: 21.09.2024
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом .
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости .
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом .
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 о С она замерзает – переходит из жидкого состояния в твердое, и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным . Примеры аморфных веществ – уголь, слюдяное стекло.

Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом , а саму структуру – кристаллической решеткой . Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
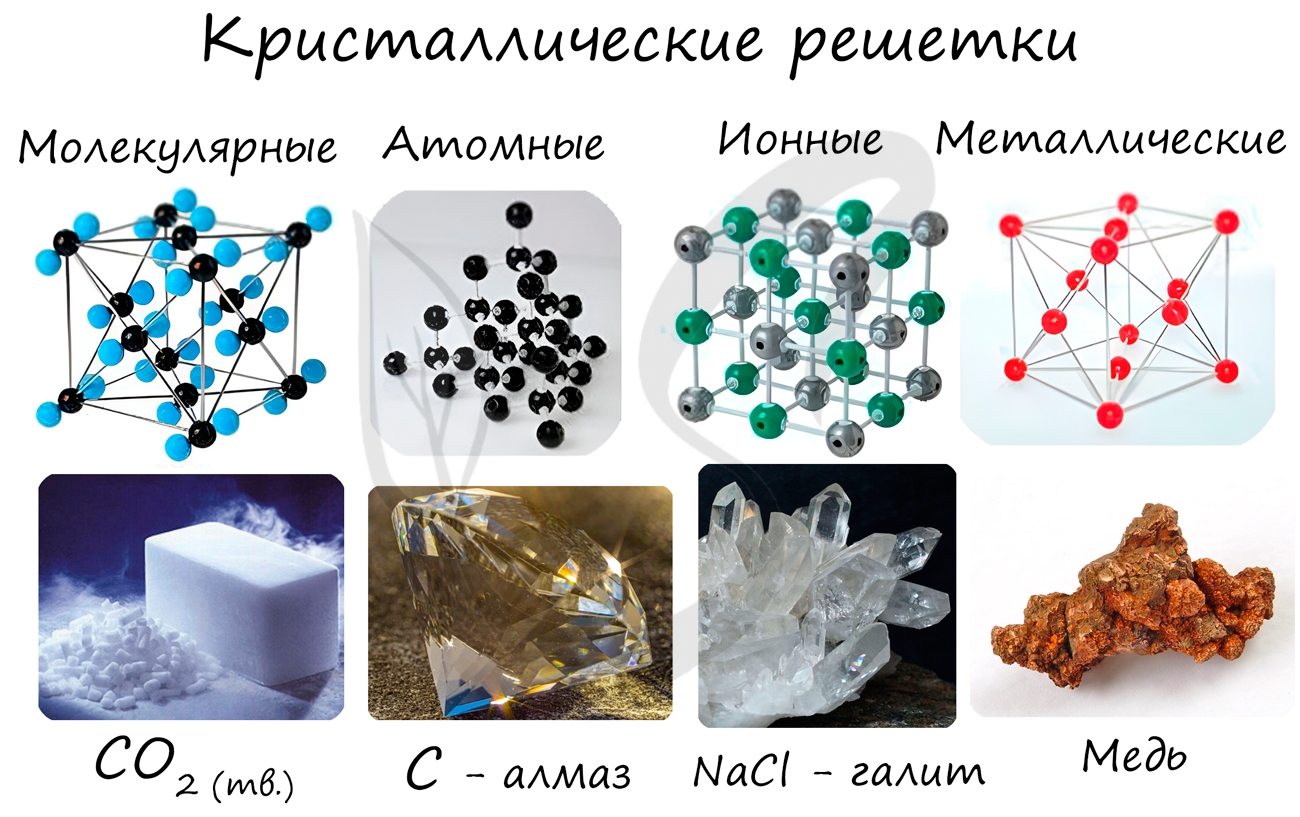
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку , различают атомную, молекулярную, ионную и металлическую кристаллическую структуру .
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы . Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества , образующие в твердом состоянии атомные кристаллы:
- Простые веществас высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (карборунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества , образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы(O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями(кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптони др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке . Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения . В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
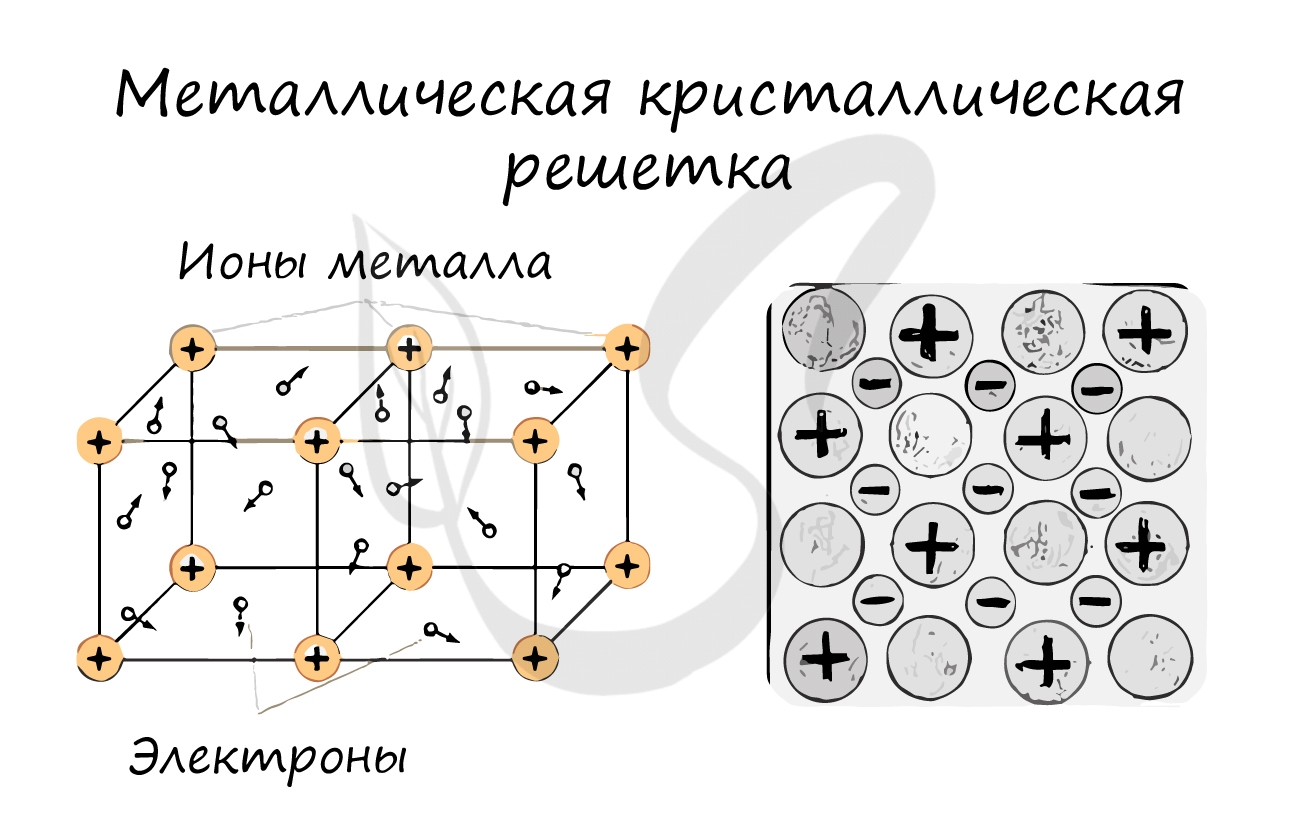
Металлическая кристаллическая решетка

И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью . Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы , как при образовании ионной связи, и образуются общие электроны , как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют « электронным газом ». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами : металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
1. Типы кристаллических решёток
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой .
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную , металлическую , атомную и молекулярную .
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
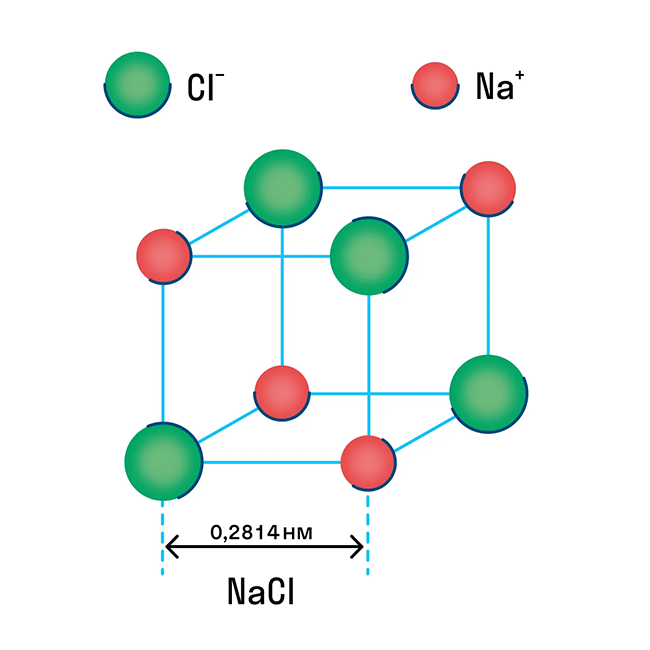
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na + и хлора Cl − , а в узлах решётки сульфата калия чередуются простые ионы калия K + и сложные сульфат-ионы S O 4 2 − .
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые , тугоплавкие , нелетучие . Такие вещества хорошо растворяются в воде .

Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск , ковкость , пластичность , хорошо проводят электрический ток и тепло .

Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит , кремний , бор и германий , а также сложные вещества, например, карборунд SiC и кремнезём , кварц , горный хрусталь , песок , в состав которых входит оксид кремния(\(IV\)) Si O 2 .
Таким веществам характерны высокая прочность и твёрдость . Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения . Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С.

Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость , низкие температуры плавления и кипения .
Такие вещества летучи . Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние.
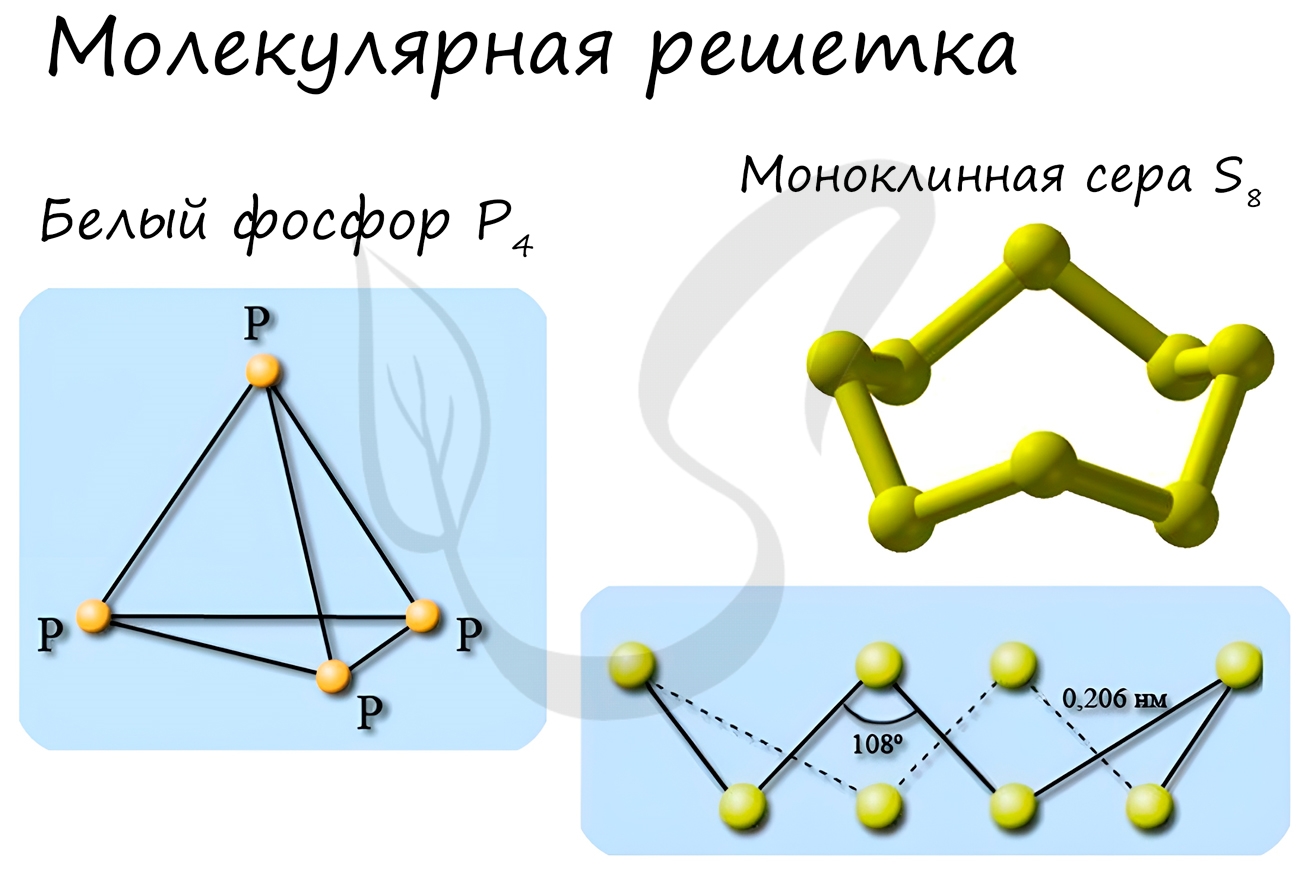
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами ( He , Ne , Ar , Kr , Xe , Rn ), а также неметаллы с двух- и многоатомными молекулами ( H 2 , O 2 , N 2 , Cl 2 , I 2 , O 3 , P 4 , S 8 ).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд , иод , твёрдые аммиак , кислоты , оксиды большинства неметаллов . Большинство органических соединений тоже представляют собой молекулярные кристаллы ( нафталин , сахар , глюкоза ).


Попробуем определить, каковы примерно температуры плавления у фторида натрия , фтороводорода и фтора .
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF , HF и F 2 составляют соответственно \(995\) °С, \(–83\) °С, \(–220\) °С.
15 главных свойств металлической кристаллической решетки
Что представляет собой металлическая кристаллическая решетка: промышленное подразделение металлов + их атомно-кристаллическое строение + понятие, классификация и свойства металлической кристаллической решетки + особенности решетки у сплавов + разбор термина в контексте сварочного процесса

Взглянув вокруг себя, вы наверняка заметите парочку вещиц с содержанием металлов. Из-за повсеместного использования данных элементов, знать базовую информацию по ним обязан каждый.
В сегодняшней статье я расскажу, что такое металлическая кристаллическая решетка + предоставлю исчерпывающую информацию в отношении кристаллической классификации металлических веществ вообще.
Понятие кристаллической решетки + классификация
Перед углублением в сложные темы по химии и физике школьной программы, я хотел бы выдать вам исчерпывающую информацию в отношении терминологии и классификации металлических элементов сквозь призму промышленности.
1) Промышленное подразделение металлов + их атомно-кристаллическое строение
Начало эры металлов началось в 20 веке. Медь, железо, серебро и прочие элементы стали неотъемлемой частью быта и промышленности населения большинства развитых стран. Базовые характеристики металлов, такие как упругость, пластичность и прочность, определяются их атомным + кристаллическим строением.

Знание этих свойств позволит умело оперировать свойствами и применять их для получения эталонных комбинаций элементов. В индустриальном плане металлы подразделяют на 5 больших коопераций . Детальнее по каждой из них я расскажу в отдельной таблице.
| Группа | Описание | Распространение (из 5 ★) |
|---|---|---|
| Черные | В категории расположилось большинство распространенных металлов планеты, такие как хром и железо. Сюда же включены и сплавы из комбинаций черных металлов по типу ферросплавов. Мировое использование черных металлов составляет 88% всей мировой потребности. | ★★★★★ |
| Цветные (легкие) | Магний, титан и прочие элементы с низким показателем плотности. По добыче дороже черных + встречаются в природе по залежам реже. Применяются в точном строительстве, и для деталей, где их применение финансово обосновано. | ★★★★ |
| Цветные (тяжелые) | Отличительная черта – повышенный удельный вес + превосходная проводимость электрического тока. Применяются в качестве реакционных катализаторов при производстве плат и прочей электронике. | ★★★ |
| Благородные | Защита от коррозии и малый удельный вес. В современном обществе, приоритетно, используются как инструмент для накопления финансов странами и украшения. Яркие представители –платина и золото. | ★★ |
| Редкоземельные | Итрий, лантан и прочие химические элементы редкоземельного типа из группы металла. Имеют весомый удельный вес и очень активны химически, что обуславливает их использование в приборостроении и смежных направлениях. | ★★★ |
Выделяют еще и щелочные металлы, но обычно их предпочитают относить в одну группу с редкоземельными, ибо по базовым характеристикам они весьма похожи между собой. Натрий, литий и прочие элементы группы при химических реакциях с водой образуют щелочи – отсюда и название группы. Используются при производстве всяческих моющих.
Обратите внимание: атомно-кристаллическое строение металлов напрямую влияет на их физические и химические свойства. Особенно важную роль в промышленности отыгрывает параметр электропроводимости.
Кристаллическое строение характерно металлическим элементам, которые пребывают в твердой фазе состояния. Атомы самостоятельно располагаются в четкой (иногда расплывчатой) геометрической фигуре объемного типа. Получаемые соединения и местоположения атомов принято называть кристаллической решеткой. С научной точки зрения термин подается практически также.

Кристаллическая решетка (КР) – сетчатый геометрический образ для исследований структуры кристаллов. Состоит из узлов, в которых могут располагаться молекулы/ионы/атомы, и соединений этих элементов.
Какие параметры используют при исследовании:
- ЕКР;
- константа КР;
- плотность упаковки;
- значение координации.
Металлическая кристаллическая решетка – это совокупность из элементарных ячеек, определяющая симметричные свойства всей структуры в целом. Признаки по структурным частям кристаллической решетки описываются за счет 3 правил Бреве.
2) Классификация кристаллических решеток
Распределение по типам кристаллических решеток производится на основании природного происхождения частиц + типам химических связей между базовыми элементами структуры. Беря в учет оговоренное, можно выделить 4 типа КР. Детальнее по 3-м из них предоставлю информацию в отдельной таблице, а что собой представляет металлическая кристаллическая решетка разберем отдельным пунктом статьи чуть ниже.
| Тип КР | Особенности |
|---|---|
| Ионная | По названию понятно, что узловыми элементами структуры являются ионы. Связываются между собой ячейки за счет электростатики, что придает ИКР электронейтральность. Отсутствие насыщенности с направленностью характеризует решетку крупными числами координации. По физике - - большая твердость, тугоплавкость и нелетучесть. Также ионные соединения характеризуются повышенной ломкостью. Даже мелкие сдвиги приводят к разрушению огромной площади КР. |
| Атомная | Ячейки КР соединяются между собой за счет связи ковалентного типа. Здесь идет подразделение на 3 категории в зависимости от структуры – каркас (алмаз), слоистость (графит) и цепочка (асбест). К базовым физическим свойствам атомных кристаллических решеток отнесу высокий запас твердости, тугоплавкость, нерастворимость в воде и отсутствие летучести. В своем большинстве, АКР характерная для сложных веществ по типу оксида алюминия или оксида кремния. |
| Молекулярная | По узлам структуры располагаются молекулы, а их соединение образуется за счет все тех же сил молекулярного типа. Их часто называют водородными или вандерваальсовскими связями. Простейшими примером веществ с молекулярной кристаллической решёткой является лед и йод. |
Кристаллическая структура характерна не только для чистых веществ, но и разнообразных соединений неорганики. Особенно это актуально для металлических соединений по типу сплавов. Учитывая распространение металлов в промышленности и бытовой сфере, разбору понятия металлической кристаллической решетки нужны уделить особое внимание. Чем я дальше и займусь.
Что такое металлическая кристаллическая решетка: обобщенная терминология и свойства
Если ранее описанные КР имели по узлам только один компонент, то металлическая кристаллическая решетка состоит из структур множественного повторения, в точках соединения которых имеется 2 типа ячеек.

Первые – ионы с положительным зарядом, а вторые – нейтральные атомы. Между узлами КР свободно передвигаются относительно свободные электроны. Со схемой металлической решетки можете ознакомиться на рисунке выше.
1) Особенности строения и классификация металлической кристаллической решетки
В зависимости от межатомного расстояния, кристаллические соединения в сплавах и чистых структурах металлов могут разбиваться на 2 подвида – изотропные и анизотропные. В первом случае расстояние между ионами и атомами в узлах структуры равно. Колебания могут составлять от 0.1% до 3%, не более. Если расстояние между узлами кристаллической решетки вдоль и вверх различается, получаемый кристалл относят к анизотропному. Четкое представление об параметрах таких КР можно получить только после изучения направления.
Важно: на практике практически нереально встретить металлы либо их сплавы, которые будут располагать четкой однородной структурой. В 95%+ случаев, металлический элемент из множества кристаллов имеет разнобойной кристаллической решетке. По данной причине была создана еще одна категория в кристаллическом строении, именуемая квазиизотропная.
Второй параметр в металлических кристаллических решетках, который дал толчок к вводу еще одной классификации, – это межатомное расстояние близлежащих элементов. Здесь используется обособленная единица измерения — ангстрем. Среднее значение для различных металлов в чистом виде составляет порядка 3-7 ангстрем.

Классификация КР по типу:
- Куб. Решетка имеет правильную форму с объемным центрированием. Число содержащихся узлов соединения – 9. Пример металла с кубической кристаллической решеткой является железо.
- Куб с центрированными гранями. Здесь уже число узлов соединения увеличено до четырнадцати. Гранецентрированная КР имеется у золота, свинца и прочих цветных + драгоценных металлах.
- Гексагональ. Кристаллическая решетка содержит уже целых 17 узлов с крайне плотным размещением друг к другу. Актуальна такая геометрия цинку, магнию и так далее.
Особенно поражает железо, ведь при нагревании выше температуры в 920 градусов по Цельсию, его кристаллическая решетка преобразуется из обычной кубической в кубическую с центрированными гранями.
2) Свойства металлической кристаллической решетки
Свойства металлов напрямую зависят от кристаллической структуры, а это значит, что большинство характеристик элементов равны параметрам КР. Как и в других направлениях, свойства металлической кристаллической решетки квалифицируются на 2 категории – физические и химические.
К общим физическим свойствам металлов я отнесу:
- ковкость;
- пластичность;
- тягучесть;
- характерный металлический отблеск;
- теплопроводимость;
- электропроводимость.
Отмечу, что физические свойства для различных чистых элементов в металлах могут иметь большую разницу. К примеру, ряд «Ag Cu Au Al Mg Zn Fe РЬ Hg» имеет меньшее значение проводимости тепла и тока. Сюда же отнесу разделение на цветные и черные металлы, а также классификацию в зависимости от плотности (легкие и тяжелые), твердости (мягкие и твердые) и температуры плавления (легкоплавкие и тугоплавкие).
К общим химических свойствам металлов отнесу:
- являются восстановителями;
- взаимодействие с кислородом и образование в результате оксидов;
- взаимодействие с галогенами;
- активные металлы могут вступать в реакцию с водородом;
- получение сульфидов при химических реакциях с серой;
- часть элементов среди металлов могут сотрудничать с азотом, выделяя нитриды;
- получение карбидов при контакте с углеродом;
- фосфиды – результат связей с фосфором;
- получение интерметаллических соединений за счет взаимодействия между металлическими компонентами.
Особенно интересным химическим взаимодействием я считаю соитие металлов при воздействии температур. В процессе нагрева элементы растворяются друг в друге, и, как результат, мы получаем металлический сплав. О них я далее также скажу пару слов.
3) Металлическая кристаллическая решетка в сплавах
Сплавом считается соединение сразу нескольких химических элементов. В большинстве случаев – это металлы, но нельзя сбрасывать со счетов и соединения, в которых имеются вкрапления неметаллов. Простейший пример сплава металла и неметалла, — это углерод.
Обратите внимание: если вкрапливаемый элемент в сплав приносит ему практическую пользу (например, улучшает коррозийную стойкость), такую присадку называют легирующей, в обратном случае получаем вредную примесь.

В металлургии имеется такое понятие как механическая смесь – это разновидность сплава, у которого кристаллические решетки компонентов не способны взаимно раствориться. Получаемое соединение мало используется в металлургии, но как явление все же существует.
Качественная взаимосвязь компонентов характерна для:
- твердых растворов. Когда атомы элемента-помощника внедряются внутрь кристаллической решетки базового компонента соединения;
- химические сплавы. Наиболее качественные метод соединения металлов. Результатом становится новая кристаллическая решетка, образованная из молекул обоих компонентов в более-менее равной мере.
В зависимости от долевого вкрапления легирующих добавок, физика и химия поведения сплавов может значительно отличаться друг от друга. Особенно чувствительны в этом плане компоновки из металлов и неметаллов.

Конечный этап процесса химического соединения металлических элементов называют первичной кристаллизацией. После нагрева элемента до нужной температуры (температура плавления), наступает этап смешивания и последующее остывание. На последней стадии происходит образование центральных элементов кристаллизации, вокруг которых и собирается полноценная кристаллическая решетка сплава из повторяющихся ячеек центра.
Центральными элементами могут быть:
- ячейки вдоль каемки литейного оборудования, где остывание происходит быстрее всего;
- неметаллические элементы, попавшие в сплав;
- легирующие элементы с высоким запасом тугоплавкости.
Рост кристаллов в 90% случаев протекает вдоль температурного градиента. Наткнувшись на препятствие, структура приобретает древовидный вид. При стыке двух таких элементов, происходит образование зерен, из которых и образуется тело поликристаллического типа. Отдельные кристаллы, которые встретили препятствие на поздних стадиях своего роста, могут вырастать до 8 000 – 11 000 микрон. Их пространственное положение не имеет четкого направления, а подается вразброс. Вся совокупность мелких + крупных зерен и составляет новое образование, именуемое сплавом.
Разбор терминологии и свойств по металлической кристаллической решетке:
Металлическая кристаллическая решетка в контексте сварки
Фактически, сварочный процесс — это ручное производство сплава, цель которого соединить независимое элементы в единое целое. Задача не из простых, особенно если приходится работать с разными типами металлов, у которых слишком большой разрыв по температуре плавления.
Проблемы возникают на этапе остывания сварочного шва. Думаю, с явлением возникновение трещин знаком каждый сварщик. Основа данного явления кроется как раз в свойствах металлической решетки металла. О классификации дефектов детальнее в таблице ниже.
| Дефект | Описание |
|---|---|
| Точечный | Изменения в структуре кристаллической решетки, которые по размерам соизмеримы с атомом. Типичными точечными дефектами является безатомные узлы, элементы вне узлов КР и замещаемые элементы неметаллов, которые становятся на место основного атома. |
| Линейный | Основная проблематика заключается в одном измерении, когда как остальные два остаются практически неизменными. Подобные дефекты принято назвать дислокационными. |
| Поверхностные | Здесь проблема уже состоит на 90% в двух измерениях. Третье измерение не затрагивается вовсе, либо проблематика является незначительной (менее 5 размеров атомов). |
| Объемные | Очевидные для сварщика проблемы – поры, трещины и прочие повреждения поверхности свариваемой области. |
Полностью избавиться от дефектов нереально физически даже самому опытному мастеру. Единственное, что может сделать сварщик – это придерживаться технологии + обращать внимание на свойства свариваемых металлов.
На этом сегодня все. Надеюсь, инфа по металлической кристаллической решетке вам пригодилась. Удачи и крепкого здоровья!
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кристаллическая решетка

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
· Обновлено 3 июня 2022
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
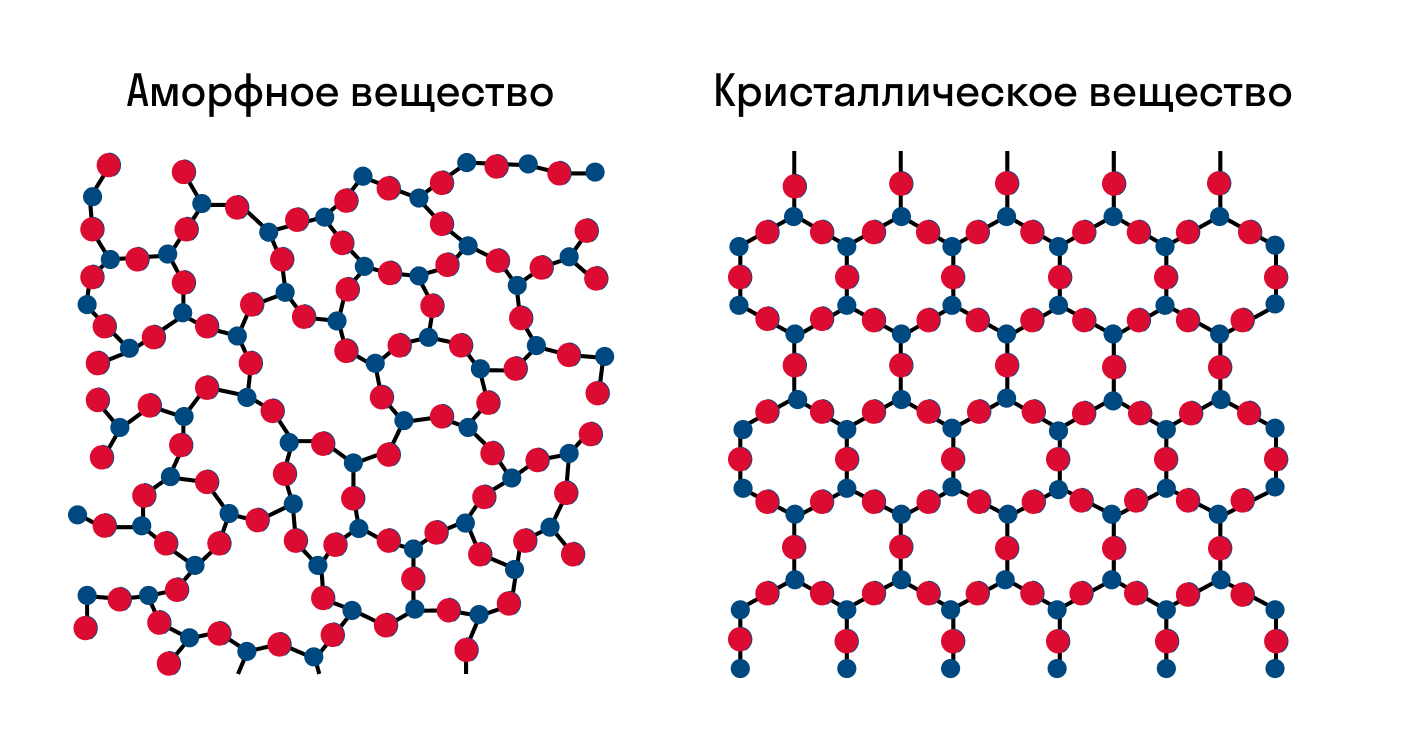
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

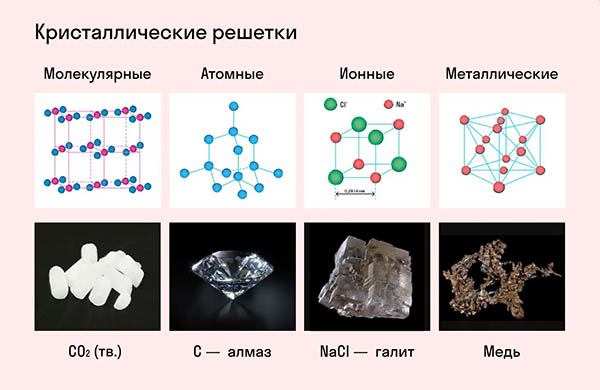
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
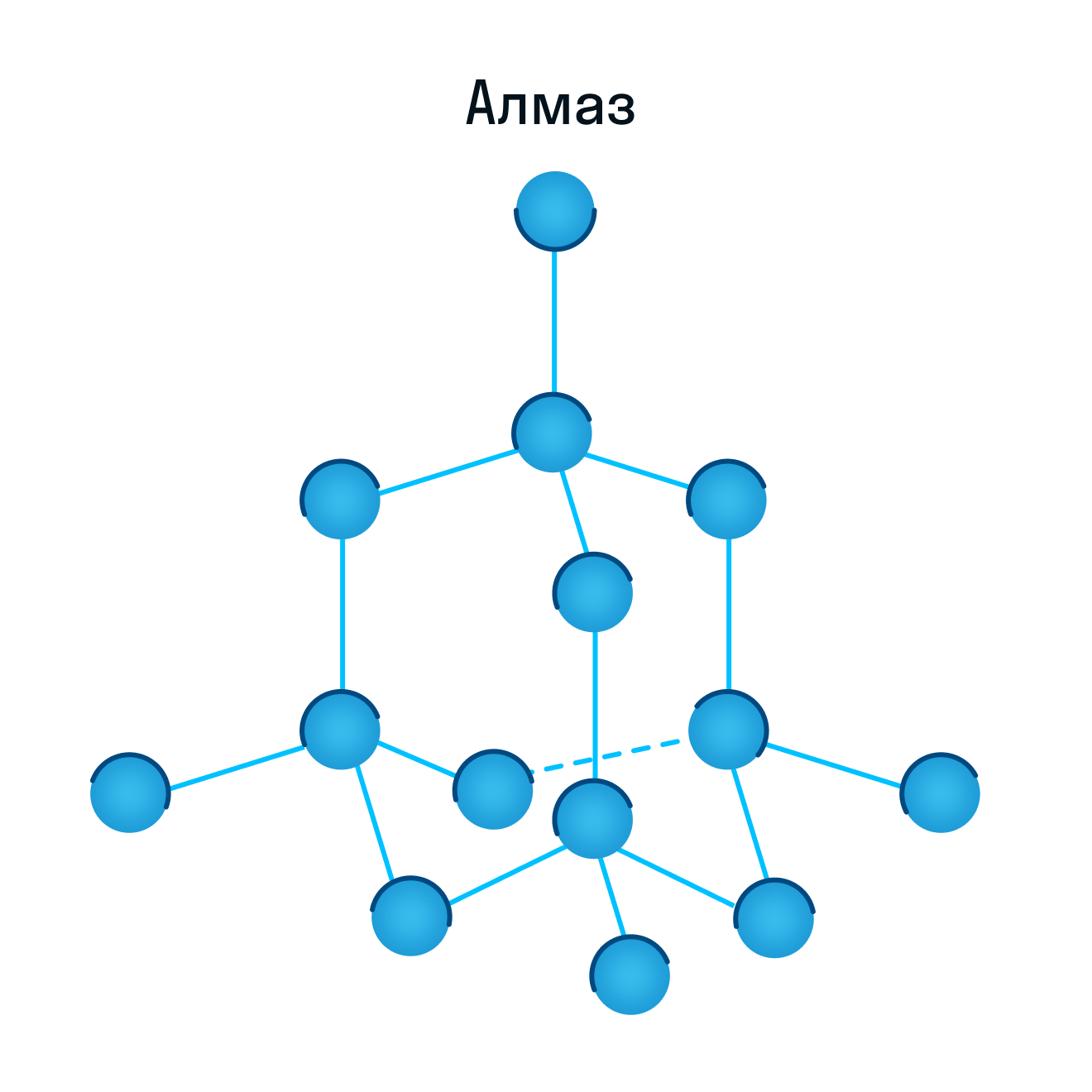
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
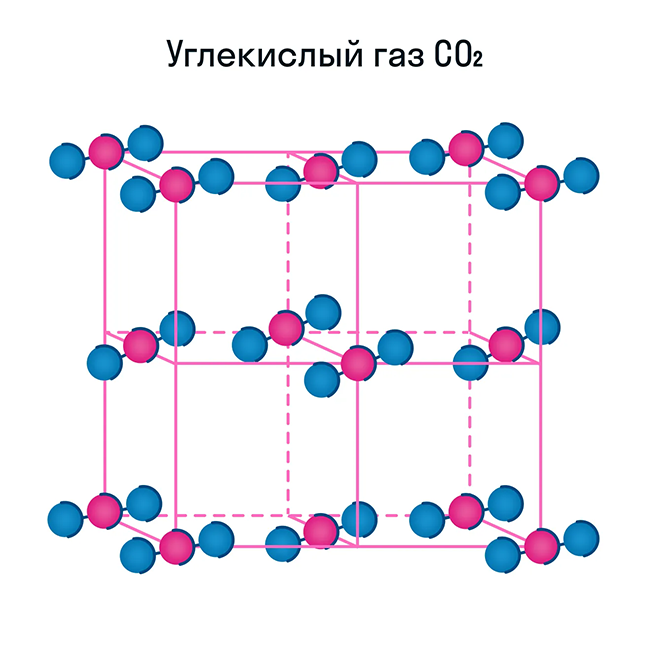
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.

Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
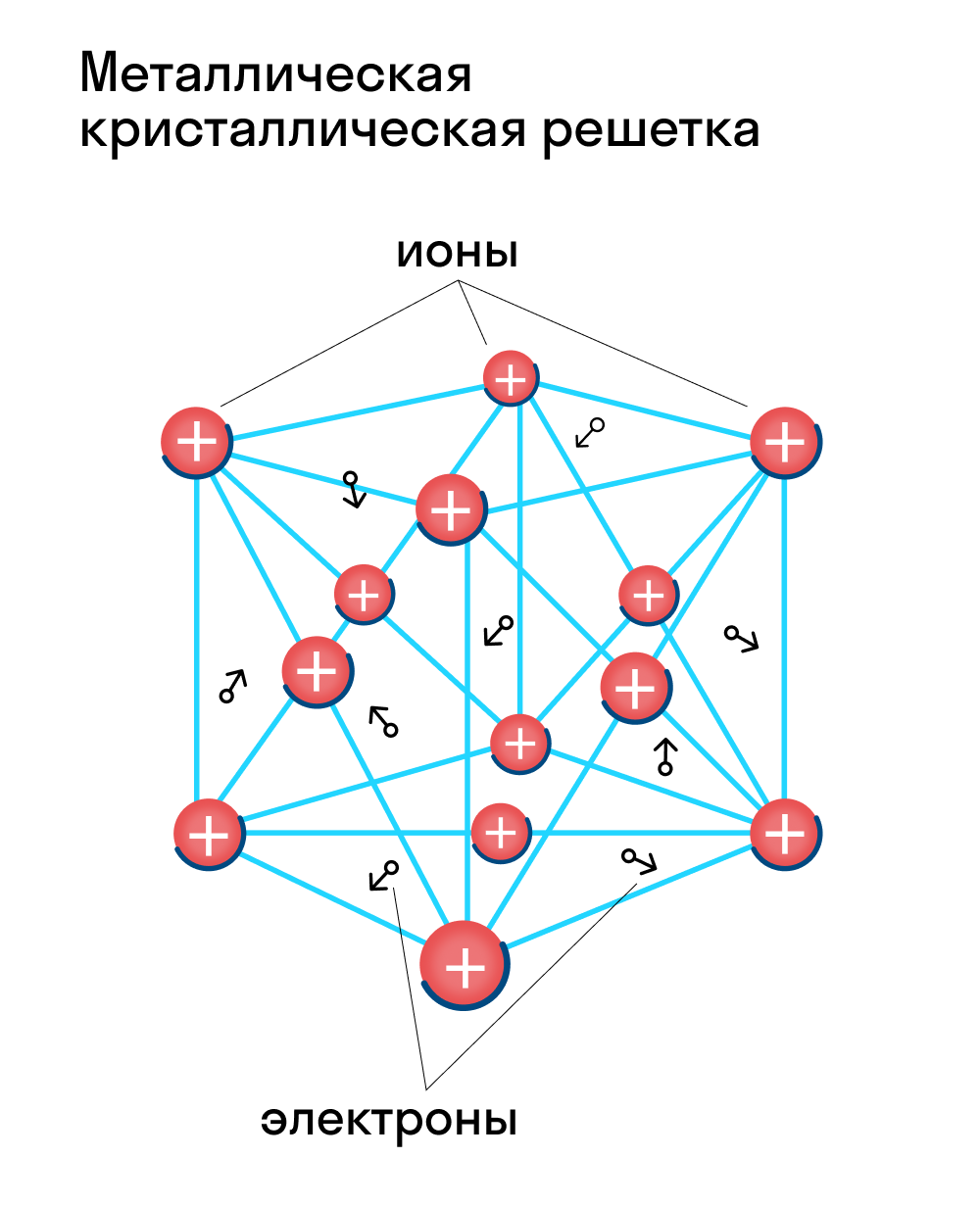
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Читайте также:
