Металлическая медь может реагировать с
Обновлено: 13.05.2024
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 вместо предполагаемой формулы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 . Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(NH3)2]Cl и [Cu(NH3)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 , т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
С бромом же хром реагирует при температуре красного каления (850-900 o C):
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 o С:
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
С водородом хром не реагирует.
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 , то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H2FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Либо же при избытке серы дисульфид железа:
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =t o => 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =t o => 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =t o => 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е.:
Тест на химические свойства соединений меди, цинка и железа.
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с железом.
Ответ: 14
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с медью.
Ответ: 34
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с цинком.
Ответ: 25
Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с железом.
Ответ: 35
Ответ: 5
Ответ: 13
Ответ: 145
Ответ: 134
Ответ: 1234
Ответ: 12
Ответ: 12345
- 1. HBr(р-р)
- 2. HI(р-р)
- 3. FeCl3(р-р)
- 4. FeCl2(р-р)
- 5. ZnO
Ответ: 1245
Ответ: 23
Ответ: 1235
Ответ: 135
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом железа (III).
2) нитрат серебра
3) нитрат меди(II)
5) хлорид хрома(III)
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом железа(II).
1) азотная кислота
2) серная кислота(разб.)
3) серная кислота(конц.)
4) нитрат железа(III)
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом меди.
3) нитрат свинца
Из приведенного списка веществ выберите два таких, которые взаимодействуют с раствором нитрата цинка.
2) карбонат кальция
3) карбонат натрия
5) сульфид натрия
Из приведенного списка веществ выберите два таких, которые взаимодействуют с бромидом железа(III).
4) нитрат серебра
Ответ: 24
Из приведенного списка веществ выберите два таких, которые взаимодействуют с хлоридом железа(II).
5) сульфид меди (II)
Из приведенного списка веществ выберите два таких, которые взаимодействуют с бромидом меди(II).
3) йодоводородная кислота
4) бромоводородная кислота
5) хлороводородная кислота
Из приведенного списка веществ выберите два таких, которые взаимодействуют с йодидом цинка.
3) хлорид меди(II)
4) хлорид железа(III)
Из приведенного списка веществ выберите два таких, которые не взаимодействуют с водным раствором нитрата железа (II).
3) сульфат натрия
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом меди в водном растворе.
1) перекись водорода
2) серная кислота (разб.)
5) йодид аммония
1) карбонат свинца + нитрат железа(II)
2) карбонат калия + нитрат железа(III)
3) карбонат аммония + едкий натр
4) едкий натр + цинк
5) едкий натр + медь
Ответ: 234
1) нитрат железа(II) + йодид натрия
2) нитрат железа(III) + йодид калия
3) сульфат меди + бромид аммония
4) сульфат меди + бромид бария
5) сульфат меди + иодид натрия
Ответ: 245
1) гидроксид меди + гидроксид натрия
2) гидроксид железа (II) + гидроксид цезия
3) гидроксид хрома (III) + поташ
4) гидроксид железа (II) + едкое кали
5) гидроксид цинка + гидроксид стронция
1) нитрат алюминия + сульфид натрия
2) нитрат меди + сульфид натрия
3) нитрат железа(III) + сульфид натрия
4) гидроксид цинка + нитрат аммони
5) хлорид железа(III) + карбонат калия
Из предложенного перечня выберите те пары реагентов, при смешении которых в водном растворе не наблюдается образование осадка.
1) нитрат меди + сероводород
2) нитрат железа(III) + сероводород
3) нитрат цинка + сероводород
4) хлорид меди(II) + едкий натр(избыток)
5) едкий натр(избыток) + бромид цинка
Из приведённого перечня выберите те реагенты, между которыми невозможна реакция в водном растворе.
1) сульфат цинка + сернистый газ
2) сульфат железа (III) + сернистый газ
3) сульфат железа (II) + сернистый газ
4) сульфат железа (III) + сероводород
5) сульфат цинка + сероводород
Из предложенного перечня выберите те реагенты, при смешении которых не наблюдается растворение осадка.
1) сульфид меди (II) + соляная кислота
2) сульфид цинка + соляная кислота
3) сульфид железа (II) + соляная кислота
4) сульфид меди (I) + азотная кислота(конц.)
5) сульфид меди (II) + азотная кислота(конц.)
Ответ: 1
Из приведённого перечня выберите те реагенты, при смешении которых в водном растворе наблюдается выделение газа.
1) сульфат железа (III) + карбонат калия
2) сульфат меди (II) + карбонат кальция
3) сульфид цинка + бромоводородная кислота
4) сульфид меди + фосфорная кислота
5) карбонат цинка + азотная кислота
Из приведённого перечня выберите такое вещество, с которым способно реагировать железо.
Запишите уравнение этой реакции
Ответ: 2Fe + 3Br2 = 2FeBr3
В какой из приведенных пар веществ возможна окислительно-восстановительная реакция?
1) гидроксид железа (III) + соляная кислота
2) гидроксид железа (II) + соляная кислота
3) гидроксид железа (III) + бромоводородная кислота
4) гидроксид железа (II) + плавиковая кислота
5) гидроксид железа (III) + йодоводородная кислота
1) хлорид железа(III) + нитрат серебра
2) бромид железа(II) + нитрат свинца
3) хлорид железа(III) + сульфид натрия
4) бромид железа(II) + сульфид калия
5) хлорид железа(III) + нитрат меди
Ответ: 2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
1) сульфат железа(III) + карбонат калия
2) сульфат железа(II) сульфат аммония
3) сульфат железа(III) + сульфит натрия
4) сульфат железа(II) + карбонат цинка
5) сульфат железа(III) + нитрат меди
Из приведенного перечня веществ выберите такое, с которым способна взаимодействовать металлическая медь.
1) хлорид хрома (II)
2) бромид марганца (II)
4) бромид железа (II)
5) хлорид железа (III)
Ответ: Cu + 2FeCl3 = CuCl2 + 2FeCl2
Из приведенного перечня выберите такую пару реагентов, между которыми возможна окислительно-восстановительная реакция.
1) хлорид меди(II) + нитрат серебра
2) бромид меди(II) + фторид аммония
3) сульфат меди(II) + иодид калия
4) нитрат меди(II) + сульфат бария
5) хлорид меди(II) + бромид железа (III)
Из приведенного перечня веществ выберите такое, которое способно вступать в реакцию с металлической медью.
Ответ: 2Cu + I2 = 2CuI
Из приведенного перечня веществ выберите такое, которое способно вступать в реакцию с металлическим цинком.
1) гидроксид алюминия
2) гидроксид бериллия
3) гидроксид железа(II)
4) гидроксид калия(раствор)
5) гидроксид меди(II)
Железо растворили в горячей концентрированной серной кислоте.
Железо растворили в горячей концентрированной азотной кислоте.
Запишите уравнение реакции, протекающей при обжиге сульфида железа(II).
Запишите уравнение реакции, протекающей при обжиге пирита.
Запишите уравнение реакции, протекающей при образовании железной окалины из простых веществ.
Запишите уравнение реакции, протекающей между железной окалиной и избытком соляной кислоты.
Запишите уравнение реакции, протекающей между железной окалиной и концентрированной азотной кислотой.
Запишите уравнение реакции, протекающей между железной окалиной и йодоводородной кислотой.
Запишите уравнение реакции, протекающей между оксидом железа(II) и концентрированной азотной кислотой.
Запишите уравнение реакции, протекающей при сплавлении порошков железа и оксида железа(III)
Ответ: Fe2O3 + Fe = 3FeO
Запишите уравнение реакции, протекающей при сплавлении едкого натра и оксида железа(III).
Запишите уравнение реакции, протекающей между медным порошком и концентрированной азотной кислотой.
Запишите уравнение реакции, протекающей между медным порошком и разбавленной азотной кислотой.
Запишите уравнение реакции, протекающей между оксидом меди(I) и концентрированной азотной кислотой.
Запишите уравнение реакции, протекающей между оксидом меди(I) и концентрированной серной кислотой.
Запишите уравнение реакции, протекающей между концентрированной азотной кислотой и сульфидом меди(II).
Запишите уравнение реакции, протекающей при обжиге сульфида меди(II) в токе кислорода.
Ответ: 2CuS + 3O2 = 2CuO + 2SO2
Запишите уравнение реакции, протекающей между металлическим цинком и раствором гидроксида натрия.
Запишите уравнение реакции, протекающей при сплавлении оксида цинка с гидроксидом калия.
Ответ: 2KOH + ZnO = K2ZnO2 + H2O
Запишите уравнение реакции, протекающей при обжиге сульфида цинка в токе кислорода.
Ответ: 2ZnS + 3O2 = 2ZnO + 2SO2
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 413
Ответ: 342
Ответ: 411
Ответ: 214
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
Ответ: 241
Ответ: 124
Ответ: 412
Ответ: 423
Навеску сплава меди и цинка массой 10 г растворили в необходимом количестве концентрированной азотной кислоты. Определите массовую долю цинка в сплаве, если при пропускании через полученный раствор сероводорода выпало 9,6 г черного осадка. Ответ округлите до целых.
Ответ: 36
Навеску смеси железного и цинкового порошков массой 2,33 г обработали избытком разбавленной соляной кислоты. При этом выделилось 896 мл газа. При обработке такой же навески избытком раствора едкого кали выделилось 224 мл газа. Определите массовую долю железа в сплаве. Ответ укажите в процентах и округлите до десятых.
Ответ: 72,1
При полном окислении навески порошков меди и железа было израсходовано 4,48 л хлора. При внесении такой же навески в избыток бромоводородной кислоты выделилось 2,24 л газа. Определите массовую долю меди в сплаве. Ответ округлите до десятых.
Ответ: 36,4
Смесь железных и цинковых опилок массой 1,815 г растворили в 200 г 18,25% соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе, если известно, что массовая доля железа в исходной смеси 46,28%. Ответ округлите до целых.
Ответ: 17
Рассчитайте массу угарного газа, необходимого для полного восстановления твердого остатка, полученного при прокаливании смеси 9 г нитрата железа(II) и 9,4 г нитрата меди. Ответ округлите до десятых.
Ответ: 3,5
Рассчитайте объем 30%-ного раствора серной кислоты, необходимой для растворения твердого остатка, полученного при разложении смеси 2,1 г карбоната магния и 18,9 г нитрата цинка. Плотность раствора серной кислоты 1,3 г/см 3 . Ответ округлите до десятых.
Ответ: 31,4
Вычислите массу осадка, который выпадет при пропускании 11,2 л сероводорода через раствор, полученный при взаимодействии 3,2 г меди и 10,87 мл 80%-ного раствора азотной кислоты (плотность 1,45 г/см 3 ). Ответ округлите до десятых.
Ответ: 4,8
Навеску меди массой 12,8 г внесли в 300 мл 70% раствора азотной кислоты (плотность 1,35 г/мл). После окончания реакции к раствору добавили 100 мл 10% поташа (плотность 1,1 г/см 3 ). Определите массовую долю кислоты в полученном растворе. Ответ округлите до десятых.
Ответ: 44,1
Навеску оксида меди(I) массой 3,6 г полностью растворили в избытке концентрированной серной кислоты. Полученный раствор имел массу 50 г. Далее в раствор погрузили графитовые электроды и проводили процесс электролиза до выделения на аноде 112 мл газа. Определите массовую долю соли в полученном растворе. Ответ округлите до сотых.
Ответ: 13,01
При электролизе раствора хлорида меди(II) на аноде выделилось 6,72 л газа. Полученный на катоде металл растворили в необходимом количестве концентрированной азотной кислоты. Рассчитайте объем сероводорода, необходимый для полного осаждения меди из полученного раствора. Ответ округлите до сотых.
Ответ: 6,72
Навеску нитрата серебра массой 17 г растворили в воде и проводили электролиз полученного раствора до выделения на аноде 224 мл газа. Определите массу хлороводорода, необходимого для полного осаждения оставшегося серебра из раствора. Ответ округлите до сотых.
Ответ: 2,19
Навеску нитрата меди массой 9,4 г растворили в воде и проводили электролиз полученного раствора до выделения на аноде 448 мл газа. Определите массу 20% раствора гидроксида натрия, необходимую для полного осаждения оставшегося металла из раствора. Ответ округлите до целых.
Ответ: 20
При электролизе 100 г раствора сульфата меди масса на электродах выделилось 1,6 г веществ. Определите массу 10 %-ного раствора нитрата бария, необходимую для полного осаждения сульфат-ионов из исходного раствора. Ответ округлите до десятых.
Ответ: 52,2
Навеску бромида меди(II) растворили в 50 мл воды и проводили электролиз полученного раствора до полного расходования соли. Определите массовую долю соли в исходном растворе, если полученное на аноде вещество может прореагировать с 30 мл 10% раствора гидроксида калия (плотность 1,12 г/см 3 ). Ответ округлите до сотых.
Ответ: 11,85
Навеску нитрата железа (III) массой 12,1 г подвергли термическому разложению. Определите объем газа, который выделится при сплавлении полученного твердого остатка с поташом. Ответ укажите в литрах и округлите до сотых.
Ответ: 0,56
Навеску смеси нитрата меди и нитрата цинка с массовой долей нитрата цинка 50% полностью разложили при нагревании. Определите суммарный объем выделившихся газов, если известно, что полученный твердый остаток может прореагировать с 100 г 10%-ного раствора гидроксида натрия. Ответ округлите до целых.
Навеску смеси карбоната и нитрата цинка обработали избытком соляной кислоты. При этом выделилось 6,72 л газа. При прокаливании такой же навески выделилось 17,92 л газов. Определите массовую долю карбоната цинка в исходной смеси. Ответ округлите до десятых.
Ответ: 49,8
Навеску нитрата меди массой 47 г подвергли частичному разложению при нагревании. Полученный твердый остаток внесли в 200 мл 20% раствора гидроксида натрия (плотность 1,1 г/см 3 ). Определите массовую долю щелочи в полученном растворе, если известно, что при прокаливании навески выделилось 11,2 л газов. Ответ округлите до десятых.
Химические и физические свойства меди

Химические свойства меди определяются положением ее в периодической системе Д. И. Менделеева. Обозначение данного металла Cu (купрум, cuprum), он имеет 29-й порядковый номер, находится в первой группе (побочной подгруппе), в 4 большом периоде.
Выделяется отдельный ее вид: черновая медь, которая является при конвертировании продукта кислородом. Атомная (молярная) масса равна 63,5 г/моль, молекулярная масса — 63,5 а. е. м.
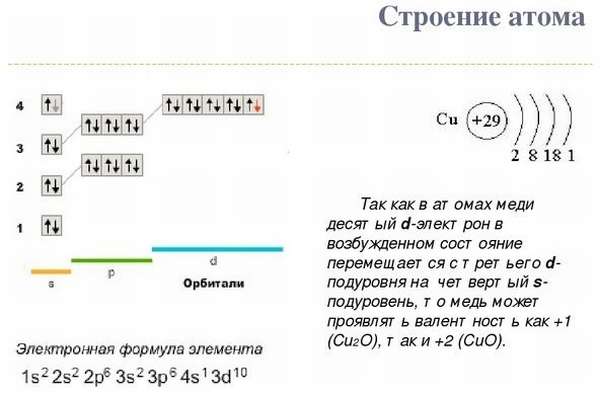
В зависимости от соединения, в котором металл находится, он может иметь валентность +1 и +2, но в редких случаях степень окисления может быть +3 и +5, что является исключением. Строение атома Cu и электронная формула показаны на рисунке:
Кристаллическая решетка меди представляет собой каркас в форме куба, который образован прямыми линиями. Решетка довольно прочная, молекулярная, так как в узлах находятся молекулы.
Физические свойства и характеристика
Медь в чистом виде – это довольно ковкий, тягучий, вязкий металл, имеющий красновато-коричневый цвет.

Его твердость достигается путем добавления в состав различных примесей. Она имеет высокую электропроводность и теплопроводность, но примеси, которые зачастую добавляют в сплав, ухудшают эти показатели.
Преимуществом данного металла является устойчивость к коррозии. Температура плавления равна 1085 градусов по Цельсию, а температура кипения – 2562 градуса. Плотность равна 8900 кг/м3. Удельный вес равен 8930 кг/м3.
Медь в чистом виде является диамагнетиком, то есть магнитными свойствами не обладает. Магнититься могут только ее сплавы, где концентрация непосредственно самой меди не более 50%.
С чем реагирует
Медь НЕ реагирует с водородом, углеродом, азотом, а так же кремнием.
Реагирует с кислотами и солями, оксидами, галогенами, кислородом и неметаллами, но не может реагировать со щелочами, так как находится в электрохимическом ряду после водорода. Так же не может реагировать с фтором, бромом, хлором.
Отношение к кислороду
По отношению к кислороду металл проявляет слабую активность, но при длительном нахождении на воздухе покрывается очень тонкой, почти незаметной зеленоватой пленкой, которая и является оксидом меди.

В зависимости от температуры, при которой протекает реакция, купрум образует 2 оксида: CuO и Cu2O.
Взаимодействие с водой
По причине того, что медь находится в ряду электрохимического напряжения после водорода, она не вытесняет водород из воды. Но если присутствует кислород, водород может вытеснять молекулы металла, за счет чего и происходит окислительно-восстановительная реакция.
Реакции с кислотами
Из-за своего положения в электрохимическом ряду, не вытесняет водород из кислот, поэтому некоторые из них на нее не действуют. Но при достаточном доступе кислорода, растворяются в них, образуя соответствующие кислотам соли.
Отношение к галогенам и неметаллам
С галогенами медь реагирует довольно хорошо. В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.

Cu реагирует с серой, в зависимости от температуры образуются следующие сульфиды: Сu2S, CuS.
Может образовывать йодиды (с йодом).
Реакции с оксидами неметаллов
Медь может реагировать не со всеми оксидами неметаллов, что зависит от неметалла, температуры и других условий протекания химической реакции.
Химические свойства меди

Одновалетной
Ион Cu+ крайне неустойчив, особенно в водных растворах. Примерами одновалентной меди могут служить:
Двухвалентной
Это наиболее характерная степень окисления для меди. Так же более устойчивая и распространенная, например:
Трехвалентной
Наиболее редкая и нестабильная степень окисления этого металла, которая является исключением, например:
Заключение
Медь – распространенное вещество, которое незаменимо во многих отраслях, так как является очень гибким и плавким. Имеет высокие показатели, во многом сравнимые с железом, что позволяет изготавливать из нее многие незаменимые детали в производстве и механике.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Читайте также:
|

