Оксиды и гидроксиды металлов презентация
Обновлено: 05.10.2024
Дается понятие об амфотерности оксидов и гидроксидов.
| Вложение | Размер |
|---|---|
| amfoternye_oksidy_i_gidroksidy.pptx | 905.16 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Амфотерные оксиды и гидроксиды
Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о классификации и свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществ Цели урока:
Основные классы сложных веществ (повторение) Генетическая связь (повторение) Лабораторная работа Понятие амфотерности. Амфотерные оксиды и гидроксиды План урока
Основные классы сложных веществ: Вещества Кислоты Основания Оксиды Соли
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2 Si O 2 Cl 2 O 7 C O 2 H 2 O Fe O оксиды
Задание 1 Выберите из списка веществ оксиды: H 2 O , CO 2 , P 2 O 5 , WO 3 Fe 2 O 3 SO 3 , CaCl 2 , SCl 6 , CuO , H 2 SO 4 , NaOH ,
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов ( ОН ) Основания - М(ОН) n __ где М – металл, n – число групп ОН и в то же время заряд иона металла NaOH Ca(OH) 2 Fe(OH) 3 + +2 +3 Называем: гидроксид металла
Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид натрия (едкий натр) KOH – гидроксид калия (едкое кали) Ca(OH) 2 – гидроксид кальция (гашеная известь, известковое молоко, известковая вода) Ba(OH) 2 - гидроксид бария LiOH - гидроксид лития Основания Нерастворимые Растворимые (щелочи) NaOH , KOH , Ba(OH) 2 Fe(OH) 3 , Cu(OH) 2
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Кислородосодержащие кислоты: Бескислородные Азотная кислота – H NO 3 Соляная кислота - H Cl Азотистая кислота – H NO 2 Сероводородная – H 2 S Серная кислота – H 2 SO 4 Бромоводородная - H Br Сернистая кислота – H 2 SO 3 Угольная кислота – H 2 CO 3 Фосфорная кислота – H 3 PO 4 Кислоты
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков Соли KNO 3 NaCl CuSO 4 FeS CaCO 3 Ca 3 (PO 4 ) 2
Распределите вещества по классам Оксиды Кислоты Основания Соли
Задание 2 Распределите вещества по классам: H 2 S, SO 3 , CuSO 4 , FeCl 3 , KOH, Na 2 O, Al(OH) 3 , K 3 PO 4 , FeS, Al 2 (SO 4 ) 3 , Al 2 O 3 , H 2 CO 3 , Cl 2 O 7 , Ca(OH) 2 , H 3 PO 4 , Mg(NO 3 ) 2 , HCl, CaO, CuSO 4
Проверьте себя: Оксиды Кислоты Основания Соли SO 3 Na 2 O Al 2 O 3 Cl 2 O 7 CaO H 2 S H 2 CO 3 H 3 PO 4 HCl KOH Al(OH) 3 Ca(OH) 2 CuSO 4 FeCl 3 K 3 PO 4 FeS Al 2 (SO 4 ) 3 Mg(NO 3 ) 2 CuSO 4
М Основание нм Кислота (кислородосодержащая) Генетическая связь Основный оксид Кислотный оксид Соль
CaO Ca(OH) 2 P 2 O 5 H 3 PO 4 P Ca Генетическая связь Ca 3 ( PO ) 4
Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl 3 + 3NaOH Al(OH) 3 + 3NaCl Лабораторная работа
Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи Лабораторная работа
Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO 3 H – O - N O H 2 SO 4 H – O O S H – O O NaOH Na – O - H = = - - = =
Гидроксид алюминия можно записать как основание и как кислоту Al( OH ) 3 = H 3 AlO 3 Al O 3 H 3 = = Кислота Основание
Al ( OH ) 3 + 3HCl = Al Cl 3 +3H 2 O H 3 AlO 3 + 3NaOH = Na 3 AlO 3 +3H 2 O Хлорид алюминия Алюминат натрия Запишите уравнения реакций:
Al 2 O 3 + 6HCl = 2 Al Cl 3 + 3H 2 O Al 2 O 3 + 3NaOH = Na 3 AlO 3 + 3H 2 O Как основный Как кислотный Амфотерность оксида алюминия
Амфотерные Оксиды металлов (с.о. +2,+3,+4)
Какие из групп веществ проявляют амфотерные свойства? Ca (ОН) 2 , Cu (ОН) 2 , Na ОН, Fe ( O Н) 2 Fe 2 O 3 , Al 2 O 3 , Fe ( O Н) 3 , ZnO, Be ( O Н) 2 SO 3 , Cl 2 O 7 , WO 3 , Н 2 SO 4 , Н 2 CrO 4
Допишите уравнение реакции: Zn(OH) 2 + 2NaOH в результате образуются Na 2 ZnO 2 + 2H 2 O Zn(OH) 2 + Na 2 O ZnSO 4 + 2 NaCl Реакция не идет
Подумай ещё немного!
Генетический ряд алюминия. Осуществите превращения: Na 3 AlO 3 Al Al 2 O 3 AlCl 3 Al(OH) 3 Al 2 (SO 4 ) 3
По теме: методические разработки, презентации и конспекты
Первые попытки классификации химических элементов. Амфотерные оксиды и гидроксиды.
Работа посвящена изучению истории открытия периодического закона, показан исторический ход развития науки от накопления фактов к их классификации. Особое внимани.

Практическая работа "Получение амфотерного гидроксида и опыты с ним"
Цель: получить амфотерный гидроксид и изучить его свойства.Задачи:- Образовательные: содействовать в ходе урока обобщению и углублению знаний, закрепить умения п.

Соединения металлов. Оксиды и гидроксиды.

Урок по химии в 9-м классе на тему "Амфотерность оксида и гидроксида алюминия"
Урок строится на основе презентации, включает выполнение лабораторных опытов учащимися по доказательству амфотерности гидроксида алюминия, к которым имеются указания в слайдах, в уроке выдержаны основ.

Урок химии в 9 классе по теме "Переходные металлы. Амфотерные оксиды и гидроксиды"

Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды.

УМК. Оксиды и гидроксиды (Занятие)
Цель занятия: расширить, закрепить, обобщить и систематизировать знания о важнейших оксидах и гидроксидах.
Оксиды и гидроксиды металлов. 11 класс
1. Химические свойства основных оксидов и гидроксидов металлов химия 11 класс
2. Цели урока:
• закрепить знания о классификации и
номенклатуре; химических свойствах
основных оксидов и гидроксидов
металлов, научить составлять уравнения
реакций, подтверждающие эти свойства;
закрепить навыки решения расчетных
задач по химическим уравнениям и по
формуле.
3. КЛАССИФИКАЦИЯ ОКСИДОВ
• Оксиды
1) несолеобразующие
N2O, NO, CO
2) Солеобразующие
Основные
CaO
соответствуют
Основания
Ca(OH)2
Амфотерные
ZnO
соответствуют
Кислотные
P2O5
соответствуют
кислоты
H3 PO4
4. Кислотные оксиды
• Кислотные оксиды - это оксиды, которые
реагируют со щелочами с образованием соли и
воды, но они не реагируют с кислотами.
• Например, при взаимодействии кислотного оксида –
оксида углерода (IV) с гидроксидом натрия образуются
карбонат натрия и вода:
• CO2 + 2NaOH = Na2CO3 + H2O
• К кислотным оксидам относятся, как правило,
оксиды неметаллов (например, SO2, CO2, P2O5),
и те оксиды металлов, в которых металл
находится в валентности более III (например,
Mn2O7, CrO3).
5. Основные оксиды
6. Физические свойства
8. Амфотерные оксиды
• Эти оксиды проявляют двойные
свойства, т.е свойства и
кислотных, и основных оксидов.
Значит, они способны реагировать
как со щелочами, так и с
кислотами.
• К амфотерным оксидам относятся,
например, оксид алюминия, оксид цинка,
оксид бериллия, оксид хрома(III):
• Al2O3, ZnO, BeO, Cr2O3
9. Несолеобразующие
• безразличные оксиды не
реагируют с образованием
солей ни с кислотами, ни со
щелочами. К такому виду оксидов
относятся, например, оксиды азота N2O
и NO, оксид углерода(II) – СО.
10. Ответь на вопросы
• 1Ряд веществ, являющихся оксидами
А) Na2O, Na2O2, CuO, Cu2S
Б) FeO, Fe2O3, Fe3O4, FeCl2
2Ряд основных оксидов.
.
А) ZnO, BeO, Al2O3, Cr2O3
Б ) CaO, CuO, K2O, MgO
B) CO2, Cu2O, MgO, OF2
Г ) Li2O, SO3, BeO, Cl2O7.
B) CO2, Cu2O, BaO, Al2O3
Г ) CrO3, MnO, FeO, Na2O.
3 Ряд амфотерных оксидов:
А) SO2, SO3, V2O5, CuO
Б ) CaO, K2O, MgO, Li2O
B) ZnO, BeO, Fe2O3, Al2O3
Г) P2O5, Mn2O7, BaO, CO2.
11. Ответь на вопросы
• 4
Ряд кислотных оксидов:
А) Al2O3 , SO3, BeO, Cl2O7
Б) P2O5, Cl2O7, CrO3 , Mn2O7
B) Li2O, SO3, BeO, Cl2O7
Г) SO2, SO3, CuO, Mn2O3.
5 Ряд несолеобразующих оксидов:
А) Li2O, SO3, BeO, Cl2O7.
Б) ZnO, Mn2O7, MnO, Al2O3
В) CO, N2O, NO, SiO
Г) CrO3, MnO, FeO, Na2O.
12. Установите соответствие между формулами оксидов и характером их свойств.
Формулы оксидов
1) P2O5 и SO3
2) ZnO и SO2
3) CO2 и CO
4) СаО и FеО
Характер свойств оксидов
А) кислотный и кислотный
Б) основный и основный
В) амфотерный и кислотный
Г) амфотерный и основный
Д) солеобразующий и несолеобразующий
13. Проверь себя
14. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.)
• 1) О.О. + кислота =соль + вода (реакция обмена)
CaO + H2 SO4 → CaSO4 + H2O
• 2) О.О. + кислотный оксид = соль
(реакция соединения)
СaO + SiO2 = CaSiO3
• 3) О.О.(раств) + вода = основание (щелочь)
(реакция соединения)
Na2O + H2O → 2NaOH
15. Химические свойства
• 4. Взаимодействие с амфотерными
оксидами:
СaO + Al2O3 → Сa(AlO2)2
• 5.Многие основные оксиды могут
восстанавливаться до простых
веществ:
16. Химические свойства
• Оксиды благородных
металлов и ртути разлагаются при
нагревании:
• 2Ag2O → 4Ag + O2
• 2HgO = 2Hg + O₂
17. Тренировочные упражнения
• 1. К + O2 = КО2
• 2. K2O + H2O = 2KOH
• 3. 2KOH + H2SO4 = K2SO4 + 2H2O
• 1. 4Li + O2 = 2Li2O
• 2. Li2O + H2O = 2LiOH
• 3.LiOH + HCl = LiCl + H2O
19. Определения
• Гидроксиды – это электролиты, в
результате диссоциации их водных
растворов образуется толь один вид
анионов: гидроксид-анион ОН-.
20. Классификация гидроксидов
• ·По растворимости в воде
гидроксиды делятся на:
К растворимым гидроксидам относятся гидроксиды
щелочных и щелочноземельных металлов. Остальные
гидроксиды относятся к нерастворимым.
21. По количеству гидроксогрупп гидроксиды делятся на:
22. Физические свойства
• Гидроксиды щелочных металлов при обычных условиях –
это твердые белые вещества, гигроскопичны и очень
хорошо растворимы в воде. При растворении в воде
гидроксидов щелочных металлов происходит интенсивное
выделение тепла. Поэтому при приготовлении их растворов
нужно быть очень осторожным.
• Гидроксиды щелочноземельных металлов – это также белые
кристаллические вещества, но менее растворимые в воде,
чем гидроксиды щелочных металлов.
• Амфотерные гидроксиды в основном образуются в виде
студенистых гелеобразных осадков при прибавлении
растворов щелочей к растворимым солям соответствующих
металлов.
23. Химические свойства
• 1. Реакция с кислотами. Все гидроксиды
реагируют с кислотами с образованием
соли и воды.
• Реакция сильных гидроксидов с
сильными кислотами
называется реакцией нейтрализации.
• NaOH + HNO3 = NaNO3 + H2O
• Mg(OH)2 + 2HCl = MgCl2 + H2O
24. 2. Реакция с кислотными оксидами.
• 3. Реакция с солями. Щелочи реагируют с
растворами солей, если в результате
реакции один из продуктов выпадает в
осадок, поскольку образование
нерастворимых соединений смещает
равновесие вправо и делает её практически
необратимой.
• CuSO4 + 2NaOH = Cu (OH)2↓ +
Na2SO4
• Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
26. Химические свойства
• Разложение при нагревании.
Нерастворимые гидроксиды при
нагревании разлагаются на
соответствующий оксид и воду.
Cu (OH) 2
Mn (OH)2
CuO + H2O
MnO + H2O
Этот процесс происходит медленно и без нагревания при хранении оксидов в безводной среде.
27. Зарядка для глаз ( вверх вниз по ступеням, считаем фонари зигзагами)
28. Основные способы получения гидроксидов
• 1. Щелочи можно получить при
взаимодействии соответствующих
металлов с водой.
K + H2O =KOH + H2
Ba + H2O = Ba(OH)2 + H2
29. Получение
• 2. Щелочи можно получить при
взаимодействии оксидов щелочных и
щелочноземельных металлов с водой.
• BaO + H2O = Ba(OH)2
• 3. Электролиз растворов солей металлов
I-A и II-A группы.
• 2NaCl + 2H2O = 2NaOH + Cl2↑+ H2↑
30. Получение
• 4. Нерастворимые и амфотерные гидроксиды
получают в основном обменными реакциями
солей соответствующего металла со щелочью.
• NaOH + Fe(NO3)3 = NaNO3 +
Fe(OH)3↓
• Некоторые сложности наблюдаются
при получении амфотерных
гидроксидов,
• NaOH + Al(NO3)3 = NaNO3 +
Al(OH)3↓
31. Получение
• 5. Нерастворимые гидроксиды
можно получить при
необратимом гидролизе
некоторых солей.
• 2Al(NO3)3 + 3Na2S +6H2O →
2Al(OH)3↓+ 3H2S↑ + 6NaNO3
Оксиды и гидроксиды металлов
4. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.
5. Оксиды основные
6. Основные оксиды
• Химические свойства:
1. Взаимодействуют с водой (10. ) → щелочь:
Na2О + H2O →2NaOH
2. Взаимодействуют с кислотами →соль и вода:
Na2О + 2НCl → 2NaCl + H2О
3. Взаимодействуют с кислотными оксидами→соль:
Na2О + SO3 → Na2SO4
4. Взаимодействуют с амфотерными оксидами →
соль: Na2О + ZnO → Na2ZnO2
5. Взаимодействуют с восстановителями →Металл:
(не 10. )
CuО + C → Cu+CO
7. Амфотерные оксиды
• Химические свойства:
1. НЕ Взаимодействуют с водой
2. Взаимодействуют с кислотами →соль и воду:
Al 2О 3 + 6НCl → 2AlCl3 + 3H2О
3. Взаимодействуют с кислотными оксидами →
соль:
Al 2О 3 + 3SO3 → Al2 (SO4) 3
4. Взаимодействуют с восстановителями
→Металл:
Al 2О 3 + 3C → 2Al+3CO
5. Взаимодействуют со щелочами → соль:
Al 2О 3 + 2NaOH→ NaAlO2+ 2H2О
8. Получение оксидов металлов
ПОЛУЧЕНИЕ ОКСИДОВ
1.Окислением простых веществ:
2Cu+ О2 → 2CuО
2.Горением сложных веществ:
2H2 S+3О2 →2H2O+2SО2
3.Разложением сложных веществ при to :
1. Нерастворимых оснований
t
Cu(OН)2=CuО + H2O
2. Некоторых солей
t
СаСО3= СО2 + СаО
0
0
10. Гидроксиды металлов
11. Гидроксиды щелочных металлов
• Общая формула – МеОН
• Белые кристаллические вещества,
гигроскопичны, хорошо растворимы в
воде (с выделением тепла). Растворы
мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Щелочи. Основные свойства усиливаются
в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
12. Гидроксиды щелочных металлов
1. Изменяют цвет индикаторов:
Лакмус – синий
Фенолфталеин – малиновый
Метил-оранж – желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl+ H2O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO3 → Na2SO4+H2O
4. Взаимодействуют с растворами солей, если
образуется газ или осадок.
2NaOH + CuSO4 → Na2SO4+ Cu(OH)2
13. Гидроксиды щелочных металлов
5. Взаимодействуют с некоторыми неметаллами
(серой, кремнием, фосфором)
2NaOH +Si + H2O → Na2SiO3 + 2H2↑
6. Взаимодействуют с амфотерными
гидроксидами
2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]
Zn(OH)2+2NaOH=Na2ZnO2+2H2O
и амфотерными оксидами
Al 2О 3 + 2NaOH→ NaAlO2+ 2H2О
14. Гидроксиды металлов II гр.гл.подгр
• Общая формула – Ме(ОН)2
• Белые кристаллические вещества, в воде
растворимы хуже, чем гидроксиды
щелочных металлов. Ве(ОН)2 – в воде
нерастворим.
• Основные свойства усиливаются в ряду:
Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2
→ Вa(ОН)2
15. Гидроксиды металлов II гр.гл.подгр
• Ве(ОН)2 – амфотерный гидроксид
• Mg(ОН)2 – слабое основание
• Са(ОН)2, Sr(ОН)2, Ва(ОН)2 – сильные
основания – щелочи.
1. Изменяют цвет индикаторов:
Лакмус – синий
Фенолфталеин – малиновый
Метил-оранж – желтый
2. Взаимодействуют с кислотами, образуя соль
и воду:
Ве(ОН)2 + Н2 SO4 →BeSO4 + 2H2О
3. Взаимодействуют с кислотными оксидами.
Са(ОН)2 + SO3 →CaSO4
16. Гидроксиды металлов II гр.гл.подгр
4. Взаимодействуют с растворами солей,
если образуется газ или осадок.
Ва(ОН)2 + K2SO4 →BaSO4 + 2KOH
5. Гидроксид бериллия взаимодействует со
щелочами:
Ве(ОН)2 + 2NaOH → Na2[Ве(OH)4]
17. Получение гидроксидов
1.Получение растворимых в воде оснований-щелочей
А)Активный металл + вода= щелочь + водород
2Na + 2H2O→2NaOH + H2
Б)Основной оксид + вода = щелочь
K2O + H2O 2KOH
2.Получение нерастворимых в воде оснований
а)Растворимая соль + щелочь = нерастворимое
основание
2NaOH + CuSO4 → Na2SO4+ Cu(OH)2
Рефлексия
Задание 1.
Осуществите цепочку превращений:
К2O → КOH → K2SO4
Задание 2.
C какими веществами взаимодействует К2O:
серная кислота, гидроксид натрия, вода,
оксид серы (IV), оксид кальция
Задание 3.
C какими веществами взаимодействует КOН:
соляная кислота, гидроксид бария, вода,
оксид серы (IV), оксид натрия
Рефлексия
Задание 2. Решите задачу:
Задача 1. В результате полного восстановления
30,4 г смеси оксида железа (II) FeO и оксида
железа (III) Fe2O3 избытком CO было получено
11,2 л (н. у.) углекислого газа. Определите
массовую долю оксидов железа в смеси.
Решение:
хг
хмоль
FeO +CO═Fe+CO2
72г/моль
1моль
30,4г
11,2л или 0,5 моль
уг
у моль
Fe2O3 +3CO═2Fe+3CO2
160г/моль
3моль
|
Задание 2. Решите задачу:
Рефлексия
Задача 1. В результате полного восстановления
30,4 г смеси оксида железа (II) FeO и оксида
железа (III) Fe2O3 избытком CO было получено
11,2 л (н. у.) углекислого газа. Определите
массовую долю оксидов железа в смеси.
Решение:
x+3y=0,5
72х+160у=30,4
у=0,1моль
Ответ: w(FeO)=0,4737 или 47,37%
w(Fe2O3)=0,5263 или 52,63%
Рефлексия
Задание 2. Решите задачу:
Задача 2. Масса воды после восстановления
водородом 31,9 г смеси оксида меди (II) и
оксида железа (III) составляет 9 г. Вычислить
состав смеси оксидов (в процентах по массе).
Решение:
хг
хмоль
СuO+H2═Cu+H2O
80г/моль
1моль
30,4г
уг
у моль
Fe2O3 +3H2═2Fe+3H2O
160г/моль
3моль
|
9г или 0,5 моль
Задание 2. Решите задачу:
Рефлексия
Задача 2. Масса воды после восстановления
водородом 31,9 г смеси оксида меди (II) и
оксида железа (III) составляет 9 г. Вычислить
состав смеси оксидов (в процентах по массе).
Решение:
x+3y=0,5
80х+160у=30,4
у=0,12моль
Ответ: w(СuO)=0,3684 или 36,84%
w(Fe2O3)=0,6316 или 63,16%
Задача 3. На полную нейтрализацию раствора,
содержащего 34,2 г смеси гидроксидов натрия и
кальция, было израсходовано 29,4 г фосфорной
кислоты. Определите количественный состав
исходной смеси.
Задача 4*. При взаимодействии 12 г смеси
оксидов меди (II) и магния с азотной кислотой
образовалось 33,6 г нитратов этих металлов.
Определить массовые доли оксидов в
исходной смеси.
24. Рефлексия
1.На уроке я работал…
2.Своей работой на уроке я…
3.Урок для меня показался…
4.За урок я…
5.Мое настроение…
6.Материал урока мне был…
активно, доволен, коротким, не устал,
полезен, стало лучше, понятен,
интересен, легким.

презентация к уроку по теме "Оксиды и гидроксиды металлов". Урок-обобщение. Сравниваются свойства металлов 1,2,3 групп главных подгрупп и их кислородных соединений.
Просмотр содержимого документа
«Оксиды и гидроксиды металлов»
или = водород + основание (если основание не растворимо в воде)
Реакция протекает только в том случае, если
металл находится в ряду активности до водорода.
Основание – сложное вещество, в котором каждый атом металла связан с одной или несколькими гидроксогруппами.
в степенях окисления +1 и +2 проявляют основные свойства ,
Заполнить таблицу: Сравнительная характеристика оксидов и гидроксидов
металлов главных подгрупп I - III групп
Вопросы для сравнения
I группа
II группа
Степень окисления Ме в оксиде.
2. Физические свойства.
III группа
3. Химические свойства (сравнить).
4. Способы получения оксидов.
Взаимодействие:
б) с кислотами
в) с кислотными оксидами
г) с амфотерными оксидами
д) со щелочами
5. Формула гидроксида.
Степень окисления Ме в гидроксиде.
6. Физические свойства
7. Химические свойства (сравнить).
8. Способы получения гидроксидов.
а) действие на индикаторы
г) с растворами солей
д) с неметаллами
е) со щелочами
ж) с амфотерными оксидами и гидроксидами
з) отношение к нагреванию

Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов.
Na 2 O , Mg +2 O , Al 2 O 3
основные амфотерный
Na +1 O Н , Mg +2 (O Н ) 2 , Al +3 (O Н ) 3
щелочь Слабое Амфотерный
основание гидроксид
В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз .

Соединения металлов I А группы
Оксиды щелочных металлов
Общая формула Ме 2 О
Физические свойства: Твердые, кристаллические вещества, хорошо растворимые в воде.
Li 2 O , Na 2 O – бесцветные, К 2 О, Rb 2 O – желтые, Cs 2 О – оранжевый.
Способы получения:
Окислением металла получается только оксид лития
4 Li + O 2 → 2 Li 2 O
(в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li 2 O ) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Na 2 O 2 + 2Na → 2Na 2 O
KO 2 + 3K → 2K 2 O
Химические свойства
Типичные основные оксиды:
Взаимодействуют с водой, образуя щелочи: Na 2 О + H 2 O →
2. Взаимодействуют с кислотами, образуя соль и воду: Na 2 О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na 2 О + SO 3 →
4. Взаимодействуют с амфотерными оксидами, образуя соли: Na 2 О + ZnO → Na 2 ZnO 2

Гидроксиды щелочных металлов
Общая формула – МеОН
Физические свойства: Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Сильные основания - Щелочи. Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
1. Электролиз растворов хлоридов:
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2
2. Обменные реакции между солью и основанием:
K 2 CO 3 + Ca(OH) 2 → CaCO 3 + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2 Li + 2 H 2 O → 2 LiOH + H 2
Li 2 O + H 2 O → 2 LiOH
Na 2 O 2 + 2 H 2 O → 2 NaOH + H 2 O 2
![Химические свойства 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют со всеми кислотами. NaOH + HCl → NaCl + H 2 O 3. Взаимодействуют с кислотными оксидами. 2NaOH + SO 3 → Na 2 SO 4 + H 2 O 4. Взаимодействуют с растворами солей, если образуется газ или осадок. 2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными оксидами и гидроксидами 2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ] 2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ] 7. При нагревании не разлагаются, кроме LiOH .](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img11.jpg)
1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl + H 2 O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑
6. Взаимодействуют с амфотерными оксидами и гидроксидами
2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ]
2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ]
7. При нагревании не разлагаются, кроме LiOH .
![Соединения металлов главной подгруппы II группы Оксиды металлов II А группы Общая формула МеО Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде. Способы получения: Окисление металлов (кроме Ba , который образует пероксид) 2Са + О 2 → 2СаО 2) Термическое разложение нитратов или карбонатов CaCO 3 → CaO + CO 2 2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2 Химические свойства ВеО – амфотерный оксид Оксиды Mg , Ca , Sr , Ba – основные оксиды Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание): СаО + H 2 O → 2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img12.jpg)
Соединения металлов главной подгруппы II группы
Оксиды металлов II А группы
Общая формула МеО
Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде.
Окисление металлов (кроме Ba , который образует пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO 3 → CaO + CO 2
2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2
ВеО – амфотерный оксид
Оксиды Mg , Ca , Sr , Ba – основные оксиды
Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание):
2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 →
4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]

Гидроксиды металлов II А группы
Общая формула – Ме(ОН) 2
Физические свойства: Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН) 2 – в воде нерастворим.
Основные свойства усиливаются в ряду:
Ве(ОН) 2 → Mg (ОН) 2 → Ca (ОН) 2 → Sr (ОН) 2 → В a (ОН) 2
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2 H 2 O → Ba ( OH ) 2 + H 2
CaO (негашеная известь) + H 2 O → Ca ( OH ) 2 (гашеная известь)
![Химические свойства Ве(ОН) 2 – амфотерный гидроксид Mg (ОН) 2 – слабое основание Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют с кислотами, образуя соль и воду: Ве(ОН) 2 + Н 2 SO 4 → 3. Взаимодействуют с кислотными оксидами: Са(ОН) 2 + SO 3 → 4. Взаимодействуют с растворами солей, если образуется газ или осадок: Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ] При нагревании разлагаются: Са(ОН) 2 →](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img14.jpg)
Ве(ОН) 2 – амфотерный гидроксид
Mg (ОН) 2 – слабое основание
Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи.
Изменяют цвет индикаторов:
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН) 2 + Н 2 SO 4 →
3. Взаимодействуют с кислотными оксидами:
4. Взаимодействуют с растворами солей, если образуется газ или осадок:
Ва(ОН) 2 + K 2 SO 4 →
Гидроксид бериллия взаимодействует со щелочами:
Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ]
При нагревании разлагаются: Са(ОН) 2 →

Соединения металлов главной подгруппы III группы
Соединения алюминия
Оксид алюминия
Al 2 O 3
O = Al – O – Al = O
Физические свойства: Глинозем, корунд, окрашенный – рубин (красный), сапфир (синий).
Твердое тугоплавкое ( t° пл.=2050 ° С) вещество; существует в нескольких кристаллических модификациях.
Сжигание порошка алюминия: 4 Al + 3 O 2 → 2 Al 2 O 3
Разложение гидроксида алюминия: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O
![Химические свойства Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует. 1) Реагирует с кислотами и растворами щелочей: Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ] 2) Сплавляется со щелочами или карбонатами щелочных металлов: Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2 Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img16.jpg)
Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1) Реагирует с кислотами и растворами щелочей:
Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O
Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2
Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O
![Гидроксид алюминия Al ( OH ) 3 Физические свойства: белое кристаллическое вещество, нерастворимое в воде. Способы получения: 1) Осаждением из растворов солей щелочами или гидроксидом аммония: AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4 Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый) 2) Слабым подкислением растворов алюминатов: Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3 Химические свойства Al ( OH ) 3 - а мфотерный гидроксид : 1) Реагирует с кислотами и растворами щелочей: Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ] (тетрагидроксоалюминат натрия) При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img17.jpg)
Гидроксид алюминия Al ( OH ) 3
Физические свойства: белое кристаллическое вещество,
нерастворимое в воде.
1) Осаждением из растворов солей щелочами или гидроксидом аммония:
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl
Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4
Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый)
2) Слабым подкислением растворов алюминатов:
Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3
Al ( OH ) 3 - а мфотерный гидроксид :
Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O
Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ]
При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O

Презентация по химии "Оксиды и гидроксиды металлов" (10 класс)

В данной презентации рассматривается тема "Оксиды металлов",их получение и свойста,а также гидроксиды.Учащимся предлагается рассмотретьновый тип задач " Решние задач на смеси и сплавы металлов" .
Просмотр содержимого документа
«Презентация по химии "Оксиды и гидроксиды металлов" (10 класс)»

Оксиды и гидроксиды металлов
учитель химии,
высшая категория
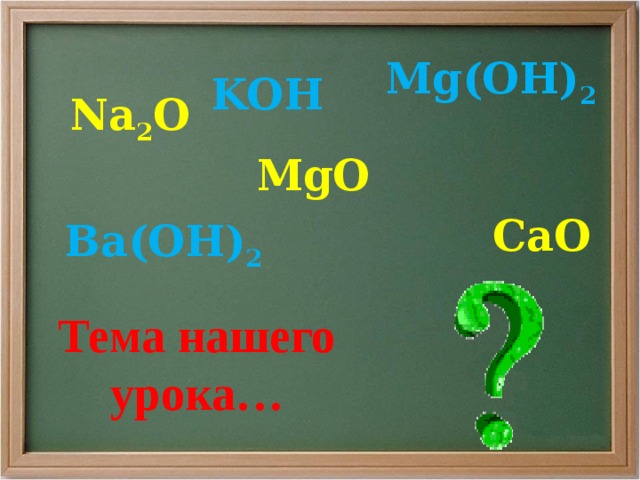
Mg(OH) 2
Na 2 O
Ba(OH) 2
Тема нашего урока…

. 05 .17г
«Оксиды и гидроксиды металлов»

В результате изучения темы, вы будете способны:
2. Рассматривать способы получения МеО и МеОН
3. Рассматривать хим.св-ва МеО и МеОН
4. Осуществлять ЦП.
5. Решать задачи на смеси Ме
6.Осуществлять рефлексию своей деятельности
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород .
Основания - сложные вещества, состоящие из атомов металла, соединенных с одной или несколькими гидроксогруппами.
- Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов.
- Na2O, Mg+2O , Al2O3
NaO Н , Mg +2 O Н , Al ( O Н) 3
- В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз.



I. ПОЛУЧЕНИЕ ОКСИДОВ
1. Окислением простых веществ:
2 Cu + О 2 = 2 Cu О
2 .Горением сложных веществ:
3.Разложением сложных веществ при t o :
1. Нерастворимых оснований
Cu ( O Н) 2 = Cu О + H 2 O
2 . Некоторых солей
СаСО 3 = СО 2 + СаО



Оксиды щелочных металлов( I гр.гл)
- Общая формулаМе2О
- Твердые, кристаллические вещества белого цвета
- Типичные основные оксиды:
- Взаимодействуют с водой, образуя щелочи:
Na 2 О + H 2 O →
2 . Взаимодействуют с кислотами, образуя соль и воду: К 2 О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na 2 О + SO 3 →
4. Взаимодействуют с амфотерными оксидами образуя соли: Na 2 О + ZnO(Zn(OH) 2) → Na 2 ZnO 2

Оксиды металлов II группы, главной подгруппы
- Общая формулаМеО
- Твердые, кристаллические вещества белого цвета
- ВеО – амфотерный оксид
- ОксидыMg, Ca, Sr, Ba– основные оксиды
![Оксиды металлов II группы, главной подгруппы Взаимодействуют с водой(кроме ВеО), образуя щелочи( MgO – слабое основание): СаО + H 2 O → 2 . Взаимодействуют с кислотами, образуя соль и воду: Mg О + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2NaOH + H 2 O → Na 2 [ Ве (OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img12.jpg)
- Взаимодействуют с водой(кроме ВеО), образуя щелочи(MgO– слабое основание):
СаО + H 2 O →
2 . Взаимодействуют с кислотами, образуя соль и воду: Mg О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 →
4. ВеО взаимодействует со щелочами:
ВеО + 2NaOH + H 2 O → Na 2 [ Ве (OH) 4 ]


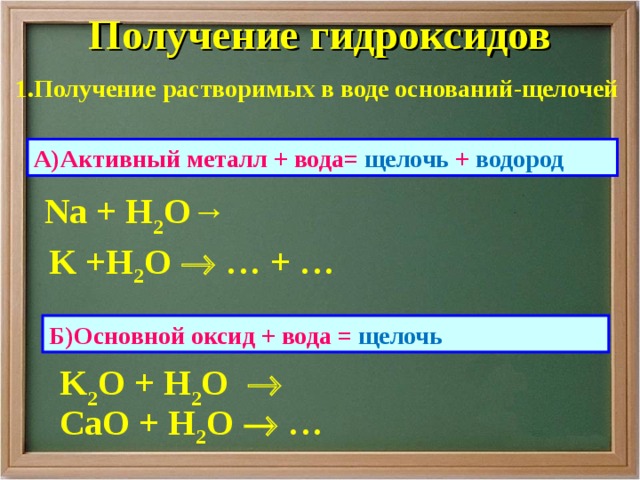
Получение гидроксидов
1.Получение растворимых в воде оснований-щелочей
А)Активный металл + вода= щелочь + водород
Na + H 2 O→
K +H 2 O … + …
Б)Основной оксид + вода = щелочь
K 2 O + H 2 O
Са O + H 2 O …



- Общая формула –МеОН
- Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Щелочи. Основные свойства усиливаются в ряду:

1. Изменяют цвет индикаторов:
Лакмус – на ….
Фенолфталеин – на ….
Метил-оранж – на ….
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → … + …
3. Взаимодействуют с кислотными оксидами.
NaOH + SO 3 → … + …
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
NaOH + CuSO 4 → … + …
![Гидроксиды щелочных металлов 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными гидроксидами 2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ] Zn(OH) 2 +2NaOH=Na 2 ZnO 2 +2H 2 O](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img20.jpg)
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑
6. Взаимодействуют с амфотерными гидроксидами
2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ]
Zn(OH) 2 +2NaOH=Na 2 ZnO 2 +2H 2 O

Гидроксиды металлов II гр.гл.подгр
- Общая формула –Ме(ОН)2
- Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН)2– в воде нерастворим.
- Основные свойства усиливаются в ряду:

Фенолфталеин – …..
Метил-оранж – ….
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН) 2 + Н 2 SO 4 →
3 . Взаимодействуют с кислотными оксидами.
Са(ОН) 2 + SO 3 →
![Гидроксиды металлов II гр.гл.подгр 4. Взаимодействуют с растворами солей, если образуется газ или осадок. Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2NaOH → Na 2 [ Ве (OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img23.jpg)
Ва(ОН) 2 + K 2 SO 4 →
- Гидроксид бериллия взаимодействует со щелочами:
Ве(ОН) 2 + 2NaOH → Na 2 [ Ве (OH) 4 ]


Осуществите цепочку превращений: упр.1 стр.232

Задание 2 . Решите задачу:
Задача 1 . В результате полного восстановления 30,4 г смеси оксида железа ( II) FeO и оксида железа (III ) Fe 2 O 3 избытком CO было получено 11,2 л (н. у.) углекислого газа. Определите массовую долю оксидов железа в смеси.
х г х моль
FeO +CO═Fe+ CO 2
72 г/моль 1 моль
у г у моль
Fe 2 O 3 + 3 CO═ 2 Fe+ 3 CO 2
160 г/моль 3 моль
11,2л или 0,5 моль

x+3y=0 , 5
х= 0,2моль
Ответ: w (FeO)=0,4737 или 47,37%
w (Fe 2 O 3 )=0,5263 или 52,63%

Задача 2. Масса воды после восстановления
водородом 31,9 г смеси оксида меди (II) и
оксида железа (II I ) составляет 9 г. Вычислить
состав смеси оксидов (в процентах по массе).
С uO+H 2 ═Cu+ H 2 O
80 г/моль 1 моль
Fe 2 O 3 + 3 H 2 ═ 2 Fe+ 3 H 2 O
9 г или 0,5 моль

х= 0,14моль
Ответ: w (С u O)=0,3684 или 36 , 84 %
w (Fe 2 O 3 )=0,6316 или 63,16%

Задача 3. На полную нейтрализацию раствора,
содержащего 34,2 г смеси гидроксидов натрия и
кальция, было израсходовано 29,4 г фосфорной
кислоты. Определите количественный состав исходной смеси.
Задача 4*. При взаимодействии 12 г смеси
оксидов меди (II) и магния с азотной кислотой
образовалось 33,6 г нитратов этих металлов.
Определить массовые доли оксидов в
исходной смеси.

1.На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок я… 5.Мое настроение… 6.Материал урока мне был…
активно, доволен, коротким, не устал, полезен, стало лучше, понятен, интересен, легким.
Читайте также:
