Металлическая связь между атомами образуется посредством
Обновлено: 16.05.2024
хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель М. с. отвечает образованию частично заполненных валентными электронами металла зон энергетич. уровней (см. Твердое тело), наз. зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать М. с. можно только в рамках квантовой механики, качественно образование М. с. можно понять исходя из представлений о ковалентной связи.
При сближении двух атомов металла, напр. Li, образуется ковалентная связь, при этом происходит расщепление каждого энергетич. уровня валентного электрона на два. Когда Nатомов Li образуют кристаллич. решетку, перекрывание электронных облаков соседних атомов приводит к тому, что каждый энергетич. уровень валентного электрона расщепляется на Nуровней, расстояния между к-рыми из-за большой величины Nнастолько малы, что их совокупность может считаться практически непрерывной зоной энергетич. уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании большего числа связей, чем, напр., в двухатомной молекуле при том же числе валентных электронов, то минимум энергии системы (или максимум энергии связи) достигается при расстояниях больших, чем в случае двухцентровой связи в молекуле. Межатомные расстояния в металлах заметно больше, чем в соед. с ковалентной связью (металлич. радиус атомов всегда больше ковалентного радиуса), а координац. число (число ближайших соседей) в кристаллич. решетках металлов обычно 8 или больше 8. Для наиб. часто встречающихся кристаллич. структур координац. числа равны 8 (объемноцентрир. кубич.), 12 (гранецентрир. кубическая и гексаген. плотно-упакованная). Расчеты параметров металлич. решеток с использованием ковалентных радиусов дают заниженные результаты. Так, расстояние между атомами Li в молекуле Li 2 (ковалентная связь) равно 0,267 нм, в металле Li-0,304 нм. Каждый атом Li в металле имеет 8 ближайших соседей, а на расстоянии, в
Во мн. металлах М. с. между атомами включает вклады ионной или ковалентной составляющей. Особенности М. с. у каждого металла м. б. связаны, напр., с электростатич. отталкиванием ионов друг от друга с учетом распределения электрич. зарядовое них, с вкладом в образование связи электронов внутр. незаполненных оболочек переходных металлов, с корреляцией движения электронов в электронном газе и нек-рыми др. причинами.
М. с. характерна не только для металлов и их сплавов, но и для металлических соединений (см. также Интерметал-лиды), она сохраняется не только в твердых кристаллах, но и в расплавах и в аморфном состоянии.
Лит.: Блейкмор Дж., Физика твердого тела, пер. с англ., М., 1988. См. также лит. при ст. Металлы. Ю. С. Старк.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое "МЕТАЛЛИЧЕСКАЯ СВЯЗЬ" в других словарях:
Металлическая связь — Металлическая связь это одновременное существование положительно заряженных атомов и свободного электронного газа. Содержание 1 Механизм металлической связи 2 Характерные кристаллические решётки … Википедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — тип хим. связи атомов в в вах, обладающих металлич. св вами. М. с. обусловлена большой концентрацией в таких кристаллах эл нов проводимости. Отрицательно заряженный «электронный газ» удерживает положительно заряженные ионы на определённых… … Физическая энциклопедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, в химии связь, удерживающая вместе атомы МЕТАЛЛА. Внутри кристаллов металлов положительно заряженные ионы держаться посредством электростатического притяжения облака окружающих электронов, которые могут двигаться под… … Научно-технический энциклопедический словарь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — особый тип хим. связи атомов в металлах и интерметаллических соединениях, обусловленный высокой концентрацией в кристаллах электронов проводимости. Отрицательно заряженное электронное облако удерживает положительно заряженные ионы на определённых … Большая политехническая энциклопедия
металлическая связь — [metal bond] межатомная связь, характерная для металлов с равномерной плотностью электронного газа. Металлическая связь обусловлена взаимодействием отрицательно заряженного электронного газа и положительно заряженных ионных остовов,… … Энциклопедический словарь по металлургии
металлическая связь — химическая связь, обусловленная взаимодействием «электронного газа» (валентные электроны) металлов с остовом положительно заряженных ионов кристаллической решётки. По природе близка к ковалентной связи. Характерна для металлов, их сплавов,… … Энциклопедический словарь
металлическая связь — metališkasis ryšys statusas T sritis chemija apibrėžtis Delokalizuoto cheminio ryšio tipas, esantis visuose metaluose. atitikmenys: angl. metallic bond rus. металлическая связь … Chemijos terminų aiškinamasis žodynas
металлическая связь — metališkasis ryšys statusas T sritis fizika atitikmenys: angl. metallic bond vok. metallische Bindung, f rus. металлическая связь, f pranc. liaison métallique, f … Fizikos terminų žodynas
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь, возникающая при образовании химического соединения из металлических элементов. Химический состав этих соединений из за нежесткой металлической связи непостоянен и не соответствует стехиометрическому соотношению элементов по формуле данного … Металлургический словарь
Металлическая связь — тип связи атомов в кристаллических веществах, обладающих металлическими свойствами (металлах (См. Металлы), металлидах (См. Металлиды)). М. с. обусловлена большой концентрацией в таких кристаллах квазисвободных электронов (электронов… … Большая советская энциклопедия
Проверочная работа по химии Химическая связь 9 класс
Проверочная работа по химии Химическая связь 9 класс с ответами. Работа представлена в 3 вариантах в виде теста. В каждом варианте по 15 заданий.
1 вариант
1. Ковалентная связь между атомами образуется посредством:
1) общих электронных пар
2) электростатического притяжения ионов
3) «электронного газа»
4) электростатического притяжения молекул
2. Металлическая связь образуется между атомами:
1) кремния
2) цезия
3) фосфора
4) хлора
3. Формулы только ионных соединений находятся в ряду:
4. Ковалентная связь образуется между атомами, расположенными в периодической системе:
1) в 1 периоде, IA группе и во 2 периоде, VIA группе
2) в 3 периоде, IIА группе и во 2 периоде, VIA группе
3) в 4 периоде, IА группе и в 3 периоде, VIIA группе
4) в 3 периоде, IA группе и во 2 периоде, VIIA группе
5. Для молекулы Н2S не верно, что:
1) между атомами существуют ковалентные полярные связи
2) атом серы образует две одинарные связи
3) электронная плотность смещена к атому серы
4) атом серы образует двойную связь
6. Ковалентная неполярная связь существует между атомами в молекулах каждого из двух веществ:
1) хлороводород и аммиак
2) кислород и хлор
3) оксид серы (VI) и сульфид натрия
4) бромид лития и оксид алюминия
7. Для молекулы CO2 верно, что:
1) между атомами существуют двойные связи
2) электронная плотность связи С — О смещена к углероду
3) углерод образует 4 одинарные связи
4) связь С — О ковалентная неполярная
8. Наименее полярной является ковалентная связь в молекуле:
9. В оксиде кальция имеются связи:
1) ковалентная полярная и ионная
2) ковалентная неполярная
3) только ионная
4) ковалентная полярная и неполярная
10. В соединении K2SO4 имеются связи:
11. Молекулярная кристаллическая решетка характерна для:
1) хлорида калия
2) углекислого газа
3) натрия
4) нитрата натрия
12. Для веществ с ионной кристаллической решеткой характерны физические свойства:
1) высокая температура плавления
2) хрупкость
3) ковкость
4) летучесть
5) металлический блеск
13. И для алмаза, и для диоксида кремния характерны физические свойства:
1) пластичность
2) высокая твердость
3) неспособность проводить электрический ток
4) низкие температуры плавления
5) хорошая растворимость в воде
14. Установите соответствие между веществом и типом химической связи между атомами в нем:
А) сера
Б) бромоводород
В) бромид магния
Г) магний
Тип химической связи
1) металлическая
2) ковалентная полярная
3) ковалентная неполярная
4) ионная
5) водородная
15. Установите соответствие между веществом и его характеристиками:
А) кальций
Б) хлороводород
В) азот
Г) хлорид кальция
1) между атомами — ковалентная неполярная связь, молекулярная кристаллическая решетка, в обычных условиях — газ
2) между атомами — ионная связь, ионная кристаллическая решетка, твердое вещество
3) между атомами — металлическая связь, металлическая кристаллическая решетка, твердое вещество
4) между атомами — ковалентная полярная связь, молекулярная кристаллическая решетка, газ
5) между атомами — ковалентная полярная связь, молекулярная кристаллическая решетка, жидкость
2 вариант
1. Металлическая связь между атомами образуется посредством:
2. Ковалентная связь образуется между атомами:
1) лития
2) фосфора
3) цезия
4) аргона
4. Ковалентная связь не образуется между атомами, расположенными в периодической системе:
1) в 1 периоде, IА группе и во 2 периоде, VA группе
2) в 3 периоде, VIA группе и во 2 периоде, VIA группе
3) в 3 периоде, IА группе и во 2 периоде, VIIA группе
4) в 1 периоде, IА группе и в 3 периоде, VIIA группе
5. Для молекулы Н2O верно, что:
1) между атомами существуют ковалентные полярные связи
2) атом кислорода образует двойную связь
3) электронная плотность смещена к атому водорода
4) между атомами существуют ионные связи
1) хлороводород и аммиак
2) оксид серы (IV) и оксид алюминия
3) бромид лития и оксид лития
4) фосфор и бром
7. Для молекулы SO3 верно, что:
1) электронная плотность связи S — О смещена к сере
2) сера образует 4 одинарные связи
3) связь S — О — ковалентная неполярная
4) между атомами существуют двойные связи
8. Наиболее полярной является ковалентная связь в молекуле:
9. В оксиде фосфора (V) имеются связи:
1) ковалентная полярная и ионная
2) ковалентная неполярная
3) только ионная
4) ковалентная полярная
10. В соединении К3РO4 имеются связи:
1) ковалентная полярная и неполярная
2) ковалентная неполярная
3) только ионная
4) ковалентная полярная и ионная
11. Ионная кристаллическая решетка характерна для:
1) хлорида бария
2) сернистого газа
3) натрия
4) кислорода
12. Для веществ с металлической кристаллической решеткой характерны физические свойства:
1) высокая температура плавления
2) хрупкость
3) ковкость
4) летучесть
5) характерный блеск
13. И для углекислого газа, и для кислорода характерны физические свойства:
А) оксид кремния
Б) железо
В) хлорид магния
Г) фосфор
А) кислород
Б) сульфид калия
В) оксид углерода (IV)
Г) оксид кремния
1) между атомами — ковалентная неполярная связь, молекулярная кристаллическая решетка, в обычных условиях — газ
2) между атомами — ковалентная полярная связь, молекулярная кристаллическая решетка, газ
3) между атомами — металлическая связь, металлическая кристаллическая решетка
4) между атомами — ионная связь, ионная кристаллическая решетка, твердое вещество
5) между атомами — ковалентная полярная связь, атомная кристаллическая решетка, твердое вещество
3 вариант
1. Ионная связь между атомами образуется посредством:
1) кремния
2) лития
3) железа
4) гелия
3. Формулы всех соединений с металлической связью приведены в ряду:
4. Ионная связь образуется между атомами, расположенными в периодической системе:
1) в 1 периоде, IА группе и во 2 периоде, VIA группе
2) в 3 периоде, VIA группе и во 2 периоде, VIA группе
3) в 4 периоде, IА группе и во 2 периоде, VIIA группе
4) в 1 периоде, IA группе и во 2 периоде, VIIA группе
5. Для молекулы NH3 не верно, что:
1) между атомами существуют ковалентные полярные связи
2) атом азота образует тройную связь
3) электронная плотность смещена к атому азота
4) атом азота образует три одинарные связи
1) аммиак и оксид кальция
2) кремний и бор
3) оксид азота (V) и хлорид калия
4) хлороводород и оксид алюминия
7. Для молекулы Н2O верно, что:
1) между атомами существуют двойные связи
2) кислород образует 2 одинарные связи
3) связь Н — О — ковалентная неполярная
4) электронная плотность связи Н — О смещена к водороду
8. Наименее полярной является связь в молекуле:
9. В оксиде серы (VI) имеются связи:
1) ковалентная полярная и ионная
2) ковалентная неполярная
3) ковалентная полярная
4) только ионная
10. В соединении Na2CO3 имеются связи:
11. Металлическая кристаллическая решетка характерна для:
1) сульфата калия
2) углекислого газа
3) цинка
4) нитрата цинка
12. Для веществ с молекулярной кристаллической решеткой характерны физические свойства:
1) низкая темпера тура плавления
2) хрупкость
3) ковкость
4) летучесть
5) металлический блеск
13. И для хлорида натрия, и для сульфата меди (II) характерны физические свойства:
1) пластичность
2) низкая твердость
3) способность проводить электрический ток в расплаве и водном растворе
4) низкие температуры плавления
5) хорошая растворимость в воде
А) хлорид кальция
Б) оксид фосфора (V)
В) фтор
Г) барий
А) свинец
В) вода
В) алмаз
Г) оксид натрия
1) между атомами — ковалентная неполярная связь, атомная кристаллическая решетка, твердое вещество
2) между атомами — ионная связь, ионная кристаллическая решетка, твердое вещество
3) между атомами — металлическая связь, металлическая кристаллическая решетка, твердое вещество
4) между атомами — ковалентная полярная связь, молекулярная кристаллическая решетка, газ
5) между атомами — ковалентная полярная связь, молекулярная кристаллическая решетка, жидкость
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
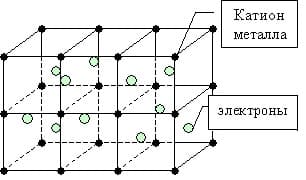
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
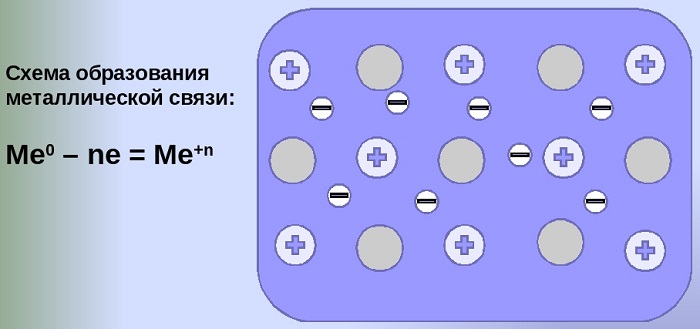
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
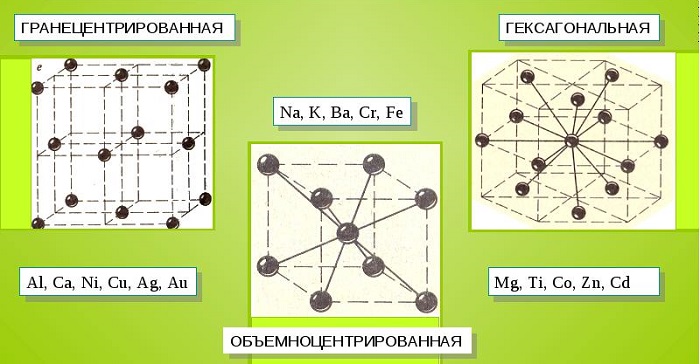
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
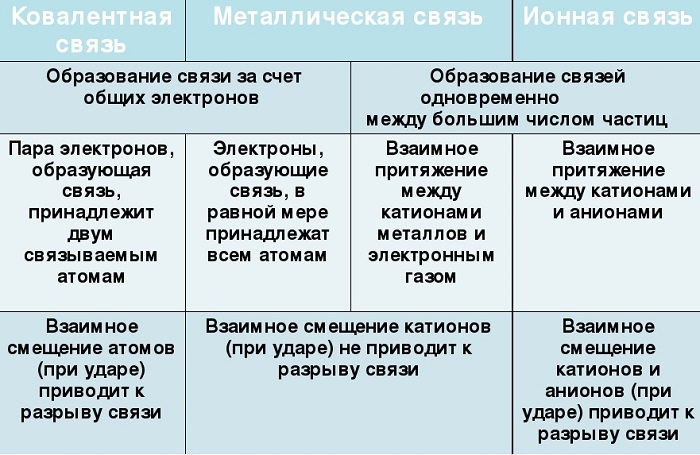
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа.
Содержание
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).



Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей – положительно заряженных ионов щелочного металла (рис.1). Кулоновское отталкивание одноимённо-заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра – квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной трансляционной решётке aw кристалла щелочного металла (рис.2).
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляцонной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щёлочный металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Постоянная решётка aw,Å [1] | 3,5021 | 4,2820 | 5,247 | 5,69 | 6,084 |
| Длина ковалентной связи, Me2, Å [2] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место, где пребывают электроны, обеспечивая основное свойство металла – проводить электрический ток [3] . Таким образом, электрический ток в металлах – это движение сорванных с орбитального радиуса электронов в поле положительно заряженных ионов, находящихся в узлах кристаллической решётки металла. Выход и вход свободных электронов в связывающее звено кристалла осуществляется через точки «0», равноудалённые от положительных ионов атомов (рис.2).
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом – свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебания ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла. В настоящее время важнейшим признаком металлов считается отрицательный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры. С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости. В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия.»
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары – коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ – Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике “За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Читайте также:
