Металлические сплавы по сравнению с составляющими их чистыми металлами
Обновлено: 19.05.2024
Из всех известных в настоящее время элементов более половины являются металлами. Металлы — непрозрачные вещества, обладающие специфическим металлическим блеском, пластичностью, высокой теплопроводностью и электропроводностью.
Файлы: 1 файл
Курсовая прокатчика.doc
Понятие о металлах и сплавах.
Из всех известных в настоящее время элементов более половины являются металлами. Металлы — непрозрачные вещества, обладающие специфическим металлическим блеском, пластичностью, высокой теплопроводностью и электропроводностью. По этому признаку металлы легко отличить от других веществ (дерево, стекло и т. д.).
Все металлы и образованные из них сплавы делят на черные (к ним относят железо и сплавы на его основе, на их долю приходится около 95 % производимой в мире металлопродукции) и цветные. В технике принята условная классификация, по которой металлы делят на группы:
- легкие — алюминий (Al),магний (Mg);
- тяжелые — медь (Си), свинец (Рb);
- тугоплавкие — вольфрам (W), молибден (Мо);
- благородные — золото (Аu), платина (Pt);
- рассеянные — гадолиний (Gd), индий (In), таллий (Tl);
- редкоземельные — скандий(Sc), иттрий (Y);
- радиоактивные — радий (Ra), уран (U).
Понятие „чистый металл” весьма условно. Любой чистый металл содержит примеси, а поэтому его следует рассматривать как сплав. Под термином „чистый металл” понимается металл, содержащий 0,010-0,001% примесей. Современная металлургия позволяет получать металлы высокой чистоты (99,999%). Однако примеси даже в малых количествах могут оказывать существенное влияние на свойства металла.
Чистые металлы обладают низкой прочностью и не обеспечивают требуемых физико-механических и технологических свойств. Поэтому их применение в технике в качестве конструкционных материалов ограничено. Наиболее широко применяют сплавы, которые обладают по сравнению с чистыми металлами более высокой прочностью и твердостью.
Сплавы — твердые и жидкие вещества — получают сплавлением или спеканием двух или более металлов или металлов с неметаллами. Элементы, образующие сплав, называют компонентами. Сплавы могут состоять из двух или большего числа компонентов. Строение металлического сплава более сложное по сравнению с чистым металлом.
Для рассмотрения строения, превращений и свойств металлов и сплавов введем понятие „фаза” и „структура”.
Фазой называется однородная часть системы (металла или сплава), имеющая границы раздела, при переходе через которые их свойства резко меняются.
Например, жидкий металл является однофазной системой; смесь жидкого металла и твердых кристалликов — двухфазной системой, так как свойства жидкого металла значительно отличаются от свойств твердых кристалликов. Фазами могут быть отдельные металлы, их химические соединения, а также растворы на основе металлов.
Под структурой понимается строение металла, т.е. взаимное расположение различных фаз, форма и размер составляющих их кристаллов.
Структурными составляющими сплава называются обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями. Структурные составляющие могут состоять из одной, двух или более фаз.
Одна из важнейших задач металловедения — определение связи между структурой и свойствами.
Кристаллические решетки.
В кристаллических веществах, к которым относятся все металлы, находящиеся в твердом состоянии, атомы занимают вполне определенное место, образуя пространственную решетку. Элементарная (наименьшая) ячейка этой решетки у каждого кристаллического вещества имеет свое, строго определенное строение и размеры (параметры). По „узору” и числу атомов в элементарной ячейке различают несколько типов атомных решеток.
У металлов чаще всего наблюдаются решетки следующих типов:
- кубическая объемноцентрированная (α-железо, вольфрам, молибден, β-титан и др.),
- кубическая гранецентрированная (γ-железо, алюминий, золото, медь, серебро, свинец и др.),
- гексагональная (бериллий, кадмий, магний, α-титан, цинк, γ-хром и др.).
Элементарная ячейка объемноцентрированной кубической (о.ц.к.) решетки образована девятью атомами, восемь из которых расположены на вершинах воображаемого куба, а девятый — в его центре (рис. 1,а).
Элементарная ячейка гранецентрированной кубической (г.ц.к.) решетки имеет более плотную упаковку и содержит 14 атомов — восемь расположены на вершине куба и шесть на пересечении диагоналей его граней (рис. 1,б).
Элементарная ячейка гексагональной решетки представляет собой гексаэдр (шестигранную призму), в центре основания которого и вершинах углов расположены атомы; кроме того, три атома находятся внутри гексаэдра. Всего ячейка содержит 17 атомов (рис. 1, в).
В элементарной ячейке кристаллической решетки можно выделить ряд характерных, так называемых кристаллографических плоскостей. В зависимости от ориентации плоскость может пересекать большее или меньшее количество атомов. В кубической о.ц.к. решетке наибольшее число атомов пересекает плоскость, проходящую по диагонали куба (рис. 1,г), в кубической г.ц.к. решетке — через диагонали граней и диагональ куба (рис. 1, д) в гексагональной — через его основание. Последняя плоскость называется базисной плоскостью.
В результате повторений элементарной ячейки в трех измерениях образуется тело кристалла с однообразно ориентированной атомной решеткой. Внешняя форма кристалла или, как его часто называют, монокристалла зависит от строения элементарной ячейки и условий кристаллизации, т.е. от образования кристаллов при переходе из жидкого состояния в твердое.
Кристаллы правильной формы встречаются в природе довольно часто. Они наблюдаются у поваренной соли, кварца, льда (снежинок) и других неметаллических веществ. Монокристаллы металла можно вырастить только искусственно в специальных условиях.
Рис. 1. Основные типы элементарных ячеек, образующих кристаллические решетки металлов, и положение кристаллографических плоскостей, наиболее плотно усеянных атомами.
Если измерить в различных направлениях физические свойства монокристалла, то окажется, что они будут сильно зависеть от выбранного направления, т.е. монокристалл обладает ярко выраженной анизотропией свойств. При испытании образцов, вырезанных из кристалла меди, было обнаружено, что в зависимости от направления их вырезки прочность образцов изменялась от 140 до 350 МПа, а относительное удлинение — в пять раз; изменялись также электро- и теплопроводность и другие свойства. Это объясняется тем, что в зависимости от избранного направления вырезки образцы совпадали с той или иной кристаллографической плоскостью, имеющей разную плотность атомов.
Известно, что атомы твердых тел совершают тепловые колебания. С ростом температуры кристаллического тела амплитуда колебаний атомов возрастает и при температуре плавления настолько увеличивается, что разрушается кристаллическая решетка — металл плавится.
Внешний вид металлического изделия не создает впечатления о металле, как о кристаллическом теле, так как металл, затвердевающий в обычных условиях, превращается не в монокристалл, а в массу, состоящую из большого количества отдельных кристалликов, ориентированных по отношению друг к другу по-разному, называемую поликристаллом. Поэтому физические свойства металла в целом одинаковы во всех направлениях.
В металлах всегда присутствует то или иное количество посторонних примесей. При кристаллизации примеси мешают правильному росту кристаллов, и форма их искажается. Такие кристаллы обычно называют кристаллитами или зернами.
Чтобы увидеть внутреннее строение металла, необходимо тщательно отполировать срез небольшого металлического образца, затем полированную поверхность протравить, т.е. обработать специально подобранными для данного металла химическими растворами. Растворы — смеси кислот или щелочей, взаимодействуя либо с самими кристаллами, либо с межкристаллитным веществом, выявляют структуру металла (рис. 2, а).
Рис. 2. Структура чистого металла и сплавов.
Значительно более сложное строение имеют кристаллиты сплавов двух или нескольких металлов. Температура плавления отдельных металлов неодинакова, поэтому температура плавления смеси зависит от соотношения массы компонентов. При кристаллизации сплавов первыми начинают выпадать из расплава самые тугоплавкие частицы, в состав которых в большинстве своем входят металлы, имеющие наиболее высокую температуру плавления. На первичных частицах нарастают вторичные, менее тугоплавкие и т.д. Кристаллит развивается, как дерево — сначала ствол, затем ветви — все тоньше и тоньше. Поэтому такие кристаллиты называют дендритами (от латинского названия дерева). По мере кристаллизации в твердом состоянии оказывается все больше тугоплавких составляющих сплава, а жидкость, окружающая кристаллиты (межкристаллитное вещество), становится все более легкоплавкой, поэтому она твердеет в последнюю очередь. На (рис. 2, б), представлена микрофотография структуры сплава. Следовательно, межкристаллитное вещество, обволакивающее каждый кристаллит и спаивающее их все в одно целое, кристаллизуется в самую последнюю очередь. При нагревании, наоборот, межкристаллитное вещество плавится в первую очередь, затем, при повышении температуры, начинают переходить в жидкое состояние части кристаллитов в порядке, обратном кристаллизации, т.е., если чистые металлы плавятся при строго определенной температуре, сплавы плавятся в интервале температур.
При сплавлении двух металлов могут быть три характерных случая:
1. Оба металла неограниченно растворяются друг в друге при любых температурах, например медь и никель, золото и серебро. Такие сплавы обладают высокой пластичностью и хорошо обрабатываются давлением в горячем и даже холодном состоянии, но плохо обрабатываются резанием — под резцом образуется длинная вьющаяся стружка, возникают налипы.
2. Металлы растворяются друг в друге в твердом состоянии ограниченно, причем наиболее часто степень растворимости очень сильно зависит от температуры. Например, при постепенном добавлении к меди цинка он сначала целиком растворяется, а по достижении содержания цинка более 40 % образуются совершенно новые кристаллы — с другой решеткой, возникает новая фаза, т.е. сплав становится двухфазным (рис. 2, в). Физико-химические свойства фаз, как правило, весьма различны, имеют разную твердость, пластичность и т.д. У двухфазных сплавов обычно более низкие пластические свойства, чем у однофазных, они хуже обрабатываются давлением, но лучше резанием.
3. Металлы, кроме растворов, образуют химические соединения. Например, в сплаве меди с оловом Cu3Sn химическое соединение выступает как самостоятельный компонент сплава, а его количество зависит от соотношения основных металлов.
Химические соединения, имеют очень высокую твердость, превосходящую твердость основных компонентов в десятки раз. Известны химические соединения, например карбиды вольфрама, молибдена или титана, твердость которых приближается к твердости алмаза. Технологические свойства подобных сплавов зависят от количества интерметаллических включений, а главное — от их формы. Например, включения в виде игл и пластинок способствуют разрушению кристалла при деформации.
Реальная кристаллическая решетка металла не является неподвижной конструкцией. Все составляющие ее частицы находятся в непрерывном движении: движутся оторванные от атомов электроны, обеспечивая межатомную металлическую связь и электрическую проводимость, около своих средних положений совершают колебательные движения атомы; время от времени тот или иной атом при превышении определенного энергетического уровня начинает перемещаться по кристаллу, нарушая правильность кристаллической решетки. Такие нарушения вызывают и "чужеродные" атомы — атомы примесей, которые внедряются в решетку при кристаллизации. Мельчайшие пузырьки газа, трещинки, включения неметаллических примесей ослабляют кристаллическую решетку, делают ее несовершенной, тем самым, изменяя и свойства металлов и сплавов.
Сплавы. Виды, характеристики сплавов
Из-за низких механических свойств чистые металлы как конструкционные материалы в машиностроении находят ограниченное применение по сравнению со сплавами.
Сплав — это конструкционный материал, полученный путем сплавления нескольких химических элементов (металлов и неметаллов) и обладающий свойствами, присущими основному сплавляемому элементу.
Металлический сплав может быть получен не только сплавлением химических элементов, но и такими способами, как спекание, электролиз, диффузия, плазменное напыление, возгонка и др. Конструкционный материал, полученный не сплавлением, называется псевдосплавом. Если сплав имеет в своем составе 50 % металла и более, то он называется металлическим сплавом.
Металлический сплав имеет более высокие механические и технологические свойства по сравнению с неметаллическим сплавом. Химические элементы, образующие сплав, называются компонентами.
По своему составу сплавы могут быть двухкомпонентными (металл + металл, металл + неметалл), трех- и более компонентными. Внутреннее строение сплавов определяется формой связи между компонентами.
Двухкомпонентные сплавы при нагревании (охлаждении) в силу особенностей взаимодействия друг с другом ведут себя неадекватно и, в связи с этим, имеют различное физическое строение и свойства.
К промышленным сплавам, которые находят широкое применение, относятся:
- чугун и сталь — сплавы железа с углеродом;
- латунь — сплав меди с цинком;
- бронза — сплав меди с оловом и др.
Сплавы имеют атомно-кристаллическое строение, обладают аллотропией (полиморфизмом) и, по сравнению с чистыми металлами, более высокими механическими и технологическими свойствами.
Форма металлической связи сплавляемых химических элементов влияет на образование структуры сплава, их атомно-кристаллическую решетку.
Фазы. Сплавам, так же как и чистым металлам, характерно атомно-кристаллическое строение. Сплав в твердом состоянии может иметь различную связь атомно-кристаллических решеток. Жидкое или твердое состояние химических компонентов, образующих сплав при определенной температуре и давлении, называется системой.
Однородная часть системы, отделенная от других частей условной границей (линией), называется фазой.
Жидкая фаза характеризуется тем, что атомные кристаллические решетки сплавляемых компонентов распадаются и компоненты растворяются друг в друге или не растворяются и присутствуют в сплаве самостоятельно. Эта закономерность присуща многим сплавам.
Твердая фаза — это однородная часть сплава с определенными атомно-кристаллическим строением и массовой долей сплавляемых компонентов. Атомные решетки сплавляемых компонентов взаимодействуют в строго определенном порядке. Атомные решетки химических элементов, образующих сплав в твердом состоянии, образуют мелкие кристаллы — структуры.
В зависимости от внутреннего строения сплавов и металлической или химической связи между сплавляемыми элементами сплавы подразделяются на две группы:
- однородные сплавы;
- неоднородные сплавы.
Однородные сплавы имеют общие атомные кристаллические решетки, в которые входят атомы сплавляемых компонентов.
Неоднородные сплавы имеют самостоятельные кристаллические решетки сплавляемых компонентов.
По характеру взаимодействия сплавляемых компонентов в твердой фазе различают механические смеси, твердые растворы и химические соединения.
Механическая смесь сплавляемых компонентов А и Б (рис. 1, а) образуется тогда, когда атомные кристаллические решетки сохраняются и не вступают в химическую реакцию с образованием какого-либо нового соединения. Связь между атомными решетками осуществляется за счет металлической связи. Механическая смесь сплава будет неоднородного типа, т. е. сплавляемые компоненты А и Б в сплаве будут самостоятельными и чередоваться между собой в зависимости от их соотношения.
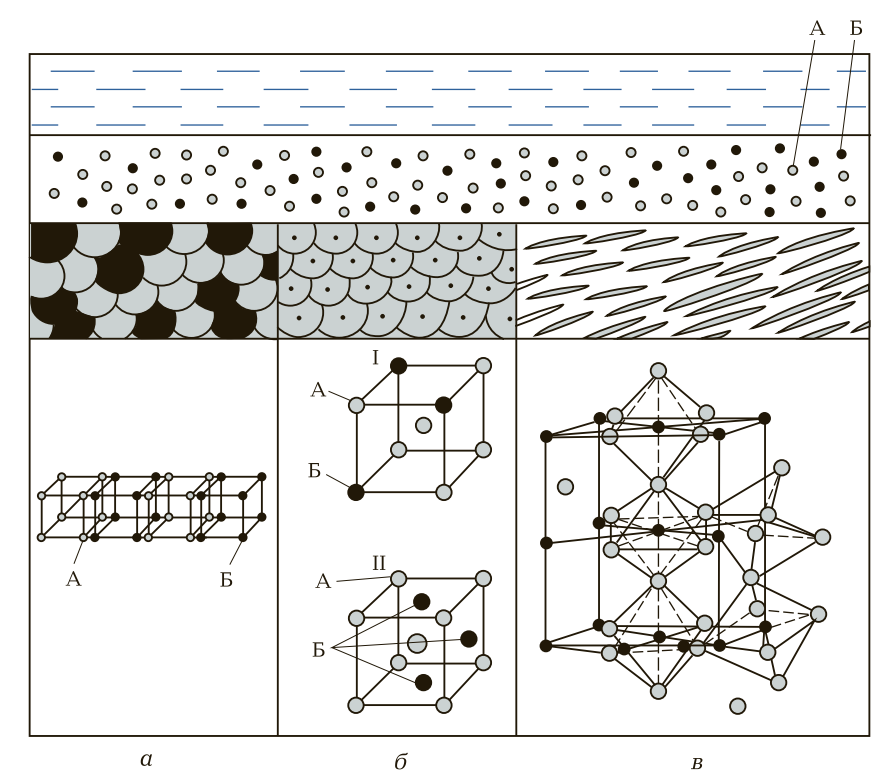
Рис. 1. Схематическое изображение структуры сплава: а — механическая смесь; б — твердый раствор (I — раствор замещения; II — раствор внедрения); в — химическое соединение; А, Б — сплавляемые компоненты
Свойства механической смеси зависят от свойств сплавляемых компонентов А и Б. Как правило, эти микроструктуры имеют относительно высокую твердость, прочность, ударную вязкость, хорошо обрабатываются резанием.
Твердые растворы в зависимости от взаимодействия атомов подразделяются на твердые растворы внедрения и твердые растворы замещения (рис. 1, б ).
На рис. 1, б, I показана атомно-кристаллическая решетка твердого раствора замещения. Атомно-кристаллическая решетка основного компонента А в форме объемно-центрированного куба (девять атомов) сохранилась, но три атома этого компонента замещены атомами сплавляемого компонента Б.
На рис. 1, б, II показана атомно-кристаллическая решетка твердого раствора внедрения. При этом виде образования сплава атомно-кристаллическая решетка основного компонента А сохраняется. Атомно-кристаллическая решетка сплавляемого компонента Б разрушается, и его отдельные атомы внедряются в пространство атомно-кристаллической решетки основного компонента А. Таким образом, в атомно-кристаллической решетке твердого раствора внедрения девять атомов, как в основном компоненте А, плюс два-три атома компонента Б.
Твердые растворы по своим свойствам наиболее близки к свойствам основного компонента. Они имеют низкую твердость, высокую плотность, ударную вязкость, прочность, хорошо деформируются в холодном и горячем состоянии. Микроструктура большинства конструкционных и инструментальных сталей представляет собой твердые растворы внедрения и замещения.
Химические соединения сплава образуются тогда, когда атомно-кристаллические решетки сплавляемых компонентов А и Б распадаются. Отдельные атомы этих компонентов образуют новые атомные решетки, которые по своему типу, форме и числу атомов отличаются от атомно-кристаллических решеток сплавляемых компонентов.
Химические соединения в сплаве образуются при строго определенном массовом соотношении сплавляемых компонентов А и Б. Например, химическое соединение углерода с железом образуется при массовой доле углерода, равной 6,67 %.
Свойства химических соединений также резко отличаются от свойств сплавляемых компонентов. Химические соединения, как правило, очень твердые, хрупкие, тугоплавкие, имеют мелкозернистую или игольчатую микроструктуру. На рис. 1, в показана атомно-кристаллическая ячейка химического соединения углерода с железом. Это сложная ромбическая пространственная атомно-кристаллическая решетка, состоящая из атомов железа и атомов углерода (компонентов А и Б).
В практике чаще всего в сплаве наблюдается смесь нескольких соединений (микроструктур), например механическая смесь химического соединения и твердого раствора или механическая смесь двух твердых растворов.
Диаграммы состояния двухкомпонентных сплавов. Любое изменение химического состава сплава влечет за собой изменение физических параметров: температуры, давления и структуры. Изменение этих параметров на границах фаз происходит скачкообразно или замедленно.
В практике металловедения для определения температур, давления, структуры и взаимодействия сплавляемых компонентов применяют графики — диаграммы состояния сплавов. Для этого нагревают (охлаждают) сплав в закрытом тигле с помощью термопары, по прибору наблюдают поведение этого сплава и по наблюдениям строят соответствующие графики.
На диаграммах состояния отображаются только условия, когда сплав имеет постоянные параметры, — равновесие, поэтому в научной литературе диаграммы состояния также называют диаграммами равновесия. В связи с тем что сплавляемые компоненты (металлы и неметаллы) обладают аллотропией, при нагревании (охлаждении) в сплавах происходят аллотропные изменения. Аллотропные изменения можно наблюдать при лабораторных исследованиях с помощью термического метода, а иногда визуально (цвет сплава становится ярче или, наоборот, тускнеет, или длительное время остается постоянным).
Любое изменение в металле при нагревании (охлаждении) характеризуется определенной температурой, которая называется критической температурой. Критические температуры на прямой отражаются соответствующими точками, которые называются критическими точками. Если рассматривать любой металл или сплав в одном измерении (температура нагрева), то графическая характеристика будет отображена в виде вертикальной прямой, на которой указывают критические температуры (точки). Если состояние металла или сплава рассматривать в двух измерениях (температура нагрева (охлаждения) и время нагрева (охлаждения), то график будет изображен в двух координатах (ось ординат и ось абсцисс).
Для примера рассмотрим состояние чистого железа при нагревании и охлаждении. На рис. 2 приведены критические температуры чистого железа при нагревании (охлаждении). Железо имеет следующие критические точки (температуры): 768; 910; 1 392 и 1 539 °С. При температуре 910 °С Fе-α (α-железо) переходит в Fе-β (β-железо). При температуре 1 392 °С Fе-β переходит в Fe-γ (γ-железо). При температуре 1 539 °С Fe-γ начинает медленно расплавляться с поглощением энергии (температуры).
При всех критических температурах на диаграммах показаны задержки перекристаллизации (горизонтальные участки). При охлаждении железа процесс перекристаллизации происходит в обратном порядке.
Для двухкомпонентных сплавов диаграмма состояния — это графическое изображение состояния сплавов в двух измерениях: температура нагрева (охлаждения) и химический состав сплава (концентрация).
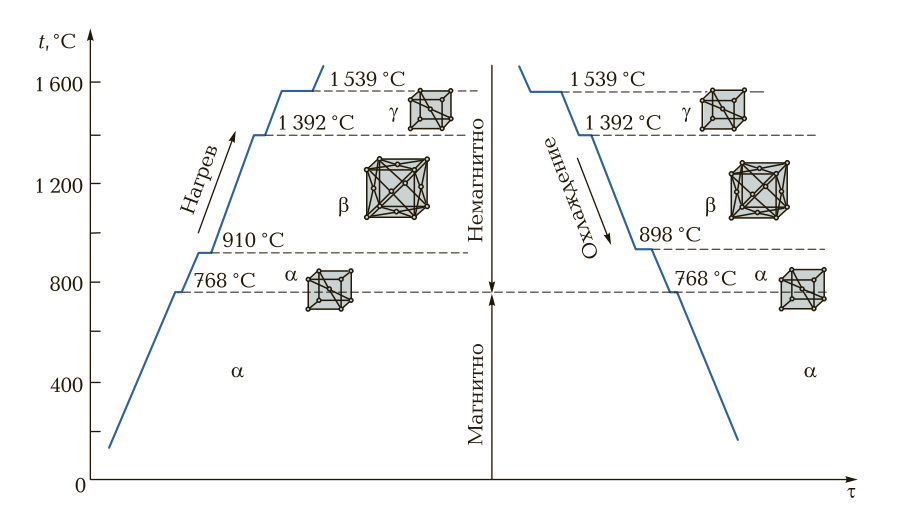
Рис. 2. Кривые нагрева и охлаждения железа: t — температура; τ — время
Температуру нагрева (охлаждения) откладывают по оси ординат, по оси абсцисс откладывают массовую долю сплавляемых компонентов (концентрация).
Для примера рассмотрим диаграмму состояния двухкомпонентного сплава свинец — сурьма (рис. 3). На оси абсцисс слева берем 100 % свинца (Pb), справа — 100 % сурьмы (Sb). Свинец и сурьма в жидком состоянии неограниченно растворяются друг в друге, в твердом состоянии — образуют механическую смесь сплавляемых компонентов.
При нагревании (охлаждении) сплава от твердого состояния до температуры плавления (а при охлаждении от жидкого состояния до температуры затвердевания) в сплаве происходит образование механических смесей (эвтектика) и расплавление при различных температурах.
Возьмем чистый свинец. При нормальной температуре и до температуры 245 °С в свинце никаких изменений внутреннего строения не происходит, и свинец будет иметь структуру Рb-α (α-свинец). При температуре 245 °С Рb-α перестраивается в Рb-β (β-свинец). Эта структура остается до температуры 327 °С.
При температуре 327 °С свинец начинает расплавляться. При расплавлении за счет поглощения энергии (температуры) температура свинца остается постоянной — 327 °С. При охлаждении свинца процесс происходит в обратном порядке.
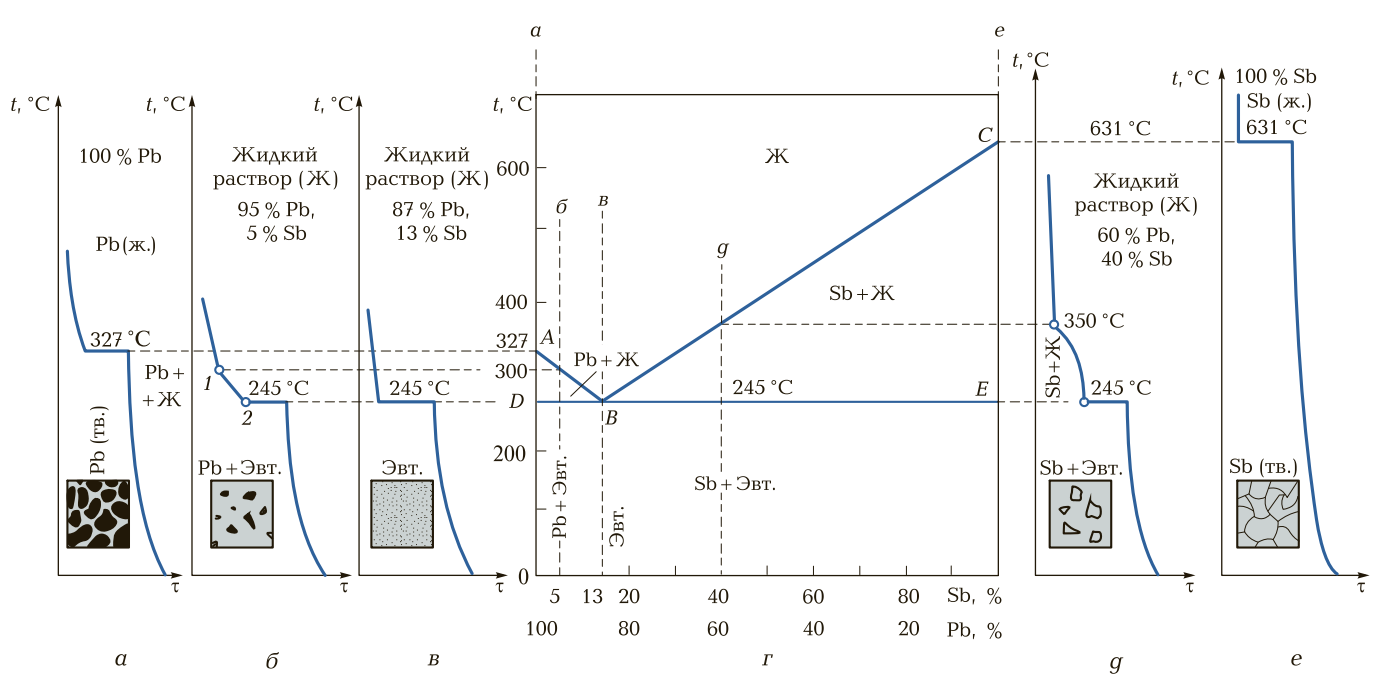
Рис. 3. Кривые охлаждения и структуры (а, б, в, д, е), диаграмма состояния (г) сплавов свинец—сурьма: 1 — температура ликвидуса; 2 — температура солидуса; АВС — линия ликвидуса; DBE — линия солидуса; Ж — жидкость; Эвт. — эвтектика
При нагревании сурьмы до температуры 245 °С никаких изменений в металле не происходит. Структура сурьмы будет Sb-α (α-сурьма). При температуре 245 °С Sb-α переходит в Sb-β. При температуре 631°С сурьма начинает расплавляться. В связи с тем что при расплавлении происходит большое поглощение теплоты, температура расплавления сурьмы на 8 … 10 °С будет ниже. При охлаждении процесс идет в обратном порядке. Далее рассмотрим поведение типовых сплавов свинца и сурьмы: 95 % Рb + 5 % Sb; 87 % Рb + 13 % Sb; 60 % Рb + 40 % Sb. Для составления диаграммы состояния двухкомпонентного сплава свинец — сурьма строим кривые нагрева (охлаждения).
При нагревании (охлаждении) 100 % Pb (рис. 3, а) при температуре 327 °С на графике будет горизонтальный участок. При нагревании (охлаждении) сплава 95 % Рb + 5 % Sb (рис. 3, б) при температуре 245 °С на графике будет горизонтальный участок. Далее при нагревании (охлаждении) при температуре 300 °С будет перегиб кривой, при этой температуре сплав начнет расплавляться (при нагревании) или кристаллизоваться (при охлаждении). При нагревании (охлаждении) сплава 87 % Рb + 13 % Sb (рис. 3, в) при температуре 245 °С также будет горизонтальный участок. При этой температуре сплав начинает плавиться и заканчивает расплавление при температуре 245 °С.
При нагревании (охлаждении) сплава 60 % Рb + 40 % Sb (рис. 3, д) до температуры 245 °С в структуре сплава никаких изменений не происходит. При температуре 245 °С свинец начинает расплавляться — на графике будет горизонтальный участок. При дальнейшем нагревании (охлаждении) при температуре 350 °С сплав расплавляется (при нагревании) или начинает кристаллизоваться (при охлаждении).
При нагревании (охлаждении) 100 % сурьмы (рис. 3, е) до температуры 631 °С сплав будет иметь твердую фазу, и при температуре 631 °С на графике будет горизонтальный участок, сурьма начинает расплавляться. За счет поглощения энергии расплавление сурьмы происходит при температуре несколько ниже 631 °С.
Для наглядного изображения характеристики сплава свинец — сурьма строим следующий график. На оси ординат откладываем температуры нагрева (охлаждения) от нормальной температуры. На этой оси будем откладывать критические точки для 100 % свинца. На оси абсцисс откладываем массовую долю в сплаве свинца и сурьмы. Справа проводим ось температур для 100 % содержания сурьмы. Далее на оси ординат проектируем критические точки, полученные в результате нагрева рассмотренных ранее сплавов.
Как видим из графиков, первое фазовое изменение сплавов происходит при температуре 245 °С. Проводим горизонтальную прямую DE, соответствующую этой температуре. На оси температур свинца проектируем точку, соответствующую температуре 327 °С — температуре плавления чистого свинца. Полученную точку обозначим буквой А.
На оси температур сурьмы проектируем точку, соответствующую 631 °С — температуре плавления сурьмы. Полученную точку обозначим буквой С. На оси абсцисс из точки, соответствующей 87 % Рb и 13 % Sb, восстанавливаем перпендикуляр (пунктиром) до горизонтальной прямой DE (температура расплавления данного сплава). Точку А (критическую температуру 327 °С) на оси ординат соединяем с критической точкой, лежащей на горизонтальной прямой, соответствующей температуре плавления данного сплава (87 % Рb + 13 % Sb). Полученную точку обозначим буквой В.
На оси абсцисс из точки, соответствующей 95 % Рb и 5 % Sb, восстанавливаем перпендикуляр до пересечения с отрезком АВ. В данной точке имеем критическую температуру 300 °С — температуру плавления (затвердевания) сплава 95 % Pb + 5 % Sb.
На оси абсцисс из точки, соответствующей 60 % Рb и 40 % Sb, восстанавливаем перпендикуляр до пересечения с отрезком ВС, получаем точку, которая соответствует критической температуре 350 °С — плавления (затвердевания) сплава 60 % Pb + 40 % Sb.
Таким образом, мы получили диаграмму состояния двухкомпонентного сплава свинец — сурьма. Все сплавы Рb— Sb независимо от массовой доли компонентов до температуры 245 °C имеют твердую фазу — механическая смесь. Сплав по линии DВЕ начинает медленно расплавляться при нагревании и затвердевает при охлаждении. Эту линию называют линией солидуса (от лат. solidus — твердый).
По линии АВС сплавы расплавляются при нагревании, при охлаждении начинают медленно кристаллизоваться. Эта линия называется линией ликвидуса (от лат. liquidus — жидкий). Между линиями DBE и линией АВС сплавы находятся в полужидком состоянии. Сплав с 87 % Рb и 13 % Sb имеет самую низкую температуру плавления (затвердевания). Этот сплав, так же как и чистые металлы, плавится при одной температуре. Такие сплавы получили название эвтектических сплавов.
Эвтектика — мелкодисперсная механическая смесь двух компонентов, образовавшаяся при температуре плавления (кристаллизации), значительно ниже температуры плавления сплавляемых компонентов в процессе затвердевания. Левее эвтектики сплавы называются доэвтектическими, правее — заэвтектическими.
Рассмотрим фазовые состояния сплава свинец — сурьма. Выше линии АВС сплав находится в жидком состоянии (жидкая фаза), между линией АВ и DB — в полужидком (Pb + жидкость). Ниже лини DB сплав состоит из механической смеси свинца и эвтектики. Между линиями ВС и ВЕ сплав будет иметь полужидкую фазу и кристаллы сурьмы. Ниже линии ВЕ сплав будет состоять из механической смеси (эвтектика и сурьма).
Диаграмма состояния сплава Pb — Sb относится к типу диаграмм, в которых сплавляемые компоненты неограниченно растворяются в жидком состоянии и не растворяются в твердом состоянии, образуя механические смеси (эвтектика).
Анализируя диаграмму состояния сплавов, можно изучить следующие характеристики: температуру плавления (кристаллизации), виды структур сплавов, способность образовывать ликвацию, режимы термообработки и обработки давлением. При изучении диаграмм состояния двухкомпонентных сплавов следует обращать внимание на превращение компонентов сплавов в кристаллическом (твердом) состоянии.
В связи с этим различают следующие особенности аллотропных изменений сплавов (типовые диаграммы состояния):
§ 273. Сплавы
В технике почти никогда не применяют чистых металлов, т. е. металлов, состоящих из атомов только одного элемента (например, железа). Почти всегда металлические изделия состоят из различных сплавов металлов с металлами или с неметаллическими элементами. Например, большое значение в технике имеют всевозможные стали — сплавы железа, углерода и других элементов (хрома, вольфрама, марганца и многих других); широко употребляется латунь (сплав меди и цинка). В самолетостроении широко используются сплавы алюминия или магния с рядом элементов (медью, железом, цинком и др.), очень легкие и вместе с тем прочные.
Причина распространенности сплавов заключается в ряде их преимуществ перед чистыми металлами. Прежде всего, сплавы почти всегда прочнее металлов, из которых они состоят (заметим, что чистое железо называют «мягким»). Сплавы нередко плавятся при более низкой температуре, чем составляющие их металлы. Например, олово плавится при , свинец — при , а сплав олова со свинцом— около .
Современная техника располагает множеством сплавов, технологические свойства которых сильно отличаются от свойств чистых металлов, благодаря чему удается удовлетворить самым разнообразным требованиям практики. Есть сплавы, почти столь же твердые, как алмаз; существуют весьма упругие сплавы; сплавы, сочетающие легкость и прочность (дюрали); сплавы, не окисляющиеся не только при соприкосновении с водой, но даже при соприкосновении с кислотами (нержавеющие стали); сплавы, не изменяющиеся при накаливании докрасна (жаростойкие); сплавы с очень большим электрическим сопротивлением (нихром) или со специальными магнитными свойствами; сплавы, почти не расширяющиеся при нагревании (инвар), и т. д.
Отметим, что и так называемые чистые металлы всегда содержат в себе небольшое количество примесей, удаление которых крайне затруднительно. Поэтому чистые металлы можно рассматривать как сплавы с очень большим преобладанием одного из составляющих металлов. Между тем даже ничтожные количества примесей иногда резко меняют свойства металлов. Например, присутствие небольших количеств серы или фосфора в стали или чугуне делает их ломкими, присутствие примесей в меди резко понижает ее электропроводность, и т. д.
Что же представляют собой сплавы и почему их свойства разнятся от свойств составляющих их элементов? На этот вопрос нельзя дать общего ответа, так как сплавы могут иметь весьма различное, иногда очень сложное строение, в особенности если между элементами, его составляющими, возможны химические соединения.
Иногда при затвердевании сплава из него выделяются мелкие кристаллики чистых металлов, тесно перемешанные между собой (рис. 455). Рост кристалликов в этой смеси затруднен присутствием кристалликов другого металла. А мы уже знаем, что мелкокристаллическое состояние металла является причиной повышенной прочности его.
Рис. 455. Шлиф поверхности латуни (сплав меди и цинка) при большом увеличении. Видны черные кристаллики меди вперемежку с серыми кристалликами цинка
Отметим, что кристаллики в металле всегда разделены очень тонкими прослойками (рис. 456). Эти прослойки имеют совсем иные физические свойства, чем сами кристаллики. Физические свойства металла определяются одновременно свойствами и кристалликов и прослоек. Например, слишком малая прочность прослоек привела бы к тому, что металл рассыпался бы в порошок. Обычно прослойки прочнее самих кристалликов, и излом металла происходит по кристалликам, а не по границам между ними.
Рис. 456. Шлиф поверхности алюминия. Черные тонкие линии — следы прослоек между кристалликами
Так как кристаллики состоят из чистых металлов (или из химических соединений их), то в прослойках скопляются неметаллические примеси к металлу. Вследствие тонкости прослоек достаточно ничтожного количества примеси, чтобы резко изменить свойства прослоек, а вместе с тем и всего металла. Таким образом, можно объяснить, например, почему примеси серы к железу столь вредны.
СПЛАВЫ
СПЛАВЫ, материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов, из которых хотя бы один является металлом. Многие металлические сплавы имеют один металл в качестве основы с малыми добавками других элементов. Самый распространенный способ получения сплавов – затвердевание однородной смеси их расплавленных компонентов. Существуют и другие методы производства – например, порошковая металлургия. В принципе, четкую границу между металлами и сплавами трудно провести, так как даже в самых чистых металлах имеются «следовые» примеси других элементов. Однако обычно под металлическими сплавами понимают материалы, получаемые целенаправленно добавлением к основному металлу других компонентов.
Почти все металлы, имеющие промышленное значение, используются в виде сплавов (см. табл. 1, 2). Так, например, все выплавляемое железо почти целиком идет на изготовление обычных и легированных сталей, а также чугунов. Дело в том, что сплавлением с некоторыми компонентами можно существенно улучшить свойства многих металлов. Если для чистого алюминия предел текучести составляет всего лишь 35 МПа, то для алюминия, содержащего 1,6% меди, 2,5% магния и 5,6% цинка, он может превышать 500 МПа. Аналогичным образом могут быть улучшены электрические, магнитные и термические свойства. Эти улучшения определяются структурой сплава – распределением и структурой его кристаллов и типом связей между атомами в кристаллах.
Многие металлы, скажем магний, выпускают высокочистыми, чтобы можно было точно знать состав изготавливаемых из него сплавов. Число металлических сплавов, применяемых в наши дни, очень велико и непрерывно растет. Их принято разделять на две большие категории: сплавы на основе железа и сплавы цветных металлов. Ниже перечисляются наиболее важные сплавы промышленного значения и указываются основные области их применения.
Сталь.
Сплавы железа с углеродом, содержащие его до 2%, называются сталями. В состав легированных сталей входят и другие элементы – хром, ванадий, никель. Сталей производится гораздо больше, чем каких-либо других металлов и сплавов, и все виды их возможных применений трудно было бы перечислить. Малоуглеродистая сталь (менее 0,25% углерода) в больших количествах потребляется в качестве конструкционного материала, а сталь с более высоким содержанием углерода (более 0,55%) идет на изготовление таких низкоскоростных режущих инструментов, как бритвенные лезвия и сверла. Легированные стали находят применение в машиностроении всех видов и в производстве быстрорежущих инструментов. См. также СТАНКИ МЕТАЛЛОРЕЖУЩИЕ.
Чугун.
Чугуном называется сплав железа с 2–4% углерода. Важным компонентом чугуна является также кремний. Из чугуна можно отливать самые разнообразные и очень полезные изделия, например крышки для люков, трубопроводную арматуру, блоки цилиндров двигателей. В правильно выполненных отливках достигаются хорошие механические свойства материала. См. также МЕТАЛЛЫ ЧЕРНЫЕ.
Сплавы на основе меди.
В основном это латуни, т.е. медные сплавы, содержащие от 5 до 45% цинка. Латунь с содержанием от 5 до 20% цинка называется красной (томпаком), а с содержанием 20–36% Zn – желтой (альфа-латунью). Латуни применяются в производстве различных мелких деталей, где требуются хорошая обрабатываемость и формуемость. Сплавы меди с оловом, кремнием, алюминием или бериллием называются бронзами. Например, сплав меди с кремнием носит название кремнистой бронзы. Фосфористая бронза (медь с 5% олова и следовыми количествами фосфора) обладает высокой прочностью и применяется для изготовления пружин и мембран.
Свинцовые сплавы.
Обычный припой (третник) представляет собой сплав примерно одной части свинца с двумя частями олова. Он широко применяется для соединения (пайки) трубопроводов и электропроводов. Из сурьмяно-свинцовых сплавов делают оболочки телефонных кабелей и пластины аккумуляторов. Сплавы свинца с кадмием, оловом и висмутом могут иметь точку плавления, лежащую значительно ниже точки кипения воды ( ~ 70 ° C); из них делают плавкие пробки клапанов спринклерных систем противопожарного водоснабжения. Пьютер, из которого ранее отливали столовые приборы (вилки, ножи, тарелки), содержит 85–90% олова (остальное – свинец). Подшипниковые сплавы на основе свинца, называемые баббитами, обычно содержат олово, сурьму и мышьяк.
Легкие сплавы.
Современная промышленность нуждается в легких сплавах высокой прочности, обладающих хорошими высокотемпературными механическими свойствами. Основными металлами легких сплавов служат алюминий, магний, титан и бериллий. Однако сплавы на основе алюминия и магния не могут применяться в условиях высокой температуры и в агрессивных средах.
Алюминиевые сплавы.
К ним относятся литейные сплавы (Al – Si), сплавы для литья под давлением (Al – Mg) и самозакаливающиеся сплавы повышенной прочности (Al – Cu). Алюминиевые сплавы экономичны, легкодоступны, прочны при низких температурах и легко обрабатываемы (они легко куются, штампуются, пригодны для глубокой вытяжки, волочения, экструдирования, литья, хорошо свариваются и обрабатываются на металлорежущих станках). К сожалению, механические свойства всех алюминиевых сплавов начинают заметно ухудшаться при температурах выше приблизительно 175 ° С. Но благодаря образованию защитной оксидной пленки они проявляют хорошую коррозионную стойкость в большинстве обычных агрессивных сред. Эти сплавы хорошо проводят электричество и тепло, обладают высокой отражательной способностью, немагнитны, безвредны в контакте с пищевыми продуктами (поскольку продукты коррозии бесцветны, не имеют вкуса и нетоксичны), взрывобезопасны (поскольку не дают искр) и хорошо поглощают ударные нагрузки. Благодаря такому сочетанию свойств алюминиевые сплавы служат хорошими материалами для легких поршней, применяются в вагоно-, автомобиле- и самолетостроении, в пищевой промышленности, в качестве архитектурно-отделочных материалов, в производстве осветительных отражателей, технологических и бытовых кабелепроводов, при прокладке высоковольтных линий электропередачи.
Примесь железа, от которой трудно избавиться, повышает прочность алюминия при высоких температурах, но снижает коррозионную стойкость и пластичность при комнатной температуре. Кобальт, хром и марганец ослабляют охрупчивающее действие железа и повышают коррозионную стойкость. При добавлении лития к алюминию повышаются модуль упругости и прочность, что делает такой сплав весьма привлекательным для авиакосмической промышленности. К сожалению, при своем превосходном отношении предела прочности к массе (удельной прочности) сплавы алюминия с литием обладают низкой пластичностью.
Магниевые сплавы.
Магниевые сплавы легки, характеризуются высокой удельной прочностью, а также хорошими литейными свойствами и превосходно обрабатываются резанием. Поэтому они применяются для изготовления деталей ракет и авиационных двигателей, корпусов для автомобильной оснастки, колес, бензобаков, портативных столов и т.п. Некоторые магниевые сплавы, обладающие высоким коэффициентом вязкостного демпфирования, идут на изготовление движущихся частей машин и элементов конструкции, работающих в условиях нежелательных вибраций.
Магниевые сплавы довольно мягки, плохо сопротивляются износу и не очень пластичны. Они легко формуются при повышенных температурах, пригодны для электродуговой, газовой и контактной сварки, а также могут соединяться пайкой (твердым), болтами, заклепками и клеями. Такие сплавы не отличаются особой коррозионной стойкостью по отношению к большинству кислот, пресной и соленой воде, но стабильны на воздухе. От коррозии их обычно защищают поверхностным покрытием – хромовым травлением, дихроматной обработкой, анодированием. Магниевым сплавам можно также придать блестящую поверхность либо плакировать медью, никелем и хромом, нанеся предварительно покрытие погружением в расплавленный цинк. Анодирование магниевых сплавов повышает их поверхностную твердость и стойкость к истиранию. Магний – металл химически активный, а потому необходимо принимать меры, предотвращающие возгорание стружки и свариваемых деталей из магниевых сплавов. См. также СВАРКА.
Титановые сплавы.
Титановые сплавы превосходят как алюминиевые, так и магниевые в отношении предела прочности и модуля упругости. Их плотность больше, чем всех других легких сплавов, но по удельной прочности они уступают только бериллиевым. При достаточно низком содержании углерода, кислорода и азота они довольно пластичны. Электрическая проводимость и коэффициент теплопроводности титановых сплавов малы, они стойки к износу и истиранию, а их усталостная прочность гораздо выше, чем у магниевых сплавов. Предел ползучести некоторых титановых сплавов при умеренных напряжениях (порядка 90 МПа) остается удовлетворительным примерно до 600 ° C, что значительно выше температуры, допустимой как для алюминиевых, так и для магниевых сплавов. Титановые сплавы достаточно стойки к действию гидроксидов, растворов солей, азотной и некоторых других активных кислот, но не очень стойки к действию галогеноводородных, серной и ортофосфорной кислот.
Титановые сплавы ковки до температур около 1150 ° C. Они допускают электродуговую сварку в атмосфере инертного газа (аргона или гелия), точечную и роликовую (шовную) сварку. Обработке резанием они не очень поддаются (схватывание режущего инструмента). Плавка титановых сплавов должна производиться в вакууме или контролируемой атмосфере во избежание загрязнения примесями кислорода или азота, вызывающими их охрупчивание. Титановые сплавы применяются в авиационной и космической промышленности для изготовления деталей, работающих при повышенных температурах (150–430 ° C), а также в некоторых химических аппаратах специального назначения. Из титанованадиевых сплавов изготавливается легкая броня для кабин боевых самолетов. Титаналюминиевованадиевый сплав – основной титановый сплав для реактивных двигателей и корпусов летательных аппаратов.
В табл. 3 приведены характеристики специальных сплавов, а в табл. 4 представлены основные элементы, добавляемые к алюминию, магнию и титану, с указанием получаемых при этом свойств.
Бериллиевые сплавы.
Пластичный бериллиевый сплав можно получить, например, вкрапляя хрупкие зерна бериллия в мягкую пластичную матрицу, такую, как серебро. Сплав этого состава удалось холодной прокаткой довести до толщины, составляющей 17% первоначальной. Бериллий превосходит все известные металлы по удельной прочности. В сочетании с низкой плотностью это делает бериллий пригодным для устройств систем наведения ракет. Модуль упругости бериллия больше, чем у стали, и бериллиевые бронзы применяются для изготовления пружин и электрических контактов. Чистый бериллий используется как замедлитель и отражатель нейтронов в ядерных реакторах. Благодаря образованию защитных оксидных слоев он устойчив на воздухе при высоких температурах. Главная трудность, связанная с бериллием, – его токсичность. Он может вызывать серьезные заболевания органов дыхания и дерматит. См. также КОРРОЗИЯ МЕТАЛЛОВ и статьи по отдельным металлам.
4. Применение металлов и их сплавов
О том, что свойства металлов меняются при их сплавлении, стало известно ещё в древности. \(5\) тысяч лет тому назад наши предки научились делать бронзу — сплав олова с медью. Бронза по твёрдости превосходит оба металла, входящие в её состав.
Свойства чистых металлов, как правило, не соответствуют необходимым требованиям, поэтому практически во всех сферах человеческой деятельности используют не чистые металлы, а их сплавы.
Сплав — это материал, который образуется в результате затвердения расплава двух или нескольких отдельных веществ.
В состав сплавов кроме металлов могут входить также неметаллы, например, такие как углерод или кремний.
Добавляя в определённом количестве примеси других металлов и неметаллов, можно получить многие тысячи материалов с самыми разнообразными свойствами, в том числе и такими, каких нет ни у одного из составляющих сплав элементов.
- механически прочнее и твёрже,
- со значительно более высокой или низкой температурой плавления,
- устойчивее к коррозии,
- устойчивее к высоким температурам,
- практически не менять своих размеров при нагревании или охлаждении и т. д.
Например, чистое железо — сравнительно мягкий металл. При добавлении в железо углерода твёрдость его существенно возрастает. По количеству углерода, а следовательно, и по твёрдости, различают сталь (содержание углерода менее \(2\) % по массе), чугун (\(С\) — более \(2\) % ). Но не только углерод изменяет свойства стали. Добавленный в сталь хром делает её нержавеющей, вольфрам делает сталь намного более твёрдой, добавка марганца делает сплав износостойким, а ванадия — прочным.
Сплавы, используемые для изготовления различных конструкций, должны быть прочными и легко обрабатываемыми.
Такие сплавы железа, как стали, отличаются высокой прочностью и твёрдостью. Их можно ковать, прессовать, сваривать.
Чугуны используют для изготовления массивных и очень прочных деталей. Например, раньше из чугуна отливали радиаторы центрального отопления, канализационные трубы, до сих пор изготавливают котлы, перила и опоры мостов. Изделия из чугуна изготавливаются с применением литья.
Сплавы алюминия, используемые в конструкциях, наряду с прочностью должны отличаться лёгкостью. Дюралюминий, силумин — сплавы алюминия, они незаменимы в самолёто-, вагоно- и кораблестроении.
Для улучшения ударопрочности, коррозионной стойкости, износоустойчивости сплавы легируют — вводят специальные добавки. Добавка марганца делает сталь ударопрочной. Чтобы получить нержавеющую сталь, в состав сплава вводят хром.
Инструментальные сплавы предназначены для изготовления режущих инструментов, штампов и деталей точных механизмов. Такие сплавы должны быть износостойкими и прочными, причём при разогревании их прочность не должна существенно уменьшаться. Таким требованиям отвечают, например, нержавеющие стали, которые прошли специальную обработку (закалку).
Для придания необходимых свойств инструментальные стали, как правило, легируют вольфрамом, ванадием или хромом.
Сплавы служат незаменимым материалом при изготовлении особо чувствительных и высокоточных приборов, различного рода датчиков и преобразователей энергии.
Например, на изготовление сердечников трансформаторов и деталей реле идёт сплав никеля. Отдельные детали электромоторов изготавливаются из сплавов кобальта.
Сплав никеля с хромом — нихром, отличающийся высоким сопротивлением — используется для изготовления нагревательных элементов печей и бытовых электроприборов.
Из сплавов меди в электротехнической промышленности и в приборостроении наиболее широкое применение находят латуни и бронзы.
Латуни незаменимы при изготовлении приборов, деталью которых являются запорные краны. Такие приборы используются в сетях подачи газа и воды.
Главным востребованным свойством легкоплавких сплавов является заданная низкая температура плавления. Это свойство, в частности, используется для пайки микросхем. Кроме того, эти сплавы должны иметь определённую плотность, прочность на разрыв, химическую инертность, теплопроводность.
Легкоплавкие сплавы производят из висмута, свинца, кадмия, олова и других металлов. Такие сплавы используют в термодатчиках, термометрах, пожарной сигнализации, например, сплав Вуда. А также в литейном деле для производства выплавляемых моделей, для фиксации костей и протезирования в медицине.
Сплав натрия с калием (температура плавления \(–\)\(12,5\) °С) используется как теплоноситель для охлаждения ядерных реакторов.
 |  |
| Рис. \(7\). Припой (сплав для паяния) имеет невысокую температуру плавления | Рис. \(8\). Легкоплавкие сплавы незаменимы в датчиках пожарной сигнализации |
Применение в чистом виде драгоценных металлов в ювелирном деле не всегда оправдано и целесообразно из-за их дороговизны, физических и химических особенностей.
Для придания ювелирным изделиям из золота большей твёрдости и износостойкости используются сплавы с другими металлами.
Самая лучшая добавка — это серебро (понижает температуру плавления) и медь (повышает твёрдость). Чистое золото используют очень редко, так как оно слишком мягкое, легко деформируется и царапается.
Из сплавов золота с \(10–30\) % других благородных металлов (платины или палладия) изготавливают форсунки лабораторных приборов, а из сплава с \(25–30\) % серебра — ювелирные изделия и электрические контакты.

Оловянная бронза (сплав меди с оловом) — один из первых освоенных человеком сплавов металлов. Она обладает большей, по сравнению с чистой медью, твёрдостью, прочностью и более легкоплавка. Бронзы успешно применяют для получения сложных по конфигурации отливок, включая художественное литьё. Классической маркой бронзы является колокольная бронза.
Одно из новых направлений в искусстве — производство художественных литых изделий из чугуна. Литые изделия из чугуна существенно превосходят по качеству кованые изделия.
Чугун — металл гораздо более хрупкий и не такой ковкий, как сталь. Но даже из такого, казалось бы, грубого материала можно получать настоящие произведения литейного искусства способом литья, например, такие как литые лестницы или решётки на окна. Такие изделия подвержены лишь поверхностной коррозии и не требуют тщательного ухода.
Читайте также:
