Металлические свойства натрия сильнее чем у
Обновлено: 04.10.2024
С увеличением числа элементарных элементов электроны имеют тенденцию к увеличению, а в подгруппах — к уменьшению. Самые низкие значения электроотрицательности характерны для первого элемента в первой группе, а самые высокие — для элемента P в седьмой группе.
Периодичность свойств элементов
Все характеристики элементов, определяемые электронной оболочкой индивидуума, закономерно изменяются в циклах и группах циклических систем. Однако, поскольку многие элементы сходных электронных структур не идентичны и сходны только при переходе от одного элемента к другому элементу подгруппы, то не происходит простого повторения свойств, а происходят более или менее интенсивные периодические изменения свойств элемента.
Химические свойства элемента определяются его способностью отдавать или добавлять электроны. Количественно это определяется энергией ионизации, сродством к электрону и электронами и зависит от радиуса индивидуума.
Атомные и ионные радиусы
Вследствие волнообразного характера движения электронов невозможно измерить абсолютный размер индивида, так как не существует его определенного предела.
Концепция орбитальных лучей недавно была расширена. Радиус орбиты — это самое удаленное от ядра расстояние наибольшего распределения электронной плотности. Таким образом, человек в базовом состоянии может иметь только лоток торговца и лоток стимулированного состояния — многие значения rПули.. На практике мы имеем дело с лучами людей, связанных определенной химической связью. Этот радиус рассматривается как фактический радиус индивида, т.е. как выявленный в результате действия. Фактический луч определяется при изучении молекулярных и кристаллических структур.
По этой причине значения атомных лучей, приведенные в различных справочниках, иногда могут значительно отличаться. Однако, несмотря на различия в значениях отдельных лучей одного и того же элемента, общая закономерность сохраняется. Это отражает зависимость атомных лучей от ядерной загрузки Z с периодическими свойствами.
Зависимость орбитальных лучей элемента r (1 Å = 10-10 м) от числа Z:.
В этот же период наблюдается тенденция к уменьшению размеров особей по мере увеличения Z. Это объясняется притяжением электронов внешнего слоя к увеличению в ядре при увеличении нагрузки.
За последний период атомное излучение увеличилось, поскольку строительство новых энергетических уровней начинается дальше ядра. В результате, в пределах первичных подгрупп размер особей увеличивается с ростом ядерной нагрузки. Во вторичных подгруппах, особенно в четверговой и шестой переходных подгруппах d-металлов, размер особей изменяется в меньшей степени. Отдельные лучи почти не отличаются друг от друга. Это можно объяснить тем, что увеличение количества лучей относительно увеличения количества квантовых уровней при переходе от четвергового к шестому периоду компенсируется сокращением количества лантанидов (57ла до71Lu), вызванное заполнением уровня 4F. По этой причине элементы D пятого и шестого периодов имеют особенно схожие характеристики. Так, в подгруппе IIIB (TI-ZR-HF) последние два элемента имеют одинаковые лучи (0,145 нм) и поэтому похожи друг на друга по природным и химическим свойствам, существенно отличаясь от Титана, радиус которого составляет 0,132 нм.
Потеря атомом электронов приводит к уменьшению его фактического размера, а добавление избыточного количества электронов — к увеличению. Таким образом, радиус положительно заряженных ионов (катионов) всегда меньше, а радиус отрицательно заряженных ионов (анионов) всегда больше, чем радиус соответствующих электрически нейтральных атомов. Так, радиус атома калия составляет 0,236 нм, радиус иона калия K+ — 0,133 нм, радиус атома хлора и иона хлора SD — 0,099 нм и 0,181 нм соответственно.
Таким образом, радиус иона отличается от радиуса электрически нейтрального атома в той степени, в которой ион имеет больший заряд. Например, атомные радиусы хрома и ионов Cr2+ и Cr3+ составляют 0,127, 0,083 и 0,064 нм соответственно.
Внутри подгрупп лучи ионов с одинаковым зарядом увеличиваются с ростом заряда ядра. Эта закономерность объясняется увеличением числа электронных слоев и расстояния внешних электронов от ядра.
Энергия ионизации
Поскольку удаление электронов из невозбужденного атома и преобразование их в положительно заряженные ионы всегда является внутренним процессом (т.е. путем поглощения энергии), то для того, чтобы это произошло, необходимо выполнить какое-то действие.
Минимальная энергия, необходимая для отрыва электрона от невозбужденного атома, называется энергией ионизации I
где E и E + обозначают соответственно нейтральный атом и положительно заряженный ион (катион) элемента, I — энергия ионизации, ē — электрон.
Энергия ионизации измеряется в кДж/моль или эВ/атом. 1 эВ (электронвольт) — это энергия, получаемая электроном в ускоряющем электрическом поле с разностью потенциалов 1 В (1 эВ = 1,6-10-19 Дж) при пересчете на 1 моль, что составляет 96,5 кДж/моль. Энергия ионизации может быть определена путем столкновения электронов, ускоренных в электрическом поле, с атомом.
Один, два или более электронов могут быть отсоединены от человека с большим количеством электронов. Отсоединение каждого электрона соответствует определенному значению энергии ионизации i1, i2, …, In так что это всегда я.1 2
Пример № 2. титан.
Периодическое изменение свойств элементов и их соединений (наглядно)
Деление элементов на металлы и неметаллы.
Нет четких ограничений. Некоторые элементы обладают свойствами перехода.
(c) Используются отрывки из учебников: «Химия» / Н.Е.-Москва, Эксмор (ЕГЭ. Экспресс-подготовка)» и «Химия: новый полный справочник для подготовки к ЕГЭ/Е.В.». Савинкина. -Москва, Издательство АСТ.
Рассматривали ли вы «Законы изменения свойств элементов и их соотношение по периодам и группам»? Выберите дальнейшие действия.
Преподавая химию, Менделеев обнаружил, что его ученикам трудно запомнить индивидуальные свойства каждого элемента. Он начал искать способы создания систематического способа облегчения запоминания свойств данных. В результате появились физические таблицы, которые позже были переименованы в периодические таблицы.
Фактчек
- Таблица Менделеева состоит из «столбцов», т.е. групп и «строк», т.е. периодов;
- Металлические свойства связаны со способностью отдавать электроны;
- Радиус атома увеличивается при увеличении числа электронных оболочек;
- Высшая валентность для большинства элементов равна номеру группы.
Задача 1.Какова максимальная прочность алюминия?
(Задание 2: Какое соединение водорода обладает наивысшими основными свойствами какого элемента?
(Задание 3: Из перечисленных элементов металлами являются
Задание 4: Какие элементы обладают наивысшими основными свойствами гидроксидов?
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.

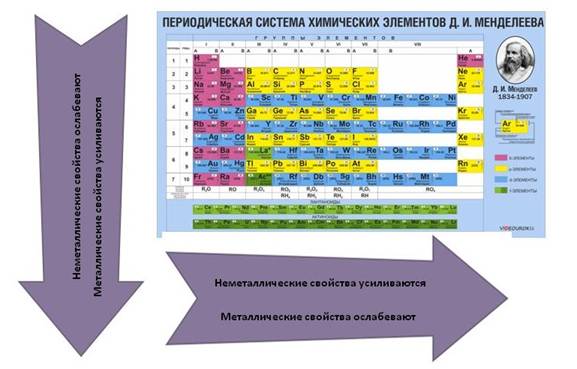
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).

Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.

Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева

Видеоурок начинается воспоминанием ученика Васи, который должен сделать домашнее задание по химии, а для этого ему нужно охарактеризовать два химических элемента: натрий и фосфор по плану, который они изучали в 8 классе. В видеофрагменте подробно расписан план характеристики химического элемента на основании положения его в Периодической системе, приведены конкретные примеры и подробное описание элементов натрия и фосфора.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева"
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические элементы в Периодической системе – это герои, и им, как и любым героям, нужно давать определенные характеристики. За основу их характеристики нужно брать Периодическую систему химических элементов Д.И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
5. определить состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7. для неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп.
Для атомов химических элементов в группах сверху вниз
· увеличивается заряд ядра атомов, который численно равен порядковому номеру элемента
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и восстановительные свойства усиливаются
· окислительные – ослабевают.
· высшая степень окисления остается неизменной и равна номеру группы
· низшая степень окисления тоже не изменяется и равна № группы – 8.
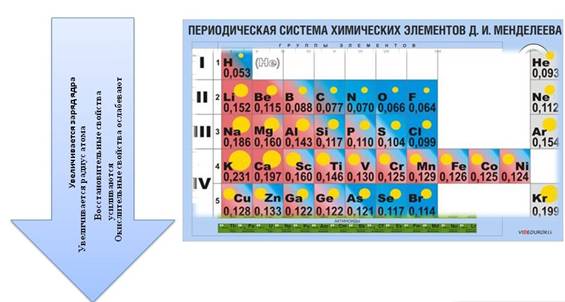
В периодах слева направо:
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
· Высшая степень окисления изменяется от +1 до +8: в первой группе ‒ +1, во второй ‒ +2, в третьей ‒ +3, в четвертой ‒ +4, в пятой ‒ +5
· низшая степень окисления изменяется от -4 до -1: в четвертой группе она равна -4, в пятой -3, в шестой -2, а в седьмой -1.
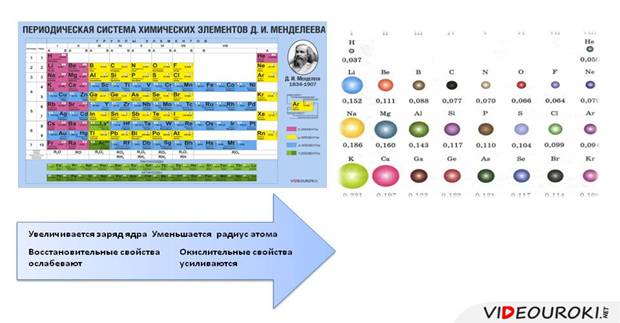

Что касается простых веществ, то металлические свойства в группах сверху вниз усиливаются, а в периодах слева направо ослабевают. Неметаллические свойства, наоборот, в группах сверху вниз ослабевают, а в периодах слева направо усиливаются.
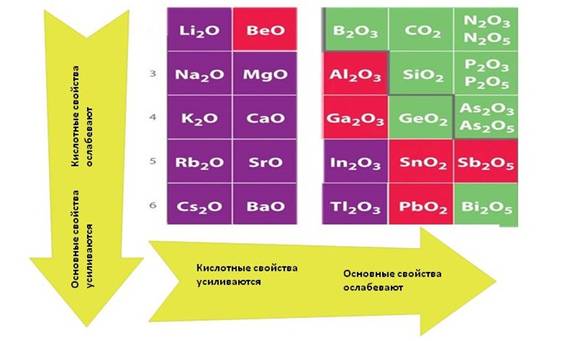
Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у оксида свинца (IV) (PbO2). В периодах слева направо усиливаются кислотные свойства, а ослабевают основные. Например, у оксида магния (MgO) основные свойства выражены сильнее, чем у оксида алюминия (Al2O3), у оксида углерода (IV) (CO2) – кислотные свойства выражены сильнее, чем у оксида бора (B2O3).
Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
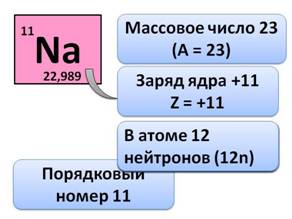
· Порядковый номер натрия (Na), т.е. клетка, в которой он стоит – 11
· Массовое число – 23

· Значит, заряд его ядра равен +11, Z = +11 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 11 электронов (11 ē), а число нейтронов определяется по формуле N = A – Z, т.е. 23 – 11 = 12, значит в атоме 12 нейтронов (12n).
· Натрий находится в 3-ем периоде, у него 3 энергетических уровня, на которых располагаются все его электроны. На первом уровне 2 электрона (это максимально), на втором – 8, на третьем – 1 электрон.
Т.к. у натрия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
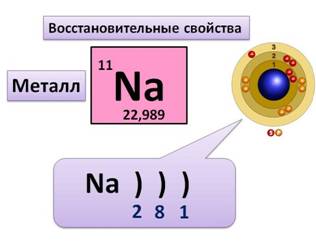
Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.

Сравним свойства натрия со свойствами его соседей по группе: металлические свойства натрия выражены сильнее, чем у лития, но слабее, чем у калия, т.к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра и их становится легче оторвать.
Сравним свойства натрия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у магния, т.к. в периодах, слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее оторвать, чем присоединить.
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи.

Гидроксид натрия – это NaOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями.

Натрий – металл, но он не образует летучих водородных соединений.
Охарактеризуем фосфор.
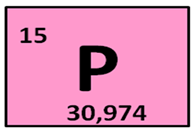
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15: (р = 15, ē = 15). Массовое число фосфора – 31, поэтому число нейтронов будет равно 16, т.к. если мы от массового числа отнимем число протонов, то будет 16 (31 – 15 = 16).

Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
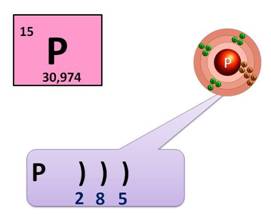
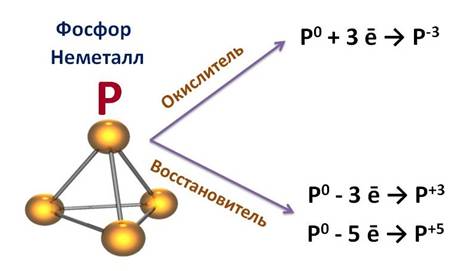
Фосфор – это неметалл, он может быть как окислителем, так и восстановителем. Как окислитель, он может присоединить 3 электрона до завершения внешнего уровня, получая при этом степень окисления -3 (Р 0 + 3 ē → Р -3 ), а как восстановитель, он может отдать 3 или 5 электронов и получить степень окисления +3 или +5 (Р 0 - 3 ē → Р +3 , Р 0 - 5 ē → Р +5 ).
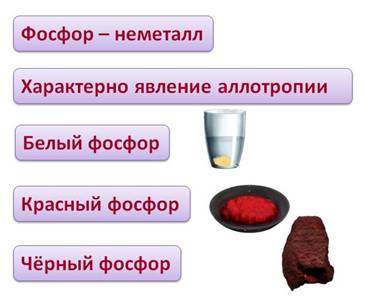
Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить свойства фосфора и его соседей. Неметаллические свойства фосфора выражены сильнее, чем у мышьяка, но слабее, чем у азота, т.к. радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду, свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Составим формулу оксида и гидроксида фосфора.
Высший оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты.

Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.

Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
Усиление металлических и неметаллических свойств в таблице. Как изменяются свойства химических элементов
Читайте также:
