Металлический блеск у неметаллов
Обновлено: 15.05.2024
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют соответственно светло-желтый, желтый и медный цвета.
Хотя на практике, вы знаете, металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листки серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического Напряжения приобретают направленное движение, то есть проводят электрический ток. При повышении температуры мета-тля возрастают амплитуды колебании находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Около абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверх проводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, в также золото, алюминии, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Они обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Поэтому происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числя .оекгронов. связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы, атомы которых имеют один валентный электрон, мягкие (режутся ножом), с небольшой плотностью (литий — самый легкий металл с р - 0.53 г/см3) и плавятся при невысоких температурах (например, температура плавления цезия 29 'С). Единственный металл, жидкий при обычных условиях. — ртуть — имеет температуру плавления, равную 38.9 'С.
Кальций, имеющий два электрона ни внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре (842º С).
Еще более арочной является кристаллическая решетка, образованная атомами скандия, которые имеют три валентных электрона.
Но самые ирочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, МП групп. Это объясняется тем. что для металлов побочных подгрупп, имеющих неспасенные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с s-орбиталей.
Вспомните, что самый тяжелый металл — это осмий (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл -это вольфрам (применяется для изготовления нитей накаливания ламп), самый твердый металл - это хром Сг (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы различаются по отношению к магнитным полям. Но этому признаку их делят на три группы:
• ферромагнитные Способны намагничиваться под действием даже слабых магнитных полей (железо — альфа-форма, кобальт, никель, гадолиний);
• парамагнитные проявляют слабую способность к намагничиванию (алюминий, хром, титан, почти все лантаноиды);
• диамагнитные не притягиваются к магниту, лаже слегка отталкиваются от него (олово, мель, висмут).
Напомним, что при рассмотрении электронного строения металлов мы подразделили металлы на металлы главных подгрупп (к- и р-элементы) и металлы побочных подгрупп.
В технике принято классифицировать металлы по различным физическим свойствам:
а) плотности - легкие (р < 5 г/см3) и тяжелые (все остальные);
б) температуре плавления - легкоплавкие и тугоплавкие.
Принято железо и его сплавы считать черными металлами, а все остальные - цветными.
Классификации металлов по химическим свойствам
Металлы с низкой химической активностью называют благородными (серебро, золото, платина и ее аналога — осмий, иридий, рутений, палладий, родий).
По близости химических свойств выделяют щелочные (металлы I группы главной подгруппы), щелочноземельные (кальций, стронций, барий, радий), а также редкоземельные металлы (скандий, иттрий, лантан и лантаноиды, актиний и актиноиды).
Тест «простые вещества – металлы и неметаллы»

Тест может быть использован для закрепления, систематизации материала по темам "Металлы" и "Неметаллы" и подготовки к итоговой контрольной работе.
Просмотр содержимого документа
«Тест «простые вещества – металлы и неметаллы»»
ТЕСТ «Простые вещества – металлы и неметаллы»
1. Физические свойства металлов:
1) ковкость, электропроводность; 2) ковкость, металлический блеск; 3) ковкость, металлический блеск, тепло- и электропроводность; 4) ковкость, металлический блеск, тепло- и электропроводность, запах.
2. Физические свойства неметаллов:
1) ковкость, металлический блеск; 2) ковкость, металлический блеск, тепло- и электропроводность; 3) ковкость, металлический блеск, тепло- и электропроводность, запах; 4) не обладают физическими свойствами металлов.
3.Агрегатное состояние простых веществ — металлов при комнатной температуре 1) газообразное; жидкое; 2) жидкое, твердое. 3) газообразное, жидкое, твердое.
4. Агрегатное состояние простых веществ — неметаллов при комнатной температуре: 1) газообразное; 2) газообразное, жидкое; 3) газообразное, жидкое, твердое.
5. Выберите названия аллотропных модификаций углерода:
а) графит; б) озон; в) красный. ; г) алмаз; д) белый.
6. Выберите названия аллотропных модификаций олова:
а) озон; б) красный. ; в) графит; г) белый. ; д) алмаз; е) α и β;
7. Выберите названия аллотропных модификаций фосфора:
а) озон; б) красный. ; в) графит; г) белый. ; д) алмаз, е) α и β;
8. Выберите названия аллотропных модификаций кислорода:
9. Свойства озона: 1) газ бледно-фиолетового цвета; 2) газ бледно-фиолетового цвета с запахом свежести; 3) газ бледно-фиолетового цвета с запахом свежести, удерживает ультрафиолетовые лучи; 4) газ бледно-фиолетового цвета с запахом свежести, удерживает ультрафиолетовые лучи, легче кислорода.
10. Свойства кислорода: 1) газ бледно-фиолетового цвета с запахом свежести; 2) газ без цвета и запаха; 3) газ бледно-фиолетового цвета с запахом свежести, удерживает ультрафиолетовые лучи;
11. Какие свойства подчеркивал М. В. Ломоносов, характеризуя металлы как «светлые тела, которые ковать можно»: а) теплопроводность; б) обычно серый цвет с металлическим блеском: в) электрическую проводимость; г) пластичность.
12. Как на практике используют пластичность металлов? а) делают зеркала; б) используют в качестве проводника электрического тока; в) выковывают изделия разной формы; г) прокатывают в листы; д) производят легкие сплавы для конструирования самолетов, ракет; е) вытягивают в проволоку.
13. Как на практике используют металлический блеск металлов? а) делают зеркала; б) используют в качестве проводника электрического тока; в) выковывают изделия разной формы; г) прокатывают в листы; д) производят легкие сплавы для конструирования самолетов, ракет; е) вытягивают в проволоку
14. Причина электрической проводимости металлов заключается в характерном для них строении: а) наличии в узлах кристаллической решетки ионов; б) наличии в узлах кристаллической решетки атомов; в) присутствии подвижных обобществленных электронов.
15. Причина пластичности металлов заключается в их строении: а) присутствие подвижных обобществленных электронов; б) наличие в узлах кристаллической решетки ионов; в) наличие в узлах кристаллической решетки атомов.
16. Причина теплопроводности металлов заключается в их строении: а) присутствие подвижных обобществленных электронов; б) наличие в узлах кристаллической решетки ионов; в) наличие в узлах кристаллической решетки атомов.
17. Выберите названия простых веществ-неметаллов, которые при обычных условиях являются газами: а) бром; б) неон; в) магний; г) фосфор; д) азот; е) фтор.
18. Выберите названия простых веществ-неметаллов, которые при обычных условиях являются твердыми: а) натрий; б) озон; в) сера; г) фосфор; д) бром; е) иод.
19. Выберите названия простых веществ-неметаллов, которые при обычных условиях являются жидкими: а) натрий; б) озон; в) сера; г) фосфор; д) бром; е) иод, ж) ртуть
20. Выберите самый пластичный драгоценный металл: а) золото; б) серебро; в) платина
21. Выберите самые электропроводные металлы: а) золото; б) серебро; в) натрий; г) железо; д) медь; е) марганец; ж) алюминий; з) магний.
22. Расположите металлы по уменьшению электропроводности: Сu; Al; Ag; Аu.
Дополните утверждения.
Число элементов-металлов в периодической системе равно .
. ……………………………..— свойство металлов изменять свою форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку.
Название самого пластичного металла — .
Название самого тугоплавкого металла — .
Число элементов-неметаллов в периодической системе равно .
. — химические элементы, образующие в свободном виде простые вещества, не обладающие физическими свойствами металлов.
………………………… — химические элементы, образующие в свободном виде простые вещества, не обладающие физическими свойствами неметаллов.
Физические свойства неметаллов
Неметаллы - элементы, атомы которых обладают неметалличностью, т.е. способностью принимать электроны. Известно 22 неметалла. Они расположены в правом верхнем углу ПСХЭ, из них 6 – инертные газы.
Элементы с неметаллическими свойствами находятся в III-VII - группах главных подгруппах Периодической системы:
- НЕМЕТАЛЛЫ VIII ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (БЛАГОРОДНЫЕ ГАЗЫ):гелий, неон, аргон, криптон, ксенон, радон.
- НЕМЕТАЛЛЫ VII ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ГАЛОГЕНЫ):фтор,хлор, бром, йод, астат.
- НЕМЕТАЛЛЫ VIГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ХАЛЬКОГЕНЫ):кислород, сера, селен, теллур.
- НЕМЕТАЛЛЫ V ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ПОДГРУППА АЗОТА):азот, фосфор, мышьяк.
- НЕМЕТАЛЛЫ IVГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ПОДГРУППА УГЛЕРОДА):углерод, кремний.
Б) Особенности атомного строения неметаллов:
1. Небольшой атомный радиус;
2. На внешнем уровне 4-8 электронов (исключение водород – 1 электрон, гелий – 2 электрона);
3. Характерно высокое значение ЭО;
4. Степени окисления от -4 до +8.
В) Строение простых веществ неметаллов
Неметаллы-простые вещества, образованные элементами неметаллами и обладающие характерными неметаллическими свойствами: отсутствие металлического блеска, неэлектропроводность и т.д.
Вид химической связи – ковалентная неполярная.
Тип кристаллической решётки – атомная, молекулярная.
1. АТОМАРНОЕ СОСТОЯНИЕ: Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии (He –гелий, Ne-неон, Ar-аргон , Kr-криптон , Xe-ксенон , Rn-радон
2. АТОМНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ: алмаз (С) и кремний (Si)
3. МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
Многие неметаллы образуют молекулу, состоящую из двух атомов
Физические свойства неметаллов
При обычной температуре неметаллы могут быть в разном агрегатном состоянии.
2. Жидкие - Br2 -бром
3. Твердые: S8 –ромбическая сера, P4-бедый фосфор, I2- йод, C - алмаз и графит
Многие не проводят электрический ток (кроме графита-C и кремния-Si).
Не проводят тепло.
В твердом состоянии - хрупкие.
Не имеют металлического блеска (кроме иода-I2, графита-C и кремния-Si)
Цвет охватывает все цвета спектра: красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода.
Температура плавления изменяется в огромном интервале: tпл (N2)= -210⁰C , а tпл (алмаз) =3730⁰С
АЛЛОТРОПИЯ- способность атомов одного химического элемента образовывать несколько простых веществ, а эти простые вещества – аллотропными видоизменениями или модификациями.
Элемент кислород образует две аллотропные модификации
Озон - O3: Газ бледно-фиолетового цвета с резким запахом свежести. Ядовит!
Обладает бактерицидными свойствами.
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип = 445 °С
У серы можно выделить три аллотропных модификации: кристаллическая(ромбическая), моноклинная и пластическая.
Переход из кристаллической в пластическую происходит при нагревании до температуры кипения при последующем быстром охлаждении.
Азот – газ без цвета и запаха, плохо растворим в воде. Азот является основной частью воздуха (79% по объѐму).
Образует трдве аллотропные модификации.
Фосфор белый P₄(молекулярная кристаллическая решётка )
Мягкое, бесцветное вещество. В темноте светится. Ядовит!
Фосфор красный Pn (атомная кристаллическая решётка) аморфное
полимерное вещество(порошок) тёмно-красного цвета. В темноте не светится, ядовит!
УГЛЕРОД
Образует две аллотропные формы.
Алмаз: Тетраэдрическая кристаллическая решетка
Бесцветные кристаллы. Самое твердое вещество в природе. tпл=3730ºC
Графит: Кристаллическая решетка напоминает соты.
Слоистое кристаллическое вещество, жирное на ощупь, непрозрачное,серого цвета.
Неметаллы

Видеофрагмент даёт представление об особенностях строения и свойствах атомов неметаллов, о положении их в Периодической системе, особенностях их физических и химических свойств, нахождении в природе и получении.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Неметаллы"
Как известно, традиционное деление элементов на металлы и неметаллы исторически сложилось из-за того, что металлы, как правило, находятся в твёрдом агрегатном состоянии, имеют металлический блеск, тепло- и электропроводны, ковки и пластичны, а неметаллы при обычных условиях этими свойствами не обладают.

К неметаллам относятся 23 химических элемента, все неметаллы являются элементами главных групп.

Условная граница между металлами и неметаллами находится на линии в направлении от бора к астату. Таким образом, элементы, расположенные начиная с третьей А группы и заканчивая восьмой А группой, являются неметаллами. К неметаллам относится и водород, расположенный в первой A группе.
Число элементов неметаллов в группе увеличивается с номером группы.
В третьей A группе находится только один элемент неметалл – бор, а восьмая A группа полностью состоит из неметаллов.
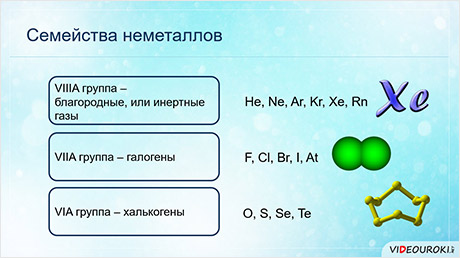
Для некоторых неметаллов используют групповые названия. Элементы восьмой A группы называются благородными, или инэртными газами, элементы седьмой A группы называются галогенами, элементы шестой A группы – халькогенами.
Наиболее типичными неметаллами являются: водород, кислород, углерод, азот, фосфор, сера, а также галогены – фтор, хлор, бром, йод.
Элементы, расположенные вдоль условной разграничительной линии: бор, кремний, германий, мышьяк, селен, тэллур, астат, являются неметаллам, но могут проявлять и металлические свойства, поэтому их называют полуметаллами.
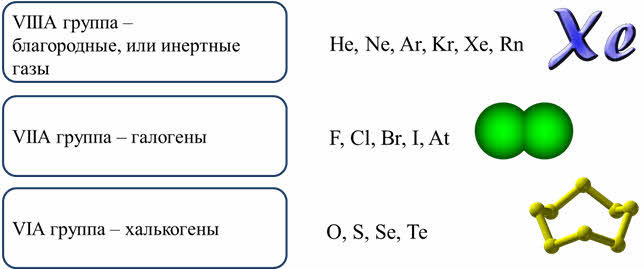
У атомов большинства неметаллов, кроме водорода, гелия и бора, на внешнем энэргетическом уровне от четырёх до восьми электронов. У атома водорода на внешнем уровне содержится только один электрон, у гелия – два и его электронный слой полностью заполнен, у бора на внешнем энергетическом уровне находится три электрона.
Число электронов на внешнем уровне численно равно номеру группы. Так, углерод и кремний – элементы четвёртой A группы содержат четыре электрона на внешнем энэргетическом уровне, а азот и фосфор – элементы пятой A группы содержат пять электронов на внешнем слое.
Атомы водорода и гелия относятся к эс-элементам, а все остальные атомы неметаллов – к пэ-элементам.
Электроотрицательность неметаллов гораздо выше, чем металлов.
Электроны внешнего энэргетического уровня прочно связаны с ядром, поэтому для атомов неметаллов характерна способность присоединять электроны до завершения внешнего слоя.
Для атомов неметаллов возможны различные степени окисления. Максимальная положительная степень окисления, кроме кислорода и фтора, равна номеру группы. Например, у углерода и кремния плюс четыре, у азота и фосфора — плюс пять, у хлора — плюс семь, у серы — плюс шесть.
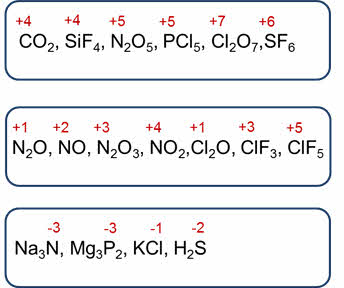
Некоторые неметаллы проявляют несколько положительных степеней окисления. Например, азот может кроме плюс пяти иметь такие степени окисления, как плюс один, плюс два, плюс три, плюс четыре, а хлор, кроме степени окисления плюс семь, имеет степени окисления плюс один, плюс три, плюс пять.
Минимальная отрицательная степень окисления равна номер группы минус восемь. У азота и фосфора минимальная отрицательная степень окисления равна минус трём, у атомов галогенов — минус один, у серы — минус два.
Таким образом, атомы неметаллов в их соединениях с атомами металлов, водорода и других менее электроотрицательных элементов проявляют отрицательные степени окисления, а в соединениях с более электроотрицательными элементами для атомов неметаллов характерны положительные степени окисления.
Благородные газа – ксенон и в меньшей степени криптон – в своих соединениях со фтором и кислородом также способны проявлять положительные степени окисления плюс два, плюс четыре, плюс шесть и плюс восемь.
Исключение составляет фтор, который в соединениях может проявлять только степень окисления минус один.
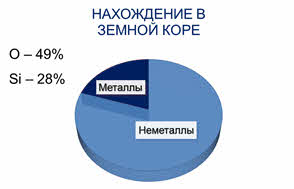
Массовая доля неметаллов в земной коре составляет почти 80%, а во вселенной достигает девяноста девяти процентов (в основном за счёт водорода и гелия). На долю кислорода в земной коре приходится более 49%, на долю кремния – около 28%, а на долю брома, йода, селена и тэллура – сотые доли процента.
Неметаллы входят и в состав живых организмов. Эти элементы называются органогенными. К ним относятся: углерод, кислород, водород, азот, фосфор, сера.
Несмотря на незначительное содержание селена, брома, йода в живых организмах, эти элементы относятся к жизненно необходимым.
В последние годы учёные установили, что селен оберегает клетки от вредного воздействия ультрафиолетового и радиоактивного облучения. Селен содержится в таких грибах, как лисички, опята, маслята, но значительно больше этого элемента содержится в ядовитых грибах: бледной поганке, мухоморе.

По мнению учёных, большие концентрации селена в грибах способствуют их быстрому росту. Но следует помнить, что употребление продуктов, содержащих селен в больших количествах, больше пяти миллиграмм на один килограмм пищи, приводит к острому отравлению организма человека.
В природе неметаллы встречаются как в виде простых веществ, так и в виде сложных соединений. Большая часть неметаллов входит в состав минералов и горных пород, в состав органических соединений.

Молекулы неметаллов могут быть одноатомными (благородные газы), двухатомными (галогены, кислород, азот и водород), а также содержать большее число атомов (как озон, фосфор и сера).
Атомы некоторых неметаллов могут образовывать цепи, например, атомы углерода образуют цепи неограниченной длины, а атомы кремния – недлинные цепи (до шести атомов).
Неметаллы образуют вещества молекулярного строения (кислород, азот, сера, благородные газы) и немолекулярного строения (углерод в виде алмаза и графита).
Для неметаллов характерно разнообразие в физических свойствах. Как вы знаете, при обычных условиях кислород, водород, азот, фтор, хлор – газы, как и элементы благородные, или инэртные газы.
Единственной жидкостью среди неметаллов является бром. Все остальные неметаллы – твёрдые вещества, которые имеют атомную кристаллическую решётку, как у бора и кремния, так и молекулярную, как у йода, фосфора, серы.
Многие неметаллы обладают окраской: графит – серо-чёрной, бром – красно-бурой, сера – жёлтой, хлор – жёлто-зелёной, йод – фиолетово-чёрной.

Очень различаются и другие физические свойства неметаллов: так температура плавления графита составляет 3850 градусов по Цэльсию, а у гелия — минус 272 градуса по Цэльсию.
Плотность газообразных неметаллов также различна: самая маленькая – у водорода, а самая большая – у радона.
Твёрдые неметаллы не обладают пластичностью.
В воде неметаллы нерастворимы или малорастворимы. Некоторые из них, как галогены, сера лучше растворяются в органических растворителях, а белый фосфор – в сероуглероде.
Различаются неметаллы и по электропроводности. Большинство неметаллов – это изоляторы.
Графит – является хорошим проводником электрического тока. Кремний, селен и тэллур обладают полупроводниковыми свойствами.
Интересно, что радиоактивный радон используется в медицине для лечения опорно-двигательного аппарата, сердечных и нервных заболеваний. Но в тоже время в литературе часто упоминается термин «радоновая проблема», который означает достаточно высокое облучение, вызванное радоном, который выделяется через разломы в земной коре.
Для неметаллов характерно явление аллотропии.
Аллотропия (от греч. аллотропия – другое свойство) явление существования элементов в виде нескольких простых веществ. Так, химический элемент кислород в природе существует в виде двух простых веществ – кислорода и озона. Различный состав и строение молекул определяют различие в их свойствах.
Кислород – газ без цвета и запаха, озон – газ светло-голубого цвета с резким характерным запахом. Они различаются также температурами плавления и кипения, реакционной способностью.
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Озон в верхних слоях атмосферы образует озоновый слой, который защищает живые организмы от ультрафиолетового излучения.
Небольшое количество озона в воздухе оказывает целебное действие на людей с заболеванием лёгких, но сильное обогащение воздуха озоном может стать опасным для здоровья. Источником озона служат работающие ксероксы, лазерные принтеры, источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы необходимо часто проветривать.
Химический элемент углерод также встречается в нескольких аллотропных модификациях: графит, алмаз, карбин, фуллерен, но наиболее распространены алмаз и графит, которые отличаются по своим свойствам. Графит – мягкое, серо-чёрное вещество, хорошо проводит электрический ток, а алмаз – прозрачный кристалл, самое твёрдое природное вещество, является изолятором.
Простые вещества неметаллы различаются и по химической активности. Наиболее химически активны галогены и кислород. Сера, фосфор, углерод и кремний вступают в химические реакции, как правило, только при нагревании.
Для неметаллов характерны и восстановительные, и окислительные свойства. Способность неметаллов проявлять те или иные свойства определяется положением их в ряду электроотрицательности. Электрооотрицательность уменьшается от фтора к водороду.
В качестве окислителей неметаллы взаимодействуют с металлами. Например, при горении магния в кислороде образуется оксид магния, кислород понижает свою степень окисления с нуля до минус двух, поэтому он вступает в роли окислителя, при горении железа в хлоре образуется хлорид железа три, хлор понижает степень окисления с нуля до минус единицы, поэтому хлор является окислителем.
В реакции с водородом неметаллы выступают в качестве окислителей, а водород – в качестве восстановителя. Например, в реакции водорода с серой образуется сероводород. Сера понижает свою степень окисления с нуля до минус двух, поэтому сера – окислитель.
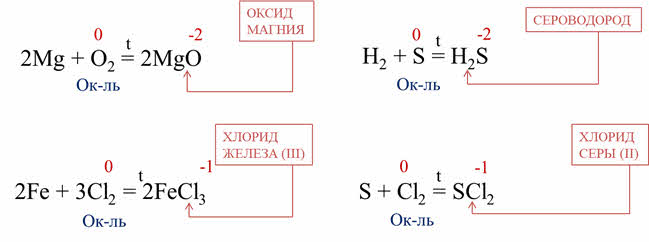
Неметаллы выступают в роли окислителей при взаимодействии с другими неметаллами, имеющими более низкую электроотрицательность. Так, в реакции серы с хлором образуется хлорид серы два, хлор понижает свою степень окисления с нуля до минус единицы, поэтому хлор – окислитель.
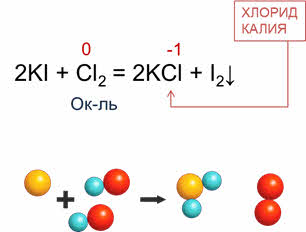
Неметаллы реагируют и со сложными веществами: в реакции хлора с йодидом калия образуется хлорид калия и йод. В этой реакции хлор понижает свою степень окисления с нуля до минус единицы, поэтому в данной реакции хлор является окислителем.
В качестве восстановителей неметаллы выступают в реакциях с неметаллами, атомы которых имеют более высокое значение электроотрицательности. Например, в реакции горения серы образуется оксид серы четыре, в данной реакции сера повышает свою степень окисления с нуля до плюс четырёх, поэтому в этой реакции сера – восстановитель.
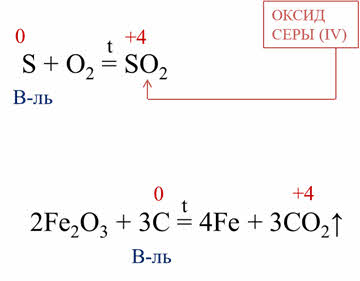
Восстановительные свойства неметаллы проявляют и в реакциях со сложными веществами. Например, в реакции углерода с оксидом железа три углерод повышает свою степень окисления с нуля до плюс четырёх, выступая в роли восстановителя.
В реакциях диспропорционирования один и тот же неметалл является одновременно и окислителем, и восстановителем.
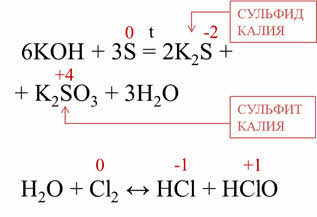
Например, в реакции серы с гидроксидом калия образуется сульфид калия, сульфит калия и вода. Сера, таким образом, изменила свою степень окисления с нуля до мину двух и плюс четырёх. В реакции хлора с водой хлор также изменяет свою степень окисления с нуля до минус единицы и плюс единицы.
Таким образом, все неметаллы являются элементами главных групп. Атомы неметаллов могут проявлять как отрицательные, так и положительные степени окисления. Простые вещества неметаллы существенно различаются между собой физическими и химическими свойствами. Для неметаллов характерно явление аллотропии. В химических реакциях неметаллы могут проявлять окислительные и восстановительные свойства.
Читайте также:
