Металлический натрий можно получить
Обновлено: 17.05.2024
Ат. вес 22,991. Как уже было указано, металлический натрий получается или электролизом расплавленного едкого натра, к которому прибавляют около 12% соды, или электролизом хлористого натрия.
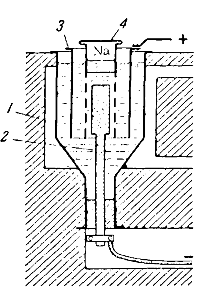
Схема установки для получения натрия из едкого натра изображена на рис. 140. Железный сосуд 1, вмещающий до 200 кг NaOH и вмазанный в печь, обогревается снаружи раскаленными газами для поддержания едкого натра в расплавленном состоянии. Катодом служит толстый никелевый или медный стержень 2, проходящий сквозь дно сосуда, анодом — никелевый цилиндр 3. Катод окружен железной сеткой, переходящей вверху в железный цилиндр 4, закрытый крышкой. Назначение сетки — предотвратить проникновение выделяющегося натрия к аноду.
В процессе электролиза расплавленный натрий накапливается внутри железного цилиндра, откуда он периодически вычерпывается и отливается в формы.
У анода вследствие разряда гидроксильных ионов выделяется кислород:
Образующаяся вода почти целиком испаряется, но все же некоторая часть ее разлагается током, вследствие чего у катода одновременно с натрием выделяется и водород.
Большой интерес представляет получение натрия из расплав-ленного хлористого натрия, так как в этом случае дорогостоящий едкий натр заменяется значительно более дешевым продуктом — поваренной солью.
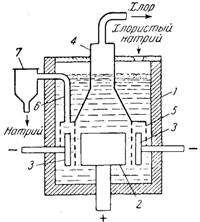
Ванна для электролиза NaCl (рис. 141) состоит из железного кожуха 1, обложенного изнутри огнеупорным кирпичом. Графитовый анод 2 окружен никелевым катодом 3, внешние стенки которого покрыты электроизоляционным материалом. Под колоколом 4 находится сетчатая перегородка 5, охватывающая катод. Металлический натрий собирается в кольцевом катодном пространстве и по трубе 6 переходит в сборник 7. Хлористый натрий загружают через отверстие в крышке ванны.
Недостатком способа является необходимость проведения процесса при сравнительно высокой температуре (610—650°), что требует довольно сложной аппаратуры.
В свободном состоянии натрий представляет собой серебристо-белый металл уд. веса 0,97, плавящийся при 97,7°. Натрий настолько мягок, что легко режется ножом. Вследствие легкой окис-ляемости на воздухе натрий хранят обычно под слоем керосина.
Металлический натрий имеет довольно широкое применение.. Он служит в качестве исходного материала при производстве перекиси натрия и амида натрия, а также используется при многих синтезах органических соединений. В лабораториях натрием часто пользуются для удаления последних следов влаги из некоторых органических растворителей.
С ртутью натрий образует твердый сплав — амальгаму натрия, которая иногда используется как восстановитель вместо чистого металла.
С кислородом натрий образует два соединения: окись натрия Na2O и перекись натрия Na2О2.
Окись натрия Na2O может быть получена путем пропускания над натрием, нагретым не выше 180°, умеренного количества кислорода или нагреванием перекиси натрия с металлическим натрием:
Окись натрия бурно реагирует с водой с образованием гидроокиси натрия и выделением большого количества тепла:
Перекись натрия Na2О2 образуется при сжигании натрия на воздухе или в кислороде. В заводских условиях перекись натрия готовят путем нагревания металлического натрия в плоских алюминиевых чашках, помещенных в железную трубу, через которую пропускается ток воздуха, освобожденного от углекислого газа. Полученный продукт имеет вид желтоватого порошка и содержит около 93% Na2О2.
Перекись натрия обладает очень сильными окислительными свойствами. Многие органические вещества при соприкосновении с ней воспламеняются.
При осторожном растворении перекиси натрия в холодной воде получается раствор, содержащий едкий натр и перекись водорода. Напомним, что все перекиси рассматриваются в настоящее время как соли очень слабой кислоты — перекиси водорода. Поэтому взаимодействие перекиси натрия с водой по существу представляет собой гидролиз соли, образованной слабой кислотой и сильным основанием:
Если нагревать полученный раствор, то вследствие разложения перекиси водорода из него выделяется кислород.
При действии на перекись натрия разбавленных кислот также получается перекись водорода:
Ввиду образования перекиси водорода при растворении Na2O2 в воде или в разбавленных кислотах перекись натрия широко применяется для отбелки тканей, шерсти, шелка, соломы, перьев и т. п.
Важное значение имеет реакция взаимодействия перекиси на трия с углекислым газом:
O 2 2 — + 2e — = 2O —
На этой реакции основано применение перекиси натрия в изолирующих противогазах, а также в подводных лодках для поглощения выдыхаемого людьми углекислого газа и одновременного пополнения запаса кисло рода в воздухе.
Гидрат окиси натрия NaOH представляет собой твердое белое, очень гигроскопическое вещество, плавящееся при 328°. Ввиду сильного разъедающего действия на ткани, кожу, бумагу и другие органические вещества он называется также едким натром («натр» старое название окиси натрия).
В воде едкий натр растворяется с выделением большого количества тепла вследствие образования различных гидратов.
Едкий натр должен храниться в хорошо закупоренных сосудах, так как он легко поглощает из воздуха углекислый газ, постепенно превращаясь в карбонат натрия.
Основным способом получения едкого натра является электролиз водного раствора поваренной соли. При пропускании тока у катода разряжаются
ионы водорода и одновременно происходит накопление гидроксильных ионов, в результате чего получается едкий натр; у анода выделяется хлор. Очень важно, чтобы продукты электролиза не смогли смешиваться, так как в противном случае едкий натр будет взаимодействовать с хлором с образованием NaCl и NaClO:
2NaOH + Сl2 = NaCl + NaClO + H2O
Существует несколько способов воспрепятствовать проникновению хлора в раствор едкого натра. Чаще других применяется диафрагменныйспособ, при котором анодное и катодное пространства отделены друг от друга перегородкой из асбеста. В электролитических ваннах, служащих для получения едкого натра по этому способу (рис. 142), вертикально установленная диафрагма 1, плотно прилегающая к железному дырчатому катоду 2, отделяет анодное пространство 3 от катодного 4. Анодами служат графитовые стержни 5. В процессе электролиза в анодное пространство непрерывно поступает раствор хлористого натрия, а из катодного вытекает раствор, содержащий смесь NaCl
и NaOH. При его выпаривании выкристаллизовывается хлористый натрий и остается почти чистый раствор щелочи. Последний сливают с NaCl и выпаривают до полного удаления всей воды. Полученную щелочь сплавляют и отливают в формы. Побочными продуктами при получении едкого натра являются хлор и водород.
Несколько иначе протекает электролиз раствора NaCl, если катодом служит металлическая ртуть. В этом случае у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя жидкий сплав, так называемую амальгаму натрия. Горячая вода легко разлагает амальгаму, причем получается едкий натр, выделяется водород и освобождается ртуть. Таким образом, пользуясь в качестве катода ртутью, можно получать совершенно чистый едкий натр, не содержащий примеси неразложившегося хлористого натрия.
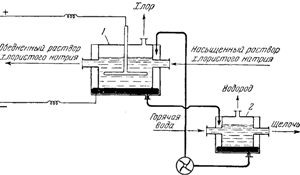
На рис. 143 показана схема установки для получения едкого натра по ртутному способу. Установка состоит из двух частей — электролизера 1, где происходит образование амальгамы натрия,
и разлагателя 2, в котором получается едкий натр и выделяется водород. На дно электролизера налит слой ртути. Насыщенный раствор хлористого натрия непрерывно поступает в электролизер с одной стороны, а обедненный раствор с меньшим содержанием NaCl выходит с другой стороны. Выделяющийся хлор отводится сверху, а амальгама натрия непрерывно перетекает в разлагатель 2, где разлагается поступающей в него горячей водой. Образующийся раствор щелочи вытекает через специальный отвод; водород удаляется через трубу вверху разлагателя. Регенерированная ртуть с помощью ртутного элеватора снова возвращается в электролизер 1.
Кроме электролитического способа получения едкого натра,, иногда еще применяется более старый способ — кипячение раствора соды с гашеной известью:
По окончании реакции раствор сливают с осадка углекислого кальция и, выпарив воду, сплавляют полученный едкий натр.
Едкий натр является одним из важнейших продуктов основной химической промышленности. Ежегодная мировая (без СССР) выработка его превышает 6,5 млн. т. B продажу он поступает под названием каустической соды. Огромные количества едкого натра потребляет нефтяная промышленность, где NaOH применяется для очистки продуктов переработки нефти, мыловаренная промышленность, бумажная, текстильная, производство искусственного волокна и ряд других производств.
Производство едкого натра в СССР в 1955 г. составило 563,4 тыс. г, что более чем в 10 раз превышает выработку едкого натра в дореволюционной России. В 1959—1965 гг. производство едкого натра намечается увеличить в несколько раз по сравнению с 1955 г.
Соли натрия. Натрий образует соли со всеми известными кислотами. Так как важнейшие соли натрия и их применение были описаны при соответствующих кислотах, то здесь мы только напомним их.
NaCl — хлористый натрий, или поваренная соль . Na2S — сульфид натрия, или сернистый натрий . Na2SO4• 10Н2О — десятиводный сульфат натрия, или глауберова соль . NaNО3 — нитрат натрия, или натриевая селитра . Na2CO3 • 10Н2О — карбонат натрия, или сода . Na2SiO3— силикат натрия, или растворимое стекло. Na2S2O3 • 5Н2O — тиосульфат натрия.
Очень многие соли натрия образуют кристаллогидраты с довольно большим содержанием кристаллизационной воды.
Все соли натрия окрашивают пламя газовой горелки в желтый цвет. Реакция эта позволяет обнаруживать присутствие самых ничтожных количеств натрия в исследуемом веществе.
Вы читаете, статья на тему Натрий (Natrium)
Похожие страницы:
НАТРИЙ ИСТОРИЯ ОТКРЫТИЯ ЭЛЕМЕНТА По распространенности, на нашей планете натрий занимает шестое место среди всех элементов. Природные соединения натрия —.
Содержание статьи1 Что такое щелочные металлы1.1 Натрий1.2 Кислородные соединения натрия. Едкий натр1.3 Калий Что такое щелочные металлы В группу щелочных.
Содержание статьи1 НАТРИЙ1.1 Все о натрии1.2 Металлический натрий1.3 Соли натрия НАТРИЙ (Natrium — от арабского натрун — сода ) .
Гидрид натрия NaH Основное получение гидрида натрия пропускание водорода через нагретый натрий при температуре до 360 — 400°C , а.
Калий (Kalium) Ат. вес 39,100. По внешнему виду, а также по физическим и химическим свойствам калий очень похож на натрий.
НАТРИЙ анализ Na, Качественная реакция на Натрий 3-Метил-1-фенил-5-пиразолон-4-азо-1′-4′-нитрофенил-2′-сульфокислоты калиевая соль C16H12N5O6SK, ММ 441,47 Оранжевые кристаллы; растворима в ДМФА, плохо в воде.
Натрий

Натрий (Na, лат. natrium ) — химический элемент первой группы, третьего периода периодической системы Менделеева, с атомным номером 11. Как простое вещество представляет собой мягкий щелочной металл серебристо-белого цвета. На внешнем энергетическом уровне натрий имеет один электрон, который он легко отдаёт, превращаясь в положительно заряженный катион Na + . Единственным стабильным изотопом является 23 Na. В свободном виде не встречается, но может быть получен из различных соединений. Натрий — шестой по распространённости элемент в земной коре: он находится в составе многочисленных минералов, включая полевые шпаты, содалит и «каменную соль» (галит, хлорид натрия).
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Применение
- 7 Изотопы натрия
- 8 Биологическая роль
- 9 Меры предосторожности

История и происхождение названия
Соединения натрия известны и использовались с давних времён. В древнегреческом переводе Библии — Септуагинте — упоминается слово νίτρον (в латинском переводе — Вульгате — ему соответствует слово nitroet ) как название вещества типа соды или поташа, которое в смеси с маслом служило моющим средством(Иер. 2:22). В Танахе слову νίτρον соответствуют др.-евр. ברית — «мыло» и נתר — «щёлок»(мыльная жидкость). Сода (натрон) встречается в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Название «натрий» происходит от латинского слова natrium (ср. др.-греч. νίτρον ), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр».
Аббревиатура «Na» и слово natrium были впервые использованы академиком, основателем шведского общества врачей Йенсом Якобсом Берцелиусом (Jöns Jakob Berzelius, 1779—1848) для обозначения природных минеральных солей, в состав которых входила сода. Ранее (а также до сих пор в английском, французском и ряде других языков) элемент именовался содий (лат. sodium ) — это название sodium, возможно, восходит к арабскому слову suda, означающему «головная боль», так как сода применялась в то время в качестве лекарства от головной боли.
Металлический натрий впервые был получен английским химиком Хемфри Дэви электролизом расплава гидроксида натрия. Дэви сообщил об этом 19 ноября 1807 года в Бейкеровской лекции (в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года, а натрий — через несколько дней после калия).
Нахождение в природе
Кларк натрия в земной коре 25 кг/т. Содержание в морской воде в виде соединений — 10,5 г/л . Металлический натрий встречается как примесь, окрашивающая каменную соль в синий цвет. Данную окраску соль приобретает под действием радиации.
Получение

Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля):
Na2CO3 + 2C → 1000oC 2Na + 3CO
Вместо угля могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий.
С появлением электроэнергетики более практичным стал другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия:
4NaOH → электрический ток 4Na + 2H2O + O2 , 2NaCl → электрический ток 2Na + Cl2 .
В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить цирконийтермическим методом или термическим разложением азида натрия.
Физические свойства


Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», дублет 588,9950 и 589,5924 нм
Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C ), температура плавления 97,86 °C , температура кипения 883,15 °C .
Под высоким давлением становится прозрачным и красным, как рубин.
При комнатной температуре натрий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм , Z = 2 .
При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc , параметры ячейки a = 0,3767 нм , c = 0,6154 нм , Z = 2 .
Химические свойства
Щелочной металл на воздухе легко окисляется до оксида натрия. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.
При горении на воздухе или в кислороде образуется пероксид натрия:
Кроме того, существует озонид натрия NaO3.
С водой натрий реагирует очень бурно, помещённый в воду кусочек натрия всплывает, из-за выделяющегося тепла плавится, превращаясь в белый шарик, который быстро движется в разных направлениях по поверхности воды, реакция идёт с выделением водорода, который может воспламениться. Уравнение реакции:
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, йода, углерода, благородных газов):
2Na + Cl2 → 2NaCl 2Na + H2 → 250−400oC,p 2NaH
Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития):
С разбавленными кислотами взаимодействует как обычный металл:
2Na + 2HCl → 2NaCl + H2↑
С концентрированными окисляющими кислотами выделяются продукты восстановления:
Растворяется в жидком аммиаке, образуя синий раствор:
С газообразным аммиаком взаимодействует при нагревании:
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой. При недостатке металла происходит реакция Вюрца.
Реагирует со спиртами, фенолами, карбоновыми кислотами с образованием солей.
Растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1).
Применение
Металлический натрий широко используется как сильный восстановитель в препаративной химии и промышленности, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах двигателей грузовиков как жидкий теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Жидкометаллический теплоноситель в ядерных реакторах на быстрых нейтронах БН-600 и БН-800.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12—24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна).
Хлорид натрия (NaCl) (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия (NaN3) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Изотопы натрия
В настоящее время (2012 г.) известно 20 изотопов с массовыми числами от 18 до 37 и 2 ядерных изомера натрия. Единственный стабильный изотоп 23 Na. У большинства изотопов период полураспада меньше одной минуты, лишь один радиоактивный изотоп — 22 Na — имеет период полураспада больше года. 22 Na претерпевает позитронный распад с периодом полураспада 2,6027 года , его используют в качестве источника позитронов и в научных исследованиях. 24 Na, с периодом полураспада по каналу β − -распада 15 часов, используется в медицине для диагностики и для лечения некоторых форм лейкемии.
Биологическая роль
Натрий входит в состав всех живых организмов. В высших организмах натрий находится большей частью в межклеточной жидкости клеток (примерно в 15 раз больше, чем в цитоплазме клетки). Разность концентраций поддерживает встроенный в мембраны клетки натрий-калиевый насос, откачивающий ионы натрия из цитоплазмы в межклеточную жидкость.
Совместно с калием натрий выполняет следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграммов. Для взрослых по данным Американской Ассоциации сердечных заболеваний минимальная необходимая доза составляет меньше 500 миллиграммов, рекомендуемая до 1500 миллиграммов в день (за исключением некоторых болезней или профессий, при которых нужно повышенное количество натрия). В виде поваренной соли в 3/4 чайной ложки содержится 1725 миллиграммов натрия. По другим данным здоровым взрослым стоит ограничивать употребление натрия 2300 миллиграммами, а людям с повышенным давлением и рядом других заболеваний 1500 или меньшим количеством.
Натрий содержится практически во всех продуктах в разных количествах, хотя большую его часть организм получает из поваренной соли, в том числе в составе консервов, полуфабрикатов, соусов, колбасных изделий и т.п. В качестве источника натрия служат также такие пищевые добавки как глутамат натрия, пищевая сода (бикарбонат натрия), нитрит натрия, сахаринат натрия и бензоат натрия. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако чрезмерно солёная пища и пища, богатая белками, препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированной пищей человека не встречается, однако некоторые проблемы могут возникнуть при голодании. Временный недостаток может быть вызван использованием мочегонных препаратов, поносом, обильным потением или избыточным употреблением воды.
Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте и нарушение усвоения аминокислот и моносахаридов. Продолжительный недостаток вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, повышенное выделение калия с мочой, у некоторых людей повышенное кровяное давление и скопление жидкости. Максимальное количество соли, которое может быть переработано почками, составляет примерно 20—30 граммов, большее количество уже опасно для жизни.
Меры предосторожности
Чистый металлический натрий огнеопасен. На воздухе склонен к самовоспламенению. Особенно опасен контакт с водой и влажными поверхностями, так как натрий очень бурно реагирует с водой, часто со взрывом, образуя едкую щёлочь (NaOH). В лабораториях небольшие количества натрия (примерно до 1 кг) хранят в закрытых стеклянных банках под слоем керосина, лигроина, бензина или вазелинового масла так, чтобы слой жидкости покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе). Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке); необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в керосин, либо тут же вводят в реакцию. Прежде чем приступить к работе с натрием, необходимо пройти инструктаж по охране труда. Лица, впервые приступающие к работе с натрием, должны производить эту работу под наблюдением сотрудников, имеющих опыт такой работы. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков граммов. Для показательных опытов, например, в школе на уроках химии, следует брать не более одного грамма натрия. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты. Следует обратить особое внимание на то, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать взрыв и разрушение трубы. Все работы с натрием, как и вообще с щелочами и щелочными металлами, должны проводиться в очках или защитной маске. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Воспламенение и даже взрыв металлического натрия при соприкосновении с водой и многими органическими соединениями может причинить серьёзные травмы и ожоги. Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щёлочью. Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающий разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).
Получение металлического натрия из средства для чистки труб! (Для химиков-энтузиастов)
Средство для чистки труб "Крот" - это раствор щелочи очень грязной щелочи.Можно ли получить чистый металлический натрий из этого раствора? Оказывается можно)))
В школе я с огромным интересом наблюдал за тем, как реагируют щелочные металлы с водой и мне всегда хотелось самостоятельно поэкспериментировать с такими веществами))
Если вас тоже завораживал металл плавающий по воде и выделяющий водород, то, наверное, вам будет интересно это видео)

Отлично. Теперь ждём "Кокаин из поваренной соли", "Виски из куриных потрошков" и другие полезные рецепты!
Именно таким образом сэр Хемфри Дэви и открыл натрий. Электролиз раствора едкого натра.
ну всё, теперь можешь пускаться во все тяжкие))
А, что еще можно сделать из крота?
Кстати, вопросик есть: Эта адская жидкость(крот имею ввиду) дюраль разъедает?

Реакция галлия и алюминия с прекрасной концовкой

Занимательные опыты по химии








Был бы у меня такой учитель

Ответ BabudaiAga в «Б - Баланс»
Если кого-то интересует проверка баланса своих кубиков - есть хороший способ без проведения 10000 бросков. Правда, это легко сделать только для пластиковых кубиков.
Для этого делается очень крутой солевой раствор. В простой воде кубик тонет, поэтому нужно воду сильно просолить, повысив ее плотность до того момента, что бы кубик плавал. После чего кубик кидается в этот раствор.
Куб находится во взвешенном состоянии, почти в невесомости, поэтому, если какая-то из граней перевешивает (кубик не сбалансирован), эта грань всегда будет тонуть - кубик проворачивается этой гранью вниз. И это легко увидеть, если попробовать чуть покрутить плавающий кубик пальцем. Сбалансированный куб держится любой гранью вверх, несбалансированный постоянно проворачивается в одно и то же положение. И скорость проворота в это положение показывает насколько куб несбалансирован.
Я так свои д20 кубы для настолок все проверял. Это намного быстрее и нагляднее, чем совершать 10000 бросков =)
Но с металлическими способ не канает. Ну, конечно, если у вас нет плошки с ртутью, что бы купать кубики в ней. =)

Продолжение поста «Б - Баланс»
Я уже говорил тебе, что такое безумие? Безумие — это точное повторение одного и того же действия, раз за разом, в надежде на изменение. Это и есть безумие.
(с) Ваас Монтенегро
По просьбам в комментариях под прошлым постом продолжаем тему баланса игровых костей.
Для ЛЛ: 10 000 бросков кубиков с Ozon. Потом ещё столько же бросков кубиков из магазина настолок. Потом четыре онлайн-генераторов кубов, тоже по 10 к роллов для каждого. Подведение итогов.
Объект исследования:
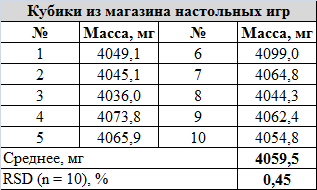
1) кубики из магазина настольных игр, набор 10 штук (250 р набор, по 25 р каждый);
2) самые дешёвые кубики от Ozon, набор 8 шт (на момент заказа 104 р, т.е. по 13 р каждый);
3) результаты генераторов: этого, этого, этого и вот этого (бесплатно, разумеется).
Как бросал: чтобы исключить влияние оператора, из говна и палок плотного картона сделал dice tower (благо, схему в интернете найти легко). Фотографировать этот шедевр орочьей инженерии, с вашего позволения, не буду: свою функцию выполняет, при бросках не деформируется, но выглядит неказисто.
Кубики из магазина настолок: розового цвета, "для няшных варгеймов", как сказано на сайте. Не думаю, что со своими патлами и бородой я соответствую критериям няшности, но уж какие были в наличии. Размер: стандартные 16 мм. Материал: написано, что нефрит. Грани и углы хорошо сглажены: кубик катится долго, делая на столе не менее 5-6 оборотов. Матрица - правосторонняя. Материал не выглядит совершенно однородным, на гранях присутствует градиент цвета. Размер точек не отличается, сами точки залиты белой краской ниже уровня грани. Внешний вид:

Сравнение массы кубиков в наборе:
Кубики с Озона: меньше стандартных, всего 12 мм. 8 штук в наборе. Материал - АБС-пластик. Прозрачные, точки заглублены и маркированы красной, жёлтой и синей краской. Кубики, кажется, пытались сбалансировать: точка на грани 1 крупнее и глубже остальных. В толще материала 3 из 8 кубов имеют маленькие (менее 1 мм) пузырьки воздуха. Кубики с этим дефектом не исключал из выборки: проверим то, что пришло, "as is", никто ведь не будет рассматривать их так пристально во время игры. Грани и углы сглажены, куб катится хорошо. Матрица тоже правосторонняя. Внешний вид:

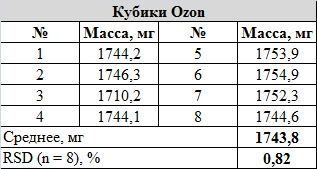
Т.к. в обоих случаях масса кубиков в наборе очень близка, принял решение кидать кубики каждого типа вместе, по 10 и 8 штук, для ускорения набора статистики. Иначе, думаю, к концу эксперимента кукушечка у меня отлетела бы окончательно.
Выгоняем котов (очень уж им хотелось присоединиться к новой весёлой игре) и начинаем. Результаты - в этом файле Excel (Яндекс.Диск). Далее для наглядности полученные результаты отнесены к "идеальным" 16,67% (1/6, столбец "Δ от нормы"). Для оценки полученных результатов использовал, как предложил уважаемый @fakir22, критерий хи-квадрат, только расчёт выполнил через функцию ХИ2ТЕСТ.
Результаты бросков для кубиков из магазина настолок:
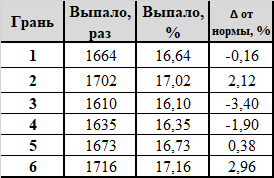
Максимальное отклонение от оптимального значения составило 3,40% (напомню, для кастомного кубика из предыдущего поста грань 6 выпадала на 9,74% чаще, а 1 - на 5,80% реже "положенного"). Для числа выпадений каждой грани RSD (n=6) 2,39%, χ^2 = 0,4451: опровергнуть гипотезу равной вероятности граней 1-6 не удалось.
Вытираем скупую мужскую слезу пот со лба, берём в руки кубики с Озона и бросаем их. правильно, ещё 10 000 раз. За окном уже брезжит рассвет и матерятся дворники. Результаты:
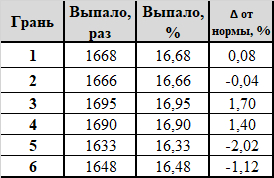
Признаться, я был удивлён. Самые дешёвые кубики, от которых не ждёшь никаких сюрпризов, показали весьма достойные результаты: RSD (n=6) 1,43%, χ^2 = 0,8891: очень. нет, ОЧЕНЬ хорошо. Очевидно, доказать неравновесность кубиков тоже не удалось. Кубики, по итогу, унёс на работу и раздарил коллегам (- Мужик, у тебя кубик есть? На, мужик, кубик).
В прошлый раз я сказал, что для нивелирования неравновесности физических дайсов стоит использовать онлайн-генераторы кубов. Чтобы не быть голословным, проверил четыре таких сайта из топа поисковика (те, что показывали полную выдачу по каждому "роллу": к этому моменту вносить результаты по одной цифре я был уже не в состоянии). Для каждого сайта делаем ещё по 10 000 "бросков" и переносим результаты в эксель.
Пикабу образовательный: теперь я знаю о возможности рассортировать данные из одной ячейки через опцию "Данные" - "Текст по столбцам" (может быть, кому-то пригодится). Полные результаты в расчётном файле по ссылке выше. Чтобы не растягивать, приведу только сводную таблицу (не реклама):
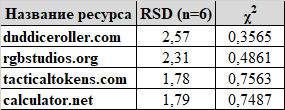
Т.о., все эти сайты дают правдоподобную картину случайного распределения результатов ролла.
Подведём итоги.
1) Если грани кубиков не имеют очевидных различий, скорее всего, распределение результатов ролла будет близко к нормальному (КАПИТАН ОЧЕВИДНОСТЬ, чёрт побери). Цена тут, вероятно, вторична.
2) При выборе кастомных костей надо быть очень осторожным. Некоторые мастера отдают предпочтение внешнему виду, по каким-то причинам (сложность ли производства, банальное попустительство или что-то ещё) забывая о балансе своих изделий.
3) Онлайн-генераторы (по крайней мере те, что я навскидку рассмотрел) дают вполне достоверную картину распределения вероятности выпадения костей. Но, разумеется, кому-то (мне, например) нравится момент бросания кубиков, в этом есть своя романтика.
Напоследок пара слов уважаемому (без сарказма) @cyberdicegames. Я ни в коем случае не ставлю под сомнение Ваше мастерство: безусловно, и кости и, особенно, коллекционные фигурки выглядят очень здорово, и я с интересом буду в дальнейшем следить за Вашими публикациями. Однако. Как там было сказано? Цитирую (орфография сохранена):
. когда мне пишут люди про баланс моих дайсов, обладая только теорией, (что у вас тут вырез на одной грани больше чем на другой и я УВЕРЕН ваши кубики НЕБАЛАНСНЫ), меня это всегда вызывает улыбку. все эти громкие заявления - пальца выделенного не стоят. . все эти люди, кто так яро выражали своё мнение про баланс - имели в своих коллекциях огромное количество дайсов просто с ужасным балансом.
Пальца выделенного, мда. Ну что же, вот я из интереса потратил своё время и теперь обладаю не только теорией, но и кучей практики (даже больше, чем хотелось бы). Самые дешёвые кубики, купленные на Озоне и в первом попавшемся магазине настолок, оказались сбалансироваными. Случайные онлайн-генераторы кубов - тоже выдают адекватные результаты. Но баланс как минимум некоторых моделей Ваших кубов, которые стоят в 69 (. ) раз дороже и которые Вы, по сути, рекламируете своими постами на Пикабу, объективно оставляет желать лучшего. Стильная, красивая, дорогая. игрушка.
Буду рад, если Вы аргументированно меня переубедите. Агрессивно отстаивая баланс своих дайсов, Вы раз за разом показываете кубик, насечки на гранях которого имеют равную длину (даже сделали, как я посмотрю, новую подпись к фото: "Perfect! Balanced Dice"). Вот только никто с этим и не спорил: например, ещё больше двух недель назад я говорил, что к этому кубику меньше всего вопросов. И даже Ваш эксперимент это подтверждает. Сомнения вызвали кубы с визуально различающейся длиной выточек, но все неудобные вопросы о них Вы игнорируете, приводите эмоциональные доводы без конкретных цифр или переходите на личности.
Вы заявляете: "самым важным элементом в моей работе является - качество", но отмахиваетесь от критики (я хотел, чтобы мои замечания были максимально обоснованными и конструктивными, сделав в общей сложности 30 000 физических роллов и 40 000 виртуальных): "мне не интересно доказывать элементарные вещи, которые каждый сам может осознать" и т.п. Это звучит инфантильно и непрофессионально.
Приглашаются: @arrraarrra (вопрос о виртуальных дайсах), @Deha4444, @ghostabv, @Whateveryouwish, @KAKAOCMETAHA, @dildus, @arigatan и остальные, спрашивавшие про баланс магазинных кубов.
Получаем натрий из ВОДНОГО раствора
Как всем известно (ну тем, кто учил химию) получить щелочные металлы из водных растворов невозможно. По крайней мере так учат в школе. Речь идёт об электролитическом методе.
При этом в продолжении темы рассказывают об электролизе расплавов щелочей, из которых всё же можно выделить щелочные металлы в виде металлов.
В видео ниже вы увидите, как буквально на коленке можно организовать процесс электролиза расплава щелочей и получить металлический натрий. (готовьте салфетки, чтобы подтирать кровь из глаз)
А также продемонстрирован лайфхак, как получить щелочные металлы их ВОДНЫХ растворов их солей.

1.3K пост 11.3K подписчиков
Правила сообщества
Старайтесь выбирать качественный контент и не ставьте теги моё на копипасты
Посты с просьбой решения домашнего задания переносятся в общую ленту
1. Оскорблять пользователей.
2. Постить материал далеко не по теме и непотребный контент (в остальном грамотно используйте теги)
3. Рекламировать сомнительные сайты и услуги коммерческого характера
Неужели все только для визуалов?(
С удовольствием бы почитал текст…
Во, только вчера на ютубе смотрел. А вот про опыт с лампочкой было б прикольно снять.
Надо чем-то увлечь людей, я бы кучу разных опытов, или поэпичней тиктокеров всяких замутил)
Всегда с интересом смотрю выпуски)
Термоусадку на гвозде лучше усаживать верхней частью пламени зажигалки, а не средней.
Меня вот какая штука интересует.
В одной из технологий оксидирования используется кипящий насыщенный раствор едкого натра.
Состав раствора примерно таков :
Дистиллированной воды 100г;
едкого натра 62г;
натриевой силитры 12г;
Вопрос заключается вот в чем.
Читая о технике безопасности работы с едким натром, нигде не видел упоминания о испарениях его растворов.
Вроде бы и очевидно, что пары щелочного раствора весьма ядовиты, но хотелось бы более полного ответа от компетентного человека.
Таким образом можно и аммоний получить электролизом, в виде амальгамы. Правда, при попытке выделить его из амальгамы аммоний немедленно разваливается.

На ноль делить нельзя. Можно найти предел отношения величин, когда одна из них стремится к нулю. :)
А не покажете опыт ( подробностей не помню, читал только в журнале) про электролиз натрия в расплаве - когда в расплав ( вроде бы селитры) макают включенную электролампочку. Ну и вариант с калием тоже хотелось бы.
А также продемонстрирован лайфхак, как получить щелочные металлы их ВОДНЫХ растворов их солей.
а как бы нахуа? оно клорадского жука убивает или сорняки убивает? кака полза практическая?
мб унитаз не пачкается при применении этих ваших ВОДНЫХ растворов?
как популяризировать науку?
что бы то - то надо натрий! Йоу ! а где взять? и погнал
Барий
В прошлом году нашел породу. Просто ехал на машине и обратил внимание на выход какой то отличающейся от основного пейзажа породы тёмного цвета. Взял на посмотреть домой. Дома при рассмотрении показалось, что данная порода содержит в себе металл. На тот момент выделить или обнаружить что то, ничего не получилось. На днях попалась она мне снова на глаза в гараже, решил еще раз попробовать с ней поработать. Вот так она выглядит.

Для начала решил рассмотреть осадок, для чего залил водой иииииииии, замучился отделять осадок. Каждый прилив воды вызывал стойкую взвешенную муть которая никак не отделялась и не осаживалась. Промучился целый день и в конце дня решил что что то находится в растворе во взвешенном состоянии что и мешает осаждению мути. Решение оказалось простым, при небольшой кислотности муть осаживалась и давала спокойно работать. В процессе выяснилось, что на поверхности водного раствора плавают самородные кристаллы каких то металлов. Хотел заснять их на видео, но по техническим причинам не получилось. Так же, в породе, обнаружились кристаллы рубинового цвета, причем довольно много их видел. Что это, - рубины, пиропы, кристаллы марганца или что другое непонятно. Вот так они выглядят на видео снятое с помощью микроскопа..
То, что основная порода принадлежит барию, указывают косвенные признаки, такие как, - желтый цвет пламени с небольшой зеленой подсветкой по краю, при нагреве породы открытым пламенем газовой горелкой. Так как барий относится к активным щелочным металлам, то находясь в кислородной среде при высокой температуре, он самовоспламеняется и сгорает в ярком ослепительно белом пламене. Здесь на видео так не получилось, селитра была загрязнена поэтому пламя довольно вялое, может потом пересниму.
При проведении различных манипуляций с данной породой, заметил, что кипячение водного раствора с наличием бария в растворе, делает посуду стойкой по отношению высаживанию на стенках сосуда паров воды, конденсата. Вот как здесь на конической колбе, где видно, что сверху колбы находится конденсат пара воды, а нижняя часть колбы конденсат не собирает, хотя до этого конденсат собирался по всей длине колбы при кипячении других растворов.

Вообще в этом году было много находок интересных и слишком интересных, но думаю не обо всем надо писать, мало ли, как говорят язык мой, враг мой. Вот, думаю подать несколько заявок на открытие месторождений, может и прокатит что нибудь.

Научное открытие


Зависимость от соцсетей
Для трех подписчиков.)
Каждый раз когда человек открывает смартфон и влетает на ютуб, пикабу, тикток, он получает мощнейший выброс дофамина. Многие считают, что дофамин это гормон счастья. Однако это уже давно не так. Дофамин - нейромедиатор который побуждает нас к получению удовольствия. Но это не само удовольствие/счастье/кайф. Именно этот нейромедиатор заставляет нас листать ленту круглые сутки, сейчас поясню подробнее.
Тысячи лет назад, в "пещерные" времена дофамин играл особую роль в построении жизни. Идешь по лесу, увидел съедобные ягоды, получи дофаминчика (побуждает к действию), собери ягоды, не умри с голода(кайф).
Пришло дружественное племя? Держи дофамина (иди поговори, узнай про хищников). Узнал, что в соседней саванне развелось много гепардов? Не иди туда, иди лучше туда где по рассказам много свиней (поел, не умер с голоду, семья цела, все хорошо).
Увидел у вражеского племени новую технологию (копье)? Держи дофамина (убей, забери копье), изучи новую технологию. Стань SWAG в своей пещере.
Плохая новость - мы попали в ловушку наших "инстинктов". Нам кажется, что пожар в Австралии, фотки моделей или друзей в инсте, новые посты в паблике Science, невероятно важны. Однако возникает вопрос, как давно вы применяли эти знания на практике? Эта информация мертвым грузом оседает в голове, не неся за собой практической пользы.
Но самое страшное - дальше.
"Ну залипаем мы в телефоне, ну и че? Два - три часа в день, ничего страшного с дофаминовой системой не произойдет, дай отдохнуть после работы."
А теперь смотри сюда.
У НАС ВСЕГО ОДНА СИСТЕМА ПОБУЖДЕНИЯ - дофаминовая.
Рецепторы дофамина можно сравнить со вкусовыми рецепторами. Чем больше дофамина ты получаешь, тем больше дофамина тебе нужно. Твоего дофамина тупо не хватит на то, чтобы прочитать книгу(результат будет не скоро), открыть бизнес, переехать в другую страну. Для этого тебе потребуется энергия и мотивация, каждый, сука, день. Но мотивации уже нет, твои рецепторы уже сожженны в соцсетях. Дофамина на спорт, образование, и иногда даже для поиска сексуального партнера, не остается.
Причина по которой я прекратил использовать смартфон - Тикток.
Алгоритмы хорошо подобрали для меня контент, все что нужно - психология, саморазвитие, спорт, мотивация, нейробиология. Господи, это именно то, что мне нужно - удобный, быстрый формат, возможность сохранять видео. Как будто Эльдорадо от мира информации. Но вот прошло 2 месяца, в сохраненные я не захожу, лишь продолжаю листать ролик за роликом с мыслью "Йоу, ты же не фигню смотришь, полезный, развивающий контент" и не замечаю, как я постепенно тупею, не могу сконцентрованно прочитать 10 страниц Канемана, речь становится хуже. И боюсь Пикабу, Ютуб, и даже Хабр, работают на этом принципе. Для большей части людей эта информация - мусор.
Каждый раз когда вижу маленьких детей залипаюих в смартфон становится не по себе.
К последним новостям мира науки
Один из крупнейших научных издательских домов Elsevier начал отправлять рецензентам анкеты с вопросами о. гендерной и расовой принадлежности.
Делается это, по словам редакции «для поддержки инклюзивности науки». В частности, инклюзивность решили внезапно поддержать в таких журналах, как Chemical engineering journal и Journal of Alloys and Compounds (само собой, никоим образом не связанных с исследованиями гендерных и расовых вопросов)


Кроме того, забавно видеть от научного издательства постановку вопроса «Каким бы расовым термином вы бы себя определили?»
И далее идёт перечисление «рас»:
Азиаты или жители Океании
Черные
Испанцы или латиноамериканцы
Коренные народы (североамериканские индейцы, южноамериканские индейцы и т.п.)
Ближневосточные или североафриканские жители
Белые
Собственное описание
Толерантность, инклюзивность и всё такое — это, конечно, хорошо, однако расоведение (раздел антропологии, изучающий человеческие расы) выделяет всего четыре расы человека (европеоидная, монголоидная, негроидная, австралоидная) и десятки малых антропологических типов. В списке же намешаны расы, народы, языковые группы и даже возможность самоопределить себя в отдельную расу.
Извините, другой науки у нас для вас нет 🌚
Правда ли, что употребление соли вредно?

Один из самых популярных мифов о питании гласит, что соль — это белая смерть, она вредна для здоровья. Мы решили проверить, правда ли это.
(Специально для любителей расширения сознания — речь идет про поваренную соль, которая хлорид натрия)
(Самое важное для ЛЛ: утверждение, что соль вредна, абсолютно некорректно. При этом к проблемам со здоровьем может привести как ее дефицит, так и избыток в суточном рационе)
Информацию о том, насколько соль опасна для нашего организма, можно найти на сайтах медицинских учреждений, например больниц. Об этом пишут СМИ, даже специалисты ООН бьют тревогу. Рассуждения о том, стоит ли полностью отказываться от соли, можно найти на порталах о диетологии и здоровом образе жизни. Стереотип о том, что соль — это яд, настолько распространён, что его можно встретить даже в кино.
1. Дефицит соли
Соль на 97% состоит из хлорида натрия и служит одним из основных источников этих элементов для нашего организма. Натрий — электролит, который играет важную роль в поддержании водно-солевого баланса (логично), а также обеспечивает передачу нервных импульсов.
Сама по себе нехватка натрия в крови — уже достаточно серьёзное заболевание, гипонатриемия. Оно может привести к тяжёлым неврологическим и психическим нарушениям, судорогам, коме и даже смерти. Ещё одна опасность низкого содержания натрия в организме — обезвоживание, которое тоже может привести к тяжёлым последствиям для здоровья. И обезвоживание, и гипонатриемия особенно опасны для людей старшего возраста. Натрий выводится из нашего организма естественным образом с мочой и потом. Именно поэтому спортсмены после тяжёлых тренировок могут ощутить нехватку натрия, один из её симптомов — мышечные спазмы.
В 2016 году специалисты Кокрановской библиотеки изучили результаты различных исследований о взаимосвязи потребления соли, давления и холестерина и выяснили, что диета с пониженным содержанием соли способствует некоторому повышению холестерина и триглицеридов в крови. А это, в свою очередь, может привести к заболеваниям сердца. Кроме того, пищевую соль часто обогащают железом, йодом и фолиевой кислотой, поэтому её употребление может восполнить и нехватку этих веществ в организме.
Американская кардиологическая ассоциация рекомендует потреблять в день 1,5 г натрия — это примерно 3/4 чайных ложки соли. Однако, согласно проведенным ими исследованиям, средний американец съедает примерно полторы, превышая норму в два раза. То же самое обнаружили и диетологи Австралии.
2. Негативные последствия избытка соли
Многочисленные исследования врачей показали, что переедание соли способствует развитию гипертонии, что, в свою очередь, может привести к инфарктам и инсультам. В 2020 году учёные заявили, что увеличение ежедневного употребления натрия всего на 1 г приводит к повышению риска смерти от сердечно-сосудистых заболеваний на 6%. Кровяное давление влияет и на здоровье почек, поэтому сильно солёная пища может отрицательно сказаться и на них.
Впрочем, на этот счёт учёные пока не смогли прийти к единому мнению. Некоторые из них считают, что доказательств влияния потребления соли на кровяное давление недостаточно. В любом случае паниковать и полностью отказываться от соли не стоит: доказано, что употребление в пределах одной-двух чайных ложек точно не способствует повышению давления.
Кроме того, обзор 2014 года показал, что сокращение количества соли в рационе на 2 г способствует снижению систолического артериального давления всего на 3,82 мм ртутного столба. При средних значениях в 125–144 мм ртутного столба такое снижение представляется не особенно значимым.
Между делом учёные выяснили, что одни люди более чувствительны к соли, чем другие. Вероятно, именно им стоит более пристально следить за соблюдением нормы потребления натрия. Но зато и сокращение соли в рационе для них будет более эффективным, чем для тех, кто не так чувствителен. В группу риска, по мнению учёных, входят пожилые люди, гипертоники, афроамериканцы, люди с хроническими заболеваниями почек, те, у кого был низкий вес при рождении.
3. Соль и рак желудка
Некоторые исследования связывают диеты с повышенным содержанием соли с риском развития рака желудка. Так, одно из исследований, проведённых в Японии, с участием более чем 40 000 человек показало, что этот риск выше аж на 30% у тех, кто предпочитает сильно солёную пищу.
При этом учёные пока не пришли к единому мнению, как конкретно соль может вызвать рак. По одной из версий, она способствует размножению бактерий, провоцирующих язвенную болезнь, которая может перерасти в рак. По другой — диета с высоким содержанием соли может вызвать клеточные мутации, которые в конечном счёте и приводят к раку.
4. Остеопороз
Ещё одна опасность избыточного потребления соли — остеопороз. Организм выводит излишки натрия через мочу, а вместе с ней выводится и кальций. Соответственно, чем больше соли необходимо вывести организму, тем больше он вымоет и кальция, что может стать причиной костных нарушений.
5. Контроль количества потребляемой соли
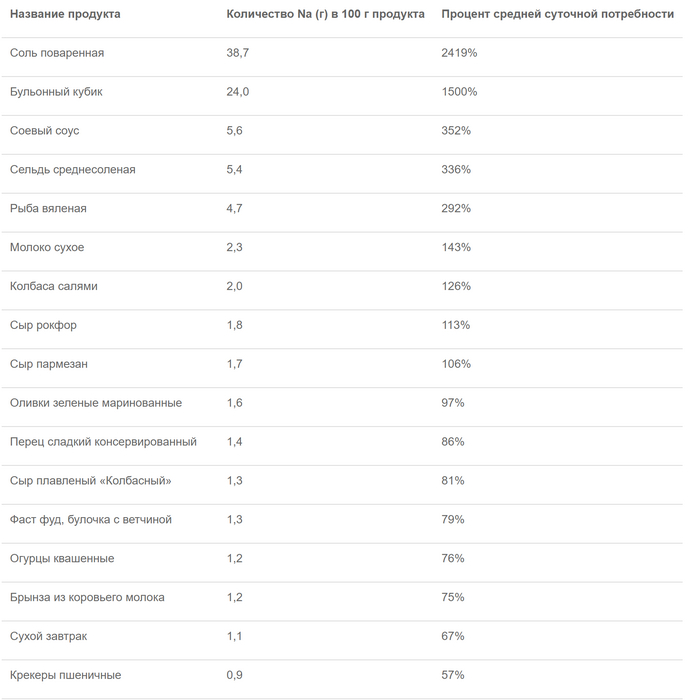
Ограничивать соль в рационе действительно есть смысл, поскольку следить за ее количеством не так просто, особенно если вы употребляете готовые продукты, например соусы. Соль содержится практически во всех продуктах питания, но оценить её количество не всегда можно на глаз.
Роспотребнадзор приводит таблицу содержания соли в различных продуктах. По их данным, в 100 г среднесолёной сельди содержится 336% дневной нормы натрия, в 100 г пармезана — 106%, а в таком же количестве оливок — 97%. Таким образом, чтобы не превысить норму, вам не только нужно выбрать в день что-то одно, но и совсем не употреблять соль в других продуктах, что практически невозможно.
Таким образом, избыточное потребление соли может быть опасно для здоровья, хотя учёные до сих пор не смогли прийти к единому мнению на этот счёт. Тем не менее полностью отказываться от неё нельзя, поскольку она — источник натрия, который необходим организму для нормальной жизнедеятельности, а его нехватка может привести к печальным последствиям для здоровья.
Поэтому, как и со многими другими продуктами, с солью всё хорошо в меру, однако утверждать, что её употребление в любых количествах приближает смерть, — несправедливо.

Наш вердикт: полуправда (проверяемый факт или утверждение представляет собой смесь правды и лжи примерно в равных пропорциях)
Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла).
Аудиоверсии проверок в виде подкастов c «Коммерсантъ FM» доступны в Simplecast, «Яндекс.Подкасты», Apple Podcasts, «ЛитРес», Soundstream и Google.Подкасты.
Читайте также:
