Металлы 11 группы таблицы менделеева
Обновлено: 28.05.2024
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
.jpg)
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов

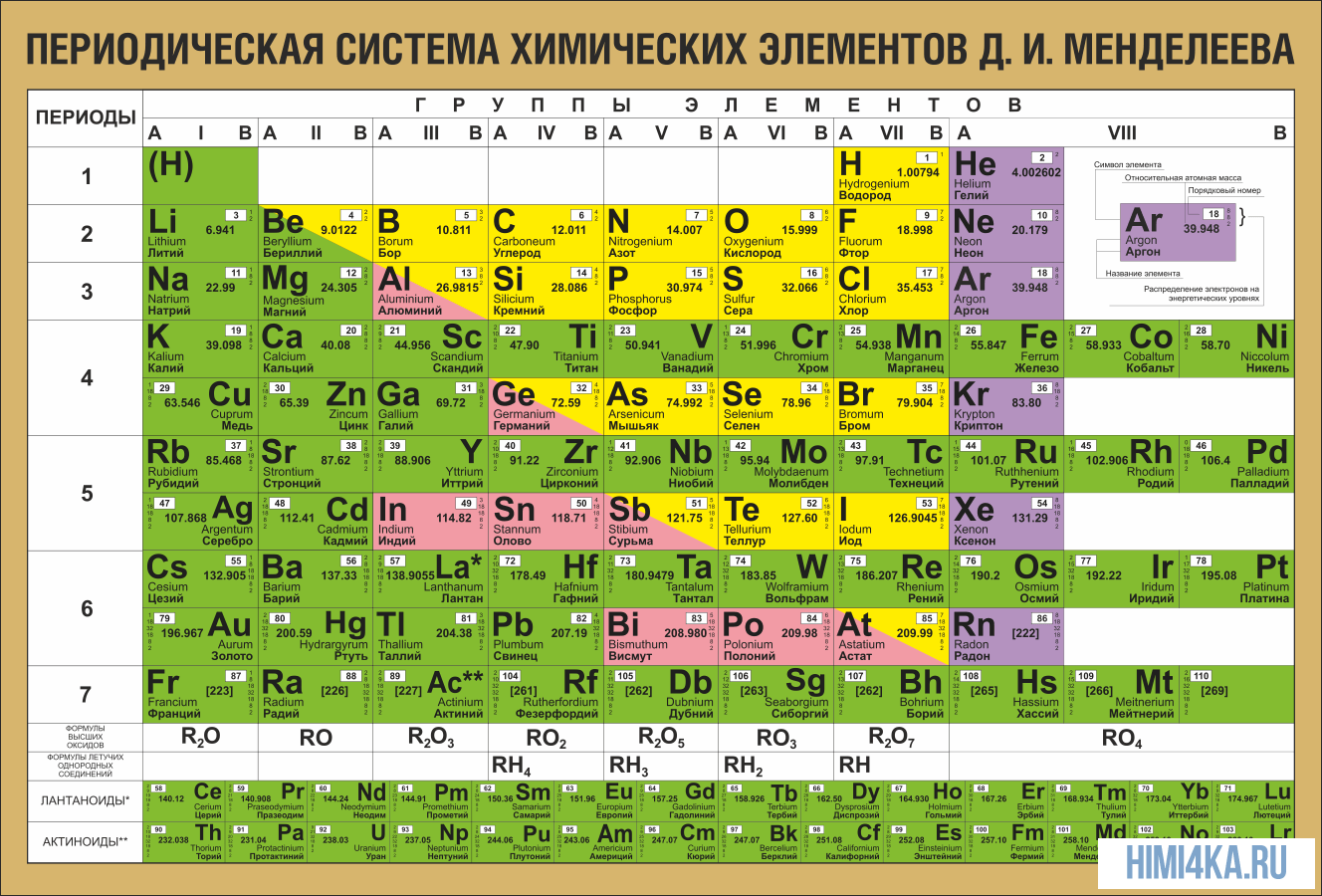
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
.jpg)
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
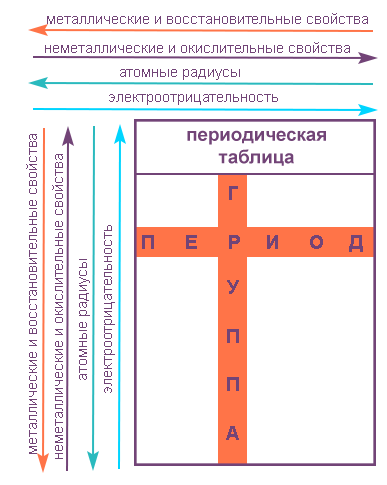
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.

Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
.jpg)
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
.jpg)
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
.jpg)
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
.jpg)
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
.jpg)
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
.jpg)
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода

Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота

Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода

Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены

Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы

Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.
Попробовать бесплатно
11 группа (1В подгруппа)
В 11 группу входят Си, Ag, Аи (табл. 1 и 2). У всех металлов этой группы на внешнем энергетическом уровне имеются один s 1 электрон (как у щелочных металлов) и полностью заполненная d -подоболочка. Эти металлы участвуют в образовании координационных соединений, КЧ которых составляет от 2 до 6.
Таблица 1. Некоторые физические и химические свойства металлов 11 группы
Относит, ат. масса
Медь Copper [от лат. Cuprum — Кипр]
Серебро Silver [от англо-сакс. siolfur — серебро, лат. Argentum]
107 Ag* (51,84) 109 Ag* (48,16)
Золото Gold [от англо-сакс. Gold]
[Xe]4f 14 5d 10 6s 1
Медь (Си) — Зd-элемент — необходимый кофактор нескольких важнейших окислительно-восстановительных ферментов, без которых нормальная жизнедеятельность невозможна, в частности, цитохромоксидазы, тирозиназы и других. Их биологическая роль связана с процессами гидроксилирования, переноса кислорода и электронов, а также окислительного катализа.
Дефицит Си вызывает анемию, поскольку сопровождается значительным ухудшением захвата Fe трансферрином из депо организма (необходимой стадии синтеза гемоглобина), ухудшением состояния соединительной ткани, потерей пигментации кожи. Дефицит Си может развиваться при избытке Zn. Физиологические последствия дефицита Си проявляются исключительно у животных. У человека такие случаи вообще неизвестны, так как во всех видах пищи содержится достаточное количество Си. В тканях здорового организма концентрация Си в течение всей жизни поддерживается строго постоянной. В организме существует система, препятствующая накоплению Си в тканях путем или ограничения всасывания, или стимуляции выведения.
Хронический избыток Си в тканях, развивающийся при некоторых заболеваниях, нарушает рост, вызывает гемолиз, снижение содержания гемоглобина, дегенеративные изменения тканей печени, почек, головного мозга. Си повышает проницаемость клеточных мембран и гидролиз АТФ, ингибирует глутатионредуктазу, легко образует комплексы с SH-, NH2- и СОOH-группами, и тем самым нарушает метаболизм содержащих их молекул. Координирующиеся атомы по способности связываться с Си(II) и с Zn(II) располагаются в ряд S>N>O, причем у меди эта способность в 10 раз выше, чем у цинка.
И Си(I), и Си(II) легко связывают сульфгидрильную группу. Си(II) окисляет ее до дисульфидной, восстанавливаясь до Си(I). Около 95% Си в организме человека находится в составе α2-глобулина крови — гликопротеина церулоплазмина. Недостаток этого белка развивается при наследственной болезни Вильсона-Коновалова, встречающейся примерно у 4 человек из миллиона. При этой болезни содержание Си в печени повышено, и усилено ее выделение с мочой (более 115 мкг/сутки). В молекуле церулоплазмина содержится 6-7 атомов Си, которые обусловливают его оксидазную активность. Обе степени окисления Си имеются в молекуле церулоплазмина в соотношении примерно 1:1, причем 2 атома Си(I) связаны с атомами серы.
Из геометрических форм молекул для Си(I) более свойствен тетраэдр, а для Сu(II) — значительно искаженный октаэдр с различной степенью удлинения двух связей в трансположении, от плоского квадрата до октаэдра. Кристаллы пептидных комплексов Сu(II) обычно имеют геометрию квадратной пирамиды, их КЧ равно 5.
Серебро (Ag). Дает характерную реакцию на воздухе с соединениями серы, образуя черную дисульфидную соль. Используется для изготовления монет, в фотографии, ювелирном деле, электрической промышленности, при изготовлении зеркал. Серебро токсично для низших организмов, благодаря чему используется для длительного сохранения воды («серебряная» вода). Для человека некоторой токсичностью обладает только нитрат, который в желудке быстро превращается в нерастворимый нетоксичный хлорид.
Ag легко образует комплексы с лигандами, содержащими большое количество тиольных, сульфидных, селеносульфидных, амино-, фосфатных, имидазольных и карбоксильных групп. При этом валентность металла может составлять и +1, и +2, и +3, а КЧ — при sp-гибридизации с образованием линейной конфигурации комплекса равняться двум, при sр 3 -гибридизации с образованием тетраэдрического комплекса — четырем. Эти свойства металла обеспечивают бактерицидное действие металла на бактериальную ДНК, вызывая разрыв водородных связей между соседними атомами пуринов и пиримидинов. Это приводит к образованию комплексов, подавляющих репликацию ДНК и деление клеток.
При внутримышечном введении солей серебро сохраняется в участке инъекции связанным с белками тканей, а при внутривенной инъекции — в белках плазмы и лейкоцитов, но не в эритроцитах. Отмечено, что Ag снижает сродство Se к негемовым железосодержащим белкам, тем самым снижая их активность в качестве переносчиков электронов. Вызываемый серебром дефицит Se можно предотвратить увеличением содержания Se и токоферола (витамина Е) в диете. Внутривенные инъекции коллоидного Ag могут стать причиной развития опухолей в селезенке и печени.
При детоксикации солей Ag может развиваться так называемый аргироз: образование гранул металлического Ag в тканях, содержащих мощные восстанавливающие группы. В этом случае имеющиеся в организме ионы серебра абсорбируются на образовавшихся гранулах, а затем катализируют ускоренную передачу электронов от молекул-восстановителей.
Золото (Аи) — наиболее ковкий и пластичный из редких металлов. С древних времен используется в ювелирном, монетном и банковском деле, как мера богатства, в электронике, для изготовления окрашенных и теплоотражающих стекол. Сплавы золота используют при протезировании в стоматологии. Биологическая роль очень мала; предполагается наличие некоторого стимулирующего физиологического действия. Соли Аи, как и соли Ag, подавляют размножение бактерий. Поскольку атомы Au слабопроницаемы для электронов и активно выделяют вторичные электроны, коллоидную форму золота используют в качестве специфического маркера при различных видах микроскопии и в цитохимии.
В водном растворе Аи присутствует только в виде комплексных солей, например, двойной натриевой соли Na3Аи(S2О3)2. Аи + образует также линейные анионы типа [Сl-Аи-Сl] – , а Аи 3+ — комплексные соединения, имеющие плоскую квадратную конфигурацию и КЧ = 4. Легче образуются комплексы с лигандами, содержащими атомы S. Сродство к О и N слабее. Соли Аи используют для лечения ряда диффузных заболеваний соединительной ткани, вводя их парентерально. Однако при этом возможно комплексообразование с донорными группами α-глобулина в плазме и других тканях, приводящее к появлению хризиаз — темных пятен на коже и в тканях. Механизм их появления, очевидно, аналогичен выявленному при аргирии при детоксикации вводимых солей. Сродство катионов Аи к тиоловым группам может приводить к подавлению активности тиоловых ферментов, некоторых лизосомальных протеаз, например, коллагеназы и эластазы, метаболизма α-тиоловых жирных кислот, синтеза глюкозамино-β-фосфата в соединительной ткани.
Таблица 2. Содержание в организме, токсическая (ТД) и летальная дозы (ЛД) металлов 11 группы
Периодический закон и Периодическая система химических элементов Д.И. Менделеева

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
12. Кислотные свойства водородных соединений ослабевают в ряду
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.

Группы и периоды Периодической системы

Свойства таблицы Менделеева
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Элемент группы 11 - Group 11 element

Группа 11 , с помощью современной IUPAC нумерации, представляет собой группу из химических элементов в периодической таблице , состоящей из меди (Cu), серебро (Ag) и золото (Au). Рентгений (Rg) также входит в эту группу периодической таблицы Менделеева, хотя до сих пор не проводились химические эксперименты, подтверждающие, что он ведет себя как более тяжелый гомолог золота. Группа 11 также известна как металлы для чеканки монет из-за их использования в чеканке монет - в то время как рост цен на металлы означает, что серебро и золото больше не используются для обращения валюты, оставаясь в слитках, медь остается обычным металлом в монетах. на сегодняшний день либо в виде монет, плакированных медью, либо в составе мельхиорового сплава. Скорее всего, это были первые три обнаруженных элемента. Медь, серебро и золото естественным образом встречаются в элементарной форме .
СОДЕРЖАНИЕ
История
Все элементы группы, за исключением рентгения , были известны с доисторических времен, поскольку все они встречаются в природе в металлической форме, и для их получения не требуется никакой металлургии.
Медь была известна и использовалась около 4000 г. до н.э., и многие предметы, оружие и материалы были сделаны и использовались с медью.
По данным RSC, первые свидетельства добычи серебра датируются 3000 годом до нашей эры в Турции и Греции. Древние люди даже придумали, как очищать серебро.
Рентгений был получен в 1994 году путем бомбардировки атомами никеля-64 висмута-209 для получения рентгения-272.
Характеристики
Как и другие группы, члены этого семейства демонстрируют закономерности в электронной конфигурации , особенно в самых внешних оболочках, что приводит к тенденциям в химическом поведении, хотя рентгений, вероятно, является исключением:
| Z | Элемент | Кол-во электронов / оболочка |
|---|---|---|
| 29 | медь | 2, 8, 18, 1 |
| 47 | Серебряный | 2, 8, 18, 18, 1 |
| 79 | золото | 2, 8, 18, 32, 18, 1 |
| 111 | рентгений | 2, 8, 18, 32, 32, 18, 1 (прогноз) |
Все элементы группы 11 - относительно инертные, устойчивые к коррозии металлы . Окрашены медь и золото.
Эти элементы имеют низкое удельное электрическое сопротивление, поэтому используются для электромонтажа. Медь - самая дешевая и широко используемая. Связующие провода для интегральных схем обычно золотые. Серебряная и посеребренная медная проводка используется в некоторых особых случаях.
Вхождение
В естественном виде медь встречается в Чили, Китае, Мексике, России и США. К различным природным рудам меди относятся: медный колчедан (CuFeS 2 ), куприт или рубиновая медь (Cu 2 O), медный глянец (Cu 2 S), малахит (Cu (OH) 2 CuCO 3 ) и азурит (Cu (OH) ) 2 2CuCO 3 ).
Медный колчедан является основной рудой и дает почти 76% мирового производства меди.
Производство
Серебро находится в самородном виде, в виде сплава с золотом ( электрумом ), а также в рудах, содержащих серу , мышьяк , сурьму или хлор . Руды включают аргентит (Ag 2 S), хлораргирит (AgCl), который включает роговое серебро , и пираргирит (Ag 3 SbS 3 ). Серебро добывается с использованием процесса Паркса .
Приложения
Эти металлы, особенно серебро, обладают необычными свойствами, которые делают их незаменимыми для промышленного применения за пределами их денежной или декоративной ценности. Они являются отличными проводниками от электричества . Самыми проводящими (по объему) из всех металлов в указанном порядке являются серебро, медь и золото. Серебро также является наиболее теплопроводным и наиболее светоотражающим элементом. Серебро также обладает необычным свойством: потускнение, которое образуется на серебре, по-прежнему обладает высокой электропроводностью.
Медь широко используется в электропроводке и схемах. Золотые контакты иногда встречаются в прецизионном оборудовании, поскольку они не подвержены коррозии. Серебро широко используется в критически важных приложениях в качестве электрических контактов, а также в фотографии (потому что нитрат серебра превращается в металл под воздействием света), сельском хозяйстве , медицине , аудиофилах и научных приложениях.
Золото, серебро и медь - довольно мягкие металлы, поэтому их легко повредить при повседневном использовании в качестве монет. Драгоценный металл также может легко истираться и изнашиваться в процессе эксплуатации. По своей нумизматической функции эти металлы должны быть сплавлены с другими металлами, чтобы монеты были более долговечными. Сплав с другими металлами делает полученные монеты более твердыми, менее подверженными деформации и более устойчивыми к износу.
Золотые монеты: Золотые монеты обычно производятся либо в виде 90% золота (например, с монетами США до 1933 года), либо в виде золота 22 карата (91,66%) (например, текущие коллекционные монеты и крюгерранды ), причем медь и серебро составляют остающийся вес в каждый случай. Слитковые золотые монеты производятся с содержанием золота до 99,999% (из серии Canadian Gold Maple Leaf ).
Серебряные монеты: Серебряные монеты обычно производятся либо в виде 90% серебра - в случае монет США, выпущенных до 1965 года (которые были в обращении во многих странах), либо монет из стерлингового серебра (92,5%) для монет Британского Содружества до 1920 года и других серебряных монет. , причем медь составляет в каждом случае оставшуюся массу. Старые европейские монеты обычно производились с содержанием серебра 83,5%. Современные серебряные инвестиционные монеты часто производятся с чистотой от 99,9% до 99,999%.
Медные монеты: Медные монеты часто имеют довольно высокую чистоту, около 97%, и обычно легированы небольшим количеством цинка и олова .
Инфляция привела к тому, что номинальная стоимость монет упала ниже стоимости традиционно используемых металлов в твердой валюте . Это привело к тому, что большинство современных монет сделаны из недрагоценных металлов - популярны медно-никелевый сплав (около 80:20, цвет серебра ), а также никель- латунь (медь (75), никель (5) и цинк (20), золото в цвет), марганец- латунь (медь, цинк, марганец и никель), бронза или сталь с простым покрытием .
Биологическая роль и токсичность
Медь, хотя и токсична в чрезмерных количествах, необходима для жизни . Доказано, что медь обладает антимикробными свойствами, что делает ее полезной для дверных ручек в больницах для предотвращения распространения болезней. Известно, что употребление пищи в медных контейнерах увеличивает риск отравления медью .
Элементарное золото и серебро не обладают известными токсическими эффектами или биологическим применением, хотя соли золота могут быть токсичными для ткани печени и почек. Как и медь, серебро обладает антимикробными свойствами . Продолжительное употребление препаратов, содержащих золото или серебро, также может привести к накоплению этих металлов в тканях организма; результаты являются необратимыми , но , по- видимому безвредными условиями пигментации , известные как патологическая пигментация тканей при лечении солей золота и аргирия соответственно.
Благодаря тому , что недолго и радиоактивное, рентгения не имеет никакого биологического использования , но это, вероятно , чрезвычайно вреден из - за его радиоактивности.
Читайте также:
