Металлы 3 группы главной подгруппы
Обновлено: 05.10.2024
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns 1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns 2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns 2 nр 1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
Общая характеристика подгруппы
С ростом заряда ядра многие важнейшие характеристики элементов изменяются немонотонно, в том числе и атомный радиус. Соответственно, свойства простых веществ, оксидов, гидроксидов и других соединений этих элементов имеют неоднозначный характер изменения. Особенно резко выделяется первый элемент подгруппы - бор, являющийся единственным неметаллом среди s 2 p 1 -элементов. Бор проявляет диагональное сходство с элементом главной подгруппы IV группы - кремнием Si.
Алюминий - важнейший элемент подгруппы, также имеет целый ряд специфических особенностей, отличающих его от бора, с одной стороны, и от подгруппы галлия, с другой стороны.
Характеристические соединения
Отношение к воде
слабая кислота 1-основная
амфотерный (идеальный амфолит)
основный со слабыми признаками амфотерности
амфотерный (основные свойства преобладают)
основание (подобен щелочам)
Алюминий
13Аl [Ne] 3s 2 3p 1
1 стабильный изотоп 27 Al
Кларк в земной коре 8,8 % по массе, самый распространенный металл. В свободном виде не встречается.
Основная форма нахождения в природе - Аl2O3 (в составе различных силикатов, полевых шпатов и глин). Встречается также в виде двойных солей: KAl(SO4)2, Na3[AlF6] и др.

Физические свойства
Простое вещество алюминий - лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. По электропроводности занимает 4-е место после Сu, Аg, Аu.
Способы получения
1. Электролиз расплава AlCl3:
2. Основной промышленный способ - электролиз расплава Al2O3 (глинозема) в криолите 3NaF • AlF3:
AlCl3 + ЗК = Al + 3KCl
Химические свойства
Аl - очень химически активный металл, однако при обычных условиях ведет себя довольно инертно - имеет высокую температуру воспламенения, со многими веществами реагирует только при высокой температуре; все реакции с участием Al проходят через первоначальный замедленный период. Такое химическое поведение алюминия объясняется наличием на его поверхности очень тонкой, прочной, газо- и водонепроницаемой пленки Al2O3. При нарушении цельности этой пленки AI реагирует со многими веществами как активный восстановитель:
Al 0 - Зе - → Аl 3+
В подавляющем большинстве соединений атомы алюминия связаны с соседними атомами ионными связями.
1. Взаимодействие с кислородом и другими неметаллами (галогенами, серой, азотом, углеродом).
Наиболее активно реагирует порошкообразный Al (алюминиевая пудра).
При обычной температуре реакция протекает только на поверхности. После нагревания до температуры воспламенения измельченный Аl сгорает с высоким экзотермичным эффектом.
б) 2Al + 3Cl2 = 2АlСl3 хлорид
Реакция с I2 протекает в присутствии воды. С F2 реакции нет. т. к. в первый же момент образуется прочный поверхностный слой AlF3.
2Al + N2 = 2AlN нитрид
4Al + ЗС = АlС3 карбид
г) C Н2 алюминий непосредственно не соединяется.
2. Взаимодействие с водой в присутствии щелочи.
1) растворение оксидной пленки Al2O3;
2) предотвращение образования нерастворимого гидроксида Аl(ОН)3.
Na[Al(OH)4] - тетрагидроксо-алюминат натрия
В отсутствие щелочи алюминий может вытеснять Н2 из воды в следующих условиях:
1) если его поверхность амальгамировать (покрыть ртутью);
2) в вакууме или в среде инертного газа после предварительной очистки поверхности металла от оксидной пленки.
3. Взаимодействие с «неокисляющими» кислотами (HCl, H2SO4 разб. и др.)
2Al + 6Н + → 2Al 3+ + 3H2↑
4. Взаимодействие с очень концентрированными HNO3 и H2SO4
При обычной Т реакции не протекают, т. к. происходит пассивирование поверхности Al, связанное с внедрением в нее атомарного или молекулярного кислорода, а также образованием его нерастворимых соединений с Al.
При нагревании реакции протекают довольно активно:
5. Взаимодействие с разбавленной HNO3
Реакция медленно протекает при обычной Т, при нагревании - более быстро.
6. Взаимодействие с органическими кислотами
Реакции протекают с разбавленными уксусной и лимонной кислотами при нагревании, ускоряются в присутствии NaCl:
Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
- постоянная валентность II
- постоянная степень окисления +2
- легкость образования 2-зарядных ионов Me +2
С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
- энергия ионизации Еион уменьшается
- сродство атомов к электрону уменьшается
- металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название - щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
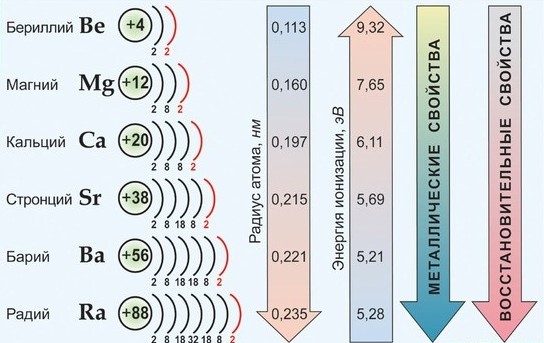
Среди s 2 -элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство). По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s 2 -элементы - белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
не растворимый, не взаимодействует
хорошо растворимые, взаимодействуют
Магний
Изотопы 24 Mg (78.60 %)
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов). Основные из них:
- магнезит MgCO3 - доломит СаСО3 • МgСО3
- карналлит КСl • МgСl2 • 6Н2O
- горькая (английская) соль MgS04• 7H2O В виде катионов Mg 2+ находится в природных водах (в 1 м 3 морской воды содержится около 1 кг Mg 2+ ). Наряду с ионами Са 2+ обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний - единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
В чистом виде магний - блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
2. Карботермический (t ˃ 2000°C)
MgO + С = Mg↑(пары) + СО ↑
Mg - химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Взаимодействие с кислородом и азотом при горении на воздухе
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
Происходит одновременное образование оксида и нитрида:
Взаимодействие с водой
При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой - нерастворимым в воде Мg(ОН)2
1) Мg активно реагирует с кипящей водой:
2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой - это может привести к взрыву.
3) Мд легко растворяется в воде в присутствии NH4CI:
Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Взаимодействие с углекислым газом и др. оксидами
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
Взаимодействие с оксидами и солями металлов
См. «Основные способы получения металлов. Магнийтермия».
Взаимодействие с галогенопроизводными УВ (в среде безводного эфира)
Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодическ ий закон звучал так: « Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы .» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.

Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома .
Поэтому современная формулировка периодического закона звучит так:
« Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов «.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом ( s -элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
1) Li 2) Ca 3) Cs 4) N 5) S
Ответ: 154
1) Be 2) Ba 3) Mg 4) N 5) F
Ответ: 541
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H + . Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру .
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные , или подгруппы А и побочные , или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус . Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например , в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.

Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например , в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.

В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.

1) O 2) Se 3) F 4) S 5) Na
Решение:
В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S.
В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142.
Ответ: 142
1) K 2) Li 3) F 4) B 5) Na
Решение:
В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na.
В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243.
Ответ: 243
1) Ca 2) P 3) N 4) О 5) Ti
p-элементы это фосфор Р, азот N, кислород О.
В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. В группе — сверху вниз увеличивается. Следовательно, правильный ответ: P, N, O или 234.
Ответ: 234
Рассмотрим закономерности изменения радиусов ионов : катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например , радиус иона Na + меньше радиуса атома натрия Na:

Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например , радиус иона Cl – больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например : частицы Na + и F ‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na + меньше радиуса иона F ‒ .
3. Электроотрицательность
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.

По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
1) Mg 2) P 3) O 4) N 5) Ti
Элементы-неметаллы – это фосфор Р, кислород О и азот N.
Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243.
III группа главная подгруппа периодической таблицы Менделеева (Алюминий)
Алюминий – лёгкий серебристо-белый металл, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Аl — довольно активный металл, однако при обычных условиях ведет себя инертно — имеет высокую температуру воспламенения, со многими веществами реагирует только при высокой температуре;
Все реакции с участием Al проходят через первоначальный замедленный период из-за наличия на его поверхности очень тонкой, прочной, газо- и водонепроницаемой пленки Al2O3. При нарушении цельности этой пленки AI реагирует со многими веществами как активный восстановитель.
Алюминий расположен в главной подгруппе III группы, в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронная конфигурация алюминия:

Нахождение алюминия в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния).
Содержание в земной коре — примерно 8,6 %.
В природе алюминий встречается в виде соединений:
Способы получения алюминия
Промышленный способ:
Алюминий получают электролизом Al2O3 в расплавленном криолите (Na3AlF6) при температуре 960–970°С:
Процесс электролиза можно представить так:
На катоде происходит восстановление ионов алюминия, а на аноде — окисление алюминат-ионов:
К: Al 3+ +3e → Al 0
Лабораторный способ:
Вакуумтермический способ
Восстановление безводного хлорида алюминия металлическим калием (при нагревании и без доступа воздуха)
Химические свойства алюминия
Качественные реакции
- Соли алюминия можно обнаружить с помощью водного раствора аммиака. При этом выпадает полупрозрачный белый осадок гидроксида алюминия:
- Качественной является реакция взаимодействия солей алюминия с недостатком щелочей. При этом образуется белый аморфный осадок гидроксида алюминия:
При дальнейшем добавлении щелочи осадок гидроксида алюминия растворяется с образованием комплексного соединения тетрагидроксоалюмината:
Обратите внимание, если изначально поместить соль алюминия в избыток раствора щелочи, то сразу образуется растворимый тетрагидроксоалюминат:
Взаимодействие с простыми веществами – неметаллами
С кислородом
С кислородом взаимодействуют с образованием прочной оксидной пленки — оксида.
При нагревании сгорает с выделением большого количества теплоты (экзотермическая реакция):
При этом может развиваться температура до 3500 0 С.
С галогенами (F, Cl, Br, I)
Реагирует сгалогенами с образованием галогенидов:
С водородом
C водородом алюминий непосредственно не соединяется
С серой и фосфором
Взаимодействует с серой при нагревании до 150 -200 0 С с образованием сульфида:
С фосфором образует фосфид:
С азотом
С азотом взаимодействует при нагревании до 1000 о С с образованием нитрида:
С углеродом
С углеродом взаимодействует при нагревании примерно до 2000 о С с образованием карбида:
Взаимодействие со сложными веществами
С водой
Алюминий покрыт стойкой защитной оксидной пленкой Al2O3, которая защищает алюминий от дальнейшего окисления и действия воды.
При снятии защитной пленки алюминий бурно реагирует с водой с образованием гидроксида алюминия и водорода:
Оксидную пленку можно удалить с помощью растворов щелочи, хлорида аммония или солей ртути (амальгирование)
С кислотами
Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации.
Однако, при нагревании реакции протекают довольно активно:
С разбавленной азотной кислотой взаимодействует при обычной Т медленно при нагревании — быстро:
С щелочами
Алюминий взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
С солями
При нагревании реагирует с растворами солей менее активных металлов:
С оксидами
Алюминий при нагревании восстанавливает менее активные металлы из их оксидов:
Этот метод широко используется при получении металлов и называется алюмотермией.
Читайте также:
