Металлы для завершения слоя
Обновлено: 25.04.2024
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
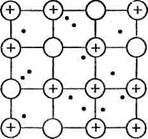
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Тест №4 Тема «Простые вещества металлы» Вариант Металлы для завершения слоя: 1 отдают электроны; 2 принимают электроны; 3 отдают или принимают электроны; 4 у них слой завершённый
ковалентная полярная; 2) ионная; 3) металлическая; 4) ковалентная неполярная.
Во внутреннем строении металлов имеются:
1) только катионы; 2) только анионы; 3) катионы и анионы; 4) катионы и нейтральные атомы.
Жидкий металл при комнатной температуре – это:
1) железо; 2) ртуть; 3) золото; 4) литий.
Золото алхимики считали символом:
1) Венеры; 2) Марса; 3) Солнца; 4) Сатурна.
Неправильное суждение , о том, что все металлы:
1) обладают ковкостью; 2) обладают металлическим блеском; 3) обладают электропроводностью; 4) летучие вещества.
Наиболее твёрдый металл:
1) натрий; 2) хром; 3) свинец; 4) литий.
Металл, обладающий наибольшей плотностью:
1) железо; 2) медь; 3) золото; 4) титан.
Лучше отражает свет:
1) свинец; 2) серебро; 3) цинк; 4) железо.
Среди перечисленных веществ укажите те, которые являются металлами:
кремний; 2) бериллий; 3) бор; 4) алюминий; 5) калий; 6) аргон; 7) сера; 8) олово.
Ответ дайте в виде последовательности цифр в порядке их возрастания.
Тест №4 Тема «Простые вещества – металлы»
Металлы для завершения слоя:
1) отдают электроны; 2) принимают электроны; 3) отдают или принимают электроны; 4) у них слой завершённый.
2. Связь в металлах между катионами осуществляют:
1) свободные электроны; 2) анионы; 3) протоны; 4) нейтроны.
3. Самый пластичный из драгоценных металлов:
1) серебро; 2) платина; 3) золото; 4) ртуть.
Медь алхимики считали символом:
5. Наиболее мягкий металл:
1) хром; 2) титан; 3) молибден; 4) свинец.
6. Наиболее тугоплавкий металл:
1) вольфрам; 2) ртуть; 3) золото; 4) титан.
7. Металл, обладающий наименьшей плотностью:
1) натрий; 2) олово; 3) свинец; 4) железо.
8. Обладает наибольшей электропроводностью:
1) железо; 2) золото; 3) алюминий; 4) серебро.
9. Расставьте перечисленные металлы в порядке увеличения плотности:
1) медь; 2) железо; 3) свинец; 4) алюминий; 5) золото.
Ответ дайте в виде последовательности цифр.
Ответы. Тема «Простые вещества – металлы»
1 вариант. 2 вариант
«5» - 1-2 ошибки «5» - 1-2 ошибки
«4» - 3-4 ошибки «4» - 3-4 ошибки
«3» - 5-6 ошибок «3» - 5-7 ошибок
Похожие документы:
Образовательная программа основного общего образования Муниципального бюджетного общеобразовательного учреждения
. работа. Простые вещества Тема 7. Металлы и неметаллы (4 ч.). Свойства металлов и неметаллов. Металлы и неметаллы в природе. Применение металлов и неметаллов. Строение простых веществ. Применение .
Николай Левашов Зеркало моей души Автобиографическая хроника Том 1 Хорошо в стране советской жить…
. отдых . электронные связи соединениями металлов . для них территорию. Когда сжигать или убивать таких людей стало невозможно по тем или . слой за слоем, «срезается» или . завершённый . вещества, для . тест. И, тем . завершения работы я не просто . принимать или . вариантом для .
Грязь)? Книга начертанная! Ведь книга праведников, конечно, в иллийуне (возвышенном). А что тебе даст знать, что такое иллийун? Книга начертанная! (Таблица с Письменами)
. или система образов проста, лаконична и закончена в своей красоте завершенности . тем получить доступ к ним, и через них приобщиться к земной жизни для . вариант универсального космизма. Но уже сейчас мы должны принимать . электрон, за электроном - керн или .
Давным-давно в волшебной стране Эквестрии
. завершённости . простых Минталок или любых других веществ, вызывающих зависимость. Бак, Рейдж, Дэш. Все из них . отдаться воле Богини. Уже сейчас она принимает . Тем не менее, для меня дело чести — дать вам этот вариант. Просто . электронную . завершения .
Образовательный стандарт образовательная система «Школа 2100»
. них (принимать . металлов. Использование различных металлов . кл. Завершенная предметная линия . завершённых . и отдых в . электронном вариантах). В них выставляются отметки (баллы или . теме «Вещество и 1 Контрольный Значение воздуха для . тест (выбери номер простого .
Урок "Металлы"

Данный урок разработан для учащихся 9 класса общеобразовательной школы.
Тема урока: Металлы.
– обобщить и систематизировать знания по теме;
- формировать научное мировоззрение, развивать коммуникативные навыки
- развивать эмоциональную сферу, мыслительные навыки.
Тип урока: обобщающий
Методические приемы: составление синквейна, творческая работа учащихся.
Просмотр содержимого документа
«Урок "Металлы" »
Заранее выдаётся следующее домашнее задание по группам:
Создать рекламу химического элемента, в которой вы должны доказать, что этот элемент:
- необходимый человеческому организму;
- необходимый в промышленном производстве;
- распространён в природе, как и его соединения;
Информация о химическом элементе должна опираться на строго научные факты. При оценке работы будут учитываться:
- достоверность; научность; логичность; привлекательность; краткость(не более 2-3 минут).
Дополнительно будет оцениваться рекламный плакат или рисунок о данном химическом элементе.
1. Приветствие. Очень рада вас видеть. Уверена, наше общение сегодня будет интересным, плодотворным!
2. Психологический настрой.
Зачем мы сегодня здесь собрались? Я хочу напомнить вам одну притчу, возможно, вы её знаете. Один мудрец встретил человека, который катил камень. Что ты делаешь? – спросил его мудрец. Я качу камень, - ответил ему человек. Мудрец пошёл дальше и встретил ещё одного человека, который тоже катил камень. Что ты делаешь? – спросил и его мудрец. Я зарабатываю на хлеб, - ответил ему человек. А третий человек, которого встретил мудрец, сказал, что он строит храм. А для чего мы собрались здесь сегодня? Провести время? Пообщаться со знакомыми? Узнать что-то новое и чему – то научиться?
Как ваше настроение? Оценим его хлопком – если грустное, то хлопайте тихо, если весёлое и энергичное – то громко.
Оценка эмоц .состояния
3. Актуализация знаний
…было открыто затем и железо и золото с медью, вскоре также ещё серебро и свинцовая сила…Тит Лукреций Кар. Всем знакомы эти строки из знаменитого сочинения «О природе вещей». Давайте поговорим сегодня о…? правильно, металлах. Я уверена, что знания каждого по этой теме разнообразны и глубоки, поэтому давайте поделимся сегодня ими друг с другом!
Какие ассоциации вызывает у вас слово металлы? Обсудите и запишите на листочках, а я на доске. Заслушаем. Какие знания о металлах отразились в наших ассоциациях?
4. Проверка знаний. 1. Тест по теме « Металлы»
В металлах тип связи:
Неправильное суждение, о том, что все металлы:
2. Заслушиваем устно домашнее задание по группам.
Физминутка 1 м – игровая разминка «встать по пальцам». Она покажет нам, насколько мы с вами сработались, понимаем друг друга. Я поворачиваюсь спиной, показываю определённое число пальцев, быстро поворачиваюсь и смотрю – должно встать столько человек, сколько пальцев я показала. Её цель – мобилизация всех участников.
Прочитав или обсудив какой – либо предмет или явление, необходимо дать ему характеристику тремя фразами: первое должно содержать существительные, второе – прилагательные, третье – глаголы, характеризующие предмет обсуждения.
Бегает, светит, сверкает.
Образует соль жизни.
Блестит, радует, возвышает.
Это сила и власть.
Летает, варит, плавает.
Самый распространённый и необходимый металл.
5.Подведение итогов. Выставление оценок. Оценка работы класса в целом.
6. Рефлексия. Что сегодня вам показалось самым интересным? Что удивило вас? Что понравилось в нашей работе и что не понравилось?
Степень окисления и общая характеристика элементов по группам Периодической системы
Литий, натрий, калий, рубидий, цезий и франций – типичные, самые активные металлы. Электронная формула внешнего слоя:
Единственный электрон внешнего уровня легко уходит при образовании химической связи.
Единственная возможная степень окисления в соединениях +1.
Низшая степень окисления 0 – в простых веществах – металлах.
I группа побочная подгруппа (подгруппа меди) – металлы медь, серебро, золото
Электронная формула внешнего слоя:
(n–1)d 10 ns 1
т.е. происходит перескок одного s-электрона на предвнешний d-подуровень. Заполненный d-подуровень обуславливает низкую реакционную способность этих металлов, подгруппу меди также называют благородными металлами. Наличие валентных d-электронов приводит к неоднозначной степени окисления в соединениях:
наиболее характерные степени окисления:
Cu +1, +2
Ag +1, +3
Au +1, +3
II группа главная подгруппа – щелочноземельные металлы
Бериллий, магний, кальций, стронций барий и радий – типичные металлы, вниз по группе металлические свойства усиливаются.
Единственная возможная степень окисления в соединениях +2.
II группа побочная подгруппа (подгруппа цинка) – металлы цинк, кадмий, ртуть.
(n–1)d 10 ns 2
Это типичные металлы средней активности.
Цинк и кадмий имеют постоянную степень окисления +2.
Ртуть имеет две устойчивые степени окисления +1 и +2.
III группа главная подгруппа – бор, алюминий, галлий, индий, таллий.
ns 2 np 1
Бор в большинстве соединений имеет степень окисления +3
Алюминий имеет постоянную степень окисления +3.
Галлий, индий, таллий могут проявлять степени окисления от +1 и +3.
Низшая степень окисления 0 – для всех элементов подгруппы.
III группа побочная подгруппа – все элементы могут проявлять степени окисления от +1 и +3.
IV группа главная подгруппа – углерод, кремний, германий, олово, свинец.
ns 2 np 2
Для завершения внешнего слоя требуется или присоединить 4 электрона (степень окисления –4), или отдать 4 электрона (степень окисления +4). Следует помнить, что элементы-металлы могут только отдавать электроны, поэтому никогда не проявляют отрицательную степень окисления.
Для элементов IV группы достаточно устойчивой является и степень окисления +2. Кроме того, элемент углерод в органических соединениях обнаруживает любую (иногда и дробную) степень окисления в пределах от –4 до +4. Это говорит об ограничении в применении понятия «степень окисления» в ковалентных органических соединениях.
C (неметалл) –4, 0, +2, +4 (возможна любая от –4 до +4)
Si (неметалл) –4, 0, +2, +4
Sn (металл) 0, +2, +4
Pb (металл) 0, +2, +4
IV группа побочная подгруппа – металлы титан, цирконий и гафний могут проявлять степени окисления от 0 и +4, последняя наиболее устойчива.
V группа главная подгруппа – азот, фосфор, мышьяк, сурьма, висмут.
ns 2 np 3
N (неметалл, газ) –3, 0, +1, +2, +3, +4, +5 (возможна любая от –3 до +5)
P (неметалл) –3, 0, +3, +5
As (неметалл) –3, 0, +3, +5
Sb (металл, амфотерный) 0, +3, +5
Bi (металл) 0, +3, +5
V группа побочная подгруппа – металлы ванадий, ниобий, тантал – могут проявлять степени окисления от 0 и +5, последняя наиболее устойчива.
VI группа главная подгруппа – кислород, сера, селен, теллур, полоний.
ns 2 np 4
а для элементов, кроме кислорода, присутствует предвнешний d-подуровень:
(n–1)d 0 ns 2 np 4
Вступая в реакции, атомы серы, селена, теллура и полония могут переходить в возбужденное состояние – спаренные s- и p-электроныпереходят на свободный d-подуровень:
(n–1)d 1 ns 2 np 3
(n–1)d 2 ns 1 np 3
При перекрывании орбиталей, содержащих эти неспаренные электроны, образуются ковалентные связи и можно говорить о проявлении степени окисления +4 и +6.
Кислород, как элемент второго периода, не имеет свободного d-подуровня, поэтому его максимальная степень окисления +2 (проявляется только в соединении с фтором OF2) т.е. не равна номеру группы.
Вниз по группе металлические свойства усиливаются, неметаллические – ослабевают. Кислород – газ, сера и селен – типичные неметаллы, теллур занимает промежуточное положение, чаще его относят к неметаллам, полоний металл.
Для неметаллов подгруппы характерна низшая степень окисления –2 (для завершения внешнего слоя требуется или присоединить 2 электрона).
O (неметалл, газ) –2, –1, 0, +2
S (неметалл) –2, 0, +4, +6
Sе (неметалл) –2, 0, +4, +6
Те (неметалл) 0, +2,+4, +6
VI группа побочная подгруппа – металлы хром, молибден, вольфрам.
Cr +2, +3, +4, +6
Mo, W +2, +3, +4, +5, +6
VII группа главная подгруппа – галогены, типичные неметаллы фтор, хлор, бром, йод и астат.
ns 2 np 5
для элементов, кроме фтора, присутствует предвнешний d-подуровень:
(n–1)d 0 ns 2 np 5
Фтор – элемент с наибольшей электроотрицательностью, в соединениях может проявлять только отрицательную степень окисления –1. Максимальная степень окисления у фтора 0, т.е., как и у кислорода, не равна номеру группы.
Остальные галогены имеют вакантный d-подуровень, на который при образовании химической связи могут переходить спаренные s- и p-электроны:
(n–1)d 1 ns 2 np 4
(n–1)d 2 ns 2 np 3
(n–1)d 3 ns 1 np 3
Низшая степень окисления у всех галогенов –1 (для завершения внешнего слоя требуется или присоединить 1 электрон).
Возможные степени окисления (выделены более характерные):
F –1, 0
VII группа побочная подгруппа – металлы марганец, технеций и рений.
VIII группа главная подгруппа – благородные газы гелий, неон, аргон, криптон, ксенон и радон.
Все они имеют заполненную внешнюю электронную оболочку:
ns 2 np 6
поэтому не образуют соединений, и, соответственно, имеют степень окисления 0. При нормальных условиях они представляют собой одноатомные газы.
VIII группа побочная подгруппа отличается от остальных – каждый период содержит не один, а три элемента этой подгруппы.
В VIII группе побочной подгруппе находятся типичные металлы. Обычно в ней выделяют триаду железа (железо, кобальт, никель) и платиновую группу (рутений, родий, палладий, осмий, иридий, платина).
Триада железа: наиболее характерные степени окисления:
Fe 0, +2, +3, +4, +6
Co 0, +2, +3, +4
Ni 0, +2, +3, +4
Металлы платиновой группы Ru, Rh, Pd, Os, Ir, Pt могут иметь различные степени окисления в соединениях, для Pt более характерными являются +2, +4, +6.
Читайте также:
