Металлы химия 8 класс
Обновлено: 17.05.2024
Образовательная. Ознакомить учащихся с положением металлов в периодической системе химических элементов. Сформировать общее представление у учащихся о металлах. Указать особенности строения атомов металлов, углубить знания о металлической связи. Проследить взаимосвязь между строением металлов и их физическими свойствами.
Воспитательная. Реализация ВПС и МПС. Продолжить расширение политехнического кругозора учащихся на основе знаний о физических свойствах металлов, об использовании металлов в различных отраслях хозяйства.
Развивающая. Продолжить развитие умений учащихся сравнивать изученный материал с новыми фактами, делать заключения на основе анализа полученной информации.
Тип урока. Усвоение новых знаний.
Оборудование. Коллекция «Металлы».
Таблица «Периодическая система химических элементов Д. И. Менделеева».
I . Организационный момент.
II . Анализ выполнения контрольной работы.
III . Изучение нового материала.
ПРОСТЫЕ ВЕЩЕСТВА
(имеющие основные соединения)
Переходные элементы
(имеющие амфотерные соединения)
Инертные элементы
1. Металлы – это ковкие, пластичные, тягучие вещества, которые имеют металлический блеск, теплопроводны и электропроводны.
2. Положение металлов в ПСХЭ.
1) химические элементы Ме в основном расположены в левой нижней части таблицы ПСХЭ.
2) в I , II , III главных подгруппах находятся металлы с четко выраженными свойствами;
в IV , V , VI главных подгруппах находятся металлы – переходные элементы.
3) в побочных подгруппах расположены только металлы – переходные элементы.
4) металлами являются химические элементы семейств лантаноиды и актиноиды.
3. Особенности строения атомов металлов.
1) на внешнем электронном слое атома содержится относительно небольшое число электронов, обычно от 1 до 3. (Исключение Ge , Sn , Pb – 4 ē. Sb , Bi – 5 ē. Po – 6 ē).
2) количество электронных слоёв в атомах металлов значительное обычно от 4 до 7. (Исключение Li , Be – 2 слоя, Na , Mg , Al – 3 слоя).
3) атомы металлов обладают большим радиусом по сравнению с атомами неметаллов.
4) химическая связь металлическая;
5) внешние валентные электроны относительно слабо удерживаются ядром атома, вследствие этого металлы обладают низкой электроотрицательностью и при химических реакциях проявляют восстановительные свойства.
4. Характерные физические свойства металлов.
1) высокая теплопроводность и электропроводность;
2) твёрдое агрегатное состояние;
3) ковкость и пластичность;
4) металлический блеск;
5) цвет в оттенках серого;
6) различная температура плавления (от –39° у Hg , до +3400° у W ).
7) различная плотность, если ρ < 5 г/см 3 – лёгкие металлы, если ρ >5 г/см 3 – тяжёлые металлы (от ρ( Li ) = 0,5 г/см 3 до ρ( Os ) = 22 г/см 3 );
8) различная степень прочности (наиболее прочные – Ti , Cr , Mn , V , самые мягкие – щёлочные металлы);
9) способность к намагничиванию (ферромагнетики и парамагнетики);
10) металлы чёрные – железо и его сплавы, металлы цветные;
11) металлы распространённые и редкоземельные.
IV . Закрепление знаний полученных на уроке.
1. Какие вещества принято считать металлами?
2. Укажите расположение металлов в ПСХЭ Д. И. Менделеева.
3. Каковы особенности строения и свойств атомов металлов?
4. Поясните сущность металлической связи.
5. Назовите наиболее характерные физические свойства металлов. Как эти свойства можно обосновать в соответствии с представлениями о строении атомов металлов и металлической связи?
Свойства металлов

Возможность отдавать электроны с внешнего энергетического уровня обуславливается восстановительными или металлическими свойствами металлов. Степень окисления металлов в соединениях всегда положительная.
Положение в таблице Менделеева
Металлы занимают левую часть периодической таблицы. В первой и второй группах находятся наиболее активные щелочные и щелочноземельные металлы. Наименее активны благородные металлы (золото, платина, серебро), находящиеся ближе к левому краю.
В периодах слева направо металлические свойства уменьшаются. Это связано с возрастанием количества электронов на внешнем энергетическом уровне и увеличением окислительных свойств.
В группах свойства металлов увеличиваются сверху вниз с увеличением числа энергетических уровней. При большом расстоянии от ядра электроны легче отделяются от атома металла.
Проследить активность металлов можно по электрохимическому ряду напряжений металлов. Стоящие слева от водорода элементы проявляют большую активность, чем металлы, стоящие справа. Наиболее активным металлом является литий.

Рис. 1. Ряд напряжений металлов.
Сравнение с неметаллами
Металлы существенно отличаются от неметаллов физическими и химическими свойствами. Сравнительная характеристика металлов и неметаллов представлена в таблице.
Признак
Металлы
Неметаллы
Есть. Самые блестящие – ртуть, серебро, палладий
Твёрдые (исключение – ртуть)
Газ, жидкость, твёрдое вещество
Являются электропроводниками. Наилучшая электропроводность у серебра, золота, меди, алюминия
Являются изоляторами (исключение – углерод, кремний)
Несмотря на то, что графит – модификация углерода, он имеет металлический блеск и обладает электропроводностью. Йод также напоминает металл характерным блеском.

Рис. 2. Графит.
Физические
Все металлы обладают физическими и механическими свойствами. К физическим свойствам относятся:
- плотность – содержание вещества в единице объёма;
- температура плавления – значение, при котором металл переходит из твёрдого состояния в жидкое;
- электропроводность – способность проводить электрический ток;
- теплопроводность – способность передавать тепло;
- удельная теплоёмкость – количество тепла, необходимое для повышения температуры 1 г металла на 1°С;
- тепловое расширение – увеличение объёма при нагревании;
- магнитные свойства – способность намагничиваться и притягивать другие металлы (свойством обладают железо, кобальт, никель, гадолиний).
В соответствии с температурой плавления все металлы делятся на два типа:
- легкоплавкие – приобретают жидкую форму при температуре в пределах 1000°С (цезий, галлий, ртуть);
- тугоплавкие – плавятся при температуре выше 1000°С (вольфрам, хром, ванадий).
К механическим свойствам относятся:
- пластичность;
- твёрдость;
- упругость;
- прочность.
Механические свойства металлов важны при создании сплавов – смесей металла и неметалла. Получившийся сплав проверяют на работоспособность и подвергают испытаниям – растяжению, ударам и т.д.
Сплавы, в состав которых входит железо, называются чёрными металлами. К цветным металлам относятся сплавы остальных металлов.

Рис. 3. Чёрные и цветные металлы.
Химические
Металлы – сильные восстановители. Элементы, стоящие левее водорода, реагируют с простыми и сложными веществами, образуя соли, кислоты, оксиды и гидроксиды:
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
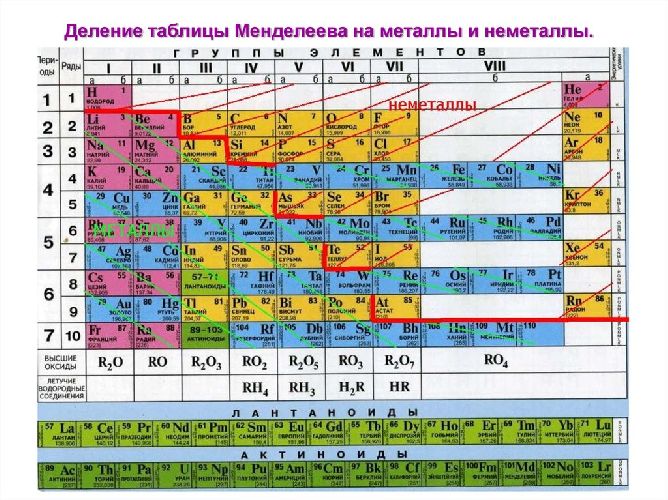
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.



В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Презентация по химии на тему "Простые вещества - металлы" (8 класс)

«Оловянная чума»
Роберт Скотт
(англ.),
полярный исследователь
Весной 1912 года погибла экспедиция Р.Скотта к Южному полюсу. Причина гибели – «оловянная чума». Экспедиция осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой»
При t=-33°С белое олово максимально быстро переходит в серое

«Оловянная чума»
Наполеон Бонапарт
Возможно «Оловянная чума» как на одна из причин поражения армии Наполеона в России в 1812 г. — рассыпались оловянные пуговицы на мундирах.
При t=-33°С белое олово максимально быстро переходит в серое

«Оловянная чума»
Музей
А.В. Суворова
г. С-Петербург
«Оловянная чума» погубила ценнейшие коллекции оловянных солдатиков. В петербургском музее А.Суворова, в подвале, где они хранились, лопнули зимой батареи отопления.
При t=-33°С белое олово максимально быстро переходит в серое

Агрегатное состояние – твердые в-ва
искл.:
От сереблисто-белого до темно-серого, искл. Au (желтый) и Cu (красно-коричневый).
Цвет
Электро- и теплопроводность
Причина – относительно
свободные е
_
Hg – жидкий металл

Как правило пластичные (Au, Ag, Cu, Al и др.), искл. Sn (серое),
Твердые (Cr, Fe) и мягкие (Au, Na, K).
Изменяется в широком интервале
Самая высокая:
Tпл.(W)= +3380°С
Самая низкая?
Tпл.(Hg)= − 38,8°С
Пластичность/хрупкость
Твердость/мягкость
Температура плавления

Искл.:
золото и медь
От серебристо-белого до серого
бериллий
германий
литий
Металлический блеск



Температура плавления
Легкоплавкие tТугоплавкие t >1000ºC

Плотность металлов
Легкие (pТяжелые(p>0,5г/мл)

Домашнее задание
Спасибо за внимание!
Белый учебник 8Г, 8К
§ 14, с.85 №1,4
Синий учебник 8А,8Б
§ 13, с. №

Фотографии металлов и неметаллов, изображения кристаллических решеток взяты из ресурсов ИНТЕРНЕТ:
Краткое описание документа:
Данную презентацию учащиеся могут использовать для самостоятельного изучения нового материала, если пропустили урок по какой-либо причине (болезнь, соревнования и т.п.). Возможно использование презентации для повторения материала, например при подготовке к контрольной работе.
Элементы данной презентации можно использовать при введении в тему "Металлы в 9 классе.
Презентация содержит информацию об отличительных физических свойствах металлов, о их возможном применении, а также об аллотропных модификациях на прмере олова.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
