Металлы и сплавы применяемые в энергетике коррозия металла
Обновлено: 28.09.2024
Металлы – кристаллические вещества, характеризующиеся высокими электро- и теплопроводностью, ковкостью. способностью хорошо отражать электромагнитные волны и др. свойствами.
В технике обычно применяют не чистые металлы , а сплавы.
Сплавы – это системы, состоящие из нескольких металлов или металлов и неметаллов.
В водохозяйственном строительстве широко применяют различные материалы в виде металлопроката и металлических изделий. Металлопрокат используют при строительстве насосных станций, производственных зданий, изготовлении металлических затворов различного типа. Металлы, применяемые в строительстве, делят на две группы: чёрные (железо и сплавы) и цветные.
В зависимости от содержания углерода чёрные металлы подразделяют на чугун и сталь.
Чугун — железоуглеродистый сплав с содержанием углерода от 2 % до 6,67 %. В зависимости от характера металлической основы он делится на четыре группы: серый, белый, высокопрочный и ковкий.
Серый чугун — содержит 2,4-3,8 % углерода. Он хорошо поддаётся обработке, имеет повышенную хрупкость. Его используют для литья изделий, не подвергающихся ударным воздействиям.
Высокопрочный чугун получают присадкой в жидкий чугун магния 0,03-0,04 %, он имеет тот же химический состав что и серый чугун. Он имеет наиболее высокие прочностные свойства. Его применяют для отливки корпусов насосов, вентилей.
Ковкий чугун — получают длительным нагревом при высоких температурах отливок из белого чугуна. Он содержит 2,5-3,0 % углерода. Его применяют для изготовления тонкостенных деталей (гайки, скобы…). В водохозяйственном строительстве применяют чугунные плиты — для облицовки поверхностей гидротехнических сооружений, подвергающихся истиранию наносами, чугунные водопроводные задвижки, трубы.
Стали — получают в результате переработки белого чугуна в мартеновских печах. С увеличением в сталях содержания углерода повышается их твёрдость и хрупкость, в то же время понижается пластичность и ударная вязкость.
Механические и физические свойства сталей значительно улучшаются при добавлении в них легирующих элементов (никеля, хрома, вольфрама). В зависимости от содержания легирующих компонентов стали делятся на четыре группы:
углеродистые (легирующие элементы отсутствуют),
низколегированные (до 2,5 % легирующих компонентов),
среднелегированные (2,5-10 % легирующих компонентов),
высоколегированные (более 10 % легирующих компонентов).
Углеродистые стали в зависимости от содержания углерода подразделяют на низкоуглеродистую (углероды до 0,15 %), среднеуглеродистую (0,25-0,6 %) и
К цветным металлам и сплавам относят алюминий, медь и их сплавы (с цинком, оловом, свинцом, магнием), цинк, свинец.
В строительстве используют лёгкие сплавы — на основе алюминия или магния, и тяжёлые сплавы — на основе меди, олова, цинка, свинца и титана.
Стальные строительные материалы и изделия
Горячекатаные стали выпускают в виде равнополочного уголка (с полками шириной 20-250 мм); неравнополочного уголка; двутавровой балки; двутавровой широкополочной балки; швеллера.
Для изготовления металлических строительных конструкций и сооружений используют прокатные стальные профили: равнополочный и неравнополочный уголки, швеллер, двутавр и тавр. В качестве крепёжных изделий из стали применяют заклёпки, болты, гайки, винты и гвозди. При выполнении строительно-монтажных работ применяют различные способы обработки металлов: механическую, термическую, сварку. К основным способам производства металлических работ относится механическая горячая и холодная обработка металлов.
При горячей обработке металлы нагревают до определённых температур, после чего им придают соответствующие формы и размеры в процессе проката, под воздействием ударов молота или давлении пресса.
Холодную обработку металлов подразделяют на слесарную и обработку металлов резанием. Слесарная и обработка состоит из следующих технологических операций: разметки, рубки, резки, отливки, сверления, нарезки.
Обработку металлов, резание осуществляют путём снятия металлической стружки режущим инструментом (точение, строгание, фрезерование). Её производят на металлорежущих станках.
Для улучшения строительных качеств стальных изделий их подвергают термической обработке — закалке, отпуску, отжигу, нормализации и цементации.
Закалка заключается в нагреве стальных изделий до температуры, несколько выше критической, некоторой выдержке их при этой температуре и в последующем быстром охлаждении их в воде, масле, масляной эмульсии. Температура нагрева при закалке зависит от содержания в стали углерода. При закалке увеличиваются прочность и твёрдость стали.
Отпуск заключается в нагреве закалённых изделий до 150—670 °C (температура отпуска), выделке их при этой температуре (в зависимости от марки стали) и последующем медленном или быстром охлаждении в спокойном воздухе, воде ил в масле. В процессе отпуска повышается вязкость стали, уменьшается внутреннее напряжение в ней и её хрупкость, улучшается её обрабатываемость.
Отжиг заключается в нагреве стальных изделий до определённой температуры (750—960 °C), выдержке их при этой температуре и последующем медленном охлаждении в печи. При отжиге стальных изделий понижается твёрдость стали, также улучшается её обрабатываемость.
Нормализация — заключается в нагреве стальных изделий до температуры несколько более высокой, чем температура отжига, выдержке их при этой температуре и последующем охлаждении в спокойном воздухе. После нормализации получается сталь с более высокой твёрдостью и мелкозернистой структурой.
Цементация — это процесс поверхностного науглероживания стали с целью получения у изделий высокой поверхностной твёрдости, износостойкости и повышенной прочности; при этом внутренняя часть стали сохраняет значительную вязкость.
Цветные металлы и сплавы
К ним относятся:
алюминий и его сплавы — это лёгкий, технологичный, коррозионностойкий материал. В чистом виде его используют для изготовления фольги, отливки деталей. Для изготовления алюминиевых изделий используют алюминиевые сплавы — алюминиево-марганцевый, алюминиево-магниевый… Применяемые в строительстве алюминиевые сплавы при незначительной плотности (2,7-2,9 г/см³), имеют прочностные характеристики, которые близки к прочностным характеристикам строительных сталей. Изделия из алюминиевых сплавов характеризуются простотой технологии изготовления, хорошим внешним видом, огне- и сейсмостойкостью, антимагнитностью, долговечностью. Такое сочетание строительно-технологических свойств у алюминиевых сплавов позволяет им конкурировать со сталью. Использование алюминиевых сплавов в ограждающих конструкциях позволяет уменьшить вес стен и кровли в 10-80 раз, сократить трудоёмкость монтажа.
Медь и её сплавы. Медь — это тяжёлый цветной металл (плотностью 8,9 г/см³), мягкий и пластичный с высокой тепло- и электропроводностью. В чистом виде медь используют в электрических проводах. В основном медь применяют в сплавах различных видов. Сплав меди с оловом, алюминием, марганцем или никелем называют бронзой. Бронза — это коррозионностойкий металл, обладающий высокими механическими свойствами. Применяют её для изготовления санитарно-технической арматуры. Сплав меди с цинком (до 40 %) называют латунью. Она обладает высокими механическими свойствами и коррозионной стойкостью, хорошо поддаётся горячей и холодной обработке. Её применяют в виде изделий, листов, проволоки, труб.
Цинк — это коррозионностойкий металл, применяемый в качестве антикоррозионного покрытия при оцинковывании стальных изделий в виде кровельной стали, болтов.
Свинец — это тяжёлый, легкообрабатываемый, коррозионностойкий металл, применяемый для зачеканивания швов раструбных труб, герметизации деформационных швов, изготовления специальных труб.
Коррозия металла и защита от неё
Воздействие на металлические конструкции и сооружения окружающей среды приводит к их разрушению, которое называется коррозией. Коррозия начинается с поверхности металла и распространяется в глубь него, при этом металл теряет блеск, поверхность его становится неровной, изъеденной.
По характеру коррозионных разрушений различают сплошную, избирательную и межкристаллитную коррозию.
Сплошную коррозию подразделяют на равномерную и неравномерную. При равномерной коррозии разрушение металла протекает с одинаковой скоростью по всей поверхности. При неравномерной коррозии разрушение металла протекает с неодинаковой скоростью на различных участках его поверхности.
Избирательная коррозия охватывает отдельные участки поверхности металла. Её подразделяют на поверхностную, точечную, сквозную, и коррозию пятнами.
Межкристаллитная коррозия проявляется внутри металла, при этом разрушаются связи по границам кристаллов, составляющих металл.
По характеру взаимодействия металла с окружающей средой различают химическую и электрохимическую коррозию. Химическая коррозия возникает при действии на металл сухих газов или жидкостей не электролитов (бензина, масла, смол). Электрохимическая коррозия сопровождается появлением электрического тока, возникающего при действии на металл жидких электролитов (водных растворов солей, кислот, щелочей), влажных газов и воздуха (проводников электричества).
Для предохранения металлов от коррозии применяют различные способы их защиты:
герметизацию металлов от агрессивной среды, уменьшение загрязнённости окружающей среды, обеспечение нормальных температурно-влажностных условий, нанесение долговечных антикоррозионных покрытий. Обычно с целью защиты металлов от коррозии их покрывают лакокрасочными материалами (грунтовками, красками, эмалями, лаками), защищают коррозионностойкими тонкими металлическими покрытиями (в том числе оцинковывание, алюминиевые покрытия и др.) с помощью газотермического напыления, плакированием. Кроме этого, металл от коррозии защищают легированием, то есть путём плавления его с другим металлом (хром, никель и др.) и неметаллом.
Классификация металлов. Защита от коррозии.
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Металлы вследствие своей высокой прочности, пластичности, износоустойчивости, тепло- и электропроводности являются наиболее важными конструкционными материалами.
В процессе эксплуатации в результате воздействия окружающей среды происходит их разрушение, так называемая коррозия.
Потери от коррозии в ведущих индустриальных странах составляют около 3-5% валового национального продукта, а затраты на возмещениекоррозионных потерь во всем мире исчисляются сотнями миллиардов долларов, поэтому раздел «Коррозия металлов и методы защиты их от коррозии» является одним из важнейших в курсе химии для инженерных специальностей.
Обычно корродируют металлы, которые встречаются в природе не в самородном состоянии, как Au, Pt, а в виде различных руд. На извлечение этих металлов из природных соединений расходуется значительное количество энергии (Ме +n + n? → Me 0 ; ΔG>0), которая накапливается в металлах, делая их термодинамически неустойчивыми, химически активными веществами (Ме 0 - n? → Me + n ; ΔG<0). В результате такого самопроизвольно протекающего коррозионного процесса металлы переходят в оксиды, гидроксиды, карбонаты, сульфиды и другие соединения и теряются безвозвратно.
Итак, коррозию можно определить как самопроизвольно протекающий окислительно-восстановительный процесс (ΔG<0) разрушения металла под воздействием окружающей среды, происходящий с выделением энергии (ΔН<0) и рассеиванием вещества (ΔS>0).
Механическое разрушение металлов, происходящее по физическим причинам, не называют коррозией, а называют эрозией, истиранием, износом.
По характеру разрушения поверхности коррозию подразделяют на сплошную и местную. Сплошная коррозия подразделяется на равномерную, если процесс окисления происходит по всей поверхности металла с одинаковой скоростью, и неравномерную – процесс окисления происходит по всей поверхности с различной скоростью на различных участках металла.
Местная коррозия подразделяется на коррозию пятнами, точечную, питтинг (углубленно-точечную), межкристаллитную (наиболее опасна, т.к. ослабляет связи между зернами структуры сплавов), растрескивающуюся, селективную (избирательную).
По механизму протекания различают следующие виды коррозии:
- электрохимическая (концентрационная, контактная, электрокоррозия);
- особые виды (биологическая, радиационная, ультразвуковая).
По характеру дополнительных воздействий различают:
- коррозию под влиянием механических напряжений;
- коррозию при трении;
- кавитационную коррозию (возникает при одновременном коррозионном и ударном воздействии агрессивной среды, когда лопаются пузырьки воздуха при работе лопастей гребного винта, роторов насосов).
Рассмотрим более подробно виды коррозии по механизму протекания.
Под химической коррозией понимают разрушение металлов окислением в окружающей среде без возникновения электрического тока в системе.
Газовая коррозия протекает при обычных условиях, но чаще при высоких температурах. Наблюдается при разливе расплавленных металлов, их термической обработке, ковке, прокатке, сварке и т.д.
Самый распространенный случай газовой коррозии – взаимодействие металла с кислородом:
Образующаяся при такой коррозии оксидная пленка в ряде случаев играет защитную функцию. Для этого она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, обладать твердостью, износостойкостью и иметь коэффициент термического расширения, близкий к этой величине для металла. Все эти качества оксидной пленки можно оценить по фактору Пиллинга-Бэдвордса (a). Металлы (щелочные, щелочноземельные), у которых a2O3, ZnO, NiO и т.д.).
При значениях a значительно больше единицы пленки получаются неслошные, лекго отделяющиеся от поверхности металла (железная окалина). Коррозионно-активными газами, кроме кислорода, являются: угарный газ, углекислый газ, сернистый ангидрид, азот, его оксиды и галогены. Например, при разливе расплавленного алюминия, происходит его взаимодействие не только с кислородом, но и с азотом воздуха.
Жидкостная коррозия протекает, как правило, в жидких неэлектролитах: спиртах, хлороформе, бензоле, бензине, керосине и других нефтепродуктах. Ускоряет процесс жидкостной коррозии сера,кислород, галогены, влага, атакже повышенная температура (коррозия поршней в двигателях внутреннего сгорания),что можно описать уравнениями : Me(II) + R1 – S – R2 → MeS + R1 – R2
Me(I) + nR – Cl → MeCl + 1/2nR – R ,
где R1 – S – R2и nR – Cl углеводороды, содержащие серу и хлор.
Электрохимическая коррозия наиболее распространенный вид коррозии. Это разрушение деталей, машин, конструкций в грунтовых, речных, морских водах, под влиянием воды (росы), под воздействием смазочно-охлаждающих жидкостей, используемых при механической обработке металлов, атмосферная коррозия и т.д.
Электрохимическая коррозия – это пространственно разделенный окислительно-восстановительный процесс разрушения металла, протекающий в среде электролита, с возникновением внутри системы электрического тока, называемого коррозионным током.
Рассмотрим химизм атмосферной коррозии стального изделия. Сталь – это сплав железа с углеродом, в котором углерода менее 2%, например, цементит (Fe3C4). При электрохимической коррозии во влажном воздухе (О2 + 2Н2О) железо и цементит образуют микрогальванопару, в которой роль анода выполняет железо, а цементит – роль катода.
Схема процесса:
Анодный процесс: Fe 0 - 2? → Fe 2+ 2 поляризация
Катодный процесс: 2H2O + O2 + 4? → 4OH - 1 деполяризация
Суммарное уравнение коррозионного процесса разрушения стального изделия, находящегося во влажном воздухе:
Для железа более характерна степень окисления (3+), поэтому процесс окисления идет дальше:
4Fe(OH)2+2H2O+O2→4Fe(OH)3, образующийся Fe(OH)3 при нагревании может терять воду.
То есть продуктами коррозии железа (ржавчина) является смесь различных соединений. Если учесть, что в воздухе присутствуют углекислый газ, сернистый газ, следовательно, могут образовываться и соли железа.
Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
После высыхания капли в её центре обнаруживается углубление, а иногда даже и отверстие (для пластин толщиной 0,1-0,2 мм). Такие процессы часто наблюдаются при атмосферной и почвенной коррозии железных и стальных изделий (троса, стопки листов и т.д.) – точечная коррозия, переходящая в питтинг. Следует отметить, что хотя конечный продукт коррозии (ржавчина) нерастворим, однако он не препятствует процессу растворения металла, поскольку формируется за пределами анодного участка (на границе соприкосновения его с катодами) в виде кольца внутри капли.
На практике часто встречаются случаи, когда металлы различной активности находятся в контакте друг с другом, образуя гальванопары. Кроме того, технические металлы содержат примеси других металлов, сплавы содержат различные металлы. Такой металл или сплав, находясь в среде электролита, дает множество микро - и макрогальванопар, в которых анодом является более активный металл, т.е. металл с меньшим значением электродного потенциала, именно он и подвергается коррозии.
Рассмотрим случай контактной коррозии с водородной деполяризациейцинка и меди, в сернокислой среде. Цинк и медь, имеют различные значения электродных потенциалов. Более активным в этой гальвано паре является цинк (Е 0 Zn2+/Zn = -0,76 В), он имеет меньшее значение электродного потенциала и будет анодом, т. е именно цинк будет подвергаться коррозионным процессам, менее активным металлом является медь (Е 0 Cu2+/Cu = +0,34 В), она будет катодом.
Запишем схему: (А) Zn | H2SO4 | Cu (K)
Анодный процесс: Zn 0 - 2? → Zn 2+
Катодный процесс: 2Н + + 2? → Н2 деполяризатор
Суммарное ионное уравнение: Zn + 2H + → Zn 2+ + H2
Факторы, влияющие на скорость коррозии:
а) напряжение и деформация при механической обработке металлов;
б) перемешивание агрессивной среды;
в) дифференциальная аэрация;
д) кислотность среды (рН).
Рассматривая фактор (д) обратите внимание, что электродные потенциалы металлов существенно зависят от состава электролита и рН среды. Так, в случае контактной (Al-Zn) коррозии в 1М растворе HCl
возникает гальвано пара, в которой роль анода выполняет Al, а катода- Zn, схема такого процесса: (А) Al | HCl | Zn (K)
В 0,1 М растворе HCl в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn | HCl | Al (K)
Электрокоррозия – протекает под действием блуждающих токов, возникает от постоянных источников тока (электротранспорт, трансформаторы, линии электропередач). Рассматривая коррозию под действием блуждающих токов, надо помнить, что место выхода тока – будет анодным участком, входа тока – катодным, участок протекания тока – нейтральной зоной. Радиус действия блуждающих токов может достигать нескольких десятков километров. Ток силой 1А за год разрушает до 3 кг алюминия, 9 кг железа, 11 кг цинка или меди, 34 кг свинца.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери от коррозии в мировой экономике огромны. Около 1/3 вводимого в эксплуатацию металла подвергается коррозии, при этом примерно 10% теряется безвозвратно.
Борьба с коррозией осуществляется различными методами. Наиболее рациональный и надежный путь – изготовление аппаратов и машин изкоррозионно-стойких металлических или неметаллических материалов,но из-за дороговизны таких материалов, чаще используют дешевые и доступные металлы с последующей защитой их от коррозии. Полностью избежать коррозии невозможно, но, применив определенные методы защиты, можно снизить ее воздействие.
Можно условно выделить следующие группы методов защиты металлов от коррозии:
1. Создание рациональных конструкций, т.е. таких, которые не имеют застойных зон и других мест скопления влаги, грязи и других коррозионно-агрессивных сред, допускают быструю очистку и аэрацию.
2. Легирование металлов. Это эффективный, хотя обычно дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты (Cr, Ni, W, Si, V, Mo, Re и другие), вызывающие пассивирование металла. Механизм защиты (например, в нержавеющих сталях) состоит в образовании на поверхности плотных оксидных слоев, типа шпинелей состава NiO . Cr2O, FeO . Cr2O3, которые оказываются более устойчивыми, чем просто оксиды хрома или никеля.
3. Создание аморфных структур металлов. Путь к этому способу защиты открыла сверхбыстрая закалка. Расплавленный металл из тигля подают в тончайший зазор между двумя массивными валками и подвергают формированию и резкому охлаждению. В этих условиях атомы не успевают выстраиваться в присущие металлам кристаллические решетки, фиксируется «хаос атомов», свойственный расплавленному металлу. В результате получается аморфная структура, подобная стеклу, резко возрастает коррозионная устойчивость металлов.
4. Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Смысл их нанесения – изоляция от агрессивной среды. Различают неметаллические и металлические покрытия.
а) неметаллические покрытия получают нанесением на поверхность металла лака, краски, смолы, олифы, эмали или стеклоэмали. Поверхность металла покрывают также резиной, эбонитом, полимерными материалами, цементом, бетоном, оксидными пленками: ZnO, Al2O3 (оксидирование) и нитридными пленками: Fe4N, Fe2N (азотирование). Покрыть поверхность металла можно осаждением нерастворимых фосфатов этого металла: Fe(H2PO4)2 + 2 Fe 2+ ® Fe3(PO4)2¯ + 4H ( фосфатирование) или насыщением поверхности металла углеродом (цементация).
б) защитные покрытия металлами. Для этого используют коррозионно-устойчивые металлы (Sn, Zn, Al, Au, Ag, Ni, Cr и др.) Различают анодные и катодные металлические покрытия. Если защищаемый металл покрывают более активным металлом, то такое покрытие называют анодным. При нарушении покрытия разрушается металл покрытия. Рассмотрим это на примере оцинкованного железа. Составим схему коррозионного разрушения.
A: Zn 0 - 2? → Zn 2+ 2
Если защищаемый металл покрыт менее активным металлом, например, железо покрыто оловом, то такой вид покрытия называется катодным. При нарушении покрытия разрушается основной металл. Рассмотрим этот случай коррозии.
(А) Fe | 2H + | Sn (K)
A: Fe 0 - 2? → Fe 2+ 1
Fe + 2H + → Fe 2+ + H2
5. Электрохимические методы защиты:
а) защита внешним потенциалом);
б) анодная (протекторная).
Защита внешним потенциалом (чаще катодная) осуществляется подключением защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока с очень малым напряжением (0,1 В). К положительному полюсу подсоединяется лом, который и разрушается. Этот вид защиты используют для металлических сооружений: трубопроводов, резервуаров и т.д.
Протекторная защита заключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь – протектор из более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Применяют в паровых котлах, для защиты корпусов морских и речных судов, трубопроводов, рельсов и т.д.
Задача. Приведите пример протекторной защиты в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов и вычислите ЭДС реакции.
Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
Среда нейтральная или слабощелочная, так как концентрация солей невелика. В этом, созданном нами, коррозионном элементе анодом служит протектор (цинк), он растворяется.
Анод: Zn 0 – 2 ® Zn 2+ .
Электроны передаются на железо. Деполяризатором в этом случае является кислород.
Катод: O2 + 2H2O + 4® 4OH - ; E 0 = 0,40 B.
ЭДС реакции определяем: DЕ = Екатода – Еанода = 0,40 – (-0,75) = 1,16 В.
Ответ: протектор Zn, он окисляется и защищает железо; DЕ = 1,16 В.
6. Воздействие на агрессивную среду. Для замедления коррозии в агрессивную среду вводят вещества, называемые ингибиторами (замедлителями). Это чаще всего органические вещества, пассивирующие поверхность металла: тиомочевина C(NH2)2S, диэтиламин C2H5 — NH — C2H5, уротропин (CH2)6N4, неорганические вещества SiO3 2- , NO2 - , Cr2O7 2- , а также освобождение воды от растворенного в ней кислорода (воду фильтруют через слой железных опилок). Либо удаляют активаторы коррозии, например, ионы Cl - , Br - , F - , SO4 2- , NO3 - .
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
4. Абраменко В.Л. Методические указания к самостоятельному изучению темы “Коррозия и защита металлов от нее”. Луганск, 1991 г.
Коррозия и защита металлов
1. Общие сведения. Классификация коррозии. Современные коррозионностойкие конструкционные сплавы
Коррозией металлов называют самопроизвольное разрушение металлических конструкций вследствие их химического или электрохимического взаимодействия с окружающей средой.
Коррозионный процесс протекает на границе двух фаз: металл– окружающая среда, т. е. является гетерогенным процессом.
Коррозия металлов наносит огромный ущерб практически любой отрасли промышленности. Потери от коррозии можно разделить на две группы: прямые и косвенные.
Прямые потери складываются в основном из потерь непосредственно самого металла вследствие коррозии.
Косвенные потери огромны и обусловлены расходами, связанными с отказом в работе оборудования, его простоем, со стоимостью ремонта и заменами деталей оборудования, с утечками нефти, газа через повреждения в трубопроводах и т. п.
С химической точки зрения металлы являются восстановителями. Они легко отдают валентные электроны и образуют положительно заряженные ионы. Во всех соединениях они проявляют только положительные степени окисления. Многие металлы, например, железо, хром, марганец, имеют переменные степени окисления. Восстановительные свойства металлов различны и определяются их стандартным электродным потенциалом. В табл. 1 приведены электродные потенциалы для металлов.
По своей химической активности и положению в ряду стандартных потенциалов металлы делятся на три группы:
- активные – от Li до Al включительно – вытесняют водород из воды и растворов кислот;
- средней активности – от Mn до Pb включительно – вытесняют водород из растворов кислот;
- неактивные – стоящие в ряду после водорода – не вытесняют водород из растворов кислот.
Все эти металлы могут самопроизвольно окисляться. Следовательно, основной причиной коррозии металлов в атмосфере или других средах является их термодинамическая нестабильность. Степень
термодинамической нестабильности металла зависит от его природы, характера коррозионной среды и конкретных условий.
Таблица 1. Ряд стандартных электродных потенциалов металлов
способности (М n+ )
способности (М о )
Основной причиной, вызывающей коррозионное разрушение металлов и сплавов, является протекание на их поверхности электрохимических или химических реакций.
В зависимости от характера этих реакций и механизма протекания, все коррозионные процессы делят на два вида:
- химической коррозией называют процессы, протекающие при непосредственном химическом взаимодействии между металлом и агрессивной средой и не сопровождающиеся возникновением электрического тока;
- электрохимической коррозией называют процессы взаимодействия металлов с водными растворами электролитов, сопровождающиеся возникновением в системе электрического тока, то есть упорядоченным передвижением электронов и ионов от одного участка металла к другому.
По условиям протекания коррозии, различают несколько видов коррозии:
- газовую – коррозию в газах при высоких температурах;
- атмосферную – коррозию в воздухе или влажном газе;
- жидкостную – коррозию в жидкой среде (в растворах неэлектролитов и электролитов);
- подземную – коррозию в почвах и грунтах;
- биокоррозию – коррозию под влиянием жизнедеятельности микроорганизмов;
- структурную – коррозию, связанную со структурной неоднородностью металла;
- коррозию блуждающими токами;
- контактную – электрохимическую коррозию, вызванную контактом металлов, имеющих разные электродные потенциалы в данном электролите;
- щелевую – коррозию в щелях и зазорах между металлами;
- под напряжением – коррозию при одновременном воздействии коррозионной среды и механических напряжений;
- коррозионную кавитацию – разрушение металла, вызванное одновременным коррозионным и ударным воздействием внешней среды.
По характеру коррозионных разрушений различают следующие виды коррозии:
- сплошную, или общую, коррозию, охватывающую всю поверхность металла, находящуюся под воздействием коррозионной среды. Она бывает: равномерной, неравномерной, избирательной;
- местную коррозию, охватывающую отдельные участки металла. Она бывает: точечной (питтинг), сквозной, язвенной и др.
2. Методы защиты металлов от коррозии
Для защиты металлов от коррозии применяются различные методы: легирование металлов, обработка коррозионной среды, электрохимическая защита, нанесение металлических и неметаллических покрытий.
Легирование металлов позволяет получать коррозионностойкие сплавы, превосходящие по стойкости основной металл. Примерами могут служить сплавы меди (латунь и бронза), ее легирование алюминием для повышения коррозионной стойкости в атмосферных условиях; легирование стали хромом и никелем с целью создания хромоникелевых сплавов.
Обработку коррозионной среды выполняют с целью уменьшения ее агрессивного воздействия на металл. Однако такая обработка целесообразна при небольших объемах электролитов. Обработка среды заключается во введении в среду ингибиторов коррозии или в уменьшении содержания деполяризатора в электролитах.
Ингибиторы коррозии, введенные в коррозионную среду в малых количествах, полностью предотвращают коррозию металлов или значительно снижают ее скорость. В зависимости от характера среды ингибиторы выступают как замедлители кислотной или щелочной коррозии, коррозии в нейтральных растворах, в неводных средах. В основном, ингибиторы являются органическими соединениями.
Электрохимическая защита подразделяется на катодную и анодную защиту. Катодная защита подразделяется на защиту внешним током и протекторную защиту.
Механизм защиты внешним током (рис. 1) сводится к тому, что за счет внешней катодной поляризации защищаемому металлу навязывают потенциал, при котором его коррозия замедляется. Суть этого способа заключается в том, что защищаемую конструкцию подсоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу подсоединяют электрод, которым может являться металлолом, а именно отрезок стальной трубы, рельсы и т. п. (рис. 1).
Протекторная защита (рис. 2) состоит в том, что к защищаемой конструкции подсоединяют металл или сплав, электродный потенциал которого более электроотрицателен, чем потенциал металла защищаемой конструкции. В качестве протекторов обычно используют цинк или сплавы цинка с алюминием. Иногда применяют сплавы на основе магния. Протекторы применяют для защиты металлических конструкций от коррозии в морской воде, других нейтральных коррозионных средах, а также в почве.
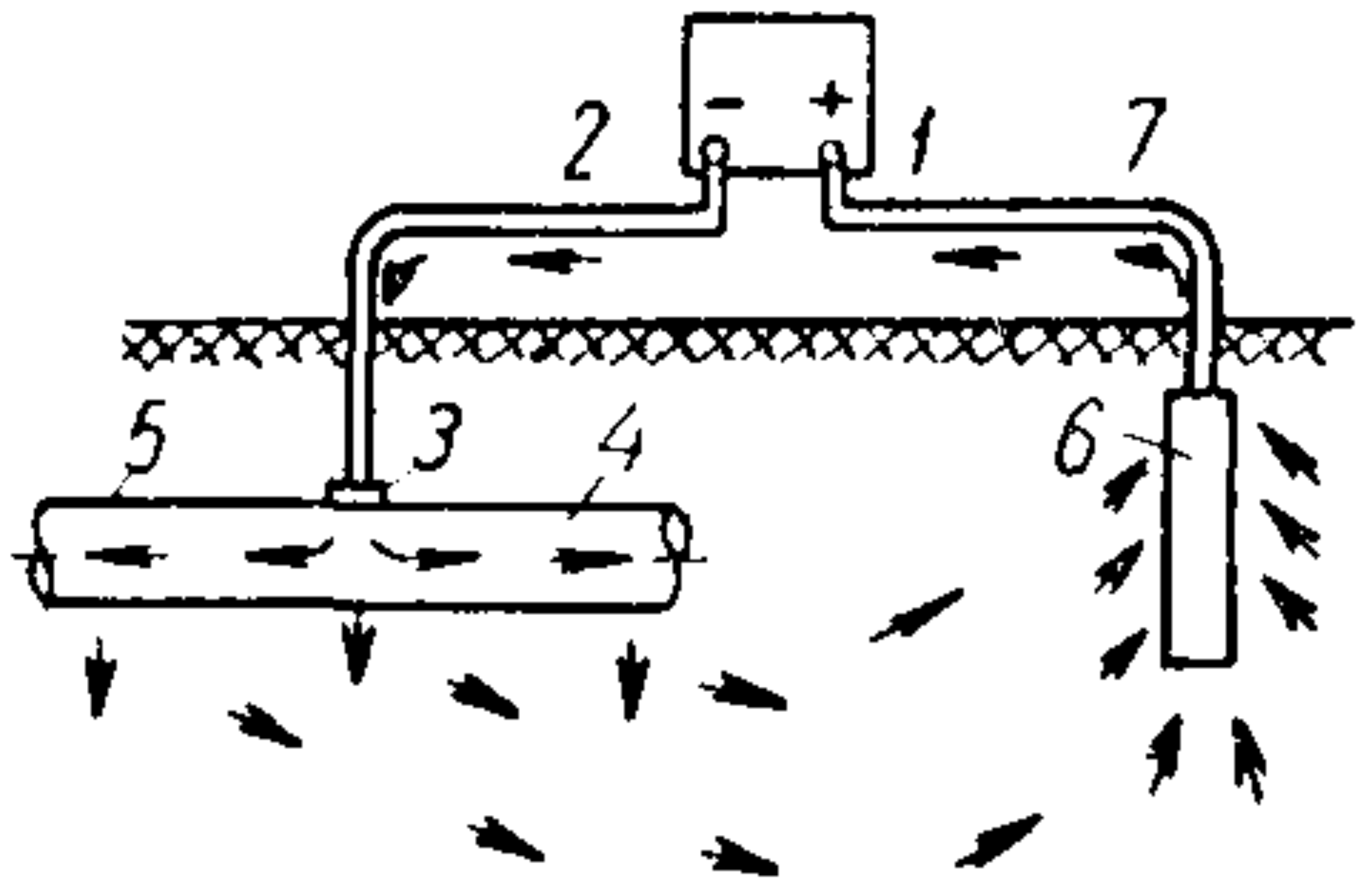
Рис. 1. Схема катодной защиты внешним током: 1 – источник постоянного тока; 2 – соединительный провод; 3 – пункт дренажа; 4 – защищаемая труба; 5 – изолирующее покрытие; 6 – анодное заземление; 7 – соединительный провод
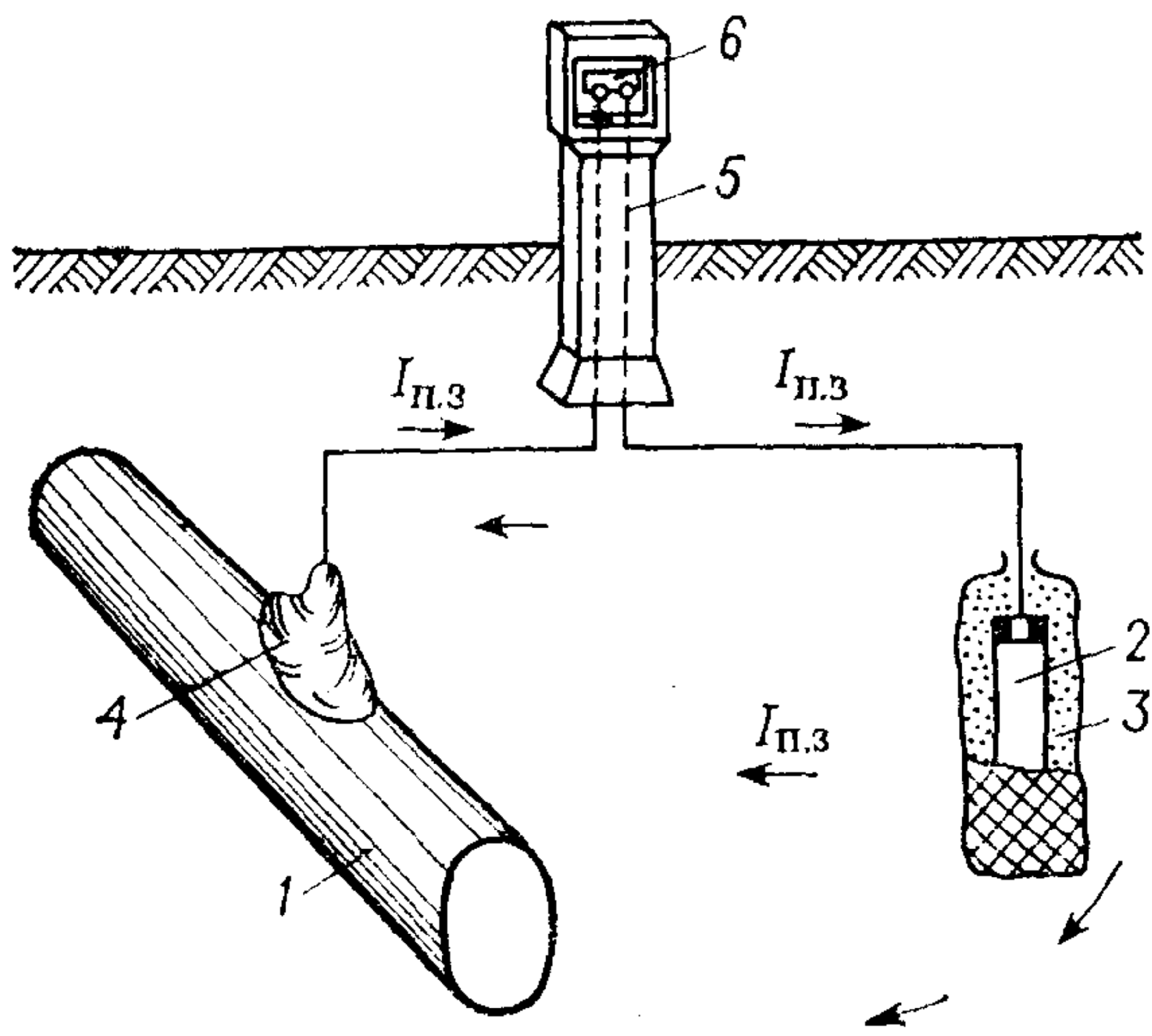
Рис. 2. Схема протекторной защиты: 1 – подземная стальная конструкция; 2 – протектор–магниевый сплав; 3 – заполнитель; 4 – электрический контакт; 5 – контрольно-измерительный вывод; 6 – закороченные клеммы; Iп.з – сила тока протекторной защиты
Защита металлическими и неметаллическими покрытиями. Для защиты металлов от коррозии используют различные виды покрытий: металлические, лакокрасочные и полимерные покрытия и покрытия, образованные в результате химической или электрохимической обработки поверхности металла. Роль любого покрытия сводится в основном к изоляции металла от внешней среды.
Выбор типа покрытия зависит от условий, в которых следует использовать металл. Для защиты изделий, не подвергающихся механическим воздействиям и применяющимся в сухих жилых помещениях, обычно бывает достаточно однослойного лакокрасочного покрытия или соответствующей химической обработки поверхности металла: оксидирования или фосфатирования. Для защиты металлических конструкций (железнодорожные мосты, подъемные краны и т. п.), а также железнодорожных вагонов, наружных деталей автомобилей, велосипедов и др., подвергающихся воздействию влажной атмосферы, применяют сложные по составу и способу нанесения лакокрасочные покрытия.
3. Коррозионностойкие металлы и сплавы
Под понятием коррозионностойкие металлы и сплавы понимают конструкционные материалы, которые в агрессивных коррозионных средах обладают достаточной коррозионной стойкостью и жаростойкостью и могут быть использованы без специальных средств противокоррозионной защиты.
При этом коррозионная стойкость конструкционного материала заключается не только в сохранении его основной массы, но и выполнении функциональных нагрузок самой металлической конструкцией.
Характеристика степени термодинамической стабильности различных металлов приближенно может быть сделана по величине стандартных электродных потенциалов: чем более электроотрицателен потенциал металла, тем он активнее (табл. 2).
Таблица 2. Стандартные электродные потенциалы
Величины электродных потенциалов –0,414 В и +0,815 В представляют собой значения равновесных потенциалов водородного и кислородного электродов в нейтральной среде.
Некоторые металлы, например, железо, алюминий, титан, хром, никель, относительно устойчивы благодаря наступлению пассивного состояния. Пассивное состояние поверхности металла нарушается при наличии в растворе некоторых активных ионов (ионы хлора, брома, фтора) и, наоборот, усиливается при наличии окислителей. Часть металлов устойчива вследствие возникновения малорастворимых и достаточно плотных пленок на поверхности из продуктов коррозии. Некоторые металлы коррозионностойки из-за отсутствия примесей, образующих эффективные катоды, так как наличие загрязнений может привести к образованию коррозионных микрогальванических элементов.
Теория коррозионностойкого легирования металлов, устойчивых к электрохимической коррозии, основывается на учении о контролирующих факторах коррозии – омическом, катодном и анодном торможении процесса коррозии.
На основе этих факторов разработаны три направления повышения коррозионной устойчивости сплавов:
- Создание сплавов, образующих более совершенный защитный слой продуктов коррозии на своей поверхности. В металл вводят компоненты, способствующие образованию плотной защитной пленки на поверхности металла. Торможение коррозии достигается как за счет увеличения омического сопротивления, так и за счет экранирующего слоя, тормозящего доставку к металлической поверхности веществ, необходимых для протекания катодного процесса или удаление продуктов электродной реакции. Например, при легировании железа медью наступает пассивное состояние железа, но этот метод имеет ограниченное применение, так как при электрохимической коррозии трудно достичь полного экранирования поверхности.
- Уменьшение катодной активности металлов. Защитные свойства металлов повышаются вследствие уменьшения площади микрокатодов или увеличения на них перенапряжения выделения водорода, т. е. происходит торможение катодного процесса. При легировании железа сурьмой, висмутом, мышьяком увеличивается перенапряжение выделения водорода.
- Снижение анодной активности металлов. Защитные свойства металлов повышаются в результате уменьшения активности анодной фазы путем введения компонентов, повышающих или термодинамическую устойчивость сплава, или его пассивность. Повышение коррозионной стойкости, например, стали, достигается легированием ее хромом; хромом и никелем; хромом, никелем и небольшими добавками палладия.
Какой из приведенных методов повышения коррозионной устойчивости сплавов надежнее и перспективнее, можно определить, исходя из конкретных условий.
При кислотной коррозии в восстановительных средах с выделением водорода и в отсутствии возможности повышения склонности к пассивированию весьма полезными могут оказаться методы уменьшения катодной активности сплавов или повышения термодинамической устойчивости анодной фазы. В условиях возможности установления пассивного состояния, наоборот, совершенно неэффективны методы снижения катодной активности, а окажутся полезными все методы, снижающие анодную активность сплавов.
При возможности установления пассивного состояния сплава эффективен метод введения активных катодов. Однако этот метод окажется вредным, если по условиям коррозии (восстановительная среда, наличие ионов хлора) установление стойкого пассивного состояния невозможно.
Повышение коррозионной стойкости металлов в кислотах достигается кислотостойким легированием. Коррозия металлов в кислотах с неокисляющимся анионом (разбавленная серная кислота, соляная кислота) протекает, в основном, с водородной деполяризацией. При коррозии в окисляющих кислотах (азотная кислота, концентрированная серная кислота) основным катодным процессом является восстановление аниона кислоты.
Коррозионную стойкость сплавов в окисляющих кислотах можно повысить, вводя легкопассивирующиеся металлы, например, хром. Сталь, легированная хромом, имеет повышенную стойкость в азотной кислоте. Стойкость металлов в кислотах, в которых возможно наступление пассивного состояния, повышается также в результате легирования металлами, являющимися эффективными катодами. Так, легирование стали типа Х18Н10 палладием повышает стойкость сплава в серной кислоте.
Для повышения коррозионной стойкости в неокисляющих кислотах сплавы легируют молибденом и медью. Кислотостойкость молибдена объясняется его склонностью к пассивированию и образованию защитных пленок.
Кислотостойкость меди связана с ее термодинамической устойчивостью в условиях коррозии с водородной деполяризацией. При коррозии легированных медью сплавов их поверхность обогащается медью вследствие ее более высокой коррозионной стойкости.
Читайте также:
