Металлы не вытесняющие водород из воды
Обновлено: 04.07.2024

Объясните, почему алюминий, относящийся к активным металлам, часто не вытесняет водород из воды и менее активные металлы из солей?
Объясните, почему алюминий, относящийся к активным металлам, часто не вытесняет водород из воды и менее активные металлы из солей.
Что надо сделать, чтобы пошла реакция между алюминием и водой?

Типичными металлами являются все элементы в ряду : А) Ca, Cs, Ba Б) Cu, Au, Ag В) Zn, Fe, Sn Г) Hg, Pb, Al?
Типичными металлами являются все элементы в ряду : А) Ca, Cs, Ba Б) Cu, Au, Ag В) Zn, Fe, Sn Г) Hg, Pb, Al.

Верны ли следующие суждения о свойствах металлов?
Верны ли следующие суждения о свойствах металлов?
А. И калий, и натрий вытесняют водород из воды.
Б. Цинк вытесняет медь из растворов его солей.

Объясните, почему при обычныз условиях алюминий не вытесняет водород из воды и менее активные металлы из растворов солей?
Объясните, почему при обычныз условиях алюминий не вытесняет водород из воды и менее активные металлы из растворов солей.

Объясните почему алюминий, относящийся к активным металлам, часто не вытесняет водород из воды?
Объясните почему алюминий, относящийся к активным металлам, часто не вытесняет водород из воды.
Типичными металлами являются все элементы в ряду : а)Са, Сs, Ba б)Сu, Au, Ag в)Zn, Fe, Sn г)Hg, Pb, Al?
Типичными металлами являются все элементы в ряду : а)Са, Сs, Ba б)Сu, Au, Ag в)Zn, Fe, Sn г)Hg, Pb, Al.

Какие все три металла не реагирует с NaOH?
Какие все три металла не реагирует с NaOH?
A) Zn, Be, Mg B) Al, Zn, Be C) Mg, Ca, Al D) Hg, Cu, Au E) Zn, Cu, Hg.
Металлы, неспособные вытеснять водород из растворов кислот и воды A) Na, Cu B) Cu, Ag C) Al, Ca D) Ag, Fe E) Pt, Mg?
Металлы, неспособные вытеснять водород из растворов кислот и воды A) Na, Cu B) Cu, Ag C) Al, Ca D) Ag, Fe E) Pt, Mg.

Назовите три металла, которые вытесняют водород из растворов кислот?
Назовите три металла, которые вытесняют водород из растворов кислот.
Соединенные металлы AL Zn п оместили в воду какой будет коррозия рвать?
Соединенные металлы AL Zn п оместили в воду какой будет коррозия рвать.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..

Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.
1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.

В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.

4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
НЕ ВЫТЕСНЯЮТ ВОДОРОД ИЗ РАЗБАВЛЕННЫХ КИСЛОТ МЕТАЛЛЫ1)Zn, Al, Mg?
Вытеснять водород из воды при комнатной температуре способен металл :а) Sn б)Ba в) Cu г)Zn?
Вытеснять водород из воды при комнатной температуре способен металл :
а) Sn б)Ba в) Cu г)Zn.
Даже при нагревании не вытесняют водород из воды :А?
Даже при нагревании не вытесняют водород из воды :
Укажите ряд, в котором все металлы взаимодействуют с разбавленной серной кислотой :1?
Укажите ряд, в котором все металлы взаимодействуют с разбавленной серной кислотой :
Распределите металлы Al, Cu, Fe, Na, Ba, Zn, K, Ag на металлы А групп и В групп?
Распределите металлы Al, Cu, Fe, Na, Ba, Zn, K, Ag на металлы А групп и В групп.
8. Какой из металлов вытесняет водород из разбавленной кислоты?
8. Какой из металлов вытесняет водород из разбавленной кислоты?
1) Mg 2 ) Ag 3) Au 4) Hg.
При взаимодейстии каких металлов с соляной кислотой образуется водород?
При взаимодейстии каких металлов с соляной кислотой образуется водород?
1) Переходный элементА) Zn б)Ag в) Na2) Металл, способный вытеснять водород из раствора кислоты?
1) Переходный элемент
2) Металл, способный вытеснять водород из раствора кислоты.
Реагируют с соляной кислотой с вытеснением водорода :1) Na, 2) Sn, 3) Li, 4) Cu, 5) Al, 6) Hg, 7)Au?
Реагируют с соляной кислотой с вытеснением водорода :
1) Na, 2) Sn, 3) Li, 4) Cu, 5) Al, 6) Hg, 7)Au.
В порядке уменьшения основных свойств металлы расположены в рядуа)?
В порядке уменьшения основных свойств металлы расположены в ряду
Даны металлы : Al, Fe, Ca, Zn, Na, Li, Ag, Ni?
Даны металлы : Al, Fe, Ca, Zn, Na, Li, Ag, Ni.
Расположите в порядке возрастания химической активности.
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями /
После удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи
2Al + 6H2O = 2Al(OH)3 + 3H2.
Помогите?
Металлы, стоящие в ряду активности до .
, вытесняют его из растворов солей.
Металл способен вытеснять _________ из кислот, только если он состоит в ряду активности металлов __ ________?
Металл способен вытеснять _________ из кислот, только если он состоит в ряду активности металлов __ ________.
Из перечисленных металлов выберите самый активный металл : медь, кальций, алюминий, серебро, железо?
Из перечисленных металлов выберите самый активный металл : медь, кальций, алюминий, серебро, железо.
Какой из указанных металлов проявляет наибольшую химическую активность в реакции с водой?
Какой из указанных металлов проявляет наибольшую химическую активность в реакции с водой?
11 класс Помогите?
11 класс Помогите!
Почему щелочные металлы не вытесняют менее активные металлы из растворов их солей?
Ответ подтвердите примерами уравнений реакций.
Реакции между металлом и солью возможна, если : а) соль до реакции растворимаб) соль после реакции нерастворимав) металл менее активен металла солиг) металл расположен в ряду активности после магния?
Реакции между металлом и солью возможна, если : а) соль до реакции растворима
б) соль после реакции нерастворима
в) металл менее активен металла соли
г) металл расположен в ряду активности после магния.
Почему в реакции Fe2O3 + H2 = Fe + H2O водород вытесняет железо, если в ряду активности металлов водород правее железа?
Почему в реакции Fe2O3 + H2 = Fe + H2O водород вытесняет железо, если в ряду активности металлов водород правее железа?
Какой металл не вытесняет водород из разбавленной кислоты магний алюминий натрий ртуть?
Какой металл не вытесняет водород из разбавленной кислоты магний алюминий натрий ртуть.
Если вам необходимо получить ответ на вопрос Объясните, почему алюминий, относящийся к активным металлам, часто не вытесняет водород из воды и менее активные металлы из солей?, относящийся к уровню подготовки учащихся 5 - 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.

Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
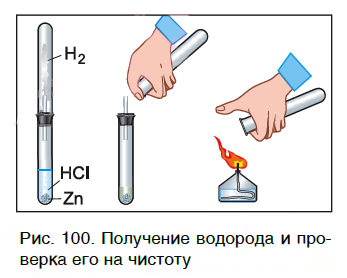
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
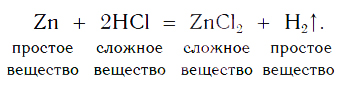
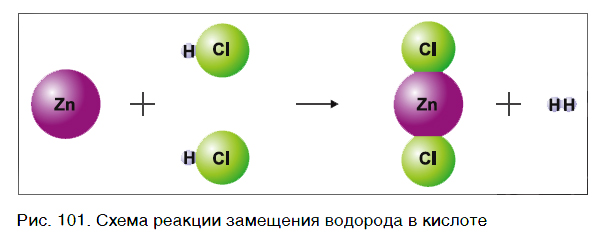
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
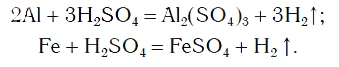
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
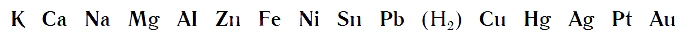
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Читайте также:
