Металлы обладают металлическим блеском
Обновлено: 18.05.2024
В соответствие именно с таким строением металлы характеризуются общими физическими свойствами.
а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло.
б) плотность. Металлы делятся на мягкие (5г/см³) и тяжелые (меньше 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg, теряют блеск и имеют черный или темно-серый цвет.
е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
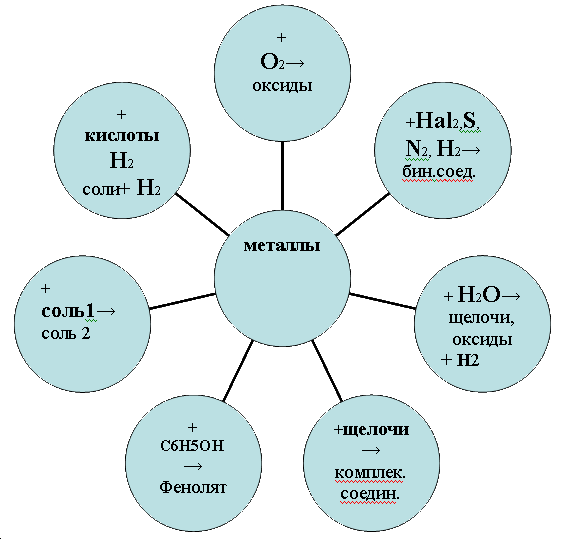
5. Химические свойства металлов.
Ряд напряжений характеризует химические свойства металлов: чем меньше электродный потенциал металла, тем больше его восстановительная способность.
А) Взаимодействие с неметаллами (в названиях полученных веществ окончание
-иды)
2Mg 0 +O2 0 —>2Mg 2+ O 2- (оксид магния)Mg 0 -2e – —>Mg 2+ 2 восстановитель
2O 0 +4e – —>2O 2– 1 окислитель
Fe 0 +S 0 —>Fe 2+ S 2- (сульфид железа II)
Fe 0 -2e – —>Fe 2+ 1 восстановитель
S 0 +2e – —>S 2– 1 окислитель
Б) Взаимодействие с водойСамые активные металлы реагируют с водой при обычных условиях, и в результате этих реакций образуются растворимые в воде основания и выделяется водород
2Na + 2HOH = 2NaOH + H2 0
2Li 0 +2H2 + O 2– —> 2Li + O 2- H + + H2 0
Li 0 -1e – —>Li + 2 восстановитель
2H + +2e – —>2H 0 1 окислитель
Менее активные металлы реагируют с водой при повышенной температуре с выделением водорода и образованием оксида соответствующего металла Zn + H2O = ZnO +H2
Базовые понятия. Запись 7 (физические свойства металлов)

В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа. В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят. Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.

Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.

По степени пластичности металлы принято подразделять следующим образом:
-высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
-пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
-хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.

Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.

Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.

Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.

Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».

Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами. Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов. В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
Карбид вольфрама: 8.5-9
Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
-лёгкие (плотность не более 5 г/см 3 ) — магний, алюминий, титан и др.:
-тяжёлые — (плотность от 5 до 10 г/см 3 ) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
-очень тяжёлые (плотность более 10 г/см 3 ) — молибден, вольфрам, золото, свинец и др.
Таблицы с плотностями:
Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
Делят металлы на несколько групп:
-легкоплавкие (температура плавления не превышает 600 o С) — цинк, олово, свинец, висмут и др.;
-среднеплавкие (от 600 o С до 1600 o С) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
-тугоплавкие ( более 1600 o С) — вольфрам, молибден, титан, хром и др.
Физические свойства металлов

Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Содержимое разработки
9. Физические свойства металлов
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
Именно строением металлической связи обусловлены физические свойства металлов.
К физическим свойствам металлов относятся:
Металлический блеск.
Электропроводность и теплопроводность.
Пластичность.
Высокая плотность и температура плавления.
Рассмотрим каждое из свойств более подробно.
Металлический блеск обусловлен металлической связью между атомами, для которой свойственны обобществленные электроны. Они как раз и испускают под воздействием света свои, вторичные волны излучения, которые мы воспринимаем как металлический блеск.
В порошкообразном состоянии большинство металлов теряют металлический блеск и приобретают серую или черную окраску.
Металлический блеск в порошкообразном состоянии сохраняют алюминий и магний.
Прекрасно отражают свет палладий Pd, ртуть Hg, серебро Ag, медь Cu.
Из алюминия, серебра и палладия, основываясь на их отражательной способности, изготавливают зеркала, в том числе и применяемые в прожекторах.
Все металлы хорошо проводят электрический ток и имеют высокую теплопроводность, также благодаря наличию металлической связи. При нагревании металла, увеличивается скорость движения электронов. Быстро движущиеся по кристаллической решетке электроны выравнивают температуру по всей поверхности металла, проводя тепло. Высокая теплопроводность металлов используется для изготовления из них посуды.
Высокая электропроводность металлов обусловлена направленным движением электронов в кристаллической решетке при воздействии электрического тока. Серебро Ag, медь Cu, золото Au и алюминий Al обладают наибольшей электропроводностью, поэтому медь Cu и алюминий Al используют в качестве материала для изготовления электрических проводов.
Наименьшей электропроводностью обладают марганец Mn, свинец Pb, ртуть Hg и вольфрам W.
Пластичность – это физической свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Большинство металлов пластично, так как слои атом-ионов металлов легко смещаются относительно друг друга и между ними не происходит разрыва связи.
Наиболее пластичные металлы – золото Au, серебро Ag, медь Cu. Из золота Au можно изготовить тонкую фольгу толщиной 0,003 мм, которую используют для золочения изделий.
Именно на пластичности металлов основано кузнечное дело и возможность изготавливать различные предметы с помощью механического воздействия на металл.
Все металлы (кроме ртути) при нормальных условиях представляют собой твердые вещества. Твердость металлов различна. Наиболее твердыми являются металлы побочной подгруппы шестой группы Периодической системы Д.И. Менделеева. Наименее твердыми являются щелочные металлы.
По плотности металлы классифицируют на легкие (их плотность от 0,53 до 5 г/см 3 ) и тяжелые (плотность этих металлов от 5 до 22,6 г/см 3 ). Самым легким металлом является литий Li, плотность которого 0,53 г/см 3 . Самыми тяжелыми металлами в настоящее время считают осмий Os и иридий Ir (плотность около 22,6 г/см 3 ).
Температура плавления.
Температура плавления металлов находится в диапазоне от 39 (ртуть Hg) до 3410 о С (вольфрам W). Температура плавления большинства металлов высока, однако некоторые металлы, например, олово Sn и свинец Pl, можно расплавить на электрической плите.
Физические свойства металлов и в настоящее время широко используются в промышленности и электронике.
В технике все металлы делятся на черные, к ним относятся железо и его сплавы, и цветные.
Изделия из различных видов металлов используются повсеместно благодаря их пластичности, но чаще всего в сплавах.
К драгоценным металлам относят золото, серебро, платину и некоторые другие редко встречающиеся металлы.

-82%
Общие сведения. Металлами называют вещества, обладающие своеобразным металлическим блеском, пластичностью, высокой прочностью
Металлами называют вещества, обладающие своеобразным металлическим блеском, пластичностью, высокой прочностью, электро- и теплопроводностью, ковкостью и свариваемостью, что обусловлено особой природой металлической связи. У металлов своеобразные не только физические, но и химические свойства: способность к окислению и восстановлению в реакциях.
Большинство химических элементов (82 из 109- 75%) относится к металлам.
Свойства сплавов обычно резко отличаются от свойств исходных металлов и их можно регулировать.
Содержание химических элементов в земной коре колеблется в больших пределах. Наиболее распространенными и ценными являются:
Содержание остальных металлов составляет около 2%. Ряд металлов (цинк, олово, свинец, кобальт, вольфрам, молибден, ванадий) содержатся в тысячных долях процента, но имеют большое значение для получения высококачественных сплавов.
Характерная особенность строения металлов – наличие металлической связи между атомами. Атомы металлов на внешней оболочке содержат небольшое количество слабосвязанных электронов. Электронные облака атомов перекрываются, поэтому внешние электроны могут свободно перемещаться и являются как бы общими, не связанными с отдельными атомами. Таким образом, общие электроны образуют электронный газ, который свободно перемещается между ионами и скрепляет их друг с другом. Эта особенность определяет стремление атомов металла располагаться как можно плотнее. Компактная упаковка атомов приводит к повышенной плотности металлов.
Металлы и сплавы в твердом состоянии имеют кристаллическое строение, которое характеризуется определенным, закономерным расположением атомов. Атомы в кристалле металла образуют пространственно кристаллическую решетку, состоящую из многократно повторяющихся ячеек, имеющих относительно простую форму.
В промышленных металлах наиболее распространены следующие кристаллические решетки (рис. 1): кубическая объемно-центрированная, кубическая гранецентрированная и гексагональная. В элементарной кубической объемно-центрированной решетке находится девять атомов (восемь в вершинах куба и один в центре).
Такую решетку имеют: железо при температуре до 910 °С и выше 1390 °С, хром, вольфрам, ванадий и др. В кубической гранецентрированной решетке 14 атомов (восемь в вершинах куба и по одному в центре каждой грани). Такую решетку имеют: железо при температуре 910-1390 °С, медь, никель, алюминий и др. В гексагональной решетке,имеющей форму шестигранной призмы, 17 атомов (12 в вершинах, два в центре оснований и три внутри призмы). Данная решетка имеется у магния, цинка и других металлов.
Возможны и другие формы кристаллических решеток. Атомы в решетке находятся на определенных расстояниях один от другого. Эти расстояния очень малы и вычисляются в нанометрах (1 нм = 10" м). Расположение атомов, межатомные расстояния, насыщенность атомами - все это влияет на качество металлов.
Размеры кристаллической решетки характеризуются параметрами (периодами) — расстояниями между центрами атомов, расположенных в узлах элементарной ячейки. Например, для железа эти параметры равны 28,4-36,3 нм.
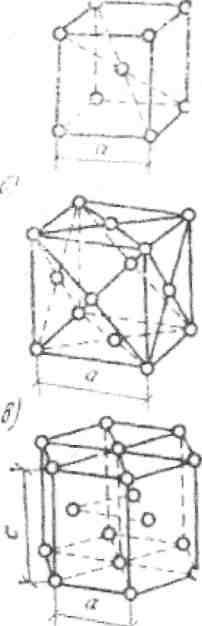 |
Рис. 1. Основные виды элементарных ячеек кристаллических решеток металлов а - объемно-центрированная кубическая; б - гранецентрированная кубическая; в – гексагональная плотноупакованная
При этом плотность и степень упаковки атомов кристаллической решетки характеризуется отношением бесчисленного множества кристаллических образований, группирующихся в виде отдельных прочно связанных между собой зерен. Большинство их имеет кубическую объемно-центрированную (хром, ванадий, молибден, вольфрам и некоторые другие) и кубическую гранецентриро-ванную решетки (алюминий, медь, никель, свинец, золото и серебро). Железо может быть в нескольких кристаллических формах с различным расположе-нием атомов. Это явление называется аллотропией.Аллотропические превращения железа наблюдаются при изменении температуры. Железо из расплавленной массы кристаллизуется в форме решетки объемно центрированного куба (рис. 1, 1) - δ – модификация железа; при охлаждении до температуры 1390 °С она перекристаллизовывается в решетку гранецентрированного куба (рис. 1, 2) - γ - модификация железа, а при 898 °С снова образует решетку объемно центрированного куба β и α-модификации. Аллотропия железа имеет большое значение в процессах горячей механической и термической обработки чугуна и стали. Главную роль при этом играют α- и γ-модификации железа. Регулируя закалкой , отжигом и другими способами содержание этих модификаций в сталях, придают им заданные механические свойства.
Кристаллическая природа металлов обуславливает анизотропию их свойств, т.е. различие свойств металлов в зависимости от направления кристаллографических осей, образующих кристаллы металлов.
Процесс перегруппировки атомов в кристаллографической решетке происходит в твердом состоянии металла подобно процессу затвердевания жидкого сплава при определенных- температурах и сопровождается тепловым эффектом. Этот процесс образования новых кристаллов из кристаллов прежней модификации называется вторичной кристаллизацией.
Металлические сплавы, представляющие собой поликристаллические тела, в которых кристаллиты (кристаллические образования, которые при правильном внутреннем строении не сохранили в процессе роста правильную форму кристалла вследствие помех соседних кристаллов) различно ориентированы один относительного другого, обладают мнимой изотропностью (квазии-зотропны). Однако в результате технологической обработки сплава (прокатки, волочения, ковки и т.д.) происходит ориентировка кристаллов по направлению обработки, и металл становится анизотропным. Некоторые механические свойства металлических сплавов при технологической и термической обработках повышаются в направлении главных кристаллографических осей. Этим частопользуются при изготовлении некоторых деталей машин и металлических строительных изделий.
Процесс кристаллизации металлических сплавов начинается при охлаждении жидкого сплава и продолжается у многих сплавов до определенных температур в отвердевшем состоянии в виде перекристаллизации. На размер и форму образующихся кристаллов влияет скорость охлаждения жидкого сплава: при медленном охлаждении образуются крупные зерна, а при быстром - металлический сплав приобретает мелкозернистое строение.
В настоящее время измельчение зерна металла достигается не только за счет увеличения скорости охлаждения, но и за счет введения различных присадок, увеличивающих число центров кристаллизации при V=const и создающих условия для замедленного роста кристаллов. Этот метод измельчения зерна называется модифицированиеми применяется при выплавке специальных чугунов, сталей и некоторых цветных металлов.
Основными способами модифицирования структуры и свойств стали применяемыми в современной металлургии, являются:
- введением в расплавленный металл веществ образующих тугоплавкие соединения, являющиеся центрами кристаллизации (Ti, Al, Si, Mn);
- введение лигирующих элементов, повышающих прочность кристаллических решоток феррита и ацетенита, замедляющих диффузионные процессы выделения углерода, карбидов и движение дислокаций;
- термическая и пормомеханическая обработка.
При затвердевании металлических слитков, болванок, заготовок образуются различные по крупности кристаллы: более мелкие у наружной поверхности, а более крупные внутри слитка. Кроме того, кристаллы ориентированны различно: внутри слитка они имеют более правильные формы, чем в наружных слоях, а чаще всего приобретают разветвленную древовидную форму. Такие скопления кристаллов в слитках называются дендритами.Возможно также образование кристаллов пластинчатой, игольчатой и других форм.
Затвердевание слитка по всему объему происходит не одновременно, поэтому и строение слитка неоднородно. В верхней части, у поверхности слитка, затвердевающего в первую очередь, образуются усадочные раковины, окруженные макро и микропорами.
При ускоренном охлаждении сплава внутри отливки могут образоваться полости - газовые пузыри - за счет газов, не успевших удалиться из металлов.
Подобная неоднородность отливок может привести к снижению их механических свойств.
Соответствующей механической обработкой отливки (давлением, прокаткой) с последующей термической обработкой можно придать волокнистое строение в направлении обработки и уменьшить размер зерен, что улучшает его механические свойства. В жидком состоянии большинство сплавов представляет собой однородный жидкий раствор. При переходе в твердое состояние однородность многих сплавов сохраняется за счет внедрения или замещения атомов в кристаллографической решетке растворителя атомами других более легких элементов.
Структура реальных сплавов в значительной степени отличается от идеального строения кристаллов. В реальном металле всегда имеются нарушения макро- и микроскопического характера (поры, газовые и неметаллические включения, микротрещины и пр.), а также дефекты кристаллического строения, связанные с нарушением правильного расположения атомов в самой кристаллической решетке. Все эти виды нарушений заметно влияют на свойства, причем наиболее велика роль несовершенства кристаллического строения, так называемых дислокаций. Из-за присутствия в металле дислокаций теоретическая прочность не реализуется. Прочность реальных кристаллов обычно составляет не более 1-5% от теоретической, рассчитанной по силам связи между атомами. В конструкции же, когда на эксплуатационные характеристики металла оказывают такие факторы, как наличие надрезов, напряженное состояние, температурные условия эксплуатации, агрессивность окружающей среды, используется только от 40 до 80% прочности исходного металла.
Член – корреспондент АНСССР И. А. Одинг еще в конце 40х годов прошлого столетия, сформулировал основные закономерности изменения прочности кристаллических тел в зависимости от от плотности дислокаций, благодаря им получили интенсивное развитие:
1. получение металлов с кристаллическим строением близким к совершенству (создание бездислакационных кристаллов с прочностью приближающейся к теоретической), и разработка на этой основе высокопрочных композиционных материалов;
2. создание в уже имеющихся материалах повышенной или высокой плотности дислокаций, что при условии равномерного или периодического распределения в объеме металла позволяет в несколько раз повысить его прочность;
Во втором пути повышения прочности металлов используются два основных метода:
- пластическая деформация (механическая энергия) для достижения необходимой плотности дислокаций;
- термическое воздействие (тепловая энергия).
Наиболее эффективно повышает прочность комбинация этих двух способов с названием термомеханическая обработка (ТМО).
Влияние структурных составляющих на свойства железоуглеродистых сплавов
Основными структурными составляющими железоуглеродистых сплавов является графит, феррит, цементит, аустенит, ледебурит и перлит, обладающие различными свойствами; поэтому количественное содержание их сильно влияет на свойства железоуглеродистых сплавов.
Графит- мягок, его истинная плотность 2,25 г/см 3 , он нарушает сплошность металла, понижая сопротивление растяжению и вязкость, увеличивает хрупкость тем больше, чем крупнее его частицы. Графит характеризует микроструктуру литейных чугунов.
Феррит- твердый раствор углерода в aFe, мягкий, вязкий, хорошо куется и сваривается. Чем больше в металле феррита, тем металл мягче, более ковок и тем больше дает удлинение при растяжении.
Цементит- карбид железа Fe3C. С увеличением его содержания сначала возрастают твердость и прочность металла (наибольший предел прочности при растяжении - при содержании углерода 1,2%); с дальнейшим увеличением количества цементита сопротивление падает, вязкость уменьшается, а твердость и хрупкость возрастает.
Аустенит- твердый раствор углерода в γ Fе; содержит до 2% углерода. В обыкновенных сталях аустенит устойчив только при температуре выше 723°С В легированных сталях, содержащих в своем составе некоторое количество Мп, Cr, Ni и других элементов, аустенит может быть устойчивым и при обычной, и даже низкой температуре. Механические свойства аустенита зависят от содержания в нем углерода. С уменьшением количества углерода аустенит становится более мягким и вязким; с увеличением - более твердым и хрупким.
Ледебурит- эвтетика (цементит + аустенит), очень тверд и хрупок, присутствует в белых чугунах. Образуется при температуре 1130 °С и содержит углерода С=4,3% - эвтектический чугун.
Перлит- эвтектоид (феррит + цементит), обладает сравнительно высокой прочностью, достаточно вязок, имеет зернистое или пластинчатоестроение. Образуется в процессе распада аустенита при температуре 723°C и содержанием углерода 00,83%, примеси Si, Мпспособствуют образованию перлита и при меньшем содержании углерода.
Металлы

Без рубрики
Общая характеристика металлов
Как известно, все химические элементы и образуемые ими простые вещества делятся на металлы и неметаллы.
Так как в периодах и группах периодической системы Д.И.Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определенно указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от бора к астату, то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от нее элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы, расположенные вблизи диагонали (например, Al, Ti, Ga, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы, а в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме Н и Не), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди р-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.

Самородки золота
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия, олова, свинца на внешнем электронном слое имеют четыре электрона, атомы сурьмы, висмута – пять, атомы полония – шесть. Атомы металлов имеют меньший заряд ядра и больший радиус по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твердыми кристаллическими веществами (кроме ртути). Кристаллическая решетка металлов образуется за счет металлической связи. Имеющиеся между узлами кристаллической решетки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Физические свойства металлов
- Все металлы – твердые вещества (кроме ртути).
- Для всех металлов характерны металлический блеск и непрозрачность.
- Все металлы – проводники теплоты и электрического тока. Металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью.
- Важными свойствами металлов являются их пластичность, упругость, прочность. Они способны под давлением изменять свою форму, не разрушаясь.
По степени твердости металлы значительно отличаются друг от друга. Так, калий, натрий – мягкие металлы (их можно резать ножом); хром – самый твердый металл (царапает стекло).
Температуры плавления и плотности металлов также изменяются в широких пределах. Самый легкоплавкий металл – ртуть (tпл.= — 39 ̊ С), самый тугоплавкий – вольфрам (tпл.= 3380 ̊ С). Плотность лития – 0,59 г/см 3 , осмия – 22,48 г/см 3 .
Металлы отличаются своим отношением к магнитным полям и делятся на три группы:
— ферромагнитные металлы способны намагничиваться под действием слабых магнитных полей (железо, кобальт, никель, гадолиний);
— парамагнитные металлы проявляют слабую способность к намагничиванию (алюминий, хром, титан, почти все лантаноиды);
— диамагнитные металлы не притягиваются к магниту, даже слегка отталкиваются от него (олово, медь, висмут).
Химические свойства металлов
Атомы металлов не могут присоединять электроны. Поэтому они во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов неодинакова. В периодах слева направо восстановительная активность металлов уменьшается; в главных подгруппах сверху вниз – увеличивается.
- Взаимодействие с простыми веществами – неметаллами:
а) с галогенами металлы образуют соли – галогениды, например:
б) с кислородом металлы образуют оксиды, например:
Горение железа в кислороде
в) с серой металлы образуют соли – сульфиды, например:
г) с водородом самые активные металлы образуют гидриды, например:
д) с углеродом многие металлы образуют карбиды, например:
- Взаимодействие со сложными веществами:
а) металлы, находящиеся в начале ряда напряжений (от Li до Na), при обычных условиях вытесняют водород из воды и образуют щелочи, например:
б) металлы, расположенные в ряду напряжений до водорода, взаимодействуют с разбавленными кислотами (HCl, H2SO4 и др.), в результате чего образуются соли и выделяется водород, например:
в) металлы взаимодействуют с растворами солей менее активных металлов, в результате чего образуется соль более активного металла, а менее активный металл выделяется в свободном виде, например:
Общие способы получения металлов
Большинство металлов встречаются в природе в виде различных соединений (оксиды, сульфиды, сульфаты, хлориды, карбонаты и др.). Только наименее активные металлы встречаются в природе в свободном виде (самородные металлы) – золото, серебро, платина и др.
Получение металлов из их соединений – это задача металлургии.
Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате которого получаются металлы в свободном виде.
В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию.
Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей: углерода, оксида углерода (II), водорода, металлов (алюминия, магния) и др.
Гидрометаллургия – это получение металлов, которое состоит из двух процессов: 1) природное соединение металла (обычно оксид) растворяется в кислоте, в результате чего получается раствор соли металла; 2) из полученного раствора данный металл вытесняется более активным металлом.
Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя в данном процессе играет электрический ток.
Сплавы
Металлы в чистом виде применяют реже, чем их сплавы. Это объясняется тем, что сплавы часто обладают более высокими техническими свойствами, чем чистые металлы. Изготовление сплавов основано на свойстве металлов в расплавленном состоянии взаимно растворяться и смешиваться друг с другом.
По своему составу и строению сплавы бывают различными. Важнейшими из них являются:
- Механическая смесь металлов. Охлажденный расплав представляет собой смесь очень мелких кристаллов отдельных металлов (например, Pb + Sb)
- Твердые растворы. При охлаждении расплава образуются однородные кристаллы. В узлах их кристаллических решеток находятся атомы различных металлов (например, Cu + Ni).
- Интерметаллические соединения. При взаимном растворении металлов их атомы реагируют между собой, образуя химические соединения. В таких соединениях металлы чаще всего не проявляют валентность, характерную для них в соединениях с неметаллами (например, Cu3Zn, Zn3Mg, Ag2Zn5).
В состав сплавов могут входить и неметаллы (углерод, бор и др.)

Бронза
Способность металлов в расплавленном виде не только механически смешиваться, но и образовывать между собой (и атомами неметаллов) различные соединения – одна из главных причин, объясняющая, почему сплавы по физическим свойствам сильно отличаются от свойств составляющих их металлов. Сплав полученный из монокарбида вольфрама и кобальта – «победит» — по твердости сравним с алмазом. В настоящее время в технике применяют большое число различных сплавов, обладающих заранее заданными свойствами. Для их получения используют более 40 химических элементов в разнообразных сочетаниях и количественных соотношениях.
Некоторые широко используемые сплавы
Сталь – сплав железа и углерода, добавки: Mn, Cr, Ni, Si, P, S.
Бронза – сплав меди с оловом, добавки: Zn, Pb, Al, Mn, P, Si.
Латунь – сплав меди с цинком, добавки: Sn, Mn, Al, Pb, Si.
Мельхиор – сплав меди с никелем.
Дюралюминий – сплав алюминия с медью (3-5%), марганцем (1%), магнием (1%).
Читайте также:
