Металлы отдают или принимают электроны
Обновлено: 04.10.2024
Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ - 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Усиление металлических и неметаллических свойств в таблице. Как изменяются свойства химических элементов
С увеличением числа элементарных элементов электроны имеют тенденцию к увеличению, а в подгруппах — к уменьшению. Самые низкие значения электроотрицательности характерны для первого элемента в первой группе, а самые высокие — для элемента P в седьмой группе.
Периодичность свойств элементов
Все характеристики элементов, определяемые электронной оболочкой индивидуума, закономерно изменяются в циклах и группах циклических систем. Однако, поскольку многие элементы сходных электронных структур не идентичны и сходны только при переходе от одного элемента к другому элементу подгруппы, то не происходит простого повторения свойств, а происходят более или менее интенсивные периодические изменения свойств элемента.
Химические свойства элемента определяются его способностью отдавать или добавлять электроны. Количественно это определяется энергией ионизации, сродством к электрону и электронами и зависит от радиуса индивидуума.
Атомные и ионные радиусы
Вследствие волнообразного характера движения электронов невозможно измерить абсолютный размер индивида, так как не существует его определенного предела.
Концепция орбитальных лучей недавно была расширена. Радиус орбиты — это самое удаленное от ядра расстояние наибольшего распределения электронной плотности. Таким образом, человек в базовом состоянии может иметь только лоток торговца и лоток стимулированного состояния — многие значения rПули.. На практике мы имеем дело с лучами людей, связанных определенной химической связью. Этот радиус рассматривается как фактический радиус индивида, т.е. как выявленный в результате действия. Фактический луч определяется при изучении молекулярных и кристаллических структур.
По этой причине значения атомных лучей, приведенные в различных справочниках, иногда могут значительно отличаться. Однако, несмотря на различия в значениях отдельных лучей одного и того же элемента, общая закономерность сохраняется. Это отражает зависимость атомных лучей от ядерной загрузки Z с периодическими свойствами.
Зависимость орбитальных лучей элемента r (1 Å = 10-10 м) от числа Z:.
В этот же период наблюдается тенденция к уменьшению размеров особей по мере увеличения Z. Это объясняется притяжением электронов внешнего слоя к увеличению в ядре при увеличении нагрузки.
За последний период атомное излучение увеличилось, поскольку строительство новых энергетических уровней начинается дальше ядра. В результате, в пределах первичных подгрупп размер особей увеличивается с ростом ядерной нагрузки. Во вторичных подгруппах, особенно в четверговой и шестой переходных подгруппах d-металлов, размер особей изменяется в меньшей степени. Отдельные лучи почти не отличаются друг от друга. Это можно объяснить тем, что увеличение количества лучей относительно увеличения количества квантовых уровней при переходе от четвергового к шестому периоду компенсируется сокращением количества лантанидов (57ла до71Lu), вызванное заполнением уровня 4F. По этой причине элементы D пятого и шестого периодов имеют особенно схожие характеристики. Так, в подгруппе IIIB (TI-ZR-HF) последние два элемента имеют одинаковые лучи (0,145 нм) и поэтому похожи друг на друга по природным и химическим свойствам, существенно отличаясь от Титана, радиус которого составляет 0,132 нм.
Потеря атомом электронов приводит к уменьшению его фактического размера, а добавление избыточного количества электронов — к увеличению. Таким образом, радиус положительно заряженных ионов (катионов) всегда меньше, а радиус отрицательно заряженных ионов (анионов) всегда больше, чем радиус соответствующих электрически нейтральных атомов. Так, радиус атома калия составляет 0,236 нм, радиус иона калия K+ — 0,133 нм, радиус атома хлора и иона хлора SD — 0,099 нм и 0,181 нм соответственно.
Таким образом, радиус иона отличается от радиуса электрически нейтрального атома в той степени, в которой ион имеет больший заряд. Например, атомные радиусы хрома и ионов Cr2+ и Cr3+ составляют 0,127, 0,083 и 0,064 нм соответственно.
Внутри подгрупп лучи ионов с одинаковым зарядом увеличиваются с ростом заряда ядра. Эта закономерность объясняется увеличением числа электронных слоев и расстояния внешних электронов от ядра.
Энергия ионизации
Поскольку удаление электронов из невозбужденного атома и преобразование их в положительно заряженные ионы всегда является внутренним процессом (т.е. путем поглощения энергии), то для того, чтобы это произошло, необходимо выполнить какое-то действие.
Минимальная энергия, необходимая для отрыва электрона от невозбужденного атома, называется энергией ионизации I
где E и E + обозначают соответственно нейтральный атом и положительно заряженный ион (катион) элемента, I — энергия ионизации, ē — электрон.
Энергия ионизации измеряется в кДж/моль или эВ/атом. 1 эВ (электронвольт) — это энергия, получаемая электроном в ускоряющем электрическом поле с разностью потенциалов 1 В (1 эВ = 1,6-10-19 Дж) при пересчете на 1 моль, что составляет 96,5 кДж/моль. Энергия ионизации может быть определена путем столкновения электронов, ускоренных в электрическом поле, с атомом.
Один, два или более электронов могут быть отсоединены от человека с большим количеством электронов. Отсоединение каждого электрона соответствует определенному значению энергии ионизации i1, i2, …, In так что это всегда я.1 2
Пример № 2. титан.
Периодическое изменение свойств элементов и их соединений (наглядно)
Деление элементов на металлы и неметаллы.
Нет четких ограничений. Некоторые элементы обладают свойствами перехода.
(c) Используются отрывки из учебников: «Химия» / Н.Е.-Москва, Эксмор (ЕГЭ. Экспресс-подготовка)» и «Химия: новый полный справочник для подготовки к ЕГЭ/Е.В.». Савинкина. -Москва, Издательство АСТ.
Рассматривали ли вы «Законы изменения свойств элементов и их соотношение по периодам и группам»? Выберите дальнейшие действия.
Преподавая химию, Менделеев обнаружил, что его ученикам трудно запомнить индивидуальные свойства каждого элемента. Он начал искать способы создания систематического способа облегчения запоминания свойств данных. В результате появились физические таблицы, которые позже были переименованы в периодические таблицы.
Фактчек
- Таблица Менделеева состоит из «столбцов», т.е. групп и «строк», т.е. периодов;
- Металлические свойства связаны со способностью отдавать электроны;
- Радиус атома увеличивается при увеличении числа электронных оболочек;
- Высшая валентность для большинства элементов равна номеру группы.
Задача 1.Какова максимальная прочность алюминия?
(Задание 2: Какое соединение водорода обладает наивысшими основными свойствами какого элемента?
(Задание 3: Из перечисленных элементов металлами являются
Задание 4: Какие элементы обладают наивысшими основными свойствами гидроксидов?
Металлы
В периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определённо указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от элемента бора B (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от неё элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы расположенные вблизи диагонали (например, Al, Ti, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме H и He), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов третьего периода:
Элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон).
Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099.
Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7.
Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0.
Любой гидроксид содержит гидроксидные группы – OH.
а. Радиус атомов уменьшается;
б. Заряд ядра увеличивается;
в. Электроотрицательность увеличивается;
г. Число электронов на внешнем слое увеличивается;
д. Прочность связи внешних электронов с ядром увеличивается;
е. Способность атомов отдавать электроны уменьшается.
Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы.
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Pb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi – пять, атомы полония Po – шесть. Атомы металла имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Потому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твёрдыми веществами (кроме ртути). Кристаллическая решётка металлов образуется за счёт металлической связи. Имеющиеся между узлами кристаллической решётки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
Атомы металлов более или менее легко отдают электроны, то есть окисляются.
Энергия, которая необходима для отрыва электрона от атома и превращение его в положительно заряженный ион, называется энергией ионизации. Металлы характеризуются небольшими величинами энергий ионизации.
Атомы металлов не могут присоединять электроны. Поэтому металлы во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов не одинакова. В периодах слева направо восстановительная активность уменьшается; в главных подгруппах сверху вниз – увеличивается. Восстановительная активность металлов в химических реакциях, которые протекают в водных растворах различных веществ, характеризуется положением металлов в электрохимическом ряду напряжений металлов.
Металлы являются восстановителями и вступают в химические реакции с различными окислителями.
2. Альдегиды
Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу).
Металлическая связь
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
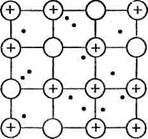
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.

Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).

Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.

Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
Читайте также:
