Металлы побочных подгрупп 11 класс
Обновлено: 02.05.2024
· У атомов некоторых d -элементов происходит провал одного из s -электронов на d -орбиталь предвнешнего уровня и на внешнем энергетическом уровне остается один электрон.
+29 С u 2ē,8ē,18ē,1ē; 1s 2 2s 2 2 р 6 3s 2 3 р 6 3d 10 4s 1
должно быть по правилу
(это происходит в том случае, если до завершения d -подуровня недостает одного электрона, т.к полузаполненные и заполненные d -орбитали более устойчивы)
· В побочных подгруппах с увеличением заряда ядра атома химическая активность, как правило, уменьшается: Cu активнее Ag и активнее Au .
· Многие металлы побочных подгрупп имеют переменные степени окисления (с.о)
Наиболее характерны: 0 +2 +3 +6
При увеличении с.о. атома металла побочной подгруппы основные свойства оксидов и гидроксидов ослабляются, а кислотные усиливаются.
Марганец и его соединения
Светло-серый металл, более твердый и хрупкий по сравнению с железом.
Соединения с высшей степенью окисления являются сильными окислителями. Характер восстановления зависит от среды:
Mn 2+ (М nSO 4 )- бесцветный (розоватый)
Хром и его соединения:
Хром - серовато-белый тугоплавкий металл, устойчив на воздухе, имеет плотную защитную пленку Cr 2 O 3.
Слабыми окислителями окисляется до Cr +2 ( Cr + 2 HCl = CrCl 2 + H 2 ↑)
Сильными окислителями до Cr +3 (4 Cr + 3 O 2 =2 Cr 2 O 3 ; 2 Cr + 3 Cl 2 = 2 Cr Cl 3 )
Соединения Cr +2 имеют основной характер ( CrO → Cr ( OH )2)
Соединения Cr +3 имеют амфотерный характер ( Cr 2 O 3 → Cr ( OH )3; HCrO 2- хромистая)
Соединения Cr +6 имеют кислотный характер ( CrO 3 → H 2 CrO 4 -хромовая; H 2 Cr 2 O 7 - дихромовая). Соли: хроматы- Na 2 CrO 4 (желтые) и дихроматы - Na 2 Cr 2 O 7 (оранжевые)
В зависимости от среды соединения хрома могут взаимопревращаться:
кислая среда Cr +6 ( Cr 2 O 7 2- ; H 2 Cr 2 O 7 ) - оранжевый
Cr ( OH )3 щелочная среда Cr +6 ( CrO 4 2 - ; H 2 CrO 4 )- желтый
Свойства металлов побочных подгрупп
Металл, строение физические свойства
Химические свойства
Простые вещества
Оксиды и гидроксиды
Цинк +30 Zn 2ē,8ē,18ē,2ē;
1 s 2 2 s 2 2р 6 3 s 2 3р 6 3 d 10 4 s 2
белый с голубоватым оттенком металл, хрупок, хорошо прокатывается.
Соединения цинка в природе:
ZnS - цинковая обманка
ZnCO 3 - цинковый шпат
2Zn + O2 = 2ZnO ( t 0 )
Zn + Н 2 О = ZnO + Н 2 ↑ ( t 0 )
Имеют двойственную природу – амфотерны.
Проявляют кислотные и основные свойства.
· ZnO +2 HCl = ZnCl 2 + Н2О – основные свойства
- кислотные свойства оксидов:
Zn О + 2 NaOH = Na 2 ZnO 2 + Н2 O (сплав)
· Zn ( OH )2 +2 HCl = ZnCl 2 +2Н2О - основные св-ва
- кислотные свойства гидроксидов
ZnS – входит в состав минеральной краски липтона, под действием ультрафиолетовых и радиоактивных лучей светится, применяется для покрытия мостов и деталей.
ZnCl 2 – применяются в медицине, в пастах- как прижигающее средство, в растворах как вяжущее и дезинфицирующее средство
- ZnSO 4 входит в состав глазных капель как противовоспалительное средство.
c .о.= 0, +2, +3, +6, +8
серебристо-белый, мягкий, ковкий, электро-теплопро-воден, намагничивается.
Железные руды:
Fe 3 O 4 –магнитный железняк, магнетит
Fe 2 O 3 – красный железняк (гематит)
Fe 2 O 3 •Н2О – бурый железняк (лимонит)
FeS 2 – железный (серный) колчедан, пирит
FeCO3- железный шпат.
Fe +2- со слабыми окислителями:
-2 ē ( Н + ( HCl ); Cu 2+ ( CuCl 2 ); S )
Fe 0 Fe + 2HCl = FeCl2+ Н 2 ↑
-3 ē Fe +3 c сильными окислителями:
- c неметаллами : Fe + S = FeS ( t 0 )
-с водой: 4 Fe +6Н2О +3 O 2 =4 Fe ( OH )3 (о.у)
-пассивируется при о.у. концентрирован-ными HNO 3 и H 2 SO 4 , но при t 0 :
-c солями : Fe + CuSO4 = FeSO4 + Cu↓
· FeO –, черный порошок (с.о.+2), амфотерен, преобладают основные свойства:
FeO + 4 NaOH = Na 4 FeO 3 + 2Н2О ( t 0 )
Fe ( OH )2 – белое вещество, на воздухе окисляется (зеленеет, буреет) амфотерен, основные свойства преобладают,
· Fe 2 O 3 - амфотерный гидроксид, бурый порошок (с.о.+3)
Fe ( OH )3- амфотерен.
Fe +2 + 2ОН - = Fe ( OH )2 ↓ (зеленый)
2. Красная кровяная соль K 3 [ Fe ( CN )6]
Fe +3 + 3ОН - = Fe ( OH )3↓ (бурый)
2. Желтая кровяная соль K 4 [ Fe ( CN )6]
4.Роданид калия – К SCN (тиоцианат – К NCS )
Fe 3+ + SCN ‾ = Fe ( SCN )3 – кроваво-красный роданид железа ( III )
FeCl 3 •6 H 2 O дезинфицирующее и крово-останавливающее средство
Медь – металл красно-желтого цвета, мягкий, пластичный, по электро-проводности уступает только серебру.
CuFeS 2 – халькопирит
С u2S – халькозин, медный блеск.
Взаимодействует только при повышенной температуре:
-с простыми веществами:
Cu + S = CuS ( t 0 )
- c конц. серной; разб и конц. азотной кислотами:
· С u2O – темно-красные кристаллы
· С uO – коричнево-черный.
· Cu ( OH )2 - ярко-голубые кристаллы или аморфный (осажденный из водного раствора). A мфотерен (реагирует с разб. кислотами и конц. щелочами), с преобладанием основных свойств.
Является окислителем альдегидной группы:
2 CuOH = Н2О + С u 2 O -(красн.) желтый
CuSO 4 • 5Н2О - медный купорос используют для борьбы с вредителями и болезнями растений. Это вяжущее и антисептическое средство, используется в глазной практике при конъюнктивитах - (0,25% -ный раствор глазные капли), прижигания при трахоме в виде глазных карандашей (сплав сульфата меди, нитрата калия, квасцов и камфоры).
-5% раствор сульфата меди ( II ) употребляют при ожогах кожи фосфором
-0,25-0,5% растворы используют при лечении острых воспалительных заболеваниях кожи.
Задания по теме «Металлы побочных подгрупп»
А1 . Уравнению реакции Zn ( OH )2 + H 2 SO 4 = Zn SO 4 + 2 H 2 O
Соответствует сокращенное ионное уравнение:
A .2 В схеме превращений: ZnO → Х1 → Х2 → Zn ( OH )2
Веществами Х1 и Х2 соответственно являются
1) Zn ( OH )2 и ZnCl 2 2) Zn ( OH )2 и ZnSO 4 3) ZnCl 2 и ZnSO 4 4) ZnCl 2 и ZnO
A .3 Сокращенное ионное уравнение Fe 2+ + 2 OH - = Fe ( OH )2 соответствует взаимодействию веществ:
A .4 . Продуктами взаимодействия меди с концентрированной серной кислотой при нагревании являются:
А.5 . 2 В ряду превращений: CuO + X → CuCl 2 + У→ С u ( OH )2
Вещества Х и У соответственно :
1) Н Cl и NaOH 2) Н Cl и Fe ( OH )3 3) NaCl и Н2О 4) Cl 2 и Н2О
А.6. Высший гидроксид хрома
1. проявляет кислотные свойства 2. проявляет основные свойства
3. проявляет амфотерные свойства 4. не проявляет кислотно- основных свойств
А.7 . Оксид железа ( III )
1. не проявляет кислотно-основных свойств 2. проявляет кислотные свойства
3. проявляет основные свойства 4. проявляет амфотерные свойства
А.8. Верны ли следующие суждения о гидроксиде цинка?
А. Гидроксид цинка растворяется в серной кислоте
Б. Гидроксид цинка растворяется в щелочи натрия
1. верно только А 2. верно только Б 3. верны оба суждения 4. оба суждения неверны
А 9. Степень окисления хрома в веществах К2 Cr 2 O 7 , Cr 2 ( SO 4 )3 , Cr ( OH )2, Cr соответственно равна:
А.10 . Соединения меди ( I ) в окислительно-восстановительных реакциях
1. не проявляют ни окислительные, ни восстановительные свойства
2. проявляют только окислительные свойства
3. проявляют только восстановительные свойства
4. проявляют как окислительные, так и восстановительные свойства
A .11 При реакции железа с нагретой серной кислотой происходит реакция:
A .12 При восстановлении КMnO4 в сильнощелочной среде образуется: 1. Mn 3+ 2. Mn 2+ 3. MnO4 2- 4. MnO2
А .1 3 . В результате взаимодействий каких веществ образуется хлорид железа( III )
1) Fe и HCl 2) Fe и Cl 2 3) Fe О и HCl 4) Fe (ОН)2 и HCl
А. 14. В схеме превращений FeCl 3 → X 1 → X 2 → Fe ( OH )3 веществами X 1 и X 2 могут быть соответственно
А. 15. Верны ли следующие суждения о меди?
А. Для меди характерны степени окисления +1 и +2 Б. Медь вытесняет цинк из раствора сульфата цинка.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А. 16. При обычных условиях практически осуществима реакция между железом и
1) серой (кр.) 2) серной кислотой (конц.) 3) нитратом цинка (р-р) 4) нитратом меди ( II ) р-р
А.17. Взаимодействие перманганата калия с соляной кислотой описывается уравнением:
1. 2 KMnO 4 +8 HCl = KCl + MnCl 7 + 4Н2О
2. 2 KMnO 4 +16 HCl =2 KCl + 2 MnCl 2 + 5 Cl 2 ↑ +8Н2О
А. 18.Медь реагирует с каждым из двух веществ 1) Mg Cl 2 , O 2 2) NaOH , HCl 3) AgNO 3 , HNO 3 4) Cl 2 , H 2 O
А19. Верны ли следующие суждения о соединениях хрома?
А. Высшая степень окисления хрома +4 Б. Высший оксид хрома относится к основным оксидам
А.20 . Сульфат железа ( III ) в растворе взаимодействует 1) СО2 2) Н2СО3 4)КОН 5) NaBr
А.21 . В схеме превращений +КОН + H 2 SO 4
FeCl 2 → Х1 → Х2 конечным продуктом Х2 является:
1) сульфит железа ( II ) 2) сульфат железа ( II ) 3) сульфид железа ( III ) 4) сульфид железа ( II )
А.22 . В схеме превращений +КОН + H 2 SO 4
FeCl 3 → Х1 → Х2 конечным продуктом Х2 является:
1) сульфат железа ( III ) 2) сульфат железа ( II ) 3) сульфид железа ( III ) 4) сульфид железа ( II )
А.23 . Восстановление железа происходит в ходе реакции, уравнение которой:
В.1 . Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
В.2. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
В.3. Установите соответствие между реагентами и степенью окисления атома- восстановителя
Г ) CrCl3+ NaClO + NaOH →
В.4 Установите соответствие между формулой оксида металла и формулой соли, которую можно получить из этого оксида с помощью обменных реакций
В.5 . В стакан с 500г 3,4 % - ного раствора нитрата серебра поместили 32 г цинковых опилок. Сколько метал-лического осадка (г) будет в стакане после окончания реакции? Ответ дайте с точностью до целого числа. (36г)
В.6. Массовая доля воды в кристаллогидрате перманганата натрия равна 27,6%. Определите число n в формуле NaMnO 4 • n Н2О (3)
С.1 . Закончите уравнения окислительно- восстановительной реакции, составьте схему электронного баланса, расставьте коэффициенты : Zn + HNO 3 ( разб.) = NH 4 NO 3 + … +…
Укажите окислитель и восстановитель
C .2 . Составьте уравнение реакций, происходящих при растворении железа в сернокислом растворе дихромата калия. Приведите схему электронного (или электронно- ионного) баланса. Какая масса дихромата необходима для окисления 11,2 г железа?
С.3 . Составьте уравнения реакций (с указанием условий их протекания) соответствующие превращениям:
С.4 . Напишите уравнения реакций (с указанием условий их протекания) соответствующие превращениям:
Ответы на задания по теме «Металлы побочных подгрупп »
A .2 В схеме превращений: ZnO → Х1 → Х2 → Zn ( OH )2 Веществами Х1 и Х2 соответственно являются
2) Zn ( OH )2 и ZnCl 2 2) Zn ( OH )2 и ZnSO 4 3) ZnCl 2 и ZnSO 4 4) ZnCl 2 и ZnO
1) С uSO 4 + Н2 2) С uO + Н2 3) CuSO 4 + SO 2 + Н2О 4) CuS + Н2О
А.5 . 2 В ряду превращений: CuO + X → CuCl 2 + У→ С u ( OH )2 Вещества Х и У соответственно :
1) Н Cl и NaOH 2) Н Cl и Fe ( OH )3 3) NaCl и Н2О 4) Cl 2 и Н2О
1. проявляет кислотные свойства 2. проявляет основные свойства
3. проявляет основные свойства 4. проявляет амфотерные свойства
А.8 . Верны ли следующие суждения о гидроксиде цинка?
А.10. Соединения меди ( I ) в окислительно-восстановительных реакциях
4. проявляют как окислительные, так и восстановительные свойства
A .12 . При восстановлении КMnO4 в сильнощелочной среде образуется: 1. Mn 3+ 2. Mn 2+ 3. MnO4 2- 4. MnO2
А.13. В результате взаимодействий каких веществ образуется хлорид железа( III )
1. Fe и HCl 2. Fe и Cl 2 3 Fe О и HCl 4. Fe (ОН)2 и HCl
А. Для меди характерны степени окисления +1 и +2, Б. Медь вытесняет цинк из раствора сульфата цинка.
1) серой (кр.) 2) серной кислотой (конц.)
3) нитратом цинка (р-р) 4) нитратом меди ( II ) р-р
А.17 . Взаимодействие перманганата калия с соляной кислотой описывается уравнением:
2. 2 KMnO 4 +16 HCl =2 KCl + 2 MnCl 2 + 5 Cl 2 ↑ +8Н2О
А. 18.Медь реагирует с каждым из двух веществ 1) Mg Cl 2 , O 2 2) NaOH , HCl 3) AgNO 3 , HNO 3 4) Cl 2 , H 2 O
А. Высшая степень окисления хрома +4
Б. Высший оксид хрома относится к основным оксидам
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Металлы побочных подгрупп
презентация к уроку на тему
Подгруппа меди (медь, серебро, золото) Подгруппа цинка (цинк, кадмий, ртуть) Переходные металлы (хром, марганец, молибден, вольфрам и др.) Подгруппа железа (железо, кобальт, никель) Платиновая группа (рутений, родий, палладий, осмий, иридий, платина) Металлы побочных подгрупп
Особенностью является наличие заполненного предвнешнего d- подуровня, достигаемое за счёт перескока электрона с внешнего s-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Подгруппа меди. Cu, Ag Серебро Ag [ Kr ] 4d 10 5s 1 0, +1, +3 Медь Cu [Ar] 3d 10 4s 1 0, +1, +2
при 400–500°С : 2Cu + O 2 = 2CuO; при 1000°С : 4Cu + O 2 = 2Cu 2 O при 400°С : Cu + S = CuS ; при выше 400°С : 2Cu + S = Cu 2 S при нагревании с фтором, хлором, бромом образуются галогениды меди (II) Cu + Br 2 = CuBr 2 с йодом – образуеся йодид меди (I): 2Cu + I 2 = 2CuI Медь не реагирует с водородом, азотом, углеродом и кремнием В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди(II) ( CuOH )2CO3 Химические свойства меди
Растворяется в разбавленной азотной кислоте: 3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O Реагирует с концентрированными кислотами-окислителями: Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O; Cu + 4HNO 3 = Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O Медь растворяется в водном растворе аммиака в присутствии кислорода воздуха с образованием гидроксида тетраамминмеди (II): 2Cu + 8NH 3 + 2H 2 O + O 2 = 2[ Cu (NH 3 ) 4 ](OH) 2 . Медь окисляется оксидом азота ( IV) 2Cu + NO 2 = Cu 2 O + NO и хлоридом железа( III) Cu + 2FeCl 3 = CuCl 2 + 2FeCl 2 Химические свойства меди
Соли Cu2+ обычно окрашены в голубой или зеленоватый цвет. Образование нерастворимого гидроксида меди ( II ) голубого цвета: CuSO4+ 2NH4OH = Cu(OH)2 + (NH4)2SO4 Образование красно-бурого осадка гексациано феррата ( II ) меди Качественная реакция на Cu 2+ 2Cu 2+ + [Fe(CN) 6 ] 4− → Cu 2 [Fe(CN) 6 ]↓
При обычных условиях реагирует с серой, образуя сульфид серебра (I): 2Ag + S = Ag 2 S, при нагревании с галогенами образуются галогениды серебра (I): 2Ag + Br 2 = 2AgBr. Серебро не реагирует с кислородом, водородом, азотом, углеродом и кремнием. Растворяется в разбавленной азотной кислоте 3Ag + 4HNO 3 = 3AgNO 3 + NO + 2H 2 O Реагирует с концентрированными кислотами-окислителями: 2Ag + 2H 2 SO 4 = Ag 2 SO 4 + SO 2 + 2H 2 O; Ag +2HNO 3 = AgNO 3 + NO 2 + H 2 O. Химические свойства серебра
Образование белого творожистого осадка Ag+ + Cl - = AgCl ↓ , растворимого в гидрате аммиака AgCl + 2NH4OH = [Ag(NH3)2] Cl Образование красного осадка Ag+ + CrO4 - = AgCrO4↓ Образование желтого осадка Ag+ +PO4 3- = Ag3PO4 ↓ Образование белого-чернеющего осадка Ag+ + S2O3 2- = Ag2S2O3 ( разлагается) Качественная реакция на Ag +
Цинк [ Ar ] 3d 10 4s 2 хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Ртуть [ Xe ] 4f 14 5d 10 6s 2 один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии Подгруппа цинка. Zn , Hg
На воздухе покрывается оксидной пленкой, при сильном нагреве горит голубоватым пламенем 2Zn + O 2 = 2ZnO При н.у. Zn + Cl 2 = ZnCl 2 С парами воды при температуре красного каления Zn + H 2 O = ZnO + H 2 Вытесняет водород из разбавленых кислот Zn + 2HCl = ZnCl 2 + H 2 С разбавленной HNO3 4Zn + 10HNO 3 = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O С концентрированными кислотами-окислителями Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O; Zn + 4HNO 3 = Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O Химические свойства цинка
Типичный переходный элемент. Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O; Zn + 4HNO 3 = Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O Оксид цинка: ZnCO 3 = ZnO + CO 2 ZnO + 2HCl = ZnCl 2 + H 2 O; ZnO + 2NaOH + H 2 O = Na 2 [Zn(OH) 4 ]. Гидроксид цинка: ZnCl 2 + 2NaOH = Zn(OH) 2 + 2NaCl Zn(OH) 2 + H 2 SO 4 = ZnSO 4 + 2H 2 O; Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ] Zn(OH) 2 + 4NH 3 = [Zn(NH 3 ) 4 ](OH) 2 Химические свойства цинка
Образование нерастворимого основания Zn 2+ + 2OH - = Zn(OH)2↓ + 2OH- = [Zn(OH)4] 2- осадок белого цвета, растворимый в избытке щелочи Качественная реакция на Zn 2+
Эл. Конфигурация [ Ar ] 3d 5 4s 1 В свободном виде — голубовато-белый металл с кубической решеткой, один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке. Хром
Оксид хрома (2) - СrО – твердое ярко – красное вещество, типичный основной оксид (ему соответствует гидроксид хрома (2) - Сr (ОН) 2 ), не растворяется в воде, но растворяется в кислотах: СrО + 2НСl = СrСl 2 + Н 2 О окисляется на воздухе: 4СrО+ О 2 = 2Сr 2 О 3 Гидроксид хрома (2) - Сr (ОН) 2 – вещество желтого цвета, плохо растворимо в воде, с ярко выраженным основным характером, поэтому взаимодействует с кислотами: Сr (ОН) 2 + Н 2 SО 4 = СrSO 4 + 2Н 2 О Соединения хрома Cr 2+
Наиболее устойчивая с.о. хрома. Оксид хрома (3) - Сr 2 О 3 нерастворим в воде, тугоплавкий, по твёрдости близок к корунду, имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. С концентрированными растворами кислот и щелочей взаимодействует с трудом: Сr 2 О 3 + 6 КОН + 3Н 2 О = 2К 3 [ Сr (ОН) 6 ] Сr 2 О 3 + 6НСl = 2СrСl 3 + 3Н 2 О Гидроксид хрома (3) Сr (ОН) 3 получают: СrСl 3 +3КОН = Сr (ОН) 3 ↓ + 3КСl Легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства: Сr (ОН) 3 + 3НNО 3 = Сr (NО 3 ) 3 + 3Н 2 О Сr (ОН) 3 + 3КОН = К 3 [ Сr (ОН) 6 ] Соединения хрома Cr 3+
Оксид хрома (6) - СrО 3 – темно – красное кристаллическое вещество, хорошо растворимо в воде, типичный кислотный оксид. Этому оксиду соответствует две кислоты: СrО 3 + Н 2 О = Н 2 СrО 4 (хромовая кислота – образуется при избытке воды) СrО 3 + Н 2 О =Н 2 Сr 2 О 7 ( дихромовая кислота – образуется при большой концентрации оксида хрома (3)). Оксид хрома (6) – очень сильный окислитель Соединения хрома Cr 6 +
В кислой среде раствора хроматы переходят в дихроматы: 2К 2 СrО 4 + Н 2 SО 4 = К 2 Сr 2 О 7 + К 2 SО 4 + Н 2 О В щелочной среде дихроматы переходят в хроматы: К 2 Сr 2 О 7 + 2КОН = 2К 2 СrО 4 + Н 2 О Хромат и дихромат Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую. Хромат - ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
Окислительные свойства Cr 6+ Дихроматы – сильные окислители . Под действием восстановителей в кислой среде переходят в соли хрома (III) K 2 Cr 2 O 7 + 3Na 2 SO 3 + 4H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3Na 2 SO 4 + K 2 SO 4 + 4H 2 O Качественные реакции на хромат-ион BaCrO 4 PbCrO 4 Ag 2 CrO 4
Степени окисления и соединения Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: Получение марганца
Соли Mn 2+ MnCl2 MnSO4
Соединения Mn 4+
Соединения М n 7+
Кислая среда Нейтральная среда Щелочная среда Окислительные свойства перманганата, в зависимости от среды реакции
Урок по теме: «Металлы побочных подгрупп. Железо»
план-конспект урока по химии (11 класс) на тему
· Показать строение железа, его физические свойства, разнообразие химических свойств железа на примере задания С-2; рассмотреть качественные реакции на ионы Fe 2+ и Fe 3+ .
· Расширить и углубить знания, связанные с ролью железа в организме человека(проектная деятельность учащихся).
· Привить навыки самостоятельной работы, научить выражать свои мысли четко и грамотно; использовать знания, полученные при изучении других предметов: биологии, экологии, физики ( межпредметные связи).
| Вложение | Размер |
|---|---|
| otkrytyy_urok.docx | 44.11 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
«Металлы побочных подгрупп. Железо»
(11 класс, профильный уровень)
Учитель химии Гумецова Л.Ш.
- Показать строение железа, его физические свойства, разнообразие химических свойств железа на примере задания С-2; рассмотреть качественные реакции на ионы Fe 2+ и Fe 3+ .
- Расширить и углубить знания, связанные с ролью железа в организме человека(проектная деятельность учащихся).
- Привить навыки самостоятельной работы, научить выражать свои мысли четко и грамотно; использовать знания, полученные при изучении других предметов: биологии, экологии, физики ( межпредметные связи).
- Штативы с пробирками, спиртовки, спички, держатели.
- Реактивы: растворы FeCl 3 , KCNS, K 4 [Fe(CN) 6 ], HCl, CuSO 4 , HNO 3 , NaOH, яблочный сок.
Раздаточный материал: таблицы.
УРОК НАЧИНАЕТСЯ С РЕФЛЕКСИИ ЭМОЦИОНАЛЬНОГО СОСТОЯНИЯ И НАСТРОЕНИЯ.
Учитель: С каким настроением вы пришли на урок?
Ученики поднимают соответствующие смайлики. В конце урока учитель смотрит как изменилось эмоциональное состояние учащихся.
Учитель: Отсутствие какого металла описал академик А. Е. Ферсман?
«На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, ни паровозов, ни автомобилей не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без этого металла. Разрушение ураганом прошло бы по всей Земле, и гибель человечества сделалась бы неминуемой. Впрочем, человек не дожил бы до этого момента, ибо лишившись трех граммов этого металла в своем теле и в крови, он бы прекратил свое существование раньше, чем развернулись бы нарисованные события».
Учитель: Про какой металл писал А.Е. Ферсман?
Учитель: Итак тема урока: « Металлы побочных подгрупп. Железо.
Рассмотрим строение атома железа.
Ученики: Железо находится в четвертом периоде, 8 группе, побочной подгруппе . Fe +26) 2 ) 8 ) 14 ) 2
Учитель: Определите степень железа в следующих соединениях: FeO, Fe 2 O 3 , FeSO 4 , Fe 2 (SO 4 ) 3 , K 2 FeO 4 .
Рассмотрим задание А-4(cлайд)
Одинаковую степень окисления железо проявляет в соединениях:
2.Fe 2 O 3 и Fe(NO 3 ) 2
3.Fe(OH) 3 и FeCl 2
Учитель: Какие физические свойства характерны для железа?
Железо — типичный металл , в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен , различные примеси (в частности — углерод ) повышают его твёрдость и хрупкость . Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую « триаду железа » — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами , атомными радиусами и значениями электроотрицательности .
Для железа характерен полиморфизм , оно имеет четыре кристаллические модификации:
Химические свойства железа
В химическом отношении железо относится к металлам средней активности. В электрохимическом ряду напряжений металлов железо расположено левее водорода.
При нагревании на воздухе выше 200 °С железо взаимодействует с кислородом, образуя оксиды нестехиометрического состава Fe x O, мелкодисперсное железо сгорает с образованием смешанного оксида железа (II, III):
3Fe + 2O 2 = Fe 3 O 4 .
С галогенами железо реагирует, образуя галогениды :
2Fe + 3Cl 2 = 2FeCl 3 ,
При взаимодействии с азотом при невысокой температуре железо, кобальт и никель образуют нитриды различного состава, например:
4Fe + N 2 = 2Fe 2 N
Взаимодействие с серой экзотермично и начинается при слабом нагревании, в результате образуются нестехиометрические соединения, которые имеют состав, близкий к ЭS:
С водородом металлы триады железа не образуют стехиометрических соединений, но они поглощают водород в значительных количествах.
С углеродом, бором, кремнием, фосфором также при нагревании образуют соединения нестехиометрического состава, например
В воде в присутствии кислорода железо медленно окисляется кислородом воздуха (корродирует):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3 .
При температуре 700–900 °С раскаленное железо реагирует с водяным паром:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2 .
Кобальт и никель с водой не взаимодействуют.
Железо реагирует с разбавленными растворами соляной и серной кислот, образуя соли железа (II):
Fe + 2HCl = FeCl 2 + H 2 ,
Fe + H 2 SO 4 = FeSO 4 + H 2 ;
с разбавленной азотной кислотой образует нитрат железа (III) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты, например:
Fe + 4HNO 3 = Fe(NO 3 ) 3 + NO + 2H 2 O.
При обычных условиях концентрированные (до 70 мас. %) серная и азотная кислоты пассивируют железо. При нагревании возможно взаимодействие с образованием солей железа (III):
2Fe + 6H 2 SO 4 = Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O,
Fe + 6HNO 3 = Fe(NO 3 ) 3 + 3NO 2 + 3H 2 O.
Разбавленные растворы щелочей на металлы триады железа не действуют. Возможно только взаимодействие железа с щелочными расплавами сильных окислителей:
Fe + KClO 3 + 2KOH = K 2 FeO 4 + KCl + H 2
Железо, кобальт и никель вытесняют металлы, которые расположены правее в электрохимическом ряду напряжений их растворов солей:
Fe + SnCl 2 = FeCl 2 + S
На грани химии, биологии и медицины возникла новая научная область бионеорганическая химия. Бионеорганическая химия рассматривает роль металлов в возникновении и развитии различных процессов в здоровом и больном организме, создаёт новые эффективные препараты на основе металлоорганических соединений, активно участвует в борьбе за сохранение здоровья людей и продление человеческой жизни. Особенно чутко организм реагирует на изменение концентрации микроэлементов, т.е. элементов, присутствующих в организме в количестве меньше одного грамма на 70кг массы человеческого тела. К таким элементам относятся медь, цинк, марганец, кобальт, железо, никель, молибден.
Открывается слайд 3: «Содержание некоторых металлов в организме человека в %».
Литий – 0,0001
Натрий – 0,03
Калий – 0,025
Кальций – 0,4
Магний – 0,05
Железо – 0,001
Марганец – 0,000001
Алюминий – 0,001
Цинк – 0,001
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЖЕЛЕЗА
В организм человека железо поступает с пищей. Пищевые продукты животного происхождения содержат железо в наиболее легко усваиваемой форме. Некоторые растительные продукты также богаты железом, однако его усвоение организмом происходит тяжелее. Считается, что организм усваивает до 35% «животного» железа. В то же время другие источники сообщают, что этот показатель составляет менее 3% . Большое количество железа содержится в говядине, в говяжьей печени, рыбе (тунец), тыкве, устрицах, овсяной крупе, какао, горохе, листовой зелени, пивных дрожжах, инжире и изюме. При заметном дефиците железа в организме он может ликвидироваться приемом пищевых добавок, содержащих железо в хелатной (легкоусваиваемой) форме: глюконат железа, фумарат железа, цитрат железа и другие.
Усвоение железа снижается при чрезмерном потреблении чая и кофе, а также яиц. Чрезмерные дозы железа могут быть опасными для детей, больных наследственной анемией, поэтому железосодержащие добавки к пище могут быть использованы для детей только по назначению врача.
В организме взрослого человека содержится около 3-5 г железа; почти две трети этого количества входит в состав гемоглобина. Считается, что оптимальная интенсивность поступления железа составляет 10-20 мг/сутки. Дефицит железа может развиться, если поступление этого элемента в организм будет менее 1 мг/сутки. Порог токсичности железа для человека составляет 200 мг/сутки. Потребность в железе у женщин на 30-60 % больше, чем у мужчин вследствие его физиологических потерь. В течение месяца женщины теряют в 2 раза больше железа, чем мужчины. При беременности у женщин потребность в железе превышает обычную физиологическую. Потребность в железе особенно увеличена у будущей матери в последние три месяца беременности. Учитывая, что железо впрок не накапливается в организме, при недостаточном его поступлении с пищей (железо главным образом содержится в мясе) может возникнуть гипохромная микроцитарная анемия.
Всасывание железа в кишечнике зависит от потребности всего организме в этом элементе. У больных анемией всасывание железа происходит более эффективно, чем у здоровых людей. Это обусловлено тем, что переход железа из содержимого кишечника в плазму регулируется ферритином (комплексное образование соединений железа с белком апоферритином).
Недостаточность железа может развиться из-за его дефицита в пище (у грудных детей, содержащихся на искусственном вскармливании, при несвоевременном прикорме на фоне естественного вскармливания, так как с грудным молоком железо не поступает). Недостаточность железа возникает при наличии в диете больших количеств неорганического фосфора, с которым оно образует плохо растворимые соединения, либо при воспалительных процессах в кишечнике, которые сочетаются с нарушением ферритинового механизма.
Избыточное поступление в организм трехвалентного железа приводит в депонированию железа в плазме крови и тканях (гемосидерозу).
– На примере ионов железа попробуем определить, действительно ли оно содержится в организме?
– Какие качественные реакции на катионы железа 2+ и 3+ вы знаете?
(Учащиеся называют: на катион железа 3+ реактивы роданид калия и желтая кровяная соль, на катион железа 2+ реактив красная кровяная соль.)
– У вас на столах имеется оборудование для выполнения лабораторной работы.
Проведем качественную реакцию на ионы железа 3+, добавив к раствору соли железа роданид калия (КCNS).
(Образуется раствор кроваво-красного цвета ).
– На что похож полученный раствор?
Ученики: На кровь, венозную. Значит, ионы железа 3+ содержатся в организме.
Качественная реакция на ион железа (III) например вот такая
FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl – реакция со щелочью
Качественная реакция на ион железа (III) – реакция с желтой кровяной солью.
3 К4[Fe(CN)6 ] +4 FeCl3 = KFe[Fe(CN)6])↓ + 12 KCl
Качественная реакция на ион железа (III) – реакция с роданидом калия.
FeCl3 + 3 КCNS = Fe(CNS)3 + 3 KCl
Качественная реакция на ион железа (II) – реакция с красной кровяной солью.
турнбуллева синь - KFe[Fe(CN)6]).
2 К3[Fe(CN)6 ] +3 FeSO4 = KFe[Fe(CN)6])↓ + 3K2SO4
Качественная реакция на ион железа (II) – реакция со щелочью.
FeSO4 +2 NaOH = Fe(OH)2 ↓ + Na2SO4
Учитель: Проверим, есть ли ионы железа 3+ в продуктах питания?
В пробирку с яблочным соком учащиеся приливают раствор желтой кровяной соли K 3 [Fe(CN) 6 ].
(Образуется осадок синего цвета .)
Учитель: Проанализируем Таблицу 1 «Металлы в организме человека» (см. Приложение 1 ).
– Скажите, где содержится в основном железо в организме?
Учащиеся: В мышечной ткани, большая часть в крови.
Учитель: Что нужно делать при недостатке железа в организме? Какие продукты употреблять?
По Таблице 2 «Содержание железа в продуктах питания» (см. Приложение 2 ) определите, в каких продуктах больше всего содержится железа?
Рассмотрим задание С-2.
Железо сожгли в хлоре. Продукт реакции растворили в воде и в раствор внесли железные опилки. Через некоторое время раствор профильтровали и в фильтрат добавили сульфид натрия. Выделившийся осадок отделили и обработали 20% ной серной кислотой, получив бесцветный раствор. Напишите уравнения описанных реакций.
Рассмотрим задание С-4.
5,6 г чистого железа растворили в 100 мл 10%- ного раствора соляной кислоты (р=1,05г/мл). Вычислите массовую долю хлороводорода в полученном растворе.
Конспект урока "Металлы побочных подгрупп"
Цель: Повторить и обобщить знания о металлах на примере металлов представителей побочных подгрупп (меди, железа, хрома); углубить знания об их свойствах и применении.
Образовательная : Изучить строение, свойства и применение металлов побочных подгрупп
Развивающие : 1. Создать условия для развития логического мышления через сравнение и установление взаимосвязи строения и свойств веществ с учетом зоны ближайшего развития 2. Формирование умений переносить полученные знания в новую ситуацию
Воспитательные: 1. Формирование научного мировоззрения через познаваемость химических явлений 2. Формирование умений осуществлять самоконтроль хода и результатов своего труда 3. Развитие коммуникативности личности
Планируемые результаты:
Знать строение атома, физические и химические свойства, получение и применение металлов побочных подгрупп.
Уметь составлять электронные формулы атомов металлов побочных подгрупп на примере меди, железа, хрома; записывать уравнения реакций, характеризующих химические свойства, способы получения.
Тип урока: изучение нового материала
Оборудование: компьютер, мультимедийный проектор, карточки с тестами, коллекция «Металлы», периодическая система химических элементов.
I .Организационный момент.
II .Актуализация опорных знаний
Устный опрос по пройденному материалу:
Прежде, чем мы приступим к изучению нового материала вспомним материал прошлого занятия. Постарайтесь ответить на вопросы.
- В какой части Периодической системы в основном расположены металлы?
Ответ: в левой нижней части таблицы
- Что общего в физических свойствах всех металлов?
Ответ: высокая электрическая проводимость, теплопроводность, ковкость, пластичность
- По каким характерным физическим свойствам металлы в значительной степени отличаются друг от друга?
Ответ: по плотности, твердости, температуре плавления
- Назовите самый легкий и самый тяжелый металл
Ответ: самый легкий литий, тяжелый осмий
- У какого из металлов самая низкая и самая высокая температура плавления?
Ответ: ртуть –38,9 ; вольфрам 3390
- Какие металлы мы изучали на последнем занятии?
Ответ: металлы главных подгрупп
- Назовите несколько металлов главных подгрупп
Ответ: литий, натрий, калий, магний, кальций и др.
- Назовите общее химическое свойство металлов главных подгрупп
Ответ: это их способность легко отдавать валентные электроны вследствие гораздо большего атомного радиуса по сравнению с неметаллическими элементами, поэтому являются восстановителями
III .Самоопределение к деятельности
- На сегодняшнем занятии мы познакомимся с еще одной группой металлов, среди которых наибольшее практическое значение имеют: медь, цинк, титан и железо
- Возникает вопрос, почему эти металлы изучаются отдельно?
Чтобы ответить на этот вопрос – выясните в чем отличие в расположении этих элементов в таблице Менделеева от ранее изученных металлов?
Ответ: эти металлы находятся в побочных подгруппах
Ответ: «Металлы побочных подгрупп»
- Какие цели вы ставите перед собой на уроке?
Ответ: узнать, изучить строение, свойства и применение металлов побочных подгрупп
- Давайте вместе обсудим план работы на сегодняшнем занятии. Предложите свои пункты плана по которому можно будет достичь вашей цели на уроке.
Ответ: предлагают изучить строение, физические, химические свойства и т.д
1) Исторические данные
2) Строение атома
3) Физические свойства
4) Химические свойства
В течении урока, вам необходимо будет сделать краткий конспект - записать необходимые данные, которые вы узнаете на занятии.
- Ответьте на вопрос: «Для чего, где вам пригодятся знания полученные на сегодняшнем уроке?»
IV. Изучение нового материала
б) Строение атома
– Электронное строение атомов меди, железа, хрома
Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).

в) Физические свойства меди, железа, хрома
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Медь — довольно мягкий металл красно-желтого цвета, ковкий, пластичный, обладает высокой тепло - и электропроводностью . Tплавл= 10830С. ρ = 8,96г/см3. СО: 0,+1,+2
Железо – сравнительно мягкий ковкий металл серебристого цвета, пластичный, намагничивается. Tплавл=15390С. ρ = 7,87г/см3.
СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов
+3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.
Хром — твердый, голубовато-белый металл. ρ = 7,2г/см3, tплавл= 18570С
г) Химические свойства меди, железа, хрома
Химические свойства меди
I. Взаимодействие с простыми веществами.
1. При высокой температуре взаимодействует с кислородом: 2Cu + O2 2CuO
2. Взаимодействует с неметаллами при высоких температурах: Cu + Cl2 CuCl2
II. Взаимодействие со сложными веществами.
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3( разб .) → 3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3( конц .) → Cu(NO3)2 + 2NO2↑+ 2H2O
Cu + 2H2SO4( конц .) → CuSO4 + SO2↑+2H2O
Химические свойства железа
1. Горит в кислороде, образуя окалину - оксид железа (II, III): 3Fe + 2O2 → Fe3O4
2. Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 2FeBr3
1. При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O Fe3O4 + 4H2 ↑
2. На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О → 4Fе(ОН)3.
3. Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4( разб .) → FeSO4 + H2↑
4. В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
2Fe + 6H2SO4( конц .) Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3( конц .) Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5. Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu↓
Химические свойства хрома
1. При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом , кремнием, бором, серой, фосфором.
4Cr + 3O2 2Cr2O3
2Cr + 3Cl2 2CrCl3
1. В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:
2 Сr + 6 Н2SО4(конц) Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц) Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Получение меди
1. Восстановлением из оксидов углём или оксидом углерода (II): CuO + C Cu + CO
CuO + CO Cu + CO2
2. При электролизе солей меди: 2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Получение железа
1. Восстановлением из оксидов углём или оксидом углерода (II)
Fe2O3 + 3CO 2Fe + 3CO2
Получение хрома
1. Алюминотермия: Cr2O3 + 2Al Al2O3 + 2Cr
2. Восстановлением оксидов хрома оксидом углерода (II), водородом :
CrO + Н2 Cr + H2O
е) Применение меди, железа, хрома
V .Закрепление
– Напишите электронное строение атома меди
– Допишите уравнения реакций:
а) Fe + O 2 ® б) Cr + H 2 SO 4 ® в) Cu + Cl 2 ®
Тест по теме урока
1) Электронная формула 1s 2 2s2 2p6 3s2 3p6 3d2 4s2 принадлежит:
а) Zn б) Ti в) Cu г) Fe
2) Определите металл по следующим данным: светло-розовый цвет, тягучий, вязкий, легко прокатывается. Температура плавления 1083 o С. По проводимости электрического тока уступает лишь серебру.
3) Степень окисления железа в формуле Fe2O3:
а) –2 б) + 4 в) + 2 г) + 3
4) Металлические свойства в ряду Ti ® Cr ® Fe:
а) уменьшаются б) увеличиваются в) не изменяются г) изменяются периодически
5) В схеме превращений Cr → CrCl 3 → Cr ( OH )3
веществами x и y могут быть соответственно
а) Cl 2 , H 2 O б) Cl 2 , NaOH в) NaCl , KOH г) HCl , KOH
VI .Итог урока.
VII .Рефлексия.
Какая цель была на уроке _________________
Достиг ли ты поставленной цели ____________
Что тебе помогло достичь цели? _______________
Я узнал на уроке _____________
Я не согласен _____________
На уроке столкнулся со следующими трудностями ___________
Поставьте себе оценку за урок _______
VIII . Домашнее задание: изучить § 28
Выполните одно из трех заданий по своим возможностям
«3» - Допишите уравнения: а) Fe+ Cl2 ® б) Ti(IV) + O2 ® в) Zn + HNO3 ®
«4» – Напишите уравнения реакций по схеме: Zn ® ZnO ® ZnSO4 ® Zn(NO3)2
«5» – Напишите уравнения реакций по схеме, заменив «X» и «Y» соответствующей формулой: Fe(III) ® «X» ® «Y» ® Fe2O3
Презентация на тему "Металлы побочных подгрупп"

В периоде слева направо происходит некоторое уменьшение атомного радиуса элементов. Это обусловлено эффектом « d -сжатия», вызванного постепенным увеличением заряда ядер и усилением кулоновского притяжения электронов к ядру.
В подгруппах сверху вниз (кроме IIIB группы ) атомный радиус несколько уменьшается или остается практически неизменным за счет сокращения размеров внутренних f -орбиталей («лантаноидное сжатие»). При этом химическая активность металлов уменьшается, что отличает их от металлов главных подгрупп.

У элементов III В группы атомные радиусы возрастают , химическая активность увеличивается, благодаря чему они проявляют большее сходство с элементами главных подгрупп, чем побочных. По реакционной способности элементы подгруппы скандия уступают лишь щелочным и щелочноземельным металлам.
В периодах слева направо металлические свойства уменьшаются.
Минимальные восстановительные свойства проявляют тяжелые металлы VIIIB и IB – групп. За свою инертность они названы благородными.

В химических реакциях электроны d-орбиталей участвуют после того, как оказываются использованными s-электроны внешнего энергетического уровня.
В образовании связей могут участвовать все или только часть d-электронов предпоследнего энергетического уровня, поэтому образуются соединения с различной валентностью или степенью окисления (кроме d-элементов II и III групп).
Например, характерными для элементов VIII В группы являются следующие степени окисления (в скобках – наиболее устойчивые):
Fe Co Ni семейство железа
Ru Rh Pd легкие платиновые металлы
О s Ir Pt тяжелые платиновые металлы

Таким образом,
особенностями электронного строения d-элементов обусловлены и их свойства:
а) большое разнообразие проявляемых валентностей и степеней окисления;
б) способность образовывать различные комплексные соединения;
в) каталитическая активность.

Физические свойства d- металлов
Физические свойства переходных металлов зависят от электронного строения, от числа неспаренных d-электронов, которые могут участвовать в образовании связей.
- Металлы, у которых по3–4 неспаренныхd-электрона (VВ и VIВ группы), имеют максимальную температуруплавления и кипения.
- Переходные металлы, имеющиена внешнемs-подуровне один электрон, как правило, имеют более высокую электрическую проводимость (Cr, Мo и особенно Cu, Ag, Au).
Химические свойства d -металлов
Все d-элементы являются восстановителями. Восстановительная способность в растворах в пределах периода уменьшается.
Наиболее сильными восстановителями являются металлы IIIВ группы.
У большинства d-элементов образуются защитные оксидные пленки , вызывающие их пассивацию и предохраняющие их от коррозии. Наиболее склонны к пассивации металлы IVВ–VIВ групп.
Элементы IIIВ и IIВ групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а лантан взаимодействует и с водой.
Не взаимодействуют с разбавленными кислотами металлы IВ группы, ртуть и платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt).
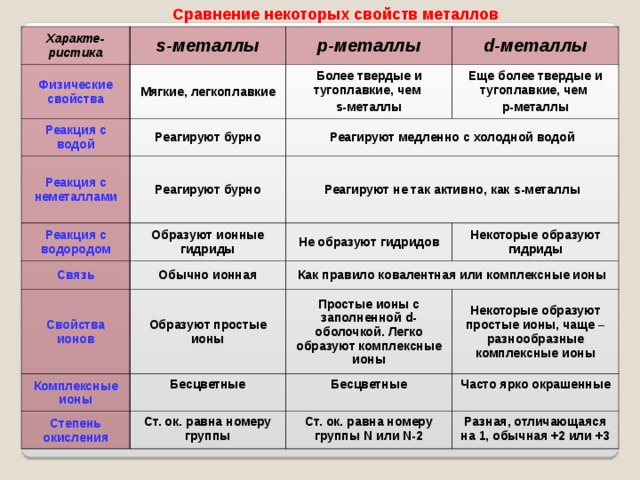
Сравнение некоторых свойств металлов
Характе-ристика
s -металлы
Физические свойства
р-металлы
Реакция с водой
Мягкие, легкоплавкие
d- металлы
Более твердые и тугоплавкие, чем
s -металлы
Реагируют бурно
Реакция с неметаллами
Еще более твердые и тугоплавкие, чем
Реагируют медленно с холодной водой
Реакция с водородом
Реагируют не так активно, как s -металлы
Образуют ионные гидриды
Свойства ионов
Не образуют гидридов
Обычно ионная
Как правило ковалентная или комплексные ионы
Некоторые образуют гидриды
Образуют простые ионы
Комплексные ионы
Простые ионы с заполненной d- оболочкой. Легко образуют комплексные ионы
Степень окисления
Некоторые образуют простые ионы, чаще – разнообразные комплексные ионы
Ст. ок. равна номеру группы
Часто ярко окрашенные
Ст. ок. равна номеру группы N или N -2
Разная, отличающаяся на 1, обычная +2 или +3
Строение и свойства соединений d -элементов зависят от степени окисления металла
Степень окисления элемента
Низшая
Свойства соединений
восстановительные
Промежуточная
Высшая
Амфотерные, окислительно-восстановительные
Mo 2+ , V 2+ , Mn 2+ , Cu + , Fe 2+
окислительные
Ковалентно-полярный
Преимущественно ковалентный
Mo 3+ , Mn 4+ , Cr 3+ , Fe 3+
Mo 6+ , V 5+ , Mn 7+ , Cr 6+

Оксиды и гидроксиды d -элементов
Переходные металлы реагируют с кислородом, образуя оксиды ( искл . Ag, Au) . Почти все они нерастворимы в воде, черного или иного цвета. Обладают заметной ковалентностью связей.
Оксид железа ( II ) FeO,
магнитный железняк (магнетит) Fe 3 O 4
и красный железняк (гематит) Fe 2 O 3 (в чашке).
Оксид хрома С r 2 O 3

![Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком: Осадок Цвет Реакция Cr(OH) 3 с NaOH (водн.) зеленый Mn(OH) 2 с NH 3 (водн.) бежевый CrO 3 3- Fe(OH) 2 Fe(OH) 3 - - зеленый ржавый - - Co(OH) 2 - Ni(OH) 2 - розовый зеленый - [Co(OH) 4 ] 2- Cu(OH) 2 [Co(NH 3 ) 6 ] 2+ - голубой Zn(OH) 2 [Ni(NH 3 ) 4 ] 2+ бесцветный - [Cu(NH 3 ) 4 ] 2+ [Zn(OH) 4 ] 2- [Zn(NH 3 ) 4 ] 2+](https://fsd.multiurok.ru/html/2017/11/02/s_59fa3a12dc15c/img14.jpg)
Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком:
Осадок
Реакция
Cr(OH) 3
с NaOH (водн.)
зеленый
Mn(OH) 2
с NH 3 (водн.)
бежевый
CrO 3 3-
Fe(OH) 2
Fe(OH) 3
ржавый
Co(OH) 2
Ni(OH) 2
розовый
[Co(OH) 4 ] 2-
Cu(OH) 2
[Co(NH 3 ) 6 ] 2+
голубой
Zn(OH) 2
[Ni(NH 3 ) 4 ] 2+
бесцветный
[Cu(NH 3 ) 4 ] 2+
[Zn(OH) 4 ] 2-
[Zn(NH 3 ) 4 ] 2+
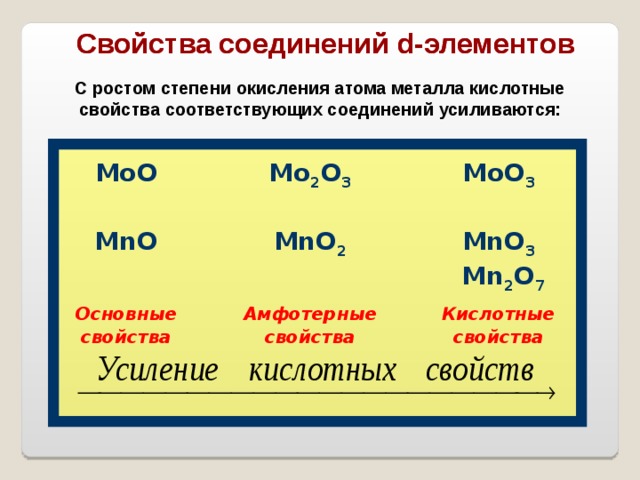
Свойства соединений d -элементов
С ростом степени окисления атома металла кислотные свойства соответствующих соединений усиливаются:
M о 2 O 3
MoO 3
MnO 2
Основные
свойства
Амфотерные
MnO 3
Mn 2 O 7
Кислотные
В пределах одной подгруппы для гидроксидов и оксидов
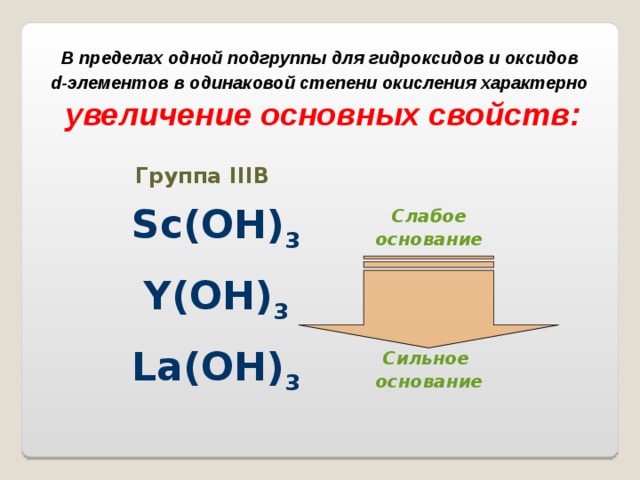
d -элементов в одинаковой степени окисления характерно
увеличение основных свойств:
Группа III В
Sc(OH) 3
Слабое
основание
Y(OH) 3
La(OH) 3
Сильное

В периоде кислотные свойства гидроксидов в высшей степени окисления металла усиливаются:
Ti(OH) 4 – HVO 3 – H 2 CrO 4 – HMnO 4 – H 2 FeO 4
Читайте также:
