Металлы проводят электрический ток потому что
Обновлено: 25.06.2024
В этом листке мы приступаем к подробному изучению того, как осуществляется прохождение электрического тока в различных проводящих средах — твёрдых телах, жидкостях и газах.
Напомним, что необходимым условием возникновения тока является наличие в среде достаточно большого количества свободных зарядов, которые могут начать упорядоченное движение под действием электрического поля. Такие среды как раз и называются проводниками электрического тока.
Наиболее широко распространены металлические проводники. Поэтому начинаем мы с вопросов распространения электрического тока в металлах.
Мы много раз говорили о свободных электронах, которые являются носителями свободных зарядов в металлах. Вам хорошо известно, что электрический ток в металлическом проводнике образуется в результате направленного движения свободных электронов.
Свободные электроны
Металлы в твёрдом состоянии имеют кристаллическую структуру: расположение атомов в пространстве характеризуется периодической повторяемостью и образует геометрически правильный рисунок, называемый кристаллической решёткой.
Атомы металлов имеют небольшое число валентных электронов, расположенных на внешней электронной оболочке. Эти валентные электроны слабо связаны с ядром, и атом легко может их потерять.
Когда атомы металла занимают места в кристаллической решётке, валентные электроны покидают свои оболочки — они становятся свободными и отправляются «гулять» по всему кристаллу (а именно, свободные электроны перемещаются по внешним орбиталям соседних атомов. Эти орбитали перекрываются друг с другом вследствие близкого расположения атомов в кристаллической решётке, так что свободные электроны оказываются «общей собственностью» всего кристалла). В узлах кристаллической решётки металла остаются положительные ионы, пространство между которыми заполнено «газом» свободных электронов (рис. 1 ).
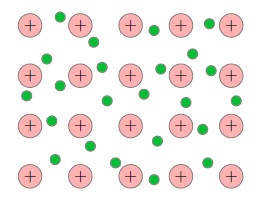
Рис. 1. Свободные электроны
Свободные электроны и впрямь ведут себя подобно частицам газа (другой адекватный образ — электронное море, которое «омывает» кристаллическую решётку) — совершая тепловое движение, они хаотически снуют туда-сюда между ионами кристаллической решётки. Суммарный заряд свободных электронов равен по модулю и противоположен по знаку общему заряду положительных ионов, поэтому металлический проводник в целом оказывается электрически нейтральным.
Газ свободных электронов является «клеем», на котором держится вся кристаллическая структура проводника. Ведь положительные ионы отталкиваются друг от друга, так что кристаллическая решётка, распираемая изнутри мощными кулоновскими силами, могла бы разлететься в разные стороны. Однако в тоже самое время ионы металла притягиваются к обволакивающему их электронному газу и, как ни в чём не бывало, остаются на своих местах, совершая лишь тепловые колебания в узлах кристаллической решётки вблизи положений равновесия.
Что произойдёт, если металлический проводник включить в замкнутую цепь, содержащую источник тока? Свободные электроны продолжают совершать хаотическое тепловое движение, но теперь — под действием возникшего внешнего электрического поля — они вдобавок начнут перемещаться упорядоченно. Это направленное течение электронного газа, накладывающееся на тепловое движение электронов, и есть электрический ток в металле (поэтому свободные электроны называются также электронами проводимости). Скорость упорядоченного движения электронов в металлическом проводнике, как нам уже известно, составляет приблизительно 0,1мм/с.
Опыт Рикке
Почему мы решили, что ток в металлах создаётся движением именно свободных электронов? Положительные ионы кристаллической решётки также испытывают на себе действие внешнего электрического поля. Может, они тоже перемещаются внутри металлического проводника и участвуют в создании тока?
Упорядоченное движение ионов означало бы постепенный перенос вещества вдоль направления электрического тока. Поэтому надо просто пропускать ток по проводнику на протяжении весьма длительного времени и посмотреть, что в итоге получится. Такого рода эксперимент и был поставлен Э.Рикке в 1901 году.
В электрическую цепь были включены три прижатых друг к другу цилиндра: два медных по краям и один алюминиевый между ними (рис. 2 ). По этой цепи пропускался электрический ток в течение года.
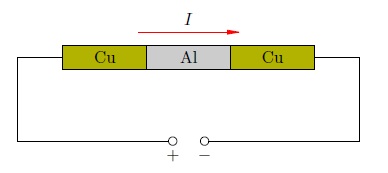
Рис. 2. Опыт Рикке
За год сквозь цилиндры прошёл заряд более трёх миллионов кулон. Предположим, что каждый атом металла теряет по одному валентному электрону, так что заряд иона равен элементарному заряду Кл. Если ток создаётся движением положительных ионов, то нетрудно подсчитать (сделайте это сами!), что такая величина прошедшего по цепи заряда соответствует переносу вдоль цепи около 2кг меди.
Однако после разъединения цилиндров было обнаружено лишь незначительное проникновение металлов друг в друга, обусловленное естественной диффузией их атомов (и не более того). Электрический ток в металлах не сопровождается переносом вещества, поэтому положительные ионы металла не принимают участия в создании тока.
Опыт Стюарта–Толмена
Прямое экспериментальное доказательство того, что электрический ток в металлах создаётся движением свободных электронов, было дано в опыте Т.Стюарта и Р.Толмена (1916 год).
Эксперименту Стюарта–Толмена предшествовали качественные наблюдения, сделанные четырьмя годами ранее русскими физиками Л.И.Мандельштамом и Н.Д.Папалекси. Они обратили внимание на так называемый электроинерционный эффект: если резко затормозить движущийся проводник, то в нём возникает кратковременный импульс тока. Эффект объясняется тем, что в течение небольшого времени после торможения проводника его свободные заряды продолжают двигаться по инерции.
Однако никаких количественных результатов Мандельштам и Папалекси не получили, и наблюдения их опубликованы не были. Честь назвать опыт своим именем принадлежит Стюарту и Толмену, которые не только наблюдали указанный электроинерционный эффект, но и произвели необходимые измерения и расчёты.
Установка Стюарта и Толмена показана на рис. 3 .
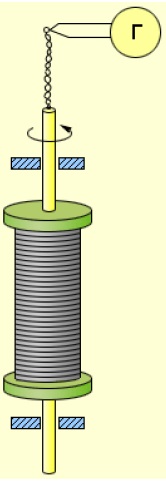
Рис. 3. Опыт Стюарта–Толмена
Катушка большим числом витков металлического провода приводилась в быстрое вращение вокруг своей оси. Концы обмотки с помощью скользящих контактов были подсоединены к специальному прибору — баллистическому гальванометру, который позволяет измерять проходящий через него заряд.
После резкого торможения катушки в цепи возникал импульс тока. Направление тока указывало на то, что он вызван движением отрицательных зарядов. Измеряя баллистическим гальванометром суммарный заряд, проходящий по цепи, Стюарт и Толмен вычислили отношение заряда одной частицы к её массе. Оно оказалось равно отношению для электрона, которое в то время уже было хорошо известно.
Так было окончательно выяснено, что носителями свободных зарядов в металлах являются свободные электроны. Как видите, этот давно и хорошо знакомый вам факт был установлен сравнительно поздно — учитывая, что металлические проводники к тому моменту уже более столетия активно использовались в самых разнообразных экcпериментах по электромагнетизму (сравните, например, с датой открытия закона Ома — 1826 год. Дело, однако, заключается в том, что сам электрон был открыт лишь в 1897 году).
Зависимость сопротивления от температуры
Опыт показывает, что при нагревании металлического проводника его сопротивление увеличивается. Как это объяснить?
Причина проста: с повышением температуры тепловые колебания ионов кристаллической решётки становятся более интенсивными, так что число соударений свободных электронов с ионами возрастает. Чем активнее тепловое движение решётки, тем труднее электронам пробираться сквозь промежутки между ионами (Представьте себе вращающуюся проходную дверь. В каком случае труднее проскочить через неё: когда она вращается медленно или быстро? :-)). Скорость упорядоченного движения электронов уменьшается, поэтому уменьшается и сила тока (при неизменном напряжении). Это и означает увеличение сопротивления.
Как опять-таки показывает опыт, зависимость сопротивления металлического проводника от температуры с хорошей точностью является линейной:
Здесь — сопротивление проводника при . График зависимости (1) является прямой линией (рис. 4 ).
Множитель называется температурным коэффициентом сопротивления. Его значения для различных металлов и сплавов можно найти в таблицах.
Длина проводника и его площадь поперечного сечения при изменении температуры меняются несущественно. Выразим и через удельное сопротивление:
и подставим эти формулы в (1) . Получим аналогичную зависимость удельного сопротивления от температуры:
Коэффициент весьма мал (для меди, например, ), так что температурной зависимостью сопротивления металла часто можно пренебречь. Однако в ряде случаев считаться с ней приходиться. Например, вольфрамовая спираль электрической лампочки раскаляется до такой степени, что её вольт-амперная характеристика оказывается существенно нелинейной.
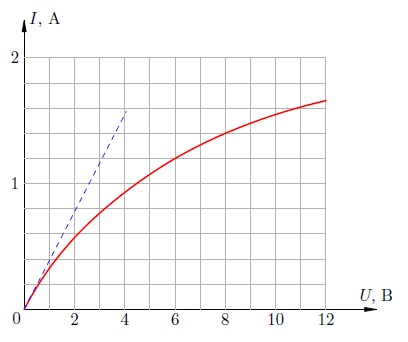
Рис. 5. Вольт-амперная характеристика лампочки
Так, на рис. 5 приведена вольт-амперная характеристика автомобильной лампочки. Если бы лампочка представляла собой идеальный резистор, её вольт-амперная характеристика была прямой линией в соответствии с законом Ома. Эта прямая изображена синим пунктиром.
Однако по мере роста напряжения, приложенного к лампочке, график отклоняется от этой прямой всё сильнее и сильнее. Почему? Дело в том, что с увеличением напряжения ток через лампочку возрастает и больше разогревает спираль; сопротивление спирали поэтому также увеличивается. Следовательно, сила тока хотя и продолжит возрастать, но будет иметь всё меньшее и меньшее значение по сравнению с тем, которое предписывается «пунктирной» линейной зависимостью тока от напряжения.
О природе электрического тока и основах электротехники
В данной короткой статье попытаюсь на пальцах объяснить основы электротехники. Для тех, кто не понимает откуда в розетке электричество, но спрашивать вроде как уже неприлично.
1. Что такое электрический ток.
"Главный инженер повернул рубильник, и электрический ток все быстрее и быстрее побежал по проводам" (с)
1.1 Пара общих слов по физике вопроса
Электрический ток - это движение заряженных частиц. Из заряженных частиц у нас имеются электроны и немножко ионы. Ионы - это атомы, которые потеряли или приобрели один или несколько электронов и поэтому потеряли электрическую нейтральность, приобрели электрический заряд. Так-то атом электрически нейтрален - заряд положительно заряженного ядра компенсируется зарядом электронной оболочки. Ионы обычно являются переносчиком заряда в электролитах, в металлических проводах носителями являются электроны. Металлы хорошо проводят ток, потому что некоторые электроны могут перескакивать от одного атому к другому. В непроводящих материалах электроны привязаны к своему атому и перемещаться не могут. (Напомню, данная статья - это объяснение физики на пальцах! Подробнее искать по "электронная теория проводимости").
Будем рассматривать ток в металлических проводниках, который создаётся электронами. Можно провести аналогию между электронами в проводнике и жидкости в водопроводной трубе. (На начальном этапе электричество так и считали особой жидкостью.) Как через стенки трубы вода не выливается, так и электроны не могут покинуть проводник, потому что положительно заряженные ядра атомов притянут их обратно. Электроны могут перемещаться только в внутри проводника.
1.2 Создание электрического тока.
Но просто так ток в проводнике не возникнет. Это все равно, что залить воду в кусок трубы и заварить с обоих концов. Вода никуда не потечет. В куске проводника электроны тоже не могут двигаться в одном направлении. Если электроны почему-то сдвинутся вправо, то слева возникнет нескомпенсированный положительный заряд, который потянет их обратно. Поэтому электроны могут только прыгать от одного атома к другому и обратно. Но если трубу свернуть в кольцо, то вода уже может течь вдоль трубы, если каким-то образом заставить ее двигаться. Точно также и концы проводника можно соединить друг с другом, и тогда электроны смогут перемещаться вдоль проводника, если их заставить. Если концы проводника соединены друг с другом, то получается замкнутая цепь. Постоянный ток может идти только в замкнутой цепи. Если цепь разомкнута, то ток не идет. Чтобы заставить воду течь по трубе используется насос. В электрической цепи роль насоса выполнят батарейка. Батарейка гонит электроны по проводнику и тем самым создает электрический ток. По научному батарейка называется генератором. Так в электротехнике называют насос для создания электрического тока.
Бывают два типа генераторов - генератор напряжения и генератор тока.
Это фундаментальная вещь на самом деле, обратите внимание! См. рисунок ниже

рис 1. Генератор напряжения величиной U

рис 2. Генератор тока величиной I
На верхней картинке изображен генератор напряжения, на нижней - генератор тока. Насос -генератор напряжения создает постоянное давление, насос-генератор тока создает постоянный поток. Верхняя цепь разомкнута, и нижняя - замкнута. Рассмотрим, какими свойствами обладает генератор напряжения. Представим следующую цепь
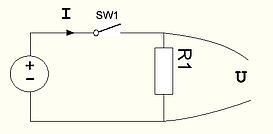
рис 3. Генератор напряжения величиной U с нагрузкой R1
В терминах водопроводной аналогии, генератор -это насос, создающий постоянное давление, выключатель SW1 - это клапан, открывающий\перекрывающий трубу, сопротивление R1 - это кран\вентиль который насколько-то приоткрыт. Этот крантель можно прикрыть - сопротивление увеличится, поток воды уменьшится. Можно открыть побольше - сопротивление уменьшится, поток воды увеличится. Вроде все интуитивно понятно. Теперь представим, что мы открываем кран все больше и больше. Тогда поток воды будет увеличиваться и увеличиваться. При этом генератор напряжения по определению поддерживает напряжение (давление) постоянным, независимо от величины потока! Если кран открыть полностью и сопротивление станет равно 0, то поток станет равным бесконечности. При этом генератор все равно будет выдавать напряжение равное U! Конечно все это происходит в идеальной модели, когда мощность генератора бесконечна. Реальные генераторы (батарейки или аккумуляторы) примерно соответствуют этой модели в определенном диапазоне напряжений и токов.
Рассмотрим теперь цепь с генератором тока.

рис 4. Генератор тока величиной I с нагрузкой R2
Что делает генератор тока? Он гонит ток! Ему сказано гнать ток величиной I, и он его гонит, невзирая на величину сопротивления (насколько открыт кран). Открыт кран полностью - ток будет равен I. Напряжение (давление) будет равно.
Закрыт кран полностью - ток все равно будет равен I! Но при этом напряжение (давление) будет равно бесконечности. Опять таки в модели.
Из этих рассуждений интуитивно понятно вытекает основной закон электротехники - Закон Ома. ( "С красной строки. Подчеркни" (с))
2. Закон Ома.
Сначала c точки зрения генератора напряжения
Если к сопротивлению R приложить напряжение U, то через сопротивление пойдет ток
I =U/R Теперь с точки зрения генератора тока
Если через сопротивление R пропускать ток I, то на сопротивлении возникнет падение напряжения U=I*R
Вот как-то надо этот момент осознать. Эти две формулировки совершенно равноправны и применение их зависит только от того, какой генератор рассматривается. Можно конечно еще записать R=U/I. Что-то вроде - если к участку цепи приложено напряжение U, и при этом в этом участке проходит ток I, то цепь имеет сопротивление R. Дальше по хорошему надо рассматривать варианты цепей с параллельным или последовательным включением резисторов, но неохота. Это чисто технические моменты. Что-то вроде
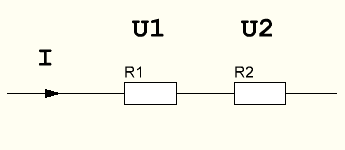
рис 5. Последовательное включение резисторов
Через данную цепь из последовательно соединенных резисторов R1 и R2 проходит ток величиной I. Какое падение напряжения будет на каждом резисторе U1 и U2?
Используйте закон Ома и все!
Эта цепь кстати с генератором тока, поскольку входная переменная здесь ток. Ну то есть самого генератора тока может и не быть, просто ток в цепи известен и считается постоянным и равным I. Поэтому как бы этот ток гонит генератор тока.
Еще - говорят "падение напряжения на резисторе", потому что "производит" напряжение (давление) генератор, а после каждого резистора напряжение будет уменьшаться, падать на этом резисторе на величину U=I*R.
Хотя пару важных практических случаев все таки рассмотрим.
1. Самая важная схема.
Самая важная схема, с которой инженеру-электронщику предстоит иметь дело постоянно на протяжении всей жизни - это делитель напряжения.
( "С красной строки. Подчеркни" (с))
3. Делитель напряжения
Схема имеет вид.
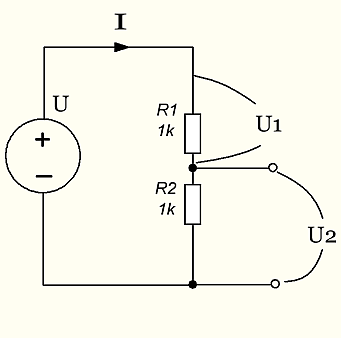
рис 6. Делитель напряжения
Делитель напряжения представляет собой два резистора, соединенных последовательно друг с другом.
Кстати, резистором называется электронный компонент (деталька), которая реализует электрическое сопротивление определенной величины . Его также (детальку) часто называют сопротивлением. Получается немного тавтология - сопротивление имеет сопротивление R. Поэтому для деталей лучше использовать название резистор. Резистор сопротивлением 1 килоом, например.
Так вот. Что же делает эта схема? Два последовательных резистора имеют некоторое эквивалентное сопротивление, назовем его R12. По цепи проходит ток I, от плюса генератора к минусу через резистор R1 и через резистор R2. При этом на резисторе R1 падает напряжение U1=I*R1, а на резисторе R2 падает напряжение U2=I*R2. Согласно закону Ома. Напряжение U=U1+U2, как видно из схемы. Таким образом U=I*R1+I*R2=I*(R1+R2).
То есть эквивалентное сопротивление последовательно соединенных резисторов равно сумме их сопротивлений.
Выражение для тока I=U/(R1+R2)
Найдем теперь, чему равно напряжение U2. U2=I*R2= U* R2/(R1+R2).

Пример картинки из интернета. Если резисторы равны, то входное напряжение Uвx делится пополам.
Второй важный случай - учет выходного сопротивления источника (генератора) и входного сопротивления приемника (цепи, к которой генератор подключен)
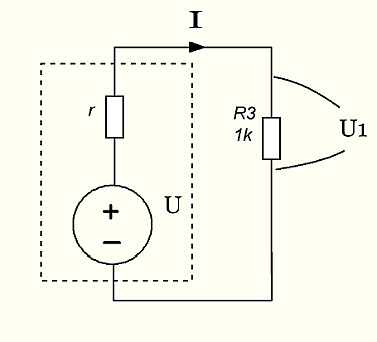
рис 7. Выходное сопротивление источника и входное сопротивление приемника.
Идеальный генератор напряжения имеет нулевое выходное сопротивление, то есть при нулевом сопротивлении внешней цепи величина тока будет равна бесконечности ∝. Реальный генератор напряжения обеспечить бесконечный ток не может. Поэтому при замыкании внешней цепи ток в ней будет ограничен внутренним сопротивлением генератора, на рис. обозначен буквой r.
Кстати, правильный способ проверки пальчиковых батареек, заключается в измерении тока, которые они могут отдать. То есть на тестере выставляется предел 10А, режим измерения тока, и щупы прикладываются к контактам батареи. Ток в районе 1А или больше говорит о том, что батарейка свежая. Если ток меньше 0.5А, то можно выкидывать. Или попробовать в настенных часах, может сколько-то проработает.
Если выходное сопротивление источника (внутреннее сопротивление r на рисунке) соизмеримо со входным сопротивлением приемника (R3 на рисунке), то эти резисторы будут действовать, как делитель напряжения. На приемник при этом будет поступать не полное напряжение источника U, а U1=U*R3/(r+R3). Если эта схема предназначена для измерения напряжения U, то она будет врать!
В следующих статьях планируется рассмотреть цепи с конденсаторами и индуктивностями.
Затем диоды, транзисторы и операционные усилители.
Электрический ток в металлах: подробное объяснение
Электрический ток в металлах представляет собой упорядоченное движение свободных электронов. Более подробно об этом читайте далее в нашей статье.
Важно знать
Как известно, электрический ток – это упорядоченный поток носителей электрического заряда. Носители – это заряженные частицы, способные свободно перемещаться во всем объеме тела.
В случае металлов этими частицами являются электроны, которые высвобождаются при образовании связи между атомами металла.
Известно, что металлы в твердом состоянии имеют кристаллическую структуру. Частицы в кристаллах расположены в определенном порядке, образуя пространственную решетку (кристалл).
Наконец, кристаллическая решетка металла образована положительными ионами, погруженными в “облако” хаотически движущихся так называемых свободных электронов, также называемых электронами проводимости. В зависимости от валентности атомов металла, один атом может освободить от одного до трех электронов при образовании металлических связей. Число таких высвобожденных электронов непосредственно переводится в число носителей заряда. Это является одним из факторов, влияющих на способность металла проводить электрический ток.
Доказательством того, что ток в металлах вызывается электронами, послужили эксперименты наших отечественных физиков Леонида Исааковича Мандельштама и Николая Дмитриевича Папалекси, а также американских физиков Бальфура Стюарта и Роберта Толмана.
Способность металла проводить электрический ток может быть описана физической величиной, называемой удельным электрическим сопротивлением. Эта физическая величина обозначается греческой буквой ρ (читается как “ро”). Единицей измерения удельного сопротивления является Ом · м, т.е. произведение Ом на метр. Удельное сопротивление – это константа, которая характеризует материал и имеет различные значения для разных материалов. Например, удельное сопротивление меди составляет 1.72*10 -8 Ом · м. Это означает, что электрическое сопротивление медного проводника длиной 1 метр и площадью поперечного сечения 1 м равно 1.72*10 -8 Ом . В целом, чем ниже удельное сопротивление материала, тем лучше он проводит электрический ток.
В таблице ниже приведены некоторые примеры удельного сопротивления часто используемых металлов.
| Металл | Удельное сопротивление (Ом · м) |
| Серебро | 1.59*10 -8 |
| Медь | 1.72*10 -8 |
| Алюминий | 2.82*10 -8 |
| Вольфрам | 5.6*10 -8 |
| Железо | 10*10 -8 |
Удельное электрическое сопротивление может быть связано с микроскопическими свойствами материала. В частности, он зависит от концентрации носителей заряда и их подвижности.
Движение свободных электронов в металлах не является полностью “свободным”, поскольку во время их движении они взаимодействуют с другими электронами, и прежде всего с ионами кристаллической решетки. Специфика этого движения описывается так называемой классической моделью проводимости.
Основные предположения и выводы этой модели представлены в большом упрощении ниже.
Классическая модель проводимости
Без внешнего электрического поля электроны совершают тепловые хаотические движения, сталкиваясь друг с другом, а также сталкиваясь с ионами кристаллической решетки. В результате такого движения среднее положение электронов практически не меняется (см. рис. 1.).

Рис. 1. Пример траектории электрона во время его хаотического теплового движения в металле
Из-за квантовых эффектов, и в частности из-за принципа запрета Паули, который не позволяет всем электронам занимать самое низкое энергетическое состояние, средняя скорость электронов в металлах, связанная с их хаотическим тепловым движением, больше, чем скорость частиц в классическом идеальном газе той же температуры. Она составляет порядка 10 м/с.
Если электрическое напряжение U приложено к концам проводника длиной L в нем появится электрическое поле с напряженностью E = U / L
Под действием этого внешнего поля, согласно второму закону динамики, электроны ускоряются: a = F / m,
где F = e*E – сила, с которой электрическое поле действует на электрон с зарядом e. Таким образом, ускорение электрона составляет: a = e*E / m .
Ускоренное движение электрона длится лишь довольно короткое время, пока он не столкнется с ионом
кристаллической решетки. В результате такого столкновения электрон теряет практически всю свою кинетическую энергию. Однако замедленный электрон не остается в состоянии покоя – он снова ускоряется под действием электрического поля, снова сталкивается с одним из ионов из ионы кристаллической решетки и т.д. Этот эффект добавляет к скорости тепловых движений дополнительную направленную среднюю скорость u, которая из-за отрицательного заряда электрона имеет направление, противоположное напряженности внешнего электрического поля. Эта скорость называется средней скоростью дрейфа (рис. 2).

Рис. 2. Дрейф электрона под действием внешнего электрического поля
В проводнике начинает течь электрический ток с силой тока I (см. рисунок 3).

Рис. 3. Дрейфующие электроны сталкиваются с ионами кристаллической решетки
Предполагая, что движение электрона равномерно ускоряется между столкновениями с ионами решетки, с ускорением a = e*E / m , и предполагая, что в результате столкновения электрон передает всю свою кинетическую энергию кристаллической решетке, мы можем вычислить скорость, которую развивает электрон в своем свободном движении: v = a*τ . В этой формуле τ – средний интервал времени между последующими столкновениями дрейфующего электрона с ионами кристаллической решетки.
Поскольку при равномерно ускоренном движении без начальной скорости средняя скорость является средним арифметическим начальной (равной нулю) и конечной скоростью, то получаем: u = v / 2 = e*E*τ / 2*m .
Из полученной формулы следует, что скорость дрейфа, помимо внешнего электрического поля, определяется средним интервалом времени между столкновениями электронов с ионами решетки. Этот параметр зависит от многих факторов (включая температуру, кристаллическую структуру металла, дефекты кристаллической структуры, примеси) и, как выясняется, существенно влияет на электрическое сопротивление материала.
Средняя дрейфовая скорость электронов составляет порядка 10 -4 м/с. Она очень мала по сравнению со скоростью теплового движения, которая составляет порядка 10 6 м/с.
Классическая теория проводимости достаточно хорошо описывает явление электропроводности в металлах. Однако эта теория не может объяснить экспериментально наблюдаемую зависимость электрического сопротивления от температуры.
Причина упомянутой неудачи классической теории проводимости заключается в том, что она не учитывает влияние ионов решетки на движение электронов между столкновениями. Более близкие к реальности результаты дает квантовая теория проводимости, которая описывает электроны как частицы, подверженные квантовой статистике, движущиеся в периодическом электрическом поле, создаваемом положительными ионами решетки.
Выводы простым языком
Отрицательный заряд всех свободных электронов по абсолютному значению равен положительному заряду всех ионов решётки. Поэтому в обычных условиях металл электрически нейтрален. Свободные электроны в нём движутся беспорядочно. Но если в металле создать электрическое поле, то свободные электроны начнут двигаться направленно под действием электрических сил. Возникнет электрический ток. Беспорядочное движение электронов при этом сохраняется, подобно тому как сохраняется беспорядочное движение в стайке мошкары, когда под действием ветра она перемещается в одном направлении.
« Скорость движения самих электронов в проводнике под действием электрического поля невелика – несколько миллиметров в секунду, а иногда и ещё меньше. Но как только в проводнике возникает электрическое поле, оно с огромной скоростью, близкой к скорости света в вакууме (300 000 км/c), распространяетcя по всей длине проводника. »
Перышкин А. В. Физика 8. – М.: Дрофа, 2010
Как пример, электрический сигнал, посланный, например, по проводам из Москвы во Владивосток (s = 8000 км), приходит туда примерно через 0,03 с.
Одновременно с распространением электрического поля все электроны начинают двигаться в одном направлении по всей длине проводника. Так, например, когда цепь электрической лампы замкнута, электроны в спирали лампы также движутся упорядоченно.
Сравнение электрического тока с потоком воды в водопроводной системе и распространения электрического поля с распространением давления воды поможет нам понять это. Когда вода поднимается в резервуар для воды, давление (напор) воды очень быстро распространяется по всей системе водоснабжения. Когда мы включаем кран, вода уже находится под давлением и сразу же начинает течь. Но вода, которая была в кране, течет, а вода из башни достигает крана гораздо позже, потому что вода движется с меньшей скоростью, чем распространяется давление.
Когда говорят о скорости распространения электрического тока в проводнике, то имеют в виду скорость распространения по проводнику электрического поля.
Электропроводность: объяснение, формулы, единица измерения, таблица
Почему медь проводит электричество лучше, чем вода? Прочитав эту статью, вы больше не будете задавать себе больше этот вопрос. Далее мы обсудим электропроводность и рассмотрим формулы, которые описывают это понятие. Наконец, вы можете проверить свои знания на двух примерах.
Простое объяснение.
Электропроводность – это физическая величина, которая описывает насколько хорошо определенный материал проводит электричество.
Формулы
Существует три различных формульных обозначения удельной электропроводности σ (греч. сигма), k (каппа) и γ (гамма). В дальнейшем мы будем использовать σ. Формула электропроводности, также называемой удельной электропроводностью, описывается формулой:
σ = 1 / ρ .
Здесь ρ называется удельным сопротивлением. Вы можете рассчитать электрическое сопротивление R проводника с учетом его параметров следующим образом: R = ( ρ * l ) / S .
Таким образом, сопротивление R равно удельному сопротивлению ρ , умноженному на длину проводника l, деленному на площадь поперечного сечения S. Если теперь вы хотите выразить эту формулу через удельную электропроводность σ = 1 / ρ , полезно знать, что электрическая проводимость G проводника выражается следующим образом: G = 1 / R .
Если в верхнюю формулу подставить удельную электропроводность σ и электрическую проводимость G, то получится следующее: 1 / G = ( 1 / σ ) * ( l / S ) .
Путем дальнейшего преобразования можно получить выражение: G = σ * S / l .
С помощью электропроводности можно также описать важную зависимость между плотностью электрического тока и напряженностью электрического поля с помощью выражения: J = σ * E .
Единица измерения
Единицей удельной электропроводности σ в СИ является: [ σ ] = 1 См/м ( Сименс на метр ).
Эти единицы определяются по формуле G = σ * S / l . Если решить эту формулу в соответствии с σ, то получим σ = G * l / S .
Единица измерения электрической проводимости G задается как: [ G ] = 1 / σ = 1 См ( Сименс, международное обозначение: S ).
Если теперь ввести в формулу все единицы измерения, то получится:
[ σ ] = 1 См * 1 м / м 2 = 1 См / м .
Вы также будете чаще использовать единицы измерения См / см , м / Ом * мм 2 или См * м / мм 2 . Вы можете преобразовать отдельные измеряемые переменные так: См / см = См / 10 -2 м и так: м / Ом * мм 2 = См * м / мм 2 = См * м / 10 -3 м * 10 -3 м = 10 6 См / м .
Электропроводность металлов
В зависимости от количества свободно перемещающихся электронов один материал проводит лучше, чем другой. В принципе, любой материал является проводящим, но в изоляторах, например, протекающий электрический ток ничтожно мал, поэтому здесь мы говорим о непроводниках.
В металлических связях валентные электроны, т.е. крайние электроны в атоме, свободно подвижны. Они расположены в так называемой полосе проводимости. Находящиеся там электроны образуют так называемый электронный газ. Соответственно, металлы являются сравнительно хорошими проводниками. Если теперь подать электрическое напряжение на металл, валентные электроны медленно движутся к положительному полюсу, потому что он их притягивает.

Рис. 1. Движение электронов в металле
На рисунке 1 видно, что некоторые электроны не могут быть притянуты непосредственно к положительному полюсу, потому что на пути стоит, так сказать, твердое атомное ядро. Там они замедляются и в некоторой степени отклоняются. Именно поэтому электроны не могут ускоряться в металле бесконечно, и именно так возникает удельное сопротивление или электропроводность.
Теперь вы также можете измерить удельную электропроводность в металле с помощью следующей формулы: σ = ( n * e 2 * τ ) / m .
В этой формуле n означает число электронов, e – заряд электрона, m – массу электрона, а τ – среднее время полета электрона между двумя столкновениями.
Таблица удельной электропроводности
Для большинства веществ уже известны значения удельной электропроводности. Некоторые из них вы можете найти в следующей таблице ниже. Все значения в этой таблице действительны для комнатной температуры, т.е. 25°C.
| Вещество | Удельная электропроводность в См / м |
| Серебро | 62 · 10 6 |
| Медь | 58 · 10 6 |
| Золото | 45,2 · 10 6 |
| Алюминий | 37,7 · 10 6 |
| Вольфрам | 19 · 10 6 |
| Латунь | 15,5 · 10 6 |
| Железо | 9,93 · 10 6 |
| Нержавеющая сталь (WNr. 1,4301) | 1,36 · 10 6 |
| Германий (легирование | 2 |
| Кремний (легирование | 0,5 · 10 -3 |
| Морская вода | примерно 5 |
| Водопроводная вода | примерно 0,05 |
| Дистиллированная вода | 5 · 10 -6 |
| Изолятор | обычно |
Удельная электропроводность сильно зависит от температуры, поэтому указанные значения применимы только при 25°C. При повышении температуры вибрация решетки в веществе становится выше. Это нарушает поток электронов, и поэтому электропроводность уменьшается с ростом температуры.
Из таблицы видно, что медь имеет вторую по величине электропроводность, поэтому медные кабели очень часто используются в электротехнике. Серебро обладает еще более высокой проводимостью, но стоит намного дороже меди.
Интересно также сравнение между морской и дистиллированной водой. Здесь электропроводность возникает благодаря растворенным в воде ионам. Морская вода имеет очень высокую долю соли, которая растворяется в воде. Эти ионы передают электрический ток. В дистиллированной воде нет растворенных ионов, поэтому в ней практически не может протекать электрический ток. Поэтому электропроводность морской воды намного выше, чем дистиллированной.
Примеры задач
Для более детального рассмотрения приведём два примера расчетов.
В первой задаче представьте, что у вас есть провод длиной 2 м с поперечным сечением 0,5 мм 2 . Электрическое сопротивление провода при комнатной температуре составляет 106 мОм. Из какого материала изготовлен провод?
Решение данной задачи можно найти с помощью формулы: R = ( 1 / σ ) * ( l / S ). Из этой формулы найдём σ = l / ( S * R ) .
Теперь вы можете вставить заданные значения, убедившись, что вы перевели сечение в м 2 .
σ = l / ( S * R ) = 2 м / ( ( 0,5 * 10 -6 м 2 ) * ( 1 / 106 * 10 -3 Ом ) ) = 37, 7 * 10 6 См / м .
Наконец, вы ищите в таблице, какой материал имеет удельную электропроводность σ = 37, 7 * 10 6 См / м и приходите к выводу, что провод сделан из алюминия.
В задаче 2 вам дано только удельное сопротивление образца с 735 * 10 -9 Ом * м. Из какого материла изготовлен образец?
Вы можете использовать формулу σ = 1 / ρ для расчёта удельной электропроводности. После подстановки значений в эту формулу вы получите: σ = 1 / ρ = 1 / 735 * 10 -9 Ом * м = 1,36 * 10 6 См / м .
Если вы снова заглянете в таблицу, то обнаружите, что образец должен быть изготовлен из нержавеющей стали.
Глава 6. Электролитическая диссоциация
Всем известно, что металлы проводят электрический ток. А проводят ли электрический ток растворы? Если бы мы попытались ответить на этот вопрос при помощи опыта, то убедились бы, что раствор сахара не проводит электрический ток, а раствор поваренной соли проводит. Почему? Может быть, исходные веществавода или сухой хлорид натрияэлектропроводны? Но тот же опыт показываетэти вещества, каждое само по себе, электрический ток не проводят.
Для того чтобы объяснить результаты этих опытов и понять смысл явления, необходимо ответить на вопрос: почему вообще некоторые вещества, например металлы, проводят электрический ток? Это происходит потому, что в металлах имеются «свободные» заряженные частицыэлектроны. С направленным движением этих заряженных частиц связана электропроводность металлов. Таким образом, если раствор NаСl проводит электрический ток, то, значит, в этом растворе тоже образуются какие-то заряженные частицы. Если раствор сахара не проводит электрический ток, значит, в растворе сахара заряженных частиц не образуется. Исходя из этого такие вещества называют: NаСlэлектролит, сахарнеэлектролит.
Электролитыэто вещества, растворы (и расплавы) которых проводят электрический ток.
Теперь нам осталось выяснить: откуда в растворе NаСl появились заряженные частицы? Вспомните, какой тип химической связи имеется в кристалле поваренной соли? Ионная связь! То есть связь между заряженными частицамиионами. Значит, хлорид натрия состоит из разноименно заряженных частиц! Но почему тогда сухой хлорид натрия не проводит электрический ток? Потому что между ионами в кристалле существуют достаточно сильные электростатические взаимодействия. А в воде? Посмотрите на рис. 1:
Какая связь между атомами Н–О?
Рис. 1.
Взаимодействие диполей воды
с кристаллом поваренной соли
Между ионами соли и молекулами воды возникают довольно значительные силы электростатического взаимодействия. В результате молекулы воды «растаскивают» кристалл на «кусочки» (ионы). Будут ли возникать такие взаимодействия в следующих случаях (рис. 2):
Рис. 2.
Варианты взаимодействия веществ
с растворителями
Очевидно, нет! В обоих случаях или растворитель (случай I), или вещество (случай II) неполярны, и взаимодействия, притяжение частиц друг к другу, ничтожны.
В ы в о д. Взаимодействие между веществом и растворителем возможно, если и вещество, и растворитель имеют достаточно полярные связи.
Следствием такого взаимодействия является диссоциацияраспад вещества на ионы. При этом образуются положительно заряженные ионыкатионы и отрицательно заряженные ионыанионы.
Электролитическая диссоциацияпроцесс распада электролитов на ионы под действием полярных молекул растворителя (чаще всего воды).
Задание 6.1. Будут ли проводить электрический ток:
а) раствор НСl в воде;
б) раствор NаСl в бензине;
в) раствор азота в воде;
г) концентрированная серная кислота?
Итак, еще раз повторим: вещества, способные в растворах или расплавах распадаться на ионы и, как следствие, проводить в этом состоянии электрический ток, называются электролитами.
Среди неорганических веществ к электролитам относят:
Проверяя электропроводность растворов электролитов одного класса, например кислот, можно заметить, что в одном случае лампочка горит ярко, в другомеле светится. Если принять во внимание, что концентрация веществ в растворах одинакова, как можно объяснить наблюдения?
Объяснение однов первом случае образуется большее число ионов (заряженных частиц), во второмменьшее, т.е. в первом случае электролитическая диссоциация идет в значительной степени. Такие электролиты называются сильными, в их растворах много ионов и почти нет (а иногда и совсем нет) молекул.
К сильным электролитам относятся:
В растворах слабых электролитов много молекул вещества и мало ионов; электролитическая диссоциация идет не полностью.
К слабым электролитам относятся:
– NН4ОН и нерастворимые основания.
Фосфорная и сернистая кислотыэлектролиты средней силы.
Задание 6.2. Выучите наизусть формулы сильных и слабых электролитов. Вспомните их названия.
Как же происходит электролитическая диссоциация?
снования диссоциируют на катион металла (или аммония NH4 + ) и анион ОН – :
П о м н и т е! 1) Заряд иона совпадает по величине с валентностью данного атома (группы атомов).
2) Число катионов и анионов может быть различным, но суммарный положительный заряд катионов равен суммарному отрицательному заряду анионов. Раствор остается электронейтральным!
Задание 6.3. Составьте уравнения диссоциации гидроксида калия, гидроксида аммония, гидроксида бария.
Кислоты диссоциируют на катион водорода и анион кислотного остатка:
Задание 6.4. Составьте уравнения диссоциации соляной, серной, фосфорной кислот.
Для многоосновных кислот диссоциация может происходить ступенчато. Это означает, что на каждой стадии отщепляется только один ион водорода. Например:
Задание 6.5. Составьте уравнения ступенчатой (постадийной) диссоциации фосфорной кислоты.
Соли диссоциируют на катион металла (или аммония) и анион кислотного остатка. При составлении таких уравнений следует учитывать вышеизложенные правила (см. «Помните!»):
Проверьте: 2•(3+) + 3•(2–) = (6+) + (6–) = 0.
В ы в о д. Для составления уравнений электролитической диссоциации:
• составьте химическую формулу соединения, укажите валентность составных частей;
• укажите число образовавшихся ионов (по индексам):
• укажите заряды ионов (по валентностям):
Задание 6.6. Составьте уравнения электролитической диссоциации нитрата хрома(III), карбоната натрия, сульфида калия, сульфата железа(III), сульфата железа(II).
Из вышеизложенного следует, что в растворах большинства неорганических веществ наряду с молекулами находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения. Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ионов химические формулы сильных и одновременно растворимых электролитов. Состав всех остальных веществ изображается в виде молекул.
Алгоритм составления ионно-молекулярных уравнений
1) Определить силу реагирующих электролитов:
2) Для сильных электролитов определить растворимость (по таблице растворимости):
3) Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы не изменять!
4) Одинаковые ионы «вычеркнуть», т.к. они не участвуют в реакции (не изменили ни состава, ни заряда). Получаем краткое ионно-молекулярное уравнение:
H2S + Cu 2+ = CuS + 2H + .
Краткое ионно-молекулярное уравнение показывает:
– что реакция возможна;
– что в результате реакции образуется осадок (СuS; в других случаяхгаз или слабый электролит или ион нового состава);
– какие ионы или молекулы должны участвовать в аналогичном процессе.
Например, для того, чтобы осуществить процесс
H2S + Cu 2+ = CuS + 2H + ,
вместо нитрата меди можно взять любую другую растворимую соль меди(II), т.к. она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте ионно-молекулярные уравнения реакции для процессов, указанных выше, и убедитесь, что краткие ионно-молекулярные уравнения у них одинаковые.
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, т.к. не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идет. В принципе можно заранее предсказать возможность такого процесса. Реакция ионного обмена в растворе возможна, если происходит связывание ионов, т.е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.8. Составьте ионно-молекулярные уравнения реакций:
а) фосфат натрия + хлорид кальция;
б) карбонат бария + азотная кислота;
в) гидроксид железа(III) + серная кислота;
г) сульфат аммония + гидроксид калия;
д) нитрат алюминия + хлорид натрия.
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
6.1. Понятие о рН (водородном показателе)
Водаочень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н + и 1 моль гидроксид-анионов ОН – . Другими словами, в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
[Н + ] = [OH – ] = 10 –7 моль/л,
где [Н + ]концентрация ионов водорода, моль/л; [OH – ] – концентрация гидроксид-анионов, моль/л. Такой раствор (среда) называется «нейтральный».
Расчеты показывают, что произведение концентраций этих ионов есть величина постоянная:
[Н + ]•[OH – ] = const = 10 –14 .
Поэтому уменьшение концентрации ионов водорода влечет за собой увеличение концентрации гидроксид-анионов, и наоборот.
Пусть, например, к чистой воде добавили кислоту, т.е. увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например: 10 –6 моль/л или 10 –2 моль/л. Такая среда (раствор) называется «кислая», или «кислотная».
Характер средыкислый, нейтральныйможно оценить количественно при помощи рН («пэ-аш»).
Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком:
Для нейтральной среды:
Для кислой среды:
Причем в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2)сильнокислой. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
Теперь предположим, что к чистой воде была добавлена щелочь, т. е. увеличена концентрация ионов ОН – . Пусть эта концентрация составит 10 –5 моль/л или 10 –3 моль/л.
Помня, что [OH – ]•[H + ] = 10 –14 , имеем:
[H + ] =[H + ] = 7.
рН = 7среда нейтральная,
Задание 6.9. Определите характер среды, т.е. ее рН, если:
а) [Н + ] равна (в моль/л): 0,01; 10 –8 ; 10 –4 ;
б) [ОН – ] равна (в моль/л): 10 –9 ; 10 –1 ; 0,001.
В о п р о с. Как можно определить реакцию среды опытным путем?
О т в е т. Реакцию среды можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее часто используемым индикатором является лакмус, который в щелочной среде приобретает синюю окраску, а в кислойкрасную.
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
б) [Н + ] = 10 –4 моль/л;
в) в растворе есть избыток ОН – ;
д) [ОН – ] = 10 –8 моль/л;
е) в растворе есть НNО3;
ж) [ОН – ] = 0,1 моль/л.
6.2. Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты, гидроксида натрия, сульфата натрия, карбоната натрия? В первых двух случаях можно уверенно сказать «да», т.к. при диссоциации образуются ионы водорода или гидроксид-анионы:
H2SO4 2H + +А индикаторы реагируют именно на избыток ионов Н + или ОН – . Но при диссоциации упомянутых солей ионы Н + и ОН – не образуются:
Na2SO4 2Na + +Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата нат- риянет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н + или ОН – .
Гидролиз солейэто процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
Na + + HOH NaOH + H + , (А)
Вспомните, что такое «сильный электролит», «слабый электролит» и ответьте на вопрос: какой из этих процессов (А или Б) невозможен в растворе?
Очевидно, невозможен процесс (А), т.к. молекул сильного электролита NаОН в растворе нет, есть только ионы Na + и ОН – .
Следовательно, происходит процесс (Б), и краткое ионно-молекулярное уравнение гидролиза карбоната натрия выглядит так:
рН > 7, среда щелочная, лакмус синий.
И действительно, лакмус становится синим в растворе карбоната натрия. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий слабому электролиту, и в результате его взаимодействия с водой образуется слабый электролит (вспомните условия протекания ионных процессов).
В ы в о д. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
| гидролиз не идет, т.к. соль образована двумя сильными электролитами; |
| гидролиз происходит, т.к. в состав соли входит остаток слабого электролита HNO2; |
Задание 6.11. Определите, происходит ли гидролиз в растворах хлорида железа(III), силиката натрия, нитрата калия. Ответ поясните.
Алгоритм составления уравнения реакции гидролиза
1. Определить, какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
3. Для иона слабого электролита составить уравнение реакции взаимодействия с молекулой воды (уравнение гидролиза):
а) Из молекулы воды притягивается противоположно заряженный ион, в данном случае ОН – ;
б) сумма зарядов до и после реакции равна: (3+) = (2+) + (1+).
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н + – значит, среда кислая, рН < 7.
Задание 6.12. Составить уравнения реакций гидролиза для сульфата алюминия, силиката калия, хлорида натрия, нитрата меди(II), сульфида калия.
Задание 6.13. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца(II), сульфата калия, сульфида натрия?
Упражнения к главе 6
1. По каким признакам вещества делят на электролиты и неэлектролиты; сильные и слабые электролиты? Приведите примеры веществ каждого типа.
2. Какие вещества относятся к кислотам? Какие ионы характерны для растворов любых кислот? Ответ подтвердить, составив уравнения электролитической диссоциации серной, фосфорной и азотной кислот.
3. Какие вещества относятся к щелочам? Какие ионы характерны для растворов всех щелочей? Ответ подтвердить, составив уравнения электролитической диссоциации гидроксидов калия, кальция и аммония.
4. Какие вещества относятся к солям? Существуют ли ионы, которые характерны для растворов любых солей? Ответ подтвердить, составив уравнения электролитической диссоциации карбоната натрия, нитрата аммония, хлорида бария, сульфата железа (III).
5. Одинаковый ли цвет приобретет лакмус, если его добавить к растворам:
– перечисленных в задании 2 кислот;
– перечисленных в задании 3 щелочей;
– перечисленных в задании 4 солей?
Почему? Ответ подтвердить составлением необходимых уравнений реакций.
6. Какие признаки помогают установить, что реакция ионного обмена возможна (идет до конца)? Ответ подтвердить, составив уравнения следующих процессов:
а) гидроксид бария + хлорид аммония . ;
б) нитрат алюминия + гидроксид калия . ;
в) карбонат кальция + азотная кислота . ;
г) сульфат меди + фосфат натрия . ;
д) хлорид железа(II) + нитрат натрия . .
7. По кратким ионно-молекулярным уравнениям составить молекулярные уравнения реакций:
Какой из предложенных процессов соответствует реакции нейтрализации?
8. Какие из перечисленных ниже веществ, попадая в воду, изменяют окраску индикатора: сернистый газ, аммиак, натрий, сульфат цинка, поваренная соль, негашеная известь, стиральная сода, железо. Почему? Ответ подтвердить составлением необходимых уравнений реакций.
Читайте также:
