Металлы с атомной кристаллической решеткой
Обновлено: 30.06.2024
Атомно – кристаллическое строение металлов и сплавов. Основные типы кристаллических решеток: объемно - центрированная кубическая, гранецентрированная кубическая, гексагональная плотноупакованная, тетрагональная решетки. Параметры кристаллических решеток. Кристаллографические плоскости и направления. Определение индексов кристаллографических плоскостей и направлений. Реальное строение металлов. Классификация дефектов кристаллического строения. Их краткая характеристика.
Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии F (F = U — TS, где U — внутренняя энергия; Т —температура; S — энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 10 5 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
Реализация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится.
Т.о. можно отметить, что в газообразном состоянии атомы расположены хаотически, в жидком состоянии имеют близкий порядок в расположении атомов, а в кристаллическом состоянии имеется и ближний и дальний порядок в расположении атомов.
Правильное, закономерное расположение частиц в пространстве и характеризует кристаллическое состояние. Кристаллическое состояние можно представить в виде плоской решетки, в узлах которой расположены атомы (рисунок 11) Такое изображение решетки называется кристаллографической плоскостью.
Это обуславливает то, что в кристалле каждый атом имеет одно и тоже ближайшее количество атомов – соседей, расположенных на Одинаковом расстоянии.
Кристаллическая решетка – это неоднократное повторение кристаллографической плоскости во всех направлениях.
Кристаллическую решетку можно «построить», выбрав для этого определенный «строительный блок» (аналогично постройке стены из кирпичей) и многократно смещая этот блок по трем непараллельным направлениям. Такая «строительная» единица кристаллической решетки имеет форму параллелепипеда и называется элементарной ячейкой. Все элементарные ячейки, составляющие кристаллическую решетку, имеют одинаковую форму и объемы. Атомы могут располагаться как в вершинах элементарной ячейки, так и в других ее точках (в узлах кристаллической решетки). В первом случае элементарные ячейки называются простыми (примитивными), во втором — сложными. Если форма элементарной ячейки определена и известно расположение всех атомов внутри нее, то имеется полное геометрическое описание кристалла, т.е. известна его атомно-кристаллическая структура.
В кристаллографии рассматривают 14 типов элементарных ячеек. Их называют пространственными решетками Бравэ. Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки а, Ь, с и три угла между ними. Эти величины называются параметрами элементарной ячейки (кристаллической решетки). Все 14 решеток Бравэ распределены по семи кристаллическим системам (сингониям) в соответствии с ориентацией и относительными величинами параметров решетки (рис. 12). Каждая кристаллическая система включает одну или несколько типов пространственных кристаллических решеток. В простой решетке атомы располагаются только по вершинам решетки, в объемноцентри-рованной еще один атом в центре решетки, в гранецентрированной еще по одному атому в центре каждой грани, и в базоцентрированной еще по одному атому в центрах пары параллельных граней.
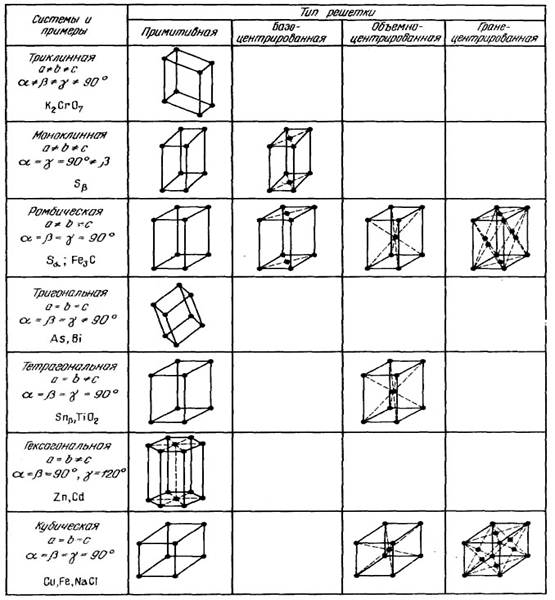
Рисунок 12 – Основные типы кристаллических решеток и их характеристики
Наиболее распространенными среди металлов являются гексагональная плотноупакованная решетка (ГПУ) –Mg, Zn, Co, Ti; гранецентрированная кубическая решетка (ГЦК) – Fe, Ni, Cu, Al, Pb, Ag, Au; объемно-центрированная кубическая решетка (ОЦК) – Fe, Cr, W, V, Mo (рисунок 13).
Компактность структуры является одним из факторов, уменьшающим свободную энергию твердого тела, т. е. обеспечивающим его равновесное состояние и следствием особенностей электронной структуры металлов и характером их межатомного взаимодействия. Поэтому основной характеристикой кристаллической решетки является координационное число. За координационное число принято число ближайших соседей данного атома, находящихся от него на одинаково близком расстоянии.
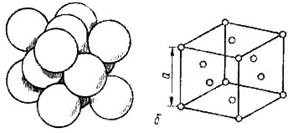
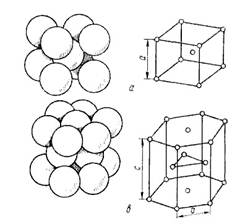
Рисунок 13- Основные виды кристаллических решеток и расположение в них атомов.
Точечное расположение атомов в кристаллических решетках, приведенных на рисунке 3, является условным, так как в действительности атомы имеют определенный размер и могут соприкасаться друг с другом. Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Параметры элементарной ячейки а, Ь, с и атомные радиусы измеряются в ангстремах (1Å – 10 -8 см). Параметры решетки металлов (их также называют периодами решетки) находятся в пределах 0,2—6,7 Å и определяются методом рентгеноструктурного анализа с точностью до третьего, а при необходимости и до четвертого или даже пятого знака после запятой.
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
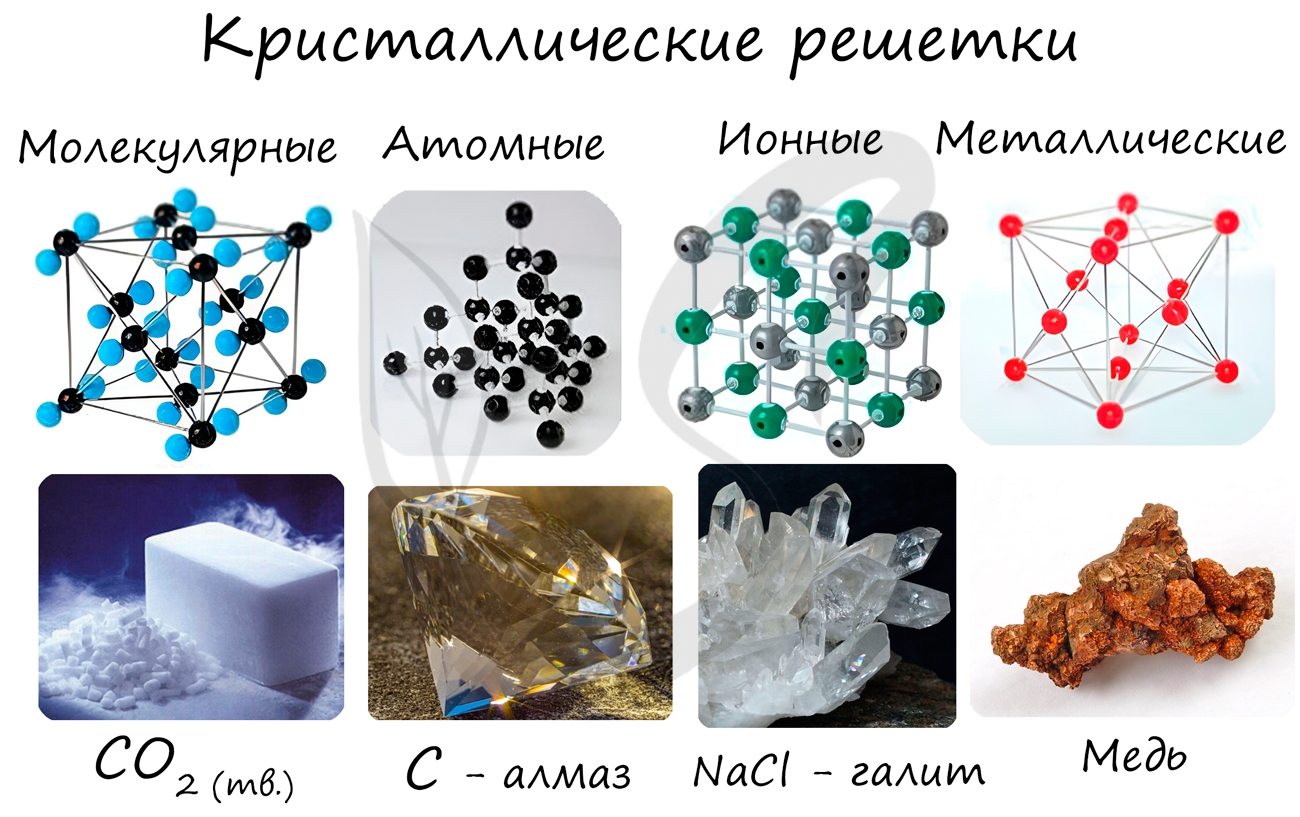
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
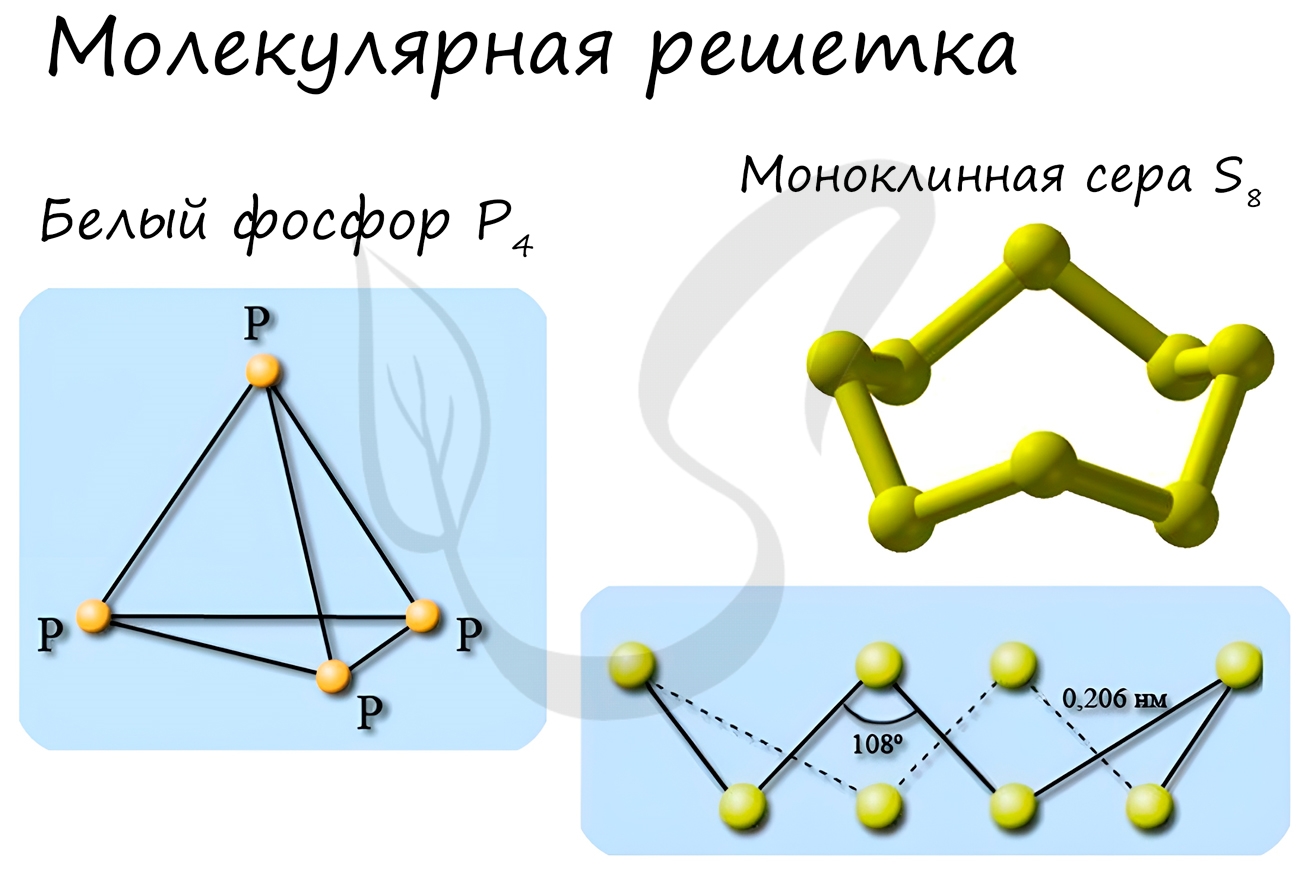
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кристаллическая решетка

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
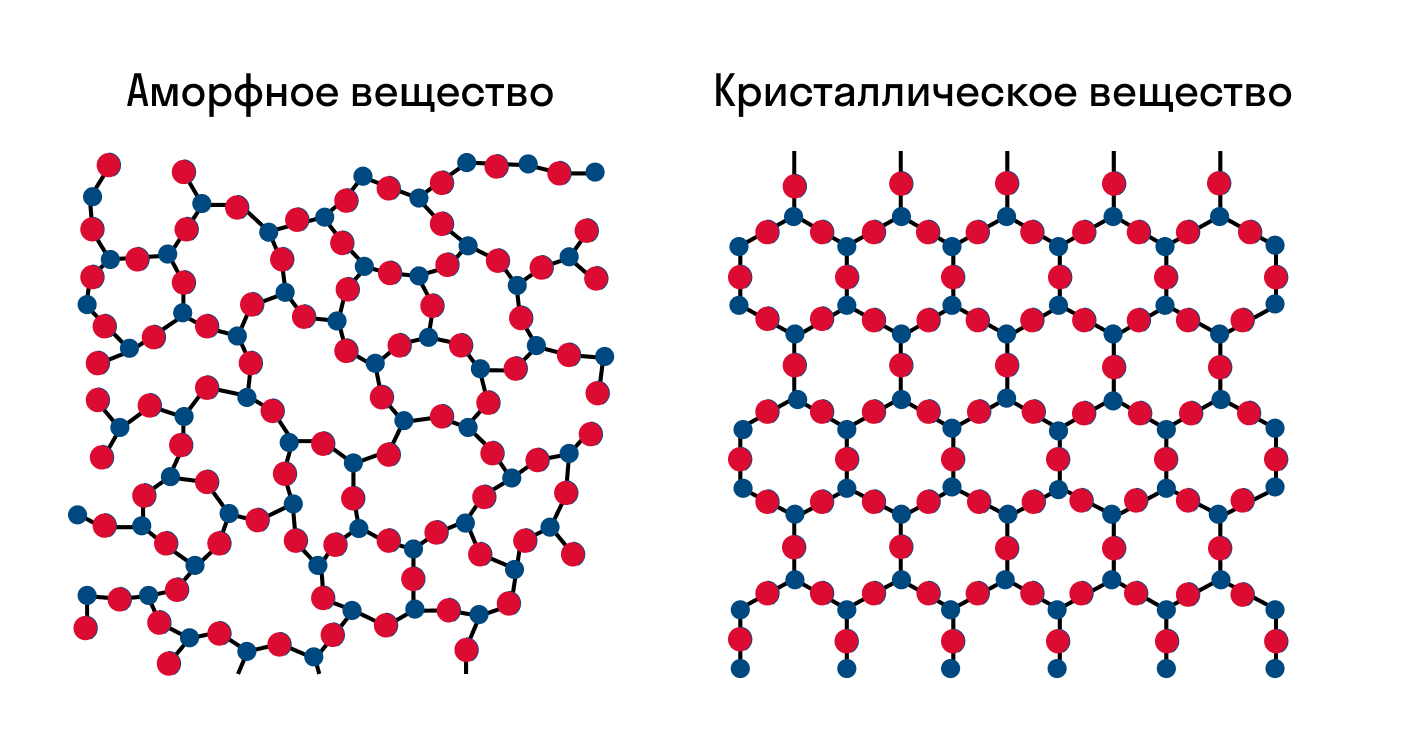
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
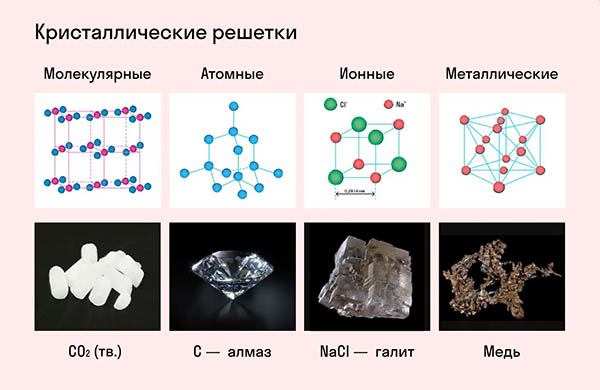
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
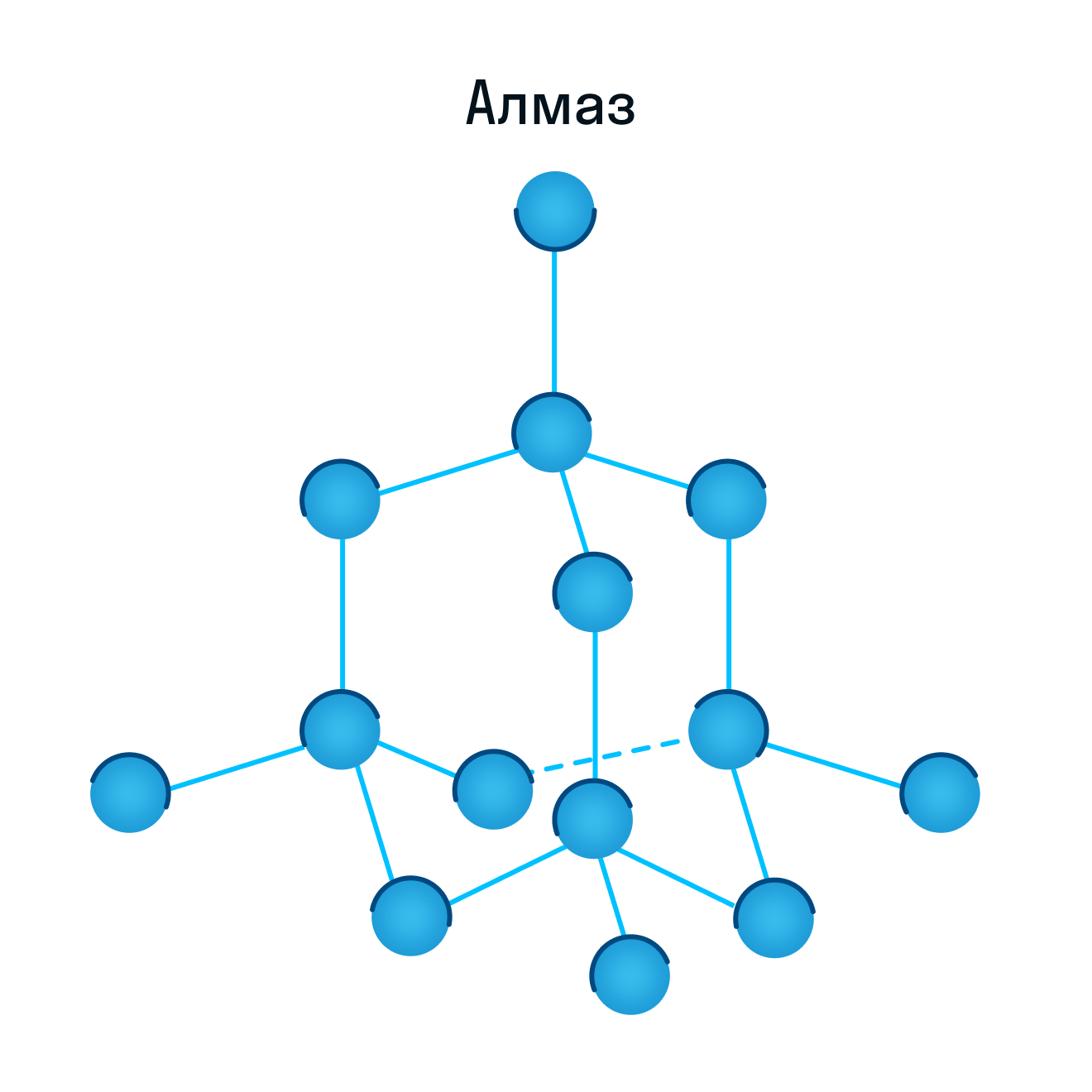
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
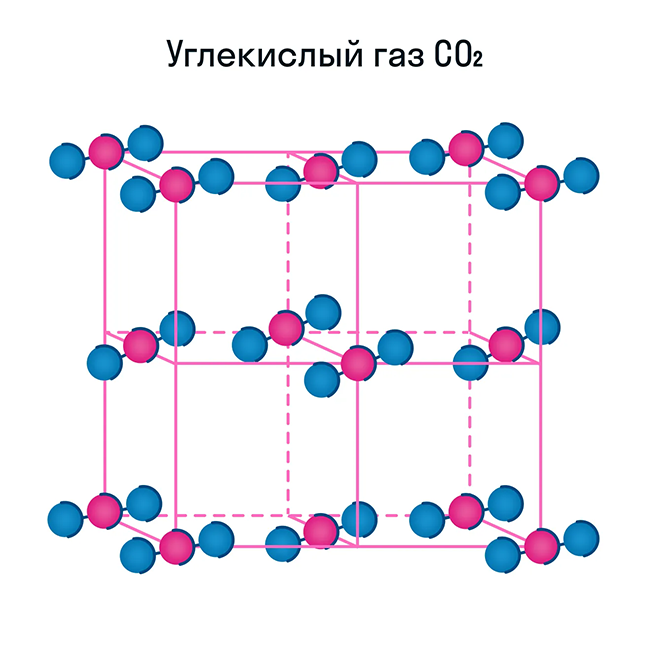
Свойства молекулярных веществ:
у некоторых — наличие запаха.
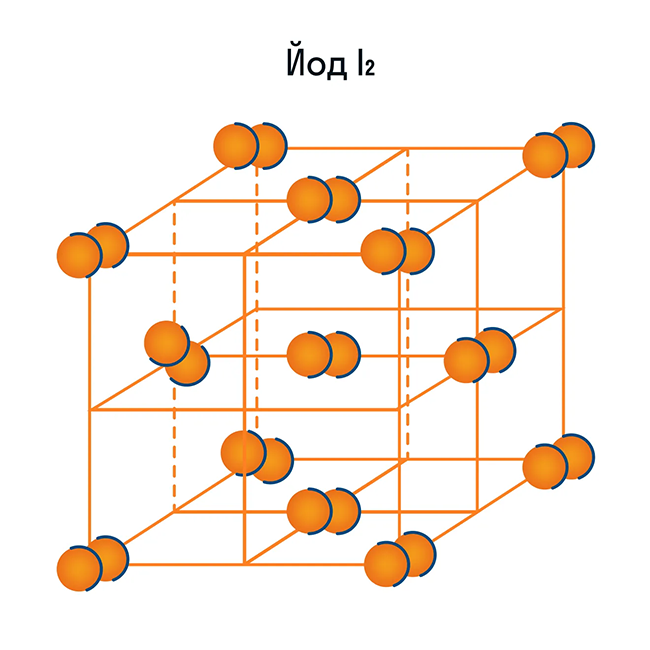
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
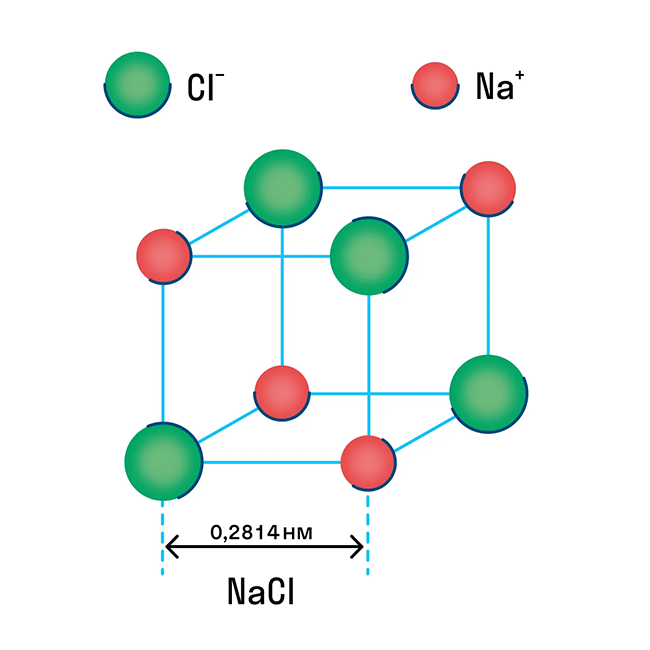
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
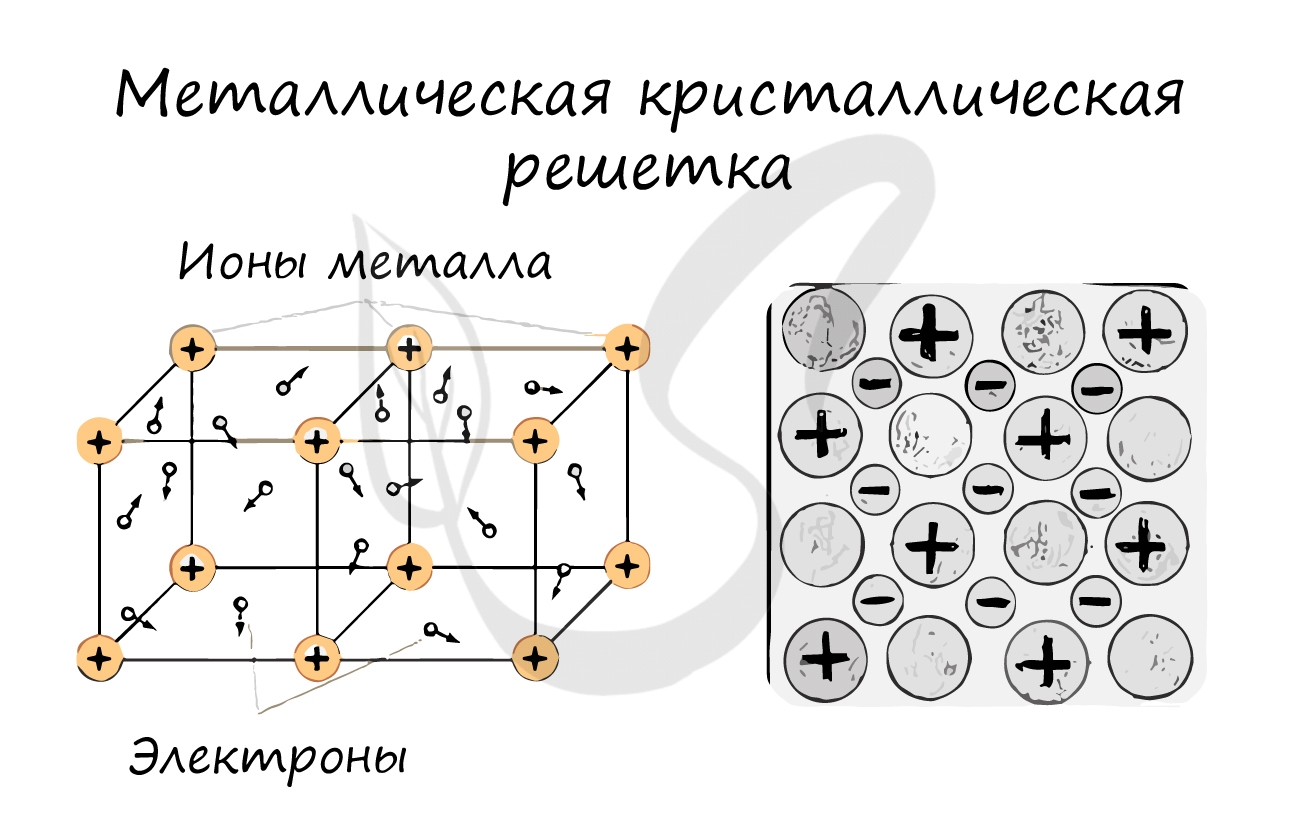
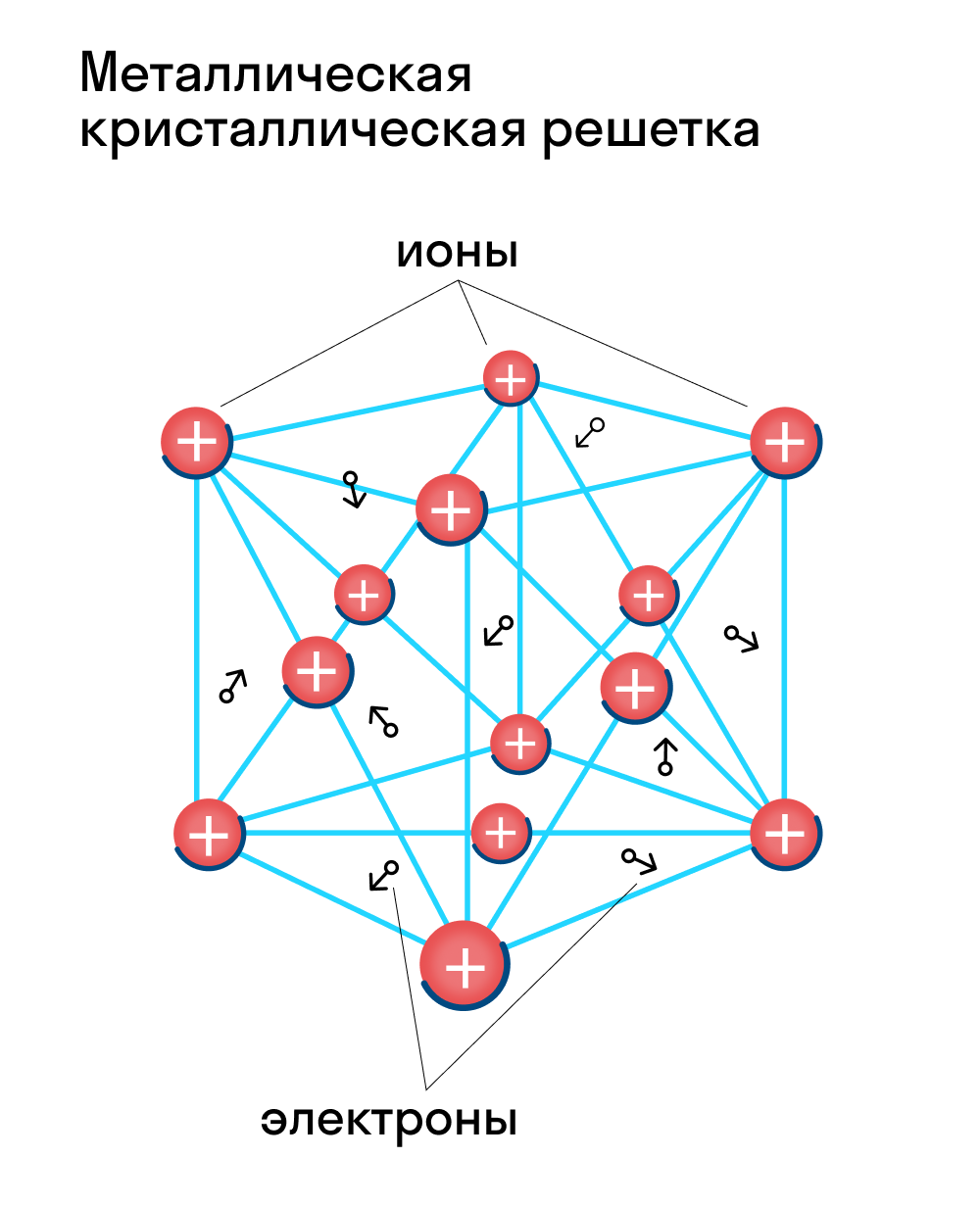
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Атомно-кристаллическое строение металлов
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
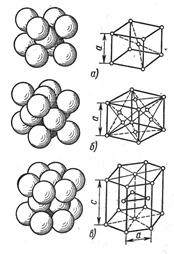
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Кристаллическое строение металлов
Металлы — один из самых распространенных веществ в материальной культуре человека. Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений. В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.

В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники. В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций. Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.

Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец
Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
Золото и платина Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий Сканидий Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.

Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.

Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.
схема кристаллической решетки.

Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.

Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.

Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму. Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.
Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны. Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;

Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
Читайте также:
